水稻黄绿叶基因YGLOSH的定位克隆
2018-01-10曹昌翔徐小红吴佳炳罗小金
曹昌翔,徐小红,吴佳炳,王 莹,罗小金
(1.复旦大学 生命科学学院 植物科学研究所,上海 200438;2.复旦大学 遗传工程国家重点实验室,上海 200438;3.江西 红一种业科技股份有限公司,赣州 341000)
水稻黄绿叶基因YGLOSH的定位克隆
曹昌翔1,2,徐小红3,吴佳炳1,2,王 莹1,2,罗小金1,2
(1.复旦大学 生命科学学院 植物科学研究所,上海 200438;2.复旦大学 遗传工程国家重点实验室,上海 200438;3.江西 红一种业科技股份有限公司,赣州 341000)
本文利用60Co γ射线诱变光温敏感型核不育系广占63S(GZ63S),在后代中获得一个稳定遗传的黄绿化叶色突变体黄广占63S,突变体从苗期至成熟期均显示叶片黄化特征.遗传分析表明该性状受一对隐性核基因控制,命名为yglosh.利用BSA方法分析突变体黄广占63S与正常绿叶对照蜀恢881构建的F2群体,将该黄化基因定位于水稻2号染色体分子标记RM279和Pm6之间,物理距离约68kb.定位区间的cDNA测序分析发现,突变体中LOC_Os02g05890基因发生单碱基突变,形成终止子提前终止该基因的翻译.转基因互补实验确定LOC_Os02g05890为目标基因,可能参与叶绿体发育或者叶绿素生物合成途径.
水稻; 黄绿化突变; 精细定位; 基因克隆
叶片是绝大多数植物光合作用的主要场所,主要依赖其中的叶绿体将太阳能转变为植物所需的生物能,约95%以上的水稻产量与其叶片的光合作用效率直接相关,目前比较高产的水稻品种光能利用率为1.5%~2.0%,比理论上水稻光能利用率(3.0%~5.0%)低很多[1],因此对高光效水稻的培养是提高水稻产量的主要途径之一.叶色突变是叶片表型变异的一种,此类变异可能会导致叶绿体发育相关基因的失活或者沉默,并通过间接影响叶绿素的生物合成或降解来改变叶绿素的含量[2].所以叶色突变的相关研究将有利于促进高光效水稻研究的发展.
水稻叶色突变一般是由叶片内叶绿素的相对含量发生改变导致,而叶绿素合成的主要场所为叶绿体,但叶绿体的发育受自身遗传物质、核基因以及细胞质基因等多方面共同调控,故叶色突变也包含质量性状与数量性状的分类.水稻叶色突变体种类繁多,且不同的叶色突变体之间的遗传模式也不尽相同,然而,叶绿体中大部分重要蛋白仍由核基因编码调控[3].近年来科学家们通过传统遗传学和反向遗传学以及蛋白组学对叶色突变以及叶绿体发育过程进行深入研究,至今已经鉴定了上千个叶绿体相关蛋白,但对叶绿体发育的分子机制以及功能作用模式的探究还远远不够.
本研究中利用水稻叶色黄绿化突变体黄绿化广占63S(黄广占63S)与恢复系蜀恢881作为研究材料,构建了由两亲本杂交F1代自交得到F2代分离群体,并利用SSR分子标记对黄绿化基因进行了初步定位以及精细定位,最后克隆了该基因,发现目的基因是一个叶色突变相关基因,可能与水稻叶绿体的发育或者叶绿素的生物合成或降解有关.
1 材料与方法
1.1 材料
本实验的研究对象为突变体黄广占63S,构建定位群体的对照品种为恢复系蜀恢881.其中突变体黄广占63S是由光温敏感型核不育系广占63S经过60Co γ射线诱变而来的突变体,叶片表现为变异型黄绿色,尤其在苗期明显;而蜀恢881则是在恢复系6323与粳稻天然杂交后代中选育,是良好的恢复系材料,叶片在灌浆期以前均表现为正常绿色.大肠杆菌菌株E.coliDH5α以及载体质粒pCAMIBIA 1304和克隆载体pMD19-T由本实验室保存.
黄广占63S与蜀恢881杂交构建了F2代分离群体.广占63S、黄广占63S、蜀恢881、F1及F2群体材料于2012年5月26日播种于江苏太仓复旦大学太仓试验田,材料管理均按正常大田生产管理.功能互补验证实验中得到的转基因植株在28℃的温室中培养,每天光照14h至6叶期转入大田继续培养,按正常生产管理.
1.2 表型统计、基因定位和候选基因分析
水稻秧苗期考察F2群体的表型并取样,采用改良的CTAB法[4]提取水稻叶片DNA(TaKaRa Thermal Cycler PCR仪购自TaKaRa公司).根据表型考查数据,统计F2代中叶片变异黄绿化和正常绿叶的具体数目,再根据孟德尔遗传定律和卡方相似度检测其分离比来进行遗传分析.
采用群体分离分析法(BSA法)[5]进行黄绿化基因定位.在F2群体两种表型中随机选择正常绿叶表型15株和黄绿叶表型15株分别构建正常绿叶池和黄绿叶池,然后利用均匀分布在水稻12条染色体上的亲本间多态性引物分析两个DNA池,筛选连锁标记.然后用获得的连锁标记分析F2群体基因型,结合叶色表型分析,初步确定与目的基因两边连锁的分子标记.
在初定位的基础上,根据参考基因组序列(日本晴基因组序列http:∥rgp.dna.affric.go.jp和9311基因组序列http:∥rice.genomics.org.cn)设计Indel标记,构建目标区域高密度的分子标记连锁图谱.本实验所用SSR分子标记来自于公共数据库(Rice Genome Research Program);新设计的引物为插入缺失(Indel, Insert/Deletion)标记,引物设计所用软件为Primer Premier 5.0和在线网站http:∥primer3.ut.ee/与http:∥www.ncbi.nlm.nih.gov/tools/primer-blast.
通过TIGR网站http:∥rice.planthiology.msu.edu/overview.shtml可以查阅目标区域内基因注释信息.对所得预测基因序列分析后设计特定引物进行PCR扩增,经过琼脂糖凝胶电泳后回收纯化所得片段.再将所得目的片段连接转化后送由上海桑尼生物科技公司进行测序分析.
1.3 载体构建、遗传转化以及功能互补实验
使用Primer Premier 5.0软件设计带有酶切位点的引物,购买TaKaRa试剂盒DRR02AM进行PCR扩增,特异性扩增目的片段.将目的片段连接T载体转化并利用抗性筛选.然后利用设计引物时相应的限制性内切酶对质粒DNA进行酶切反应.回收目的片段后(JY-ECP3000凝胶电泳仪购自北京君意东方电泳设备有限公司,紫外与可见光分析仪购自Tanon公司),用T4DNA连接酶将目的片段与表达载体(质粒pCAMIBIA 1304)进行连接.将连接产物转化入大肠杆菌E.coliDH5α感受态细胞中,挑选单克隆后用特异性引物PCR扩增并测序检测,得到含目的片段的阳性重组质粒克隆.利用基因枪法(GJ-1000高压气体基因枪,宁波新芝有限公司制造)将得到的重组质粒轰击至经过诱导培养基和高渗培养基培养的黄化植株受体的愈伤组织中,再经过一周的恢复诱导培养,加上在两轮含定量潮霉素的筛选培养基上的阳性筛选.将二次筛选后的愈伤置于分化培养基上光照培养30d左右,待分化出2~4cm左右植株后,将其转入生根壮苗培养基,生长至15~20cm后移入温室正常管理.将温室中有预期表型的植株取叶片样本提取DNA进行PCR扩增检测(试剂盒MightyAmp DNA Polymerase TaKaRa Code: DR070A).
最后,从理论模型到理论。苏佩斯主张理论是理论模型的集合,理论中所探讨的对象实质上就是在模型中所处的位置。一个理论之下拥有多种理论模型,模型与模型之间因为同构而共同组成这一理论,从而在理论内部形成一种共享结构的关系,这种共享结构的关系就是对于理论的解释,从而形成了理论中的定理。
2 结果与分析
2.1 分离群体叶色遗传分析
2.1.1 材料背景分析
在本研究中,两个亲本水稻品种分别为突变体黄广占63S和恢复系蜀恢881.其中突变体黄广占63S是由光温敏感型核不育系广占63S经过60Co γ射线诱变而来的突变体,叶片在秧苗期表现为变异型黄绿色,而广占63S是用N422s与矮广占63杂交后自交选育成的籼型光温敏感型核不育系,花粉完全败育,在日照长度大于14h温度小于23.5℃时自交结实率低于0.05%[6];对照亲本蜀恢881则是从恢复系6323与粳稻天然杂交后代中选育,是良好的恢复系材料,叶片在全生育期表现为正常绿色[7].
2.1.2 分离群体叶色遗传分析

图1 突变体黄广占63S与蜀恢 881的叶色比较Fig.1 Leaf color of Yellow Guangzhan 63S mutant and Shuhui 881

收获F2代的种子种成F3家系,其中F2代中表现为叶片黄绿化的自交后代性状不再分离,正常绿叶型的自交后代有部分产生了分离.由此可以推断该突变性状是由一对隐性核基因控制的,命名为YGLOSH,且正常绿叶为纯合或杂合显性基因表型,叶片黄绿化为纯合隐性基因表型.
2.2 基因初定位及精细定位
2.2.1 初步定位
该基因在F2群体中表现为单基因遗传,因此直接将F2群体作为初定位分离群体.在F2群体两种表型中分别随机选择正常绿叶表型15株和黄绿叶表型15株构建正常绿叶池和黄绿叶池,然后利用分布在水稻12条染色体上的597个SSR标记对亲本黄广占63S和蜀恢881进行多态性分析,获得252个多态性标记.随后利用该252个多态性标记分析正常绿叶池和黄绿叶池,筛选出6个可能的连锁标记,并用F2群体进行验证.利用6个所选标记鉴定F2群体1849个体的基因型,结合叶色表型进行连锁分析,最后锁定与目的基因两边连锁的分子标记为RM233和RM6067,两标记与目的基因重组值通过计算分别为: 0.74%和3.25%,遗传距离约为4cM.
2.2.2 精细定位
在初定位的基础上对YGLOSH基因进行精细定位.根据已经公布的日本晴粳稻品种的基因组序列和9311籼稻品种的基因序列自行设计新的插入缺失标记,在SSR标记RM233与RM6067之间构建高密度标记图谱,并再次对交换单株进行一一检测(主要标记引物序列见表1).

表1 定位中主要分子标记引物列表Tab.1 Primers of major molecular markers
检测结果显示交换单株B2-18、B2-46、B2-120、B2-131等将YGLOSH基因定位在Pm6上游(表2,),交换单株B2-64、B2-80、B2-169、B2-184等将YGLOSH基因定位在RM279的下游(表2),故YGLOSH基因被进一步定位在RM279与Pm6之间,两个标记间遗传距离约为0.41cM,物理距离约为68kb(图2,).
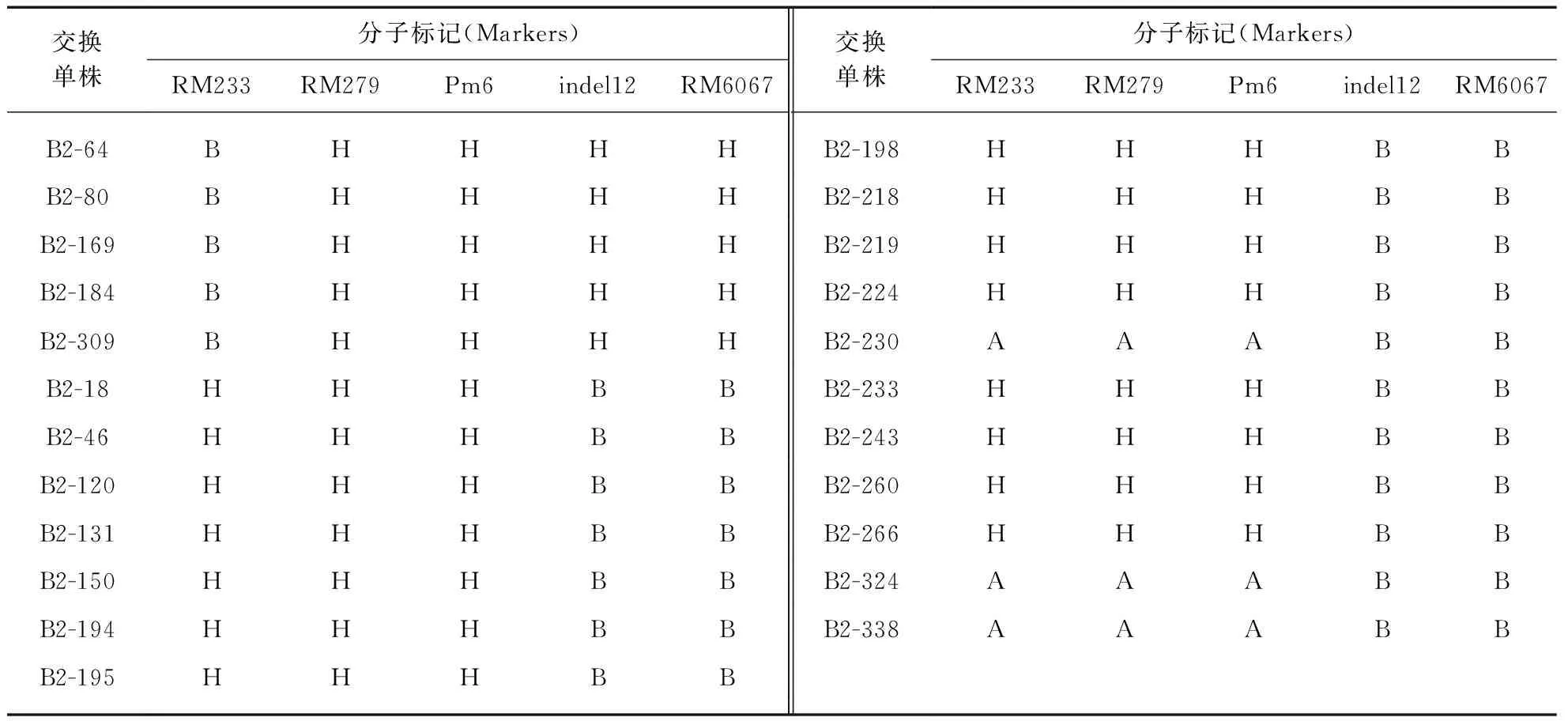
表2 F2群体关键性交换单株的基因型Tab.2 Genotypes of key recombinants from the F2 population
注: 各株均位于2号染色体;交换单株表型为叶片绿色,其中A: 亲本蜀恢881基因型;B: 亲本突变体基因型;H: 杂合基因型.
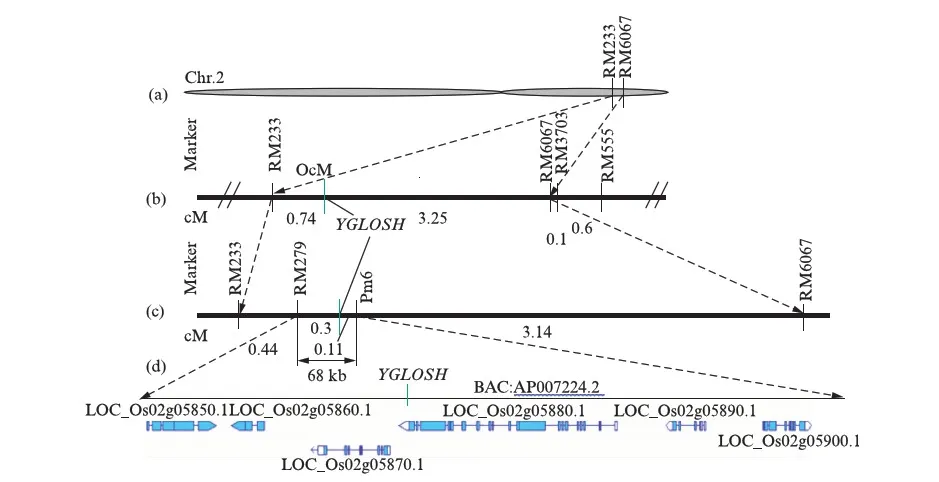
图2 水稻黄绿化基因YGLOSH的精细定位Fig.2 Fine mapping of the YGLOSH gene(a) 基因YGLOSH在水稻2号染色体上的位置;(b)&(c) 基因YGLOSH被精细定位于标记RM279与Pm6之间;(d) BAC(AP007224.2)上目标区域内的候选基因.
2.3 目标区域候选基因分析
精细定位将目的基因YGLOSH限定在水稻2号染色体的标记RM279和Pm6之间,根据水稻序列注释数据库信息(http:∥www.tigr.org),在这两个标记之间的68kb内有6个候选基因,且均在一条BAC(AP007224.2)上,其中的LOC_Os02g05850推测为编码转座子蛋白;LOC_Os02g05860为推测的编码反转录转座子蛋白;LOC_Os02g05870编码一个表达蛋白;LOC_Os02g05880为RNA聚合酶Rpb1编码基因;LOC_Os02g05890为拟南芥中编码一个叶绿体蛋白EMB1303的基因;LOC_Os02g05900为推测的编码三元复合体因子MIP1蛋白(表3).
根据两个亲本的目的区域内序列,对定位区域内的候选基因一一进行测序比对,测序结果显示两亲本的cDNA序列只有在LOC_Os02g05890上含功能性突变,在cDNA序列的174位上,蜀恢881第174位为C,黄广占63S第174位为A,由原本的TGC突变形成终止子TGA,提前终止该基因的翻译(图3),从而影响该基因在水稻植株内的功能.将预测基因LOC_Os02g05890的蛋白序列在SMART网站上做结构域分析,发现仅含有一个螺旋式跨膜区域.
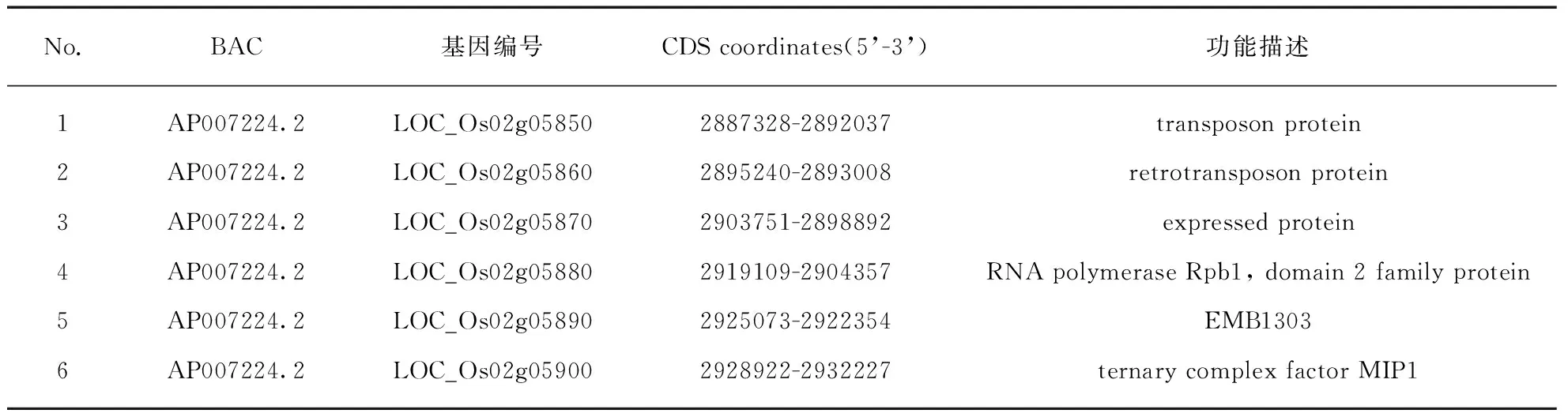
表3 候选基因分析Tab.3 Analysis of candidate genes
注: 数据来源自www.tigr.org. 各基因均位于2号染色体.
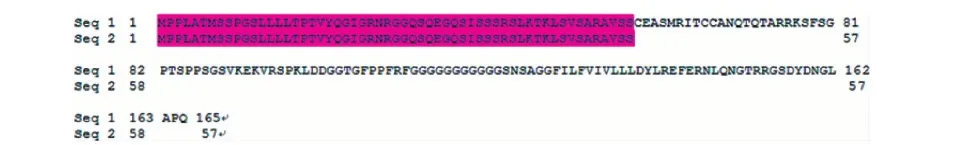
图3 LOC_Os02g05890编码的氨基酸序列比对Fig.3 Amino acid sequence analysis of LOC _Os02g05890seq 1: 亲本蜀恢881;seq 2: 亲本黄广占63S.
2.4 遗传转化及功能互补验证
2.4.1 载体构建
将目的片段用特异性引物YF(ATCCATGGTCATGCCTCCACTTGCCACA)和YR(CGAGATCTC TATTGGGGAGCGAGCCC)以蜀恢881的cDNA为模板扩增,琼脂糖凝胶电泳检测扩增片段大小(目的基因大小498bp),并将目的片段回收后连接T载体转化,挑选阳性克隆摇菌并送样测序,将测序结果与目的基因进行序列比对,确认得到目的基因克隆后,将保存的菌液复苏并提取质粒并测其浓度后利用先前设计的酶切位点用相关的酶(NcoⅠ&BglⅡ)进行酶切反应,得到的酶切产物进行琼脂糖凝胶电泳并回收目的基因片段,并将其连接到准备好的pCAMIBIA1304载体上,将连接产物进行转化后摇菌再次送去测序,验证目的基因正确插入表达载体中,将测序结果再次与目的基因序列进行比对,将确定的阳性结果对应的保存菌摇菌分管保存备用,并提取其质粒备用.
2.4.2 遗传转化及验证
用基因枪法将表达载体转入预先培养的黄广占63S的愈伤中,成功分化出45棵苗(T0代),将幼苗转入大田中正常管理.为了方便观察,转基因植株与突变体黄广占63S的并列种植.

图4 T2代转化株系转录cDNA序列比对Fig.4 cDNA sequence analysis of T3 transform linesSequence0和Sequence1分别为黄广占63S与蜀恢881;Sequence2~8均为转基因T3代植株;Sequence9为转空载体对照植株.
为了验证目的基因是否成功转入,取T2代植株叶片提取总RNA并进行反转录,用自行设计的3对特异性引物(P1: AATCGTGGAGGACAAAGCCA/TGCCTCCATCGTCAAGCTTT;P2: TGGAGGACAAA GCCAGGAAG/TCGTCAAGCTTTGGACTCCTC;P3: GGGAGAAATCGTGGAGGACA/CCTCCATCGTCA AGCTTTGGA)PCR扩增目的基因片段,经凝胶电泳后回收目的片段并送样测序,与对照组植株(转入空载体)比对结果(图4,),表明转入的目的基因成功在突变体中表达,并显现出相应表型(图5,).将筛选出的8株阳性植株继续自交种植,观察表型并且为进一步遗传分析提供材料.

图5 T2代转化株系表型对比Fig.5 Phenotype analysis of T2 transform lines(a) 苗期叶色对比,(b) 分蘖盛期叶色对比;1. 黄广占63S植株;2. T2代阳性植株; 3. 转空载体对照植株
3 讨 论
随着水稻的功能基因组学的发展,很多叶绿体发育以及叶绿素生物合成相关基因被定位、鉴定,但只有少数的叶色基因被克隆[8-12],且主要集中在编码叶绿素合成与降解途径中酶的基因[13-15].吴自明等[16]在水稻5号染色体上克隆到的黄绿叶基因YGL1是以单拷贝形式存在,编码一个叶绿素合成酶.该酶催化叶绿素酸酯植醇化后生成叶绿素a,它不仅影响叶绿素a辅基蛋白的翻译,还能使类囊体膜组分的装配更稳定.该基因单碱基突变使脯氨酸变异为丝氨酸,使得叶绿素合成酶活性降低,导致叶绿素积累速率降低.分析发现该突变虽未影响该蛋白自身的表达水平,但却导致cab1R基因(编码叶绿素结合蛋白)等在苗期叶片中的表达受抑制.Zhang等[17]通过图位方法克隆到两个镁离子螯合酶亚基基因OsCHLD和OsCHL;Lee等[18]在水稻中发现了两个与叶绿素a氧化酶高度同源的基因OsCAO1和OsCAO2;另外还有何瑞锋克隆的OsCHLH基因[19].这些叶色差异大多数是由于叶绿素合成途径受不同程度影响导致[20].
本研究中,利用60Co γ射线诱变光温敏感型核不育系广占63S(GZ63S),在后代中获得一个稳定遗传的黄绿化叶色突变体黄广占63S,突变体从苗期至成熟期均显示叶片黄化特征.为了定位、克隆该引起叶片黄绿化的基因,我们用恢复系蜀恢881为对照亲本,与黄广占63S构建F2分离群体.分析F2群体,发现1387株正常绿叶和462株黄绿化苗,符合孟德尔的单基因遗传定律,分离比逼近3∶1,表明该黄绿化基因为单基因遗传,命名为yglosh,亲本黄广占63S的基因型为隐性,蜀恢881恢复系为显性.利用BSA分析方法把该黄化基因定位于水稻2号染色体标记RM279和Pm6之间的68kb范围内.基因注释表明定位区间有6个开放阅读框.cDNA测序分析发现,突变体中LOC_Os02g05890基因发生单碱基突变,即第174位胞嘧啶C被一个腺嘌呤A取代,由原本的TGC突变形成终止子TGA,提前终止该基因的翻译.转基因互补实验确定LOC_Os02g05890为目标基因,可能参与叶绿体发育或者叶绿素生物合成途径.
同源性分析发现,水稻中的YGLOSH基因与拟南芥中的EMB1303基因氨基酸一致性为33.3%.EMB1303编码154个氨基酸,与叶绿体发育相关,该基因突变导致拟南芥叶片白化和短根,突变体的质体在类囊体膜未传统堆叠的情况下在早期发育受阻,种植后表现为色素缺失并在秧苗期死亡[21].本研究中克隆的YGLOSH基因作用机制可能与EMB1303不同,YGLOSH突变体仅仅表现为在秧苗期的黄化,后在生长过程中叶色有回绿趋势,该基因突变只是影响到了水稻叶绿素合成和代谢,但是并不会使得水稻在幼苗期死亡,该基因突变对产量也未有明显影响.
近年来,水稻叶色突变体在育种中也曾发挥作用,Su等[22]利用白转绿突变体作为筛选标记在苗期即可鉴别真假杂交种,从而通过提高杂交种的纯度提高产量.本研究中克隆的YGLOSH基因,其突变引起水稻叶色黄绿化,表型易于鉴别,因此可作为形态学标记应用于遗传学的研究中,结合光温敏不育系或细胞质雄性不育系的特点,可以在育种上帮助鉴定杂交种子的纯度,清除假杂种以及受外源花粉污染的种子.广占63S是目前生产上正大面积推广应用的光温敏两用不育系,制种期间易受低温影响自交结实,影响杂交种的纯度.将突变广占63S中的YGLOSH基因引入黄绿叶标记,在F1群体中可区分不育系自交种(叶色黄化),人工去除假杂种,保证杂交种的纯度.广占63S的光温敏核不育位点(tms5)与安农S-1相同,该位点位于2号染色体的短臂[23],与YGLOSH基因位置较近,两基因间有较强的连锁关系,可通过分子标记辅助育种把tms5与yglosh同时导入别的品种中,培育黄绿叶光温敏两用不育系.
[1] LOOMIS R S, WILLIAMS W A. Maximum crop productivity: An extimate [J].CropScience, 1963,3(1): 67-72.
[2] JUNG K. Characterization of a rice chlorophyll-deficient mutant using the T-DNA gene-trap system [J].PlantandCellPhysiology, 2003,44(5): 463-472.
[3] 高家旭.水稻黄绿叶突变体ygl80的遗传分析及基因定位 [D].成都: 四川农业大学,2014.
[4] JR S C. A rapid CTAB DNA isolation technique useful for RAPD fingerprinting and other PCR applications [J].Biotechniques, 1993,14(5): 748-750.
[5] MICHELMORE R W, PARAN I, KESSELI R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis: A rapid method to detect markers in specific genomic regions by using segregating populations [J].ProcNatlAcadSciUSA, 1991,88(21): 9828-9832.
[6] 杨振玉,张国良.中籼型优质光温敏核不育系广占63S的选育 [J].杂交水稻,2002,17(4): 4-6.
[7] 黄国寿,李平.亚种间重穗型杂交稻冈优881的选育与应用 [J].杂交水稻,2000,15(3): 7-8.
[8] SUN X Q, WANG B, XIAO Y H,etal. Genetic analysis and fine mapping of gene ygl98, for yellow-green leaf of rice [J].ActaAgronomicaSinica, 2011,37(6): 991-997.
[9] NAGAO S. Trial construction of twelve linkage groups in Japanese rice-genetical studies on rice plant, XXVII [J].JFACAgrHokkaidoUniv, 1963,53(1): 72-130.
[10] SAKAMOTO W, OHMORI T, KAGEYAMA K,etal. The purple leaf (Pl) locus of rice: The Pl(W) allele has a complex organization and includes two genes encoding basic helix-loop-helix proteins involved in anthocyanin biosynthesis [J].Plant&CellPhysiology, 2001,42(9): 982-991.
[11] 许凤华,程治军,王久林,等.水稻白条纹叶Gws基因的精细定位与遗传分析 [J].作物学报,2010,36(5): 713-720.
[12] YOO S C, CHO S H, SUGIMOTO H,etal. Rice virescent3 and stripe1 encoding the large and small subunits of ribonucleotide reductase are required for chloroplast biogenesis during early leaf development. [J].PlantPhysiology, 2009,150(1): 388-401.
[13] 刘文真.三个水稻叶色突变体的鉴定与基因克隆 [D].杭州: 浙江大学,2006.
[14] WANG P, GAO J, WAN C,etal. Divinyl chlorophyll(ide) a can be converted to monovinyl chlorophyll(ide) a by a divinyl reductase in rice [J].PlantPhysiology, 2010,153(3): 994-1003.
[15] 陈青.水稻T-DNA插入黄叶突变体基因克隆与功能分析 [D].北京: 中国农业科学院,2007.
[16] 吴自明.水稻黄绿叶基因ygl1的图位克隆及功能分析 [D].南京: 南京农业大学,2007.
[17] ZHANG H, LI J, YOO J H,etal. Rice chlorine-1 and chlorine-9 encode ChlD and ChlI subunits of Mg-chelatase, a key enzyme for chlorophyll synthesis and chloroplast development [J].PlantMolBiol, 2006,6: 325-337
[18] LEE S, KIM J H, ENU S Y,etal. Differential regulation of chlorophyll a oxygenase genes in rice [J].PlantMolBiol, 2005,57: 805-818
[19] 何瑞锋,丁毅,佘金洪,等.水稻‘斑马叶’叶绿素含量及几种酶活性的变化 [J].武汉大学学报: 自然科学版,2000,46(6): 761-765.
[20] 邓晓娟,张海清,王悦,等.水稻叶色突变基因研究进展 [J].杂交水稻,2012,27(5): 19-30.
[21] HUANG X, ZHANG X, YANG S,etal. A novel chloroplast-localized protein EMB1303 is required for chloroplast development in Arabidopsis [J].CellResearch, 2009,19(10): 1225-1225.
[22] SU N, HU M L, WU D X,etal. Disruption of a rice pentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance see purity in hybrid rice production [J].PlantPhysiology, 2012,159(1): 227-238.
[23] ZHOU H, ZHOU M, YANG Y,etal. RNase Z(S1) processes UbL40 mRNAs and controls thermosensitive genic male sterility in rice [J].NatureCommunications, 2014,5: 4884.
FineMappingandCloneaYellowGreenLeafGene(YGLOSH)inRice
CAOChangxiang1,2,XUXiaohong3,WUJiabing1,2,WANGYing1,2,LUOXiaojin1,2
(1.InstituteofPlantBiology,SchoolofLifeSciences,FudanUniversity,Shanghai200438,China;2.StateKeyLaboratoryofGeneticEngineering,FudanUniversity,Shanghai200438,China;3.JiangxiHongyiSeedIndustryScienceandTechnologyCo.,LTD,Ganzhou341000,China)
A leaf color mutant Huang guangzhan 63S was obtained by 60Co Gamma ray treating seeds of photoperiod and temperature sensitive genetic male sterility line guangzhan 63S, this mutation showed yellow-green leaves during the whole life, and the genetic analysis of F2 populations confirmed that this mutational character was controlled by a single recessive karyogene namedyglosh. Analysis the F2 population builded by Huang guangzhan 63S and Shuhui 881 with BSA method, the gene was mapped between two microsatellite makers RM279 and Pm6 with physical distances about 68kb. Through sequencing analysis of cDNA in this interval we found the LOS_Os02g05890 which had been confirmed as target gene by transgenic complementary experiment has single base mutation and generate a terminator to terminate the gene translation. The gene may participate in chloroplast development or chlorophyll biosynthetic pathway.
rice; yellowing-green leaves; fine mapping; gene clone
0427-7104(2017)06-0645-08
2015-10-26
农业种质资源创新基础研究[沪农科攻字(2014)第7-1-2号];山东省农业良种工程项目: 农业生物资源创新利用;上海市自然科学基金[13ZR1402800]
曹昌翔(1990—),男,硕士研究生;罗小金,男,副教授,通信联系人,E-mail: luoxj@fudan.edu.cn.
Q943.2
A
