RNA干扰环指蛋白2基因抑制胰腺癌细胞系PANC- 1增殖和迁移
2018-01-10吴银芳孙晓东黄东胜
吴银芳,孙晓东,郑 宇,黄东胜
(1.浙江中医药大学 第二临床医学院, 浙江 杭州 310053;2.杭州医学院附属浙江省人民医院 肝胆胰外科, 浙江 杭州 310014)
研究论文
RNA干扰环指蛋白2基因抑制胰腺癌细胞系PANC- 1增殖和迁移
吴银芳1,2,孙晓东2*,郑 宇2,黄东胜2
(1.浙江中医药大学 第二临床医学院, 浙江 杭州 310053;2.杭州医学院附属浙江省人民医院 肝胆胰外科, 浙江 杭州 310014)
目的研究沉默环指蛋白2(RNF2)基因对人胰腺癌细胞系PANC- 1增殖、迁移、周期和凋亡的影响及可能机制。方法用siRNA- RNF2转染PANC- 1细胞沉默RNF2表达,同时设立转染无义序列(siRNA- NC)的空转染组及不进行任何处理的空白对照组(mock)。荧光定量PCR检测RNF2 mRNA表达;Western blot检测RNF2和p53表达;MTS实验和划痕实验分别检测细胞增殖和迁移能力;流式细胞计量术检测细胞转染率、凋亡率和细胞周期。结果相比正常胰腺导管上皮细胞,RNF2在胰腺癌细胞系中高表达(P<0.05)。转染siRNA- RNF2的PANC- 1细胞与阴性对照组比较,RNF2 mRNA及蛋白表达下调;细胞增殖被抑制(P<0.05);细胞迁移能力下降(P<0.05);细胞凋亡率增高(P<0.05);G0/G1期细胞比例上升,S期和G2/M期细胞比例则降低(P<0.05)。此外,转染siRNA- RNF2显著下调PANC- 1细胞中p53蛋白的表达。结论siRNA- RNF2特异性下调胰腺癌细胞RNF2表达,显著抑制细胞增殖和迁移,结果提示RNF2可能成为胰腺癌基因治疗的一个新靶点。
环指蛋白2;胰腺癌;生长抑制;p53
胰腺癌是一类常见且高度恶性的消化道肿瘤,病死率居癌相关死因的第4位,5年生存率<5%[1- 2]。手术切除辅以放化疗目前仍为其主要治疗手段,但患者整体生存情况并不令人满意。因此,研究胰腺癌发病的分子生物学机制,可为胰腺癌的治疗提供新的理论依据和分子靶标。
环指蛋白2(RING finger protein,RNF2)基因定位于人染色体1q25.3位点,编码区由9个外显子组成,共编码336个氨基酸。RNF2是一种E3泛素连接酶,带有指环结构,归属于多梳基因家族(polycomb group, PcG),在干细胞自我更新、DNA损伤修复、早期胚胎发育、细胞周期调控及细胞增殖等方面发挥重要作用[3]。近年来研究发现,RNF2在许多恶性肿瘤中高表达,如乳腺癌和胰腺癌等,且其表达与肿瘤的发生、进展、预后及化疗耐药关系密切[4- 5]。因此,有理由推测RNF2在肿瘤的发生进展过程中起到了一定的生物学作用。然而是否RNF2在胰腺癌的发生进展中起到重要的作用,目前研究报道甚少。
本研究将RNF2 siRNA转染人胰腺癌细胞系PANC- 1,研究其对PANC- 1细胞增殖、细胞迁移、细胞周期及凋亡的影响,并初步探讨其作用机制,为以RNF2为靶点的胰腺癌基因治疗打下一定基础。
1 材料和方法
1.1 材料
1.1.1 材料和试剂: DMEM、Opti-MEM及胎牛血清(FBS)(Gibco公司);LipofectamineTM2000(Thermo公司);PrimeScriptTMRT reagent kit with gDNA eraser及定量PCR试剂盒(TaKaRa公司);MTS试剂盒(Promega公司);细胞周期与凋亡检测试剂盒(南京碧云天公司);靶向RNF2基因的siRNA(上海吉玛制药生物技术有限公司);Trizol试剂盒(Invitrogen公司);PCR引物(广州锐博生物公司);ECL化学发光试剂盒(Pierce公司)。
1.1.2 细胞来源:人胰腺癌细胞系SW1990、BxPC- 3、PANC- 1及正常胰腺导管上皮细胞HPDE6- C7均购自中国科学院上海生命科学研究院细胞资源中心。
1.2 实验方法
1.2.1 细胞转染:实验分为3组:未有siRNA转染的细胞为对照组(mock),转染非特异性的RNF2 siRNA为阴性对照组(siRNA- NC),以转染RNF2 siRNA为实验组(siRNA- RNF2)。以5×104个/孔将PANC- 1细胞传代于6孔板中,待细胞汇合度达70%左右时,按试剂盒说明进行转染。转染6 h后,换为有血清的DMEM培养液。分别于转染24、48和72 h后采用流式细胞计量术和荧光显微镜检测转染效率。RNF2 siRNA序列:正义链5′-AUUAUUG UGCUUGUUGAUCCU-3′,反义链5′-GAUCAACAAGC ACAAUAAUCA-3′; siRNA- NC序列:正义链5′-UUC UCCGAACGUGUCACGUTT-3′,反义链5′-TTAAGAG GCUUGCACAGUGCA-3′。
1.2.2 RT-qPCR检测RNF2 mRNA: 转染48 h后,用PBS(pH 7.4)洗涤细胞3遍,应用Trizol法抽提总RNA。紫外分光法检测RNA纯度和浓度。反转录参照TaKaRa公司试剂盒说明进行。按照SYBR® Premix Ex TaqTMⅡ 试剂盒说明进行荧光定量PCR,内参基因为β-actin。扩增反应在Bio-Rad CFX- 96 Real-time PCR仪上进行。结果采用2-ΔΔCt方法分析,每组实验均重复3次。RNF2上游引物:5′-AGCACAATAATCAGCAAGCACTC-3′,RNF2下游引物:5′-GCTCCACTACCATTTTCAATCTG-3′;β-actin上游引物:5′-TGGCACCCAGCACAATGAA-3′,β-actin下游引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。
1.2.3 Western blot检测RNF2蛋白: 用RIPA裂解液提取蛋白, BCA定量试剂盒进行蛋白定量,100 ℃变性10 min,将30 μg蛋白质通过12% SDS-PAGE进行分离。湿转至硝酸纤维素膜,封闭1 h后,加入RNF2一抗(1/1 000)、p53一抗(1/1 000, Abcam公司)、β-actin一抗(1/5 000)温育过夜。加入HRP标记羊抗兔二抗(1/5 000),室温温育1 h后,用ECL超敏化学发光试剂盒显色,Bio-Rad化学发光成像系统显像。实验重复3次。
1.2.4 MTS实验检测细胞增殖: 将处于对数期的PANC- 1细胞以1×104个/孔传代至96孔板,细胞贴壁后分别转染siRNA- RNF2或siRNA- NC,每组5个复孔,同时设置空白对照,6 h后换完全培养基继续培养。在转染前及转染后24、48、72和96 h,加入20 μL MTS试剂,37 ℃培养4 h后震荡1 min,490 nm波长处以自动酶标仪检测吸光度A值。抑制率%=[(对照孔A值-试验孔A值) /(对照孔A值-空白孔A值)]×100%,并绘制药物剂量反应曲线。
1.2.5 流式细胞仪检测细胞周期和凋亡: 按上述转染PANC- 1细胞,48 h后用0.25%胰蛋白酶消化收集细胞,4 ℃预冷70%乙醇中固定过夜。次日PBS洗2遍,每个样品均加入RNA酶A 10 μL和碘化丙啶(PI) 25 μL,4 ℃避光15 min,NovoCyte流式细胞计量仪(ACEA)检测其周期。同样操作收集细胞,PBS洗涤2遍后,加5 μL Annexin Ⅴ-FITC和10 μL PI荧光染料,按试剂盒说明书检测其凋亡,实验重复3次。
1.2.6 划痕实验检测细胞迁移: 分组转染PANC- 1细胞后,以4×105个/孔传代于6孔板中。培养至约90%汇合度时进行划痕操作。继续培养24 h,观察细胞迁移能力。划痕愈合率%=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度,实验重复3次。
1.3 统计学分析

2 结果
2.1 RNF2在胰腺癌细胞系中高表达
在3种胰腺癌细胞中RNF2 蛋白及mRNA水平的表达明显高于HPDE6-C7细胞(P<0.05) (图1),其中PANC- 1组RNF2基因表达量相对较高,故后续实验选用PANC- 1细胞作为siRNA转染对象。
2.2 siRNA- RNF2转染效率的检测
PANC- 1细胞转染siRNA- RNF2后24 h转染率为18.92%±1.34%,显著低于48 h的46.24%±2.92%。转染48 h后PANC- 1/siRNA- RNF2组有绿色荧光细胞显现,约占细胞总数的44%(图2),由此证实转染成功。
2.3 siRNA- RNF2显著下调PANC- 1细胞RNF2表达
转染48 h后,siRNA- RNF2组PANC- 1细胞中RNF2 mRNA的表达水平为0.12 ± 0.04,显著低于阴性对照组的1.04 ± 0.18 (P<0.05) 。siRNA干扰组细胞中RNF2的蛋白表达较阴性对照组也显著下降(图3)。

*P<0.05 compared with SW1990图1 RNF2在胰腺癌细胞系中高表达 Fig 1 Expression of RNF2 was up-regulated in pancreatic cancers (±s, n=3)

*P<0.05 compared with mock图2 PANC- 1细胞siRNA- RNF2转染效率的检测 Fig 2 Detection of transfection efficiency in PANC- 1 cells transfected with siRNA- RNF2 (×100, ±s, n=3)

*P<0.05 compared with mock and siRNA- NC图3 siRNA- RNF2对PANC- 1细胞RNF2表达的影响Fig 3 Effect of siRNA- RNF2 on RNF2 expression in PANC- 1 cells (±s, n=3)
2.4 转染siRNA- RNF2对PANC- 1细胞增殖、迁移、凋亡和周期的影响
siRNA- RNF2组细胞增殖能力在24 h时已降低,细胞增殖抑制率为9.2%±1.50%,至48、72和96 h时抑制率分别为17.5%±2.04%、28.1%±3.13%和51.5%±5.42%,显著高于阴性对照相的细胞增殖抑制率(P<0.05) (图4A)。划痕24 h后,siRNA- RNF2组愈合率为19.22%±1.80%,显著低于阴性对照组的59.30%±4.10%(P<0.05) (图4B)。转染48 h后,siRNA- RNF2组细胞凋亡率为20.36%±2.18%,高于阴性对照组的1.96%±0.52%(P<0.05) (图4C)。转染48 h后,siRNA- RNF2组G0/G1期的细胞比例为71.56%±5.42%,高于阴性对照组的48.38%±3.62%(P<0.05) (图4D)。
2.5 转染siRNA- RNF2对PANC- 1细胞p53表达水平的影响
转染siRNA- RNF2后细胞中p53的蛋白表达较阴性对照组明显上调(图4E),说明下调RNF2基因表达可以促进胞内p53的表达。
3 讨论
RNF2是一种E3泛素连接酶。RNF2在许多恶性肿瘤中高表达,如乳腺癌和胰腺癌等,且其表达与肿瘤的发生、进展、预后以及化疗耐药关系密切[4- 5]。本实验发现,相比正常胰腺导管上皮细胞,RNF2在胰腺癌细胞系中显著高表达(图1),与HPA数据库(http://www.proteinatlas.org/)数据及先前研究结果一致[5]。因此,RNF2可能成为胰腺癌新的肿瘤标志物和潜在的关键治疗靶标。
下调RNF2表达可以有效抑制肿瘤细胞的增殖,延缓肿瘤进展。研究发现下调RNF2表达可显著抑制HCT116结肠癌细胞增殖并诱导细胞凋亡,其机制可能与调节MDM2和p53稳定性有关[6]。RNF2可通过抑制TXNIP表达促进前列腺癌进展,敲除RNF2基因则可明显抑制前列腺癌细胞和体内移植瘤的生长[7]。已有研究表明,应用shRNA干扰RNF2表达可诱导食管癌细胞阻滞于G0/G1期并能增强肿瘤细胞对放疗的敏感性[8]。
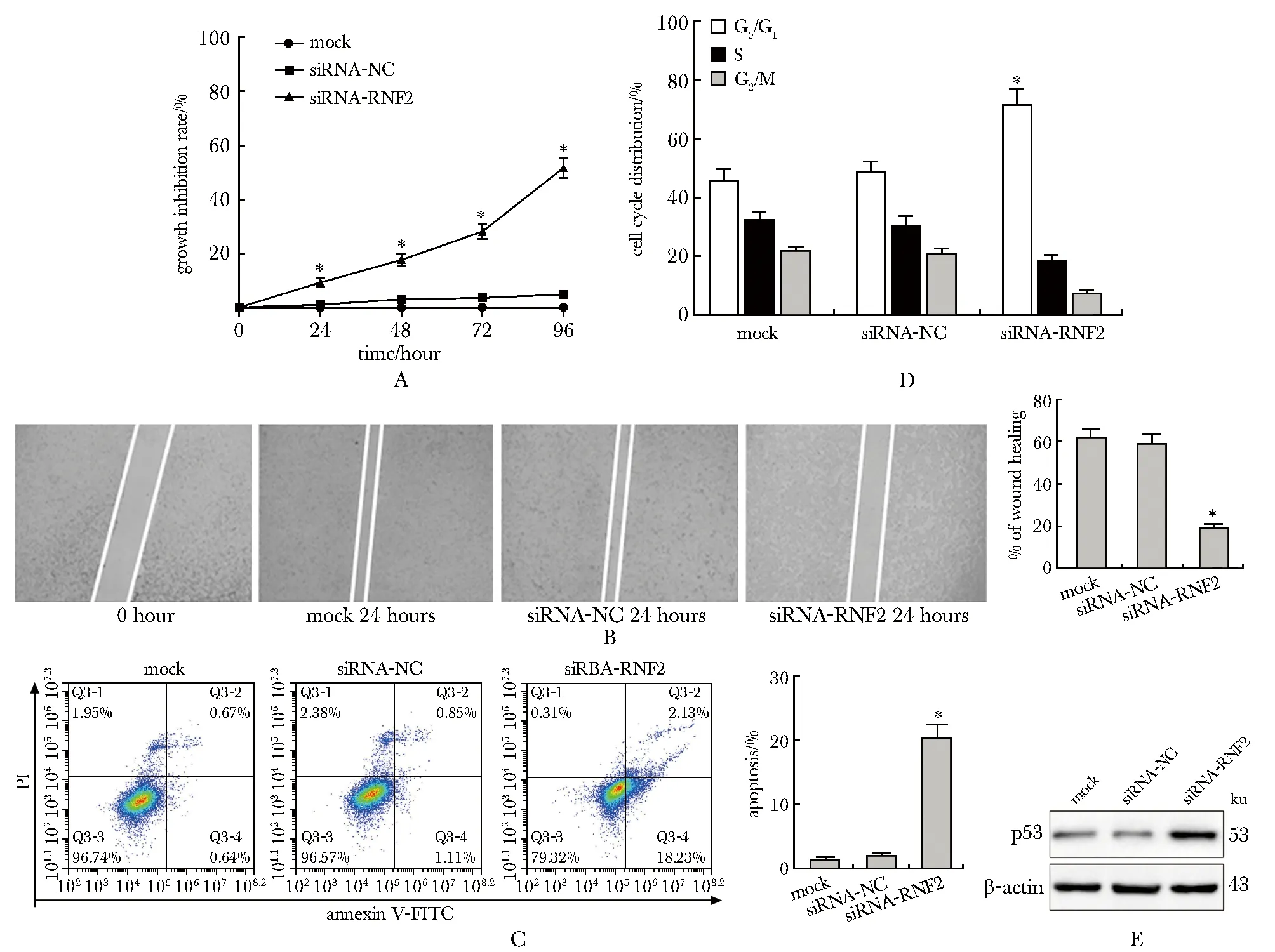
A.cell proliferation; B.cell migration; C.cell apoptosis; D.cell cycle; E.p53 expression;*P<0.05 compared with mock and siRNA- NC
图4下调RNF2表达对PANC-1细胞增殖、迁移、凋亡、周期及p53表达的影响
以上结果提示靶向RNF2可为肿瘤防治提供新的思路。但也有报道显示下调RNF2表达可以正性上调P-gp水平从而介导乳腺癌细胞化疗耐药[9]。为了研究siRNA- RNF2干扰后胰腺癌PANC- 1细胞增殖、迁移、凋亡和细胞周期的变化,本课题组进行了一系列相关实验。结果表明,下调RNF2表达可有效抑制胰腺癌细胞增殖和迁移,阻滞细胞于G0/G1期,并能诱导细胞凋亡,与上述研究结果相一致。这一研究结果为更深入的研究RNF2在胰腺癌中的功能打下一定基础。
针对下调RNF2表达抑制胰腺癌进展的可能机制,本课题组进行了初步探讨。已有研究显示,在肿瘤细胞中,RNF2通过其E3连接酶活性促进p53泛素化以降解p53从而发挥癌基因的作用,下调RNF2表达可使p53表达上调从而抑制肿瘤细胞的增殖[4,6]。p53是一种十分重要的肿瘤抑制蛋白,其主要作用为保持基因组的稳定性,减少基因突变的发生。研究发现p53的表达下调促进了肿瘤的发生和进展[10]。本实验结果显示,下调PANC- 1细胞中RNF2表达可使p53表达明显上调,提示RNF2可能通过抑制p53表达发挥促癌作用。
综上所述,下调RNF2表达可显著抑制胰腺癌细胞增殖和迁移,阻滞细胞于G0/G1期,并促进细胞凋亡,机制可能与上调p53表达有关。这将有助于进一步了解胰腺癌发病机制,为胰腺癌的治疗提供了新的干预靶点。
[1] Torre LA, Braf F, Siegel RL,etal. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015, 65: 87- 108.
[2] Beuran M, Negoi I, Paun S,etal. The epithelial to mesenchymal transition in pancreatic cancer: A systematic review [J]. Pancreatology, 2015, 15: 217- 225.
[3] Vidal M. Role of polycomb proteins Ring1A and Ring1Bin the epigenetic regulation of gene expression[J]. Int J Dev Biol, 2009, 53: 355- 370.
[4] Bosch A, Panoutsopoulou K, Corominas JM,etal. The Polycomb group protein RING1B is overexpressed in ductal breast carcinoma and is required to sustain FAK steady state levels in breast cancer epithelial cells [J]. Oncotarget, 2014, 5: 2065- 2076.
[5] Martinez-Romero C, Rooman I, Skoudy A,etal. The epigenetic regulators Bmi1 and Ring1B are differentially regulated in pancreatitis and pancreatic ductal adenocarcinoma[J]. J Pathol, 2009, 219: 205- 213.
[6] Wen W, Peng C, Kim MO,etal. Knockdown of RNF2 induces apoptosis by regulating MDM2 and p53 stability [J]. Oncogene, 2014, 33: 421- 428.
[7] Wei M, Jiao D, Han D,etal. Knockdown of RNF2 induces cell cycle arrest and apoptosis in prostate cancer cells through the upregulation of TXNIP [J]. Oncotarget, 2017, 8: 5323- 5338.
[8] Yang XX, Ma M, Sang MX,etal. Radiosensitization of esophageal carcinoma cells by knockdown of RNF2 expression [J]. Int J Oncol, 2016, 48: 1985- 1996.
[9] Rao PS, Mallya KB, Srivenugopal KS,etal. RNF2 interacts with the linker region of the human P-glycoprotein [J]. Int J Oncol, 2006, 29: 1413- 1419.
[10] Hollstein M, Sidransky D, Vogelstein B,etal. p53 mutations in human cancers [J]. Science, 1991, 253: 49- 53.
RNA interference targeting gene of RING finger protein inhibits proliferation and migration of pancreatic cancer cell line PANC- 1
WU Yin-fang1,2, SUN Xiao-dong2*, ZHENG Yu2, HUANG Dong-sheng2
(1.the Second Clinical Medical College, Zhejiang Chinese Medical University, Hangzhou 310053; 2.Dept. of Hepatobiliary and Pancreatic Surgery, Zhejiang Provincial People’s Hospital, People’s Hospital of Hangzhou Medical College, Hangzhou 310014, China)
ObjectiveTo investigate the effect of siRNA- mediated silencing ofRNF2 on cell proliferation, migration, cell cycle and apoptosis in human pancreatic cancer PANC- 1 cells and its possible mechanism.MethodsThe siRNA interference was used to down-regulate RNF2 expression. Meanwhile, there were also empty transfection group whose cells were transfected with the control siRNA and mock group without any treatment. The result of transfection was evaluated by fluorescence microscope. The expression of RNF2 mRNA was detected by RT-qPCR. Western blot was applied to detect the expression of RNF2 and p53. Cell proliferation and migration were analyzed by MTS assay and cell scratch assay, respectively. The transient transfection efficiency, apoptosis rate and cell cycle were measured by flow cytometry.ResultsCompared to the normalized human pancreatic duct epithelial cells, RNF2 expression in pancreatic cancer cells were higher (P<0.05). The expression of RNF2 mRNA and protein was decreased in PANC- 1 cells by siRNA- RNF2 at 48 h post-transfection. Transfection with siRNA- RNF2 inhibited the proliferation and migration of PANC- 1 cells (P<0.05), induced cell apoptosis (P<0.05), increased cell counts in phase G0/G1and decreased in S and G2/M phase (P<0.05). What’s more, after siRNA- RNF2 transfection, the expression of p53 protein was decreased.ConclusionssiRNA- RNF2 can specifically knockdown the expression of RNF2 gene and then inhibit the proliferation and migration of PANC- 1 cells. These results indicate RNF2 may be a potential target of gene therapy for pancreatic cancer.
RING finger protein 2; pancreatic cancer; growth inhibition; p53
2017- 09- 14
2017- 11- 18
浙江省自然科学基金(LY17H160066)
*通信作者(correspondingauthor):sunxiaodong@hmc.edu.cn
1001-6325(2018)01-0074-06
R735.9
A
