miR- 489通过调控TWIST1的表达抑制结肠癌干细胞表型和上皮间质转换
2018-01-10厉英超
任 莉,厉英超,贾 皑,张 丽,米 琛
(西安交通大学第一附属医院 消化内科, 陕西 西安 710061)
研究论文
miR- 489通过调控TWIST1的表达抑制结肠癌干细胞表型和上皮间质转换
任 莉*,厉英超,贾 皑,张 丽,米 琛
(西安交通大学第一附属医院 消化内科, 陕西 西安 710061)
目的探讨miR- 489在结肠癌干细胞表型和上皮间质转换中的作用和调控机制。方法RT-qPCR检测多个人结肠癌细胞系(HT29、SW480、SW620和HCT116)和正常肠道上皮细胞HIEC中miR- 489表达;采用基因转染技术提高结肠癌细胞中miR- 489表达,Western blot检测过表达miR- 489对结肠癌干细胞标志物CD133、CD44、EpCAM、ALDH1和上皮细胞标志物E-cadherin、间质细胞标志物vimentin和N-cadherin的表达;RT-qPCR和Western blot检测TWIST1 mRNA和蛋白表达水平。结果4个结肠癌细胞系中的miR- 489相对表达量显著低于正常肠道上皮细胞HIEC中的表达(P<0.05)。在HT29和HCT116细胞中过表达miR- 489,4个结肠癌干细胞标志物表达降低(P<0.05);上皮细胞标志物表达增加(P<0.05);间质细胞标志物表达减少(P<0.05)。TWIST1是miR- 489潜在靶基因,在2个细胞系中过表达miR- 489,TWIST1 mRNA和蛋白表达水平均显著降低(P<0.05)。结论miR- 489在结肠癌细胞中低表达,过表达miR- 489可能通过调控TWIST1抑制结肠癌干细胞表型和上皮间质转换。
miR- 489;TWIST1;结肠癌;肿瘤干细胞;上皮间质转换
结肠癌是临床常见的恶性肿瘤,在中国的发病率逐年上升[1]。上皮间质转换(epithelial-mesenchy-mal transition,EMT)的主要特征是上皮细胞的特性丧失,而间质细胞的特性获得,从而使细胞获得迁移与侵袭能力,是肿瘤转移以及治疗失败的主要原因之一[2]。肿瘤干细胞(cancer stem cell,CSCs)是肿瘤内一小部分具有多向分化、自我更新和无限增殖潜能的干细胞,被认为是肿瘤发生、发展与转移的关键。miR- 489是微小RNA分子重要一员。研究表明,miR- 489作为抑癌基因,在胰腺癌[3]、乳腺癌[4]和胃癌[5]中均低表达,其与EMT属性、肿瘤耐药性和CSCs表型密切相关。目前关于miR- 489在结肠癌中的表达及与结肠癌干细胞表型和EMT的关系尚不清楚,本研究对结肠癌中miR- 489表达、EMT过程和CSCs特性获得的具体关系和相关分子机制进行了探讨。
1 材料与方法
1.1 试剂
人结肠癌细胞系(HT29、SW480、SW620和HCT116)和正常肠道上皮细胞HIEC(ATCC公司);RPMI 1640培养基、DMEM培养基、胰蛋白酶、胎牛血清、抗CD133、CD44、EpCAM、ALDH1、E-cadherin、vimentin、N-cadherin、TWIST1抗体以及通用二抗(Invitrogen公司);Trizol试剂盒、miRNeasy Mini Kit试剂盒、RT-PCR试剂盒、脂质体miR- 489 mimics和LipofectamineTM2000(Qiagen公司);hsa-miR- 489及其内参U6引物、TWIST1引物(上海吉玛生物公司合成)。
1.2 方法
1.2.1 细胞培养和传代:将人结肠癌细胞系(HT29,SW480,SW620,HCT116)培养于RPMI 1640培养基,正常肠道上皮细胞HIEC培养于DMEM培养基,置于5% CO2、饱和湿度、37 ℃细胞培养箱中培养,至细胞汇合度达80%时采用胰蛋白酶消化,传代2~3次,取对数期增殖的细胞用于实验。
1.2.2 RT-qPCR检测mRNA:用RT-qPCR检测miR- 489和TWIST1 mRNA含量,细胞良好后弃培养基,将各人结肠癌细胞系和正常肠道上皮细胞加入Trizol快速裂解细胞,提取总RNA,按照反转录试剂盒说明进行反转录反应,将总RNA反转录为cDNA,然后以以cDNA作为模板,U6 RNA为对照,进行RT-qPCR反应,反应程序为:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸34 s,扩增40个循环。计算Ct值,并计算△Ct。收集转染72 h后的细胞,按上述方法提取细胞总RNA,RT-qPCR法检测细胞内TWIST1 mRNA表达。miR- 489、TWIST1 mRNA相对表达量=2-△△Ct。
1.2.3 miR- 489 mimics转染:选择人结肠癌细胞系中较低表达的2种,接种于6孔板中,培养基中培养至细胞汇合度达50%左右,分两组,mimics组加入100 pmol/L miR- 489 mimics+5 μL LipofectamineTM2000,对照组加等量阴性对照mimics和5 μL LipofectamineTM2000,继续培养72 h。
1.2.4 Western blot检测蛋白:收集转染72 h后的细胞,弃培养基,用PBS洗涤3次后加入RIPA裂解液至充分裂解,冰上操作;离心后采用BCA法测定总蛋白浓度。将蛋白样品以5∶1比例加入6×上样缓冲液,煮沸5 min,12% SDS-PAGE。预制5% TBS-脱脂奶粉封闭液,室温封闭1 h后加入1∶1 000稀释的CD133、CD44、EpCAM、ALDH1、E-cadherin、vimentin、N-cadherin、TWIST1一抗或GAPDH一抗,4 ℃孵育过夜,TBST漂洗,加入1∶5 000稀释的通用二抗,室温孵育1 h。ECL液显色并胶片曝光,洗片后分析各蛋白表达量。蛋白表达量以目的蛋白/内参的吸光度值比值表示。
1.3 统计学分析
2 结果
2.1 miR- 489在结肠癌细胞和正常肠道上皮细胞中的表达
4种结肠癌细胞miR- 489相对表达量显著低于正常肠道上皮细胞(P<0.05)(图1)。4种结肠癌细胞中HT29和HCT116最低,选择这2种细胞系用作后续实验研究。
2.2 过表达miR- 489对结肠癌干细胞标志物的影响
HT29(图2A)和HCT116(图2B)细胞中结肠癌干细胞标志物蛋白表达水平在mimics组显著低于对照组(P<0.05)。
2.3 过表达miR- 489对结肠癌上皮间质转换的影响
HT29(图3A)和HCT116(图3B)细胞中结肠癌上皮细胞标志物E-cadherin在mimics组显著高于对照组, 间质细胞标志物vimentin和N-cadherin显著低于对照组(P<0.05)。
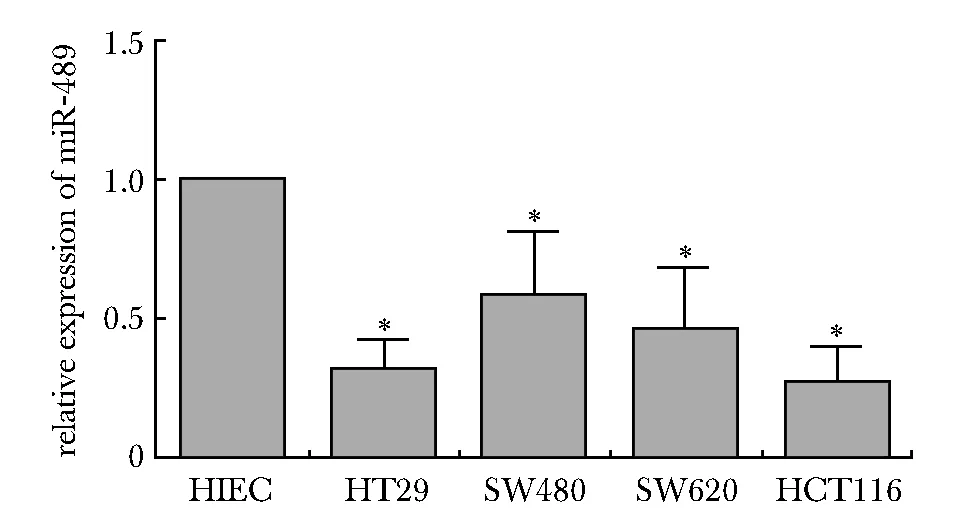
*P<0.05 compared with HIEC图1 miR- 489在结肠癌细胞和正常肠道上皮细胞中的表达Fig 1 Expression of miR- 489 in colon cancer cell lines and normal intestinal epithelial cell(±s, n=3)
2.4 miR- 489靶基因
Targetscan检索发现TWIST1是miR- 489潜在靶基因(图4)。
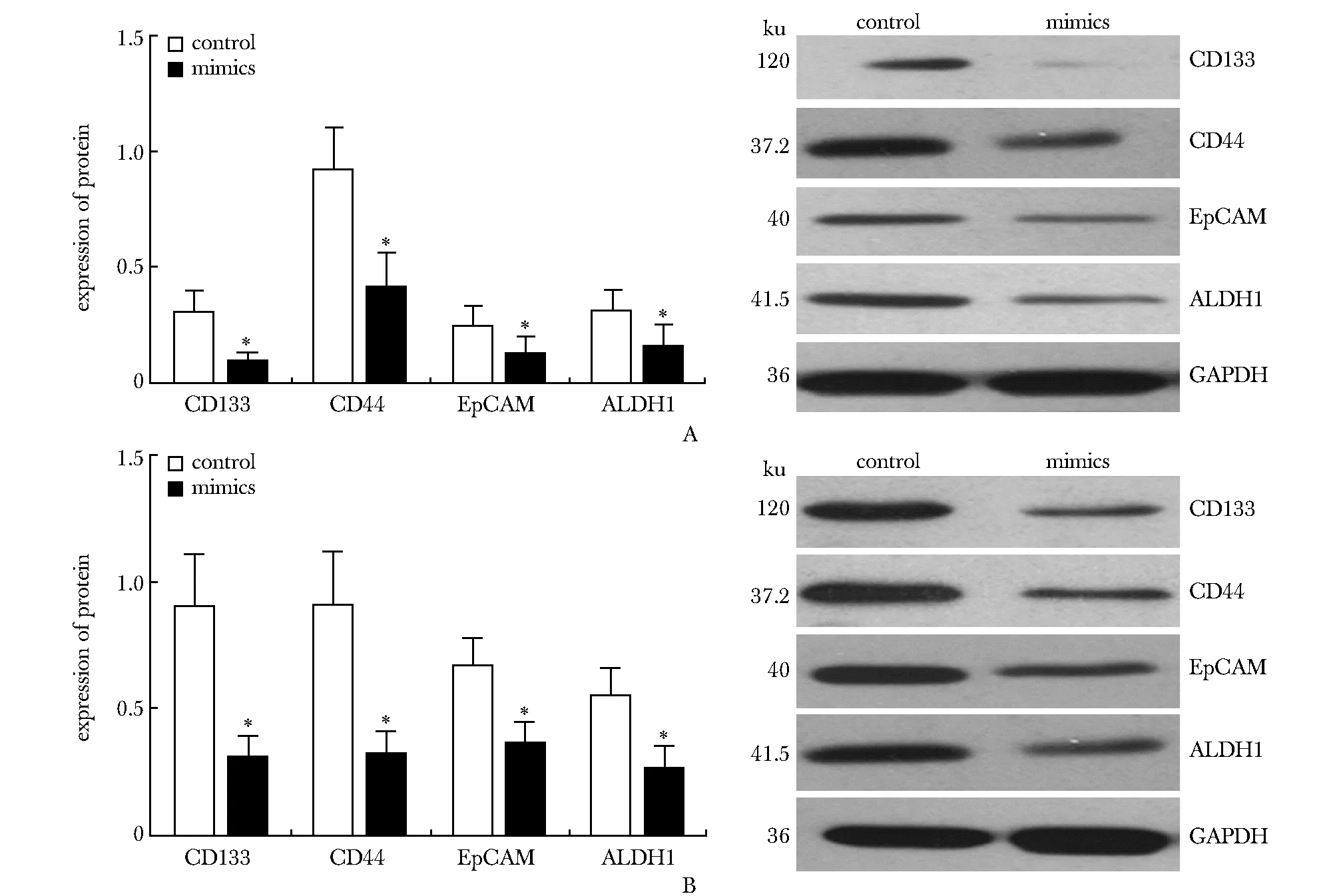
A.HT29 cell line; B.HCT116 cell line; *P<0.05 compared with control图2 过表达miR- 489对结肠癌干细胞标志物的影响Fig 2 Influence of up-regulation of miR- 489 expression on colon cancer stem cell markers(±s, n=3)
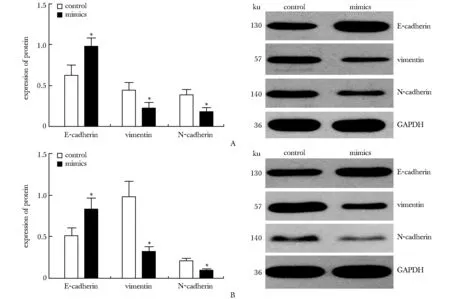
A.HT29 cell line; B.HCT116 cell line; *P<0.05 compared with control图3 过表达miR- 489对结肠癌上皮间质转换的影响
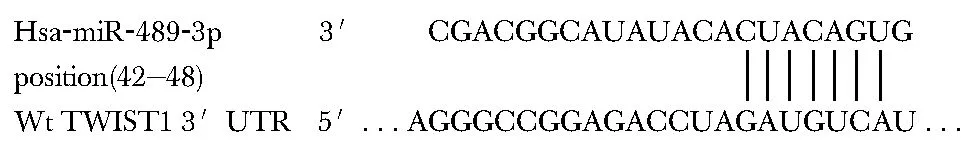
图4 miR- 489潜在靶基因检索Fig 4 Retrieval of potential target genes of miR- 489
2.5 过表达miR- 489对TWIST1 mRNA和蛋白表达的影响
过表达miR- 489,HT29(图5A)和HCT116(图5B)细胞中TWIST1 mRNA在mimics组表达量显著低于对照组(P<0.05);HT29(图6A)和HCT116(图6B)细胞中TWIST1蛋白表达水平在mimics组显著低于对照组(P<0.05)。
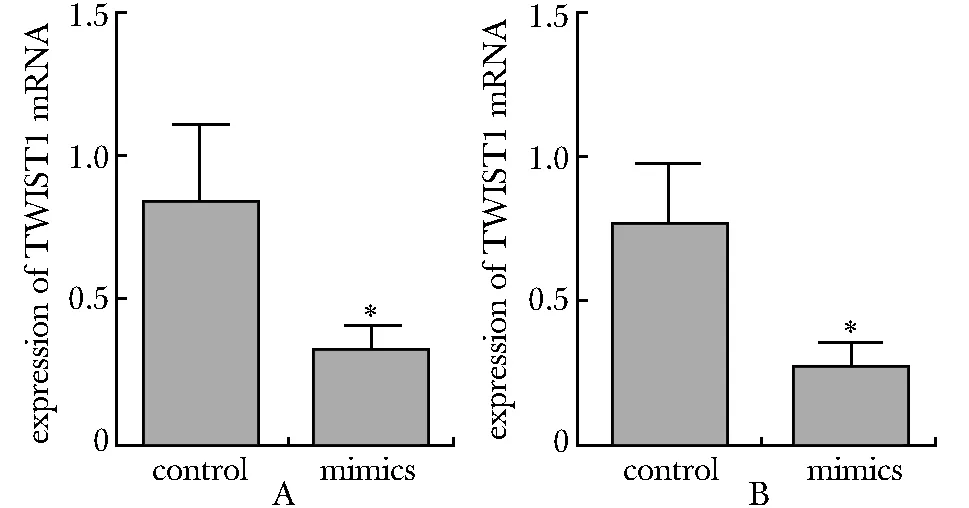
A.HT29 cell line; B.HCT116 cell line; *P<0.05 compared with control图5 过表达miR- 489对TWIST1 mRNA表达的影响Fig 5 Influence of up-regulation of miR- 489 expression
3 讨论
肿瘤转移是结肠癌预后的最主要影响因素,是一个复杂的过程,依赖于miRNAs、CSCs、EMT等多重因素作用。EMT可以让细胞获得迁移与侵袭能力,从而逃逸原发部位进入淋巴管和血管并形成远处转移,还可以继续重复EMT过程形成更多新的病灶。目前关于CSCs存在较多争议,肿瘤干细胞理论认为肿瘤起源于CSCs, 但也有研究发现癌细胞通过EMT过程即可获得侵袭能力更强的细胞和CSCs特性。可以肯定的是,实体肿瘤内存在CSCs,且在结肠癌中分离出了结肠癌CSCs[6]。
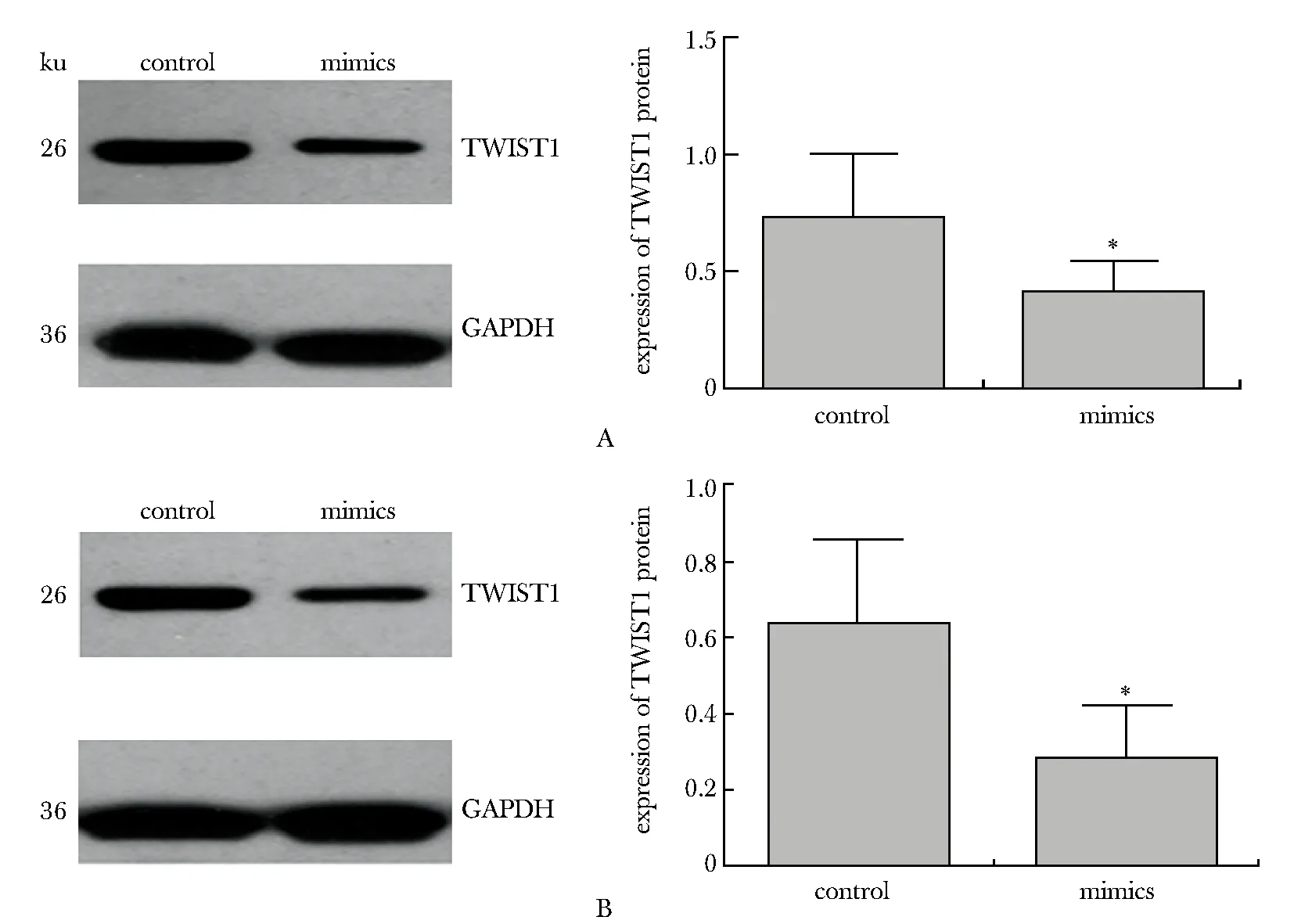
A.HT29 cell line; B.HCT116 cell line; *P<0.05 compared with control图6 过表达miR- 489对TWIST1 蛋白表达的影响Fig 6 Influence of up-regulation of miR- 489 expression on TWIST1 protein(±s, n=3)
目前关于miR- 489在肿瘤中的作用研究具有两面性,其主要作为抑癌基因在多种肿瘤中低表达。例如miR- 489作为抑癌基因靶向调控PROX1抑制胃癌生长[5]。miR- 489与EMT和CSCs特性有关,miR- 489能够调控靶基因Smad3和Smad3相关EMT属性影响乳腺癌耐药性[7]。而具有较高转移潜能的结肠癌类型与CSCs标志物和EMT标志物密切相关[8]。因此,推测miR- 489、CSCs和EMT是结肠癌转移的重要因素,且存在某种联系。
本研究结果发现,4种人结肠癌细胞系miR- 489相对表达量显著低于正常肠道上皮细胞HIEC。表明miR- 489在结肠癌中低表达,可能发挥抑癌基因作用。进一步研究miR- 489与CSCs和EMT的关系,结果发现过表达miR- 489能够抑制结肠癌干细胞表型和上皮间质转换。
miRNAs主要与靶基因的3′-非翻译区进行互补配对通过调控靶基因的表达,单个miRNA可以作用于多个靶基因。理论上miR- 489的有数个乃至数十个,但被验证的仍然较少。碱性螺旋-环-螺旋(bHLH)转录因子是调控真核生物生长发育较为重要的一类转录因子大家族。TWIST是bHLH家族成员之一,包括TWIST1和TWIST2两种亚型,新近研究发现,TWIST1是一种癌基因,是EMT的关键基因,参与EMT全过程,并影响肿瘤细胞的凋亡、迁移和侵袭[9]。TWIST1通过上调间充质表型表达,抑制上皮样结构表型促进肿瘤发生和进展[10]。通过过表达TWIST1可以降低上皮细胞标志物E-cadherin表达,并提高间质细胞标志物vimentin和N-cadherin表达,诱导EMT过程并促进肿瘤转移[11]。本研究结果表明,TWIST1可能是miR- 489的靶点,过表达miR- 489可能通过调控TWIST1抑制结肠癌干细胞表型和上皮间质转换。
[1] 万德森.结直肠癌流行病学与预防[J].中国中西医结合外科杂志,2011,17:3- 7.
[2] Cha YH, Yook JI, Kim HS,etal.Catabolic metabolism during cancer EMT[J].Arch Pharm Res,2015,38:313- 320.
[3] Yuan P, He XH, Rong YF,etal.KRAS/NF-κB/YY1/miR- 489 signaling axis controls pancreatic cancer metastasis[J].Cancer Res,2017,77:100- 111.
[4] Chen X, Wang YW, Xing AY,etal.Suppression of SPIN1-mediated PI3K-Akt pathway by miR- 489 increases chemosensitivity in breast cancer[J].J Pathol,2016,239:459- 472.
[5] Zhang B, Ji S, Ma F,etal.miR- 489 acts as a tumor suppressor in human gastric cancer by targeting PROX1[J].Am J Cancer Res,2016,6:2021- 2030.
[7] Jiang L, He D, Yang D,etal.miR- 489 regulates chemoresistance in breast cancer via epithelial mesenchymal transition pathway[J].FEBS Lett,2014,588:2009- 2015.
[8] Aquina CT, Mohile SG, Tejani MA,etal.The impact of age on complications, survival, and cause of death following colon cancer surgery[J].Br J Cancer,2017,116:389- 397.
[9] Zhang X, Wei C, Li J,etal.MicroRNA- 361- 5p inhibits epithelial-to-mesenchymal transition of glioma cells through targeting Twist1[J].Oncol Rep,2017,37:1849- 1856.
[10] Wang T, Hou J, Li Z,etal.miR- 15a- 3p and miR- 16- 1- 3p negatively regulate Twist1 to repress gastric cancer cell invasion and metastasis[J].Int J Biol Sci,2017,13:122- 134.
[11] Shiota M, Yokomizo A, Takeuchi A,etal.Protein kinase C regulates Twist1 expression via NF-κB in prostate cancer[J].Endocr Relat Cancer,2017,24:171- 180.
miR- 489 inhibits the stem cell phenotype and epithelial-mesenchymal transition of colon cancer by regulating the expression of TWIST1
REN Li*, LI Ying-chao, JIA Kai, ZHANG Li, MI Chen
(Dept. of Gastroenterology,the First Affiliated Hospital of Xi’an Jiao Tong University, Xi’an 710061, China)
ObjectiveTo explore the effects and regulation mechanism of miR- 489 on the stem cell phenotype and epithelial-mesenchymal transition of colon cancer cellsinvitro.MethodsThe miR- 489 expression of colon cancer cell lines (HT29, SW480 and SW620, HCT116) and normal intestinal epithelial cells HIEC were detected by RT-qPCR, the miR- 489 expression in colon cancer cells was raised by gene transfection technology, the colon cancer stem cell markers CD133, CD44, EpCAM, ALDH1 and epithelial marker E-cadherin, mesenchymal cells markers vimentin and N-cadherin were detected by Western blot. The expression of TWIST1 mRNA and protein were detected by RT-qPCR and Western blot.ResultsThe miR- 489 relative expression in four kinds of colon cancer cells (HT29, SW480 and SW620, HCT116) were significantly lower than that of normal HIEC intestinal epithelial cells, the difference was statistically significant (P<0.05). Up-regulation of miR- 489 expression in HT29 and HCT116 cells leaded to lower expression of colon cancer stem cell marker CD133, CD44, EpCAM ALDH1 and mesenchymal cells markers Vimentin, N-cadherin, higher expression of epithelial markers E-cadherin (P<0.05). Also, up-regulation of miR- 489 expression in HT29 and HCT116 cells leaded to lower expression of TWIST1 mRNA and protein (P<0.05).ConclusionsmiR- 489 is down-regulated in colon cancer cells and up-regulation of miR- 489 expression inhibits stem cell phenotype and epithelial-mesenchymal transition through targeting TWIST1 in colon cancer.
miR- 489; TWIST1; colon cancer; cancer stem cells; epithelial-mesenchymal transition
2017- 03- 14
2017- 04- 28
陕西省社会发展科技攻关项目(2014SF2- 16)
*通信作者(correspondingauthor):renli37465@163.com
1001-6325(2018)01-0051-06
R735.3
A
