表观扩散系数评价骨肉瘤化疗疗效的价值
2018-01-10王林吴学建王顺利史迎宾
王林,吴学建,王顺利,史迎宾
(1.郑州大学第一附属医院 创伤骨科,河南 郑州 450052;2.河南省郑州市骨科医院 骨肿瘤科,河南 郑州 450052)
表观扩散系数评价骨肉瘤化疗疗效的价值
王林1,吴学建1,王顺利2,史迎宾2
(1.郑州大学第一附属医院 创伤骨科,河南 郑州 450052;2.河南省郑州市骨科医院 骨肿瘤科,河南 郑州 450052)
目的探讨表观扩散系数(ADC)在骨肉瘤新辅助化疗疗效监测中的价值。方法28例确诊骨肉瘤患者于化疗前后接受MRI扫描。按治疗疗效分为疗效良好组和疗效较差组,分析两组治疗前后ADC值差异。结果28例骨肉瘤患者中疗效良好组21例,疗效较差组7例。治疗前疗效良好组和疗效较差组平均ADC值分别为(1.12±0.16)×10-3mm2/s和(1.57±0.20)×10-3mm2/s;治疗后分别为(2.33±0.18)×10-3mm2/s和(1.97±0.22)×10-3mm2/s,经独立样本t检验,差异均有统计学意义(P<0.05)。两组治疗前后ADC值变化率比较,差异有统计学意义(P<0.05)。结论ADC值对于评价骨肉瘤新辅助化疗疗效方面有较好价值,且治疗前ADC值可用于预测疗效。
表观扩散系数;骨肉瘤;治疗效果监测
早期评估骨肉瘤患者化疗疗效,对及时调整化疗方案和改善患者预后至关重要[1]。磁共振技术中的弥散加权成像(diffusion weighted imaging,DWI)可无创观察水分子弥散运动,已广泛应用于骨肌系统恶性肿瘤的诊断[2]。表观弥散系数(apparentdiffusion coefficient,ADC)指DWI所测得的生物组织弥散系数值,可以反映肿瘤细胞在体内的消长过程,并早于肿瘤形态学变化而预测疗效[3]。本文通过分析化疗前后骨肉瘤患者的ADC值改变,探讨其在预测骨肉瘤患者化疗疗效中的价值。
1 资料与方法
1.1 一般资料
选取2012年7月-2015年10月于郑州大学第一附属医院收治的骨肉瘤患者28例。其中,男性18例,女性10例;年龄9~40岁,平均19岁。患者临床表现为病变部位疼痛、局部肿块形成及肢体活动受限。发生于股骨远端13例,股骨干4例,胫骨近端8例,胫骨中段1例,腓骨近端2例。所有患者术前均行新辅助化疗,化疗结束评估疗效后行瘤体切除或局部截肢手术。纳入标准:①经穿刺或手术活检病理确诊的骨肉瘤;②患者之前未进行任何治疗手段;③术前常规行新辅助化疗;④化疗前后行MRI检查进行化疗疗效评估。排除标准:①不能耐受MRI检查者(例如装有心脏起搏器、有幽闭恐惧症等);②已经做过治疗的患者;③不能接受完整规范化疗患者。所有患者均签署知情同意书。
1.2 化疗方案
骨肉瘤患者均行顺铂+甲氨喋呤+表阿霉素+异环磷酰胺方案化疗。同时给予叶酸解毒。中位治疗时间为77d(42~141d)。
1.3 扫描参数
所有患者均接受>2次的MRI检查,第1次为化疗前,第2次为完成4个疗程化疗后。所有患者均采用德国Siemens公司的Verio 3.0T MR扫描仪,检查序列包括常规序列和DWI序列。常规序列包括自旋回波T1加权像(T1 weighted imaging,T1WI)序列[重复时间(repetition time,TR)630 ms,回波时间(echo time,TE)12 ms]、快速自旋回波T2加权像(T2 weighted imaging,T2WI)序列(TR 3 600 ms,TE 68 ms)及短时间反转恢复(short time inversion recovery,STIR)序列(TR 6 000 ms,TE 60 ms,TI 150 ms),矩阵320×320,视场400 mm×400 mm,层厚5 mm,层间距1 mm。DWI序列采用平面回波序列轴位成像(TR 4 000 ms, TE 60 ms),层厚5 mm,层间距1 mm,b值取0和1 000 s/mm2。增强扫描使用高压注射器经肘静脉以2.0 ml/s快速注入马根维显,扫描参数同平扫。
1.4 数据处理
将原始图像数据传至德国Siemens公司的影像后处理工作站,结合常规T1WI、T2WI、STIR及增强扫描选择合适感兴趣区(region of interest,ROI)进行测量。手工放置ROI,避开囊变坏死区,选取病灶扩散受限最显著的最大层面,选择病灶信号均匀一致且尽量接近病灶大小的ROI进行测量,分别测量3次取平均值。
化疗前后骨肉瘤病灶的ADC值变化率的计算公式:ADC值变化率=(化疗后ADC-化疗前ADC)/化疗前ADC×100%。2位有经验的骨骼肌肉系统影像科医师采用盲法对每个样本进行测量,最终所测ADC值为2名医师所测每个病灶ADC值的平均值。
1.5 病理学检查及疗效分组
2位具有>10年诊断经验的病理科医师共同观察骨肉瘤切除术后病理标本和切片,计算每个病例的肿瘤坏死率。肿瘤坏死率参照Huvos标准:完全坏死或<10%的活性肿瘤组织呈点状分布为疗效良好组(包括HuvosⅢ和Ⅳ级),没有坏死或>10%的残留活性肿瘤组织为疗效较差组(包括HuvosⅠ和Ⅱ级)[4]。
1.6 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
骨肉瘤患者化疗后根据疗效评估标准,21位患者评价为疗效良好组,7位患者评价为疗效较差组。治疗前所有病灶平均ADC值为(1.23±0.26)×10-3mm2/s,疗效良好组平均ADC值为(1.12±0.16)×10-3mm2/s,疗效较差组平均ADC值为(1.57±0.20)×10-3mm2/s。两组平均ADC值比较,差异有统计学意义(t=6.034,P=0.000)。治疗后疗效良好组平均ADC值为(2.33±0.18)×10-3mm2/s,疗效较差组平均ADC值为(1.97±0.22)×10-3mm2/s。两组平均ADC值比较,差异有统计学意义(t=-4.222,P=0.000)。见图1~8。
疗效良好组治疗后ADC值升高,ADC值变化率为(112.43±32.11)%。疗效较差组治疗后ADC值升高,ADC值变化率为(26.43±14.39)%。两组治疗前后ADC值变化率比较,差异有统计学意义(t=-6.796,P=0.000)。

图1 化疗前STIR矢状位
男性患者,18岁,右胫骨上端骨肉瘤。化疗前STIR序列,可见右侧胫骨上端溶骨性破坏,周围软组织肿块形成。

图2 化疗前ADC图
男性患者,18岁,右胫骨上端骨肉瘤。化疗前横断面ADC图显示右胫骨上端病灶呈低信号,化疗前平均ADC值为0.85× 10-3mm2/s。

图3 化疗后STIR矢状位
男性患者,18岁,右胫骨上端骨肉瘤。化疗后STIR序列,显示右侧胫骨上端病灶周围软组织肿块较前缩小,内可见坏死,疗效评价为反应良好。
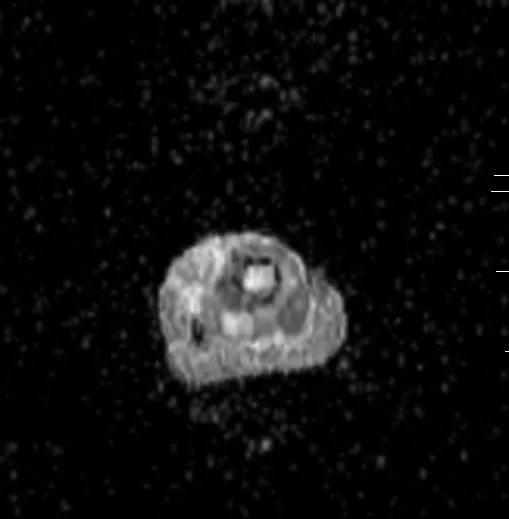
图4 化疗后ADC图
男性患者,18岁,右胫骨上端骨肉瘤。化疗后横断面ADC图显示右胫骨上端病灶信号升高,化疗后平均ADC值为2.09× 10-3mm2/s。

图5 化疗前STIR冠状位
男性患者,18岁,右侧胫骨中段骨肉瘤。化疗前STIR序列,可见右侧胫骨中段骨髓腔内斑片状压脂低信号。

图6 化疗前ADC图
男性患者,18岁,右侧胫骨中段骨肉瘤。化疗前横断面ADC图显示右胫骨中段病灶呈稍低信号,化疗前平均ADC值为1.21×10-3mm2/s。

图7 化疗后STIR冠状位
男性患者,18岁,右侧胫骨中段骨肉瘤。化疗后STIR序列,显示右胫骨中段病灶未见改变,疗效评价为反应较差组。

图8 化疗后ADC图
男性患者,18岁,右侧胫骨中段骨肉瘤。化疗后横断面ADC图显示右胫骨中段病灶信号稍增高,化疗后平均ADC值为1.82×10-3mm2/s。
3 讨论
骨肉瘤是最常见的原发骨恶性肿瘤,好发于青少年,预后差,可于数月内出现远处转移,截肢后5年存活率仅为5%~20%[5]。近年来,随着新辅助化疗的应用,骨肉瘤患者的5年生存率提高,大大改善了患者的生存率和生存质量,已成为除手术外最重要的预后影响因素[6]。目前骨肉瘤化疗疗效评估主要通过组织病理学和影像学检查来判定。组织病理学检查可以通过计算骨肉瘤病灶的肿瘤细胞坏死率来进行疗效评估,被认为是判定疗效的金标准,但受限于其为有创性的检查,且只能在肿瘤切除后进行,成本高,操作繁琐,限制了其在临床的应用[7]。
目前临床常用的影像学手段包括X线、CT、MRI及放射性核素骨扫描等,均可在一定程度上对骨肉瘤化疗疗效进行评价。X线和CT虽然能够显示骨质破坏范围的改变,判断有无新生骨形成,但均不能反应瘤体内细胞的存活情况。放射性核素骨扫描可通过放射性浓聚反映肿瘤细胞坏死率,但由于其放射性辐射较大,对于青少年患者进行随访监测疗效尚有争议。磁共振成像已经成为临床最重要的原发性骨肿瘤原发性骨局部分期的诊断方法肿瘤与术后肿瘤复发的检测。磁共振成像可以准确地对骨肉瘤进行术前分期,判断肿瘤浸润程度以及周围软组织的情况,已成为临床确定骨肉瘤分期和判断术后肿瘤复发的最重要的影像学检查[8]。
DWI是依靠不同组织间水分子弥散差异性造成的图像信号衰减来反映组织结构特性的功能性影像学检查。提供了与以往常规MRI相比不同的新的成像对比,可反映病理状态下组织内水分子运动状态的异常改变,一经研发,即成为临床早期发现、有效鉴别病灶的重要辅助手段。已经有研究证实,DWI序列结合ADC值的测定能够对骨肿瘤化疗疗效的判定提供依据[9-10]。BLACKLEDGE等[9]通过对11位乳腺癌和前列腺癌骨转移患者治疗前后的研究发现治疗后ADC值均较前有所升高,而反应良好组治疗后ADC值升高更明显。UHL等[10]分析8例骨肉瘤患者新辅助化疗前后的ADC值与术后病理改变,坏死组织ADC值的升高程度高过存活肿瘤。
骨肉瘤病灶中肿瘤细胞分布密集,核浆比例较高,肿瘤细胞产生纤维样基质造成细胞内外间隙变小,因此骨肉瘤细胞内外水分子运动受限,ADC值较低[11]。化疗后肿瘤细胞坏死,细胞数量减少,细胞膜和细胞内结构破坏,细胞核浆比例下降,肿瘤产生的纤维样基质也逐渐崩解,原阻挡细胞内外水分子运动的结构不复存在,最终导致ADC值升高[12]。笔者的研究也发现骨肉瘤疗效良好组治疗后ADC值较治疗前升高,且高于疗效较差组,两组化疗前后ADC值变化率比较有差异(P<0.05)。因此利用化疗前后ADC值的监测可以有效判断骨肉瘤化疗疗效。
近期多项关于乳腺癌、肝转移瘤的研究表明治疗前ADC值低的肿瘤较ADC值高的肿瘤对放化疗更敏感、治疗效果更好,其原因可能是治疗前ADC值低的肿瘤细胞密度相对较高,肿瘤血供相对更丰富,且坏死组织和(或)细胞膜破坏程度较低,因此化疗药物可更多地到达ADC值较低的肿瘤区域[13-14]。本研究结果显示两组治疗前ADC值有差异,疗效良好组平均ADC值低于疗效较差组,与其他学者的研究结果相符,证明ADC值可以用来对骨肉瘤化疗疗效进行预测,提供有关肿瘤预后的信息。
笔者的研究表明,ADC值测定可体现骨肉瘤对新辅助化疗的反应,为其发现肿瘤复发提供了新的检测手段,对化疗方案的制订以及预测患者预后有一定指导意义。
[1]dE BAERE T, VANELd, SHAPEERO L G, et al. Osteosarcoma after chemotherapy: evaluation with contrast material-enhanced subtraction MR imaging[J]. Radiology, 1992, 185(2): 587-592.
[2]孙美丽, 高振华, 罗柏宁. 骨肉瘤新辅助化疗疗效MRI评价的现况与进展[J]. 影像诊断与介入放射学, 2012, 21(3): 234-237.
[3]BAUR A, REISER M F.diffusion-weighted imaging of the musculoskeletal system in humans[J]. Skeletal Radiol, 2000, 29(10): 555-562.
[4]HUVOS A G, ROSEN G, MARCOVE R C. Primary osteogenic sarcoma:pathologic aspects in 20 patients after treatment with chemotherapy en bloc resection, and prosthetic bone replacement[J]. Arch Pathol Lab Med, 1977, 101(1): 14-18.
[5]林秾, 叶招明, 李玢, 等. 成人骨肉瘤的临床特点及预后影响因素[J]. 中华骨科杂志, 2009, 29(8): 717-722.
[6]汪新媛, 田京. 骨肉瘤化疗研究进展[J]. 国际骨科学杂志, 2010, 31(3): 159-161.
[7]LAUX C J, BERZACZY G, WEBER M, et al. Tumour response of osteosarcoma to neoadjuvant chemotherapy evaluated by magnetic resonance imagingas prognostic factor for outcome[J]. Int Orthop, 2015, 39(1): 97-104.
[8]张云, 崔建岭. 骨肉瘤新辅助化疗的疗效评价[J]. 国际医学放射学杂, 2016, 39(03): 281-284.
[9]BLACKLEDGE Md, COLLINSd J, TUNARIU N, et al. Assessment of treatment response by total tumor volume and global apparentdiffusion coefficient usingdiffusion-weighted MRI in patients with metastatic bonedisease: a feasibility study[J]. PLoS One, 2014, 9(4):dOI: 10.1371/journal.pone.0091779.
[10]UHL M, SAUERESSIG U, KOEHLER G, et al. Evaluation of tumour necrosisduring chemotherapy withdiffusion-weighted MR imaging: preliminary results in osteosarcomas[J]. Pediatr Radiol 2006, 36(12): 1306-1311.
[11]马玲, 孟悛非, 陈应明, 等. 表观扩散系数值在原发性恶性骨肿瘤诊断中的价值[J]. 中华放射学杂志, 2004, 38(11): 1129-1134.
[12]COLAGRANDE S, CARBONE S F, CARUSI L M, et al. Magnetic resonancediffusion-weighted imaging: extraneurological applications[J]. Radiol Med, 2006, 111(3): 392-419.
[13]金观桥, 苏丹柯, 罗殿中, 等. 表观扩散系数直方图预测局部晚期乳腺癌患者新辅助化疗疗效的价值[J]. 中华放射学杂志, 2015, 49(7): 491-494.
[14]KOHd M, SCURR E, COLLINSd, et al. Predicting response of colorectal hepatic metastasis: value of pretreatment apparentdiffusion coefficients[J]. AJR Am J Roentgenol, 2007, 188(4): 1001-1008.
Value of apparentdiffusion coefficient in evaluation of curative effect of chemotherapy for osteosarcoma
Lin Wang1, Xue-jian Wu1, Shun-li Wang2, Ying-bin Shi2
(1.department of Traumatic Orthopedics, the First Affiliated Hospital of Zhengzhou University, Zhengzhou, Henan 450052, China; 2.department of Bone Tumor, Zhengzhou Orthopaedics Hospital, Zhengzhou, Henan 450052, China)
ObjectiveTo investigate the application value of apparentdiffusion coefficient (ADC) in monitoring the effect of neoadjuvant chemotherapy for osteosarcoma.MethodsTwenty-eight osteosarcoma patients underwent MRI before and after the neoadjuvant chemotherapy. ADC values of the lesions were measured before and after treatment. The differences in ADC values before and after treatment in responders and non-responders were analyzed.ResultsAfter the neoadjuvant chemotherapy, 21 patients and 7 patients were categorized into the responder group and the non-responder group respectively. The mean pre-treatment ADC values of the responder group and the non-responder group were (1.12 ± 0.16)×10-3mm2/s and (1.57 ± 0.20)×10-3mm2/s, respectively. The mean post-treatment ADC values of the responder group and the non-responder group were (2.33 ± 0.18)×10-3mm2/s and (1.97 ± 0.22)×10-3mm2/s respectively. The differences in the ADC values between the two groups before and after chemotherapy were statistically different (P< 0.05). The difference in the rates of change of ADC values in the responder and non-responder groups before and after treatment was significant (P< 0.05).ConclusionsADC values enable a good short-term response evaluation for osteosarcoma and the pre-treatment ADC value indicates significant predictive value for responses to the treatment.
apparentdiffusion coefficient; osteosarcoma; therapeutic monitoring
10.3969/j.issn.1005-8982.2018.02.015
1005-8982(2018)02-0073-05
R738.1
A
2016-08-17
(李科 编辑)
