一种经肝门静脉注射制备肠源性脓毒症大鼠模型的方法
2018-01-10王守军康新路晓光杨轶仑范治伟白黎智宋轶
王守军 康新 路晓光 杨轶仑 范治伟 白黎智 宋轶
·论著·
一种经肝门静脉注射制备肠源性脓毒症大鼠模型的方法
王守军1,2康新1路晓光1杨轶仑1范治伟1白黎智1宋轶1
目的建立一种经肝门静脉注射制备肠源性脓毒症(GOS)大鼠模型。方法清洁级SD大鼠84只(250~300 g,12周龄),12只大鼠用于盲肠结扎并穿孔法(CLP)制备肠源性腹腔渗出液。72只大鼠采用随机数字法分为肝门静脉对照组(PV-S组)、肝门静脉渗液组(PV-E组)和下腔静脉渗液组(VC-E组),每组24只。PV-S组经肝门静脉注射0.9%氯化钠注射液(1 mL/只),PV-E组和VC-E组分别经肝门静脉和下腔静脉注射等量腹腔渗出液。各组大鼠再按腹腔渗液注射后1,2,4,6 h分为4个亚组。各亚组大鼠在相应时相点经腹主动脉采血,处死后取肺组织并收集肺泡灌洗液(BALF),测定血清和BALF中内毒素、肿瘤坏死因子-α(TNF-α)及白细胞介素-6(IL-6)含量,计算肺组织湿/干重(W/D)比值,观察肺形态学和病理形态学变化。结果PV-E组在腹腔渗液注射液后1,2,4,6 h血清和BALF中内毒素、TNF-α及IL-6含量以及肺组织病理学评分、肺湿/干重比均显著高于同时相点PV-S组大鼠(P均<0.05)。与PV-E组比较,VC-E组在腹腔渗液注射液后1,2,4,6 h血清和BALF中内毒素水平均升高(P均<0.05),而血清和BALF中TNF-α、IL-6水平降低(P均<0.05)。PV-E组大鼠经肝门静脉注射腹腔渗出液后1,2,4,6 h肺组织W/D值(1 h:8.53±2.05;2 h:9.41±1.24;4 h:10.35±0.69;6 h:11.05±1.95)较同时相点的PV-S组(1 h:5.16±1.13;2 h:5.17±1.34;4 h:5.14±2.04;6 h:5.13±1.95)和VC-E组(1 h:6.71±0.73;2 h:7.65±1.32;4 h:8.40±0.43;6 h:9.41±1.87)均明显增大(P均<0.05)。与PV-S组比较,PV-E组肺组织明显肿胀,有广泛点、片状出血点及淤血;VC-E组肺组织病变程度较PV-E组轻。与PV-S组和VC-E组比较,PV-E组肺病理组织学结果显示肺泡腔中见大量中性粒细胞、单核细胞和红细胞浸润,肺泡壁破坏严重、肺间质明显水肿,各时相点病理学组织学评分高于PV-S组(1 h:5.32±1.35 vs 0.25±0.02;2 h:6.44±0.72 vs 0.23±0.04;4 h:7.52±1.45 vs 0.27±0.02;6 h:8.69±0.35 vs 0.22±0.05,P均<0.05)和VC-E组(1 h:5.32±1.35 vs 3.37±0.73;2 h:6.44±0.72 vs 4.82±1.32;4 h:7.52±1.45 vs 6.47±0.43;6 h:8.69±0.35 vs 8.4±1.87,P均<0.05)。结论采用CLP 方法制备腹腔渗出液,经肝门静脉注射后可成功建立肺损伤为突出表现的GOS大鼠模型。
肠源性脓毒症; 盲肠结扎并穿孔法; 肝门静脉注射; 内毒素; 肿瘤坏死因子-α;白介素-6
肠源性脓毒症(gut origin sepsis,GOS)是危重患者的常见并发症,可继发急性肺损伤(acute lung injury,ALI)、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)甚至多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),已成为危重患者的重要死因之一。与其他部位感染所致的脓毒症相比,GOS的感染灶更为隐匿、临床检查手段有限,故而病死率居高不下[1]。既往研究发现[2-4],重症急性胰腺炎、失血性休克大鼠均存在肠黏膜屏障功能障碍。大量肠内细菌与毒素渗出至腹腔产生的腹腔渗出液中,存在大量毒性物质,如大肠杆菌等致病菌及其代谢产物、细菌产生的内毒素和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等炎性介质。这些肠源性细菌和内毒素易位入血是引发脓毒症、ALI/ARDS及MODS的重要原因[5-7]。但由于目前尚无符合相应临床表现的动物模型制备方法,因此极大限制了GOS相关基础研究的进行。为此,笔者设计了一种经肝门静脉注射由盲肠结扎穿孔法(cecal ligation and perforation,CLP)制备的肠源性腹腔渗出液的方法,模拟GOS早期细菌和内毒素经肝门静脉入血致ALI的病程发展过程,为进一步进行GOS相关基础研究提供一种新的建模方法。
资料与方法
一、实验动物、试剂和设备
(一)实验动物
健康清洁级成年SD大鼠84只,雌雄不限,体重250~300 g,由大连医科大学SPF动物实验中心提供(动物合格证号:SCXKGGD:2014-0025)。 本实验获得大连大学附属中山医院动物实验伦理委员会批准,动物处置过程符合动物伦理学标准。
(二)主要试剂和设备
戊巴比妥钠(上海伊卡生物技术有限公司,生产批号:EK140512);大鼠TNF-α及IL-6酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定试剂盒(美国Biosource);LEGEND MICRO 21R型台式高速冷冻离心机(美国Thermo 公司);大鼠革兰阴性菌脂多糖检测试剂盒(天津一瑞生物工程有限公司) 和MB-80微生物快速动态监测系统(北京金山川科技发展有限公司)。
二、动物分组与模型制备
(一)动物分组
随机数字法选取12只SD大鼠,用以制备GOS腹腔渗出液。余72只SD大鼠按照随机数字法分为3组:肝门静脉对照组(PV-S组)、肝门静脉渗液组(PV-E组)和腔静脉渗液组(VC-E组),每组24只。每组再按腹腔渗出液注射后1,2,4 ,6 h分为四个亚组。
(二)模型制备
1. CLP法[8]制备并采集腹腔渗出液:(1)12只SD大鼠均适应性喂养1周,术前禁食12 h,禁水4 h。(2)经腹腔注射2%戊巴比妥钠溶液(剂量为1 mL/kg体重)麻醉,取仰卧位,腹部术区备皮,碘伏消毒皮肤,铺无菌手术洞巾。(3)作长度约2.0 cm的上腹部正中切口,逐层切开皮肤、皮下组织,打开腹膜,进入腹腔。(4)牵盲肠于腹腔外,在距盲肠根部0.5 cm处结扎,用18号针头于对肠系膜缘盲肠壁透刺2个间距约1 cm的孔,将结扎后的盲肠还纳入腹腔。(5)为防止盲肠结扎穿孔后局部网膜组织包裹,炎症局限,腹腔无腹水出现,关腹前腹腔内注入0.9%氯化钠注射液3 mL,逐层缝合腹膜、肌肉及皮肤。(6)术后置SD大鼠于温暖、洁净鼠笼内。(7)造模后6 h,无菌条件下穿刺腹腔采集腹腔渗出液。每只大鼠可采集5~10 mL的腹腔渗出液,12只大鼠共收集了96 mL腹腔渗出液。将收集的腹腔渗出液注入250 mL无菌输液瓶中,连接一次性使用精密过滤输液器(过滤介质孔径为5 μm),过滤去除直径>5 μm的颗粒状物,收集滤出液备用(-20℃冰箱保存)。
2. 制备GOS模型:PV-S组经肝门静脉注射0.9%氯化钠注射液(1 mL/只),PV-E组和VC-E组分别经肝门静脉和下腔静脉注射等量CLP法制备的腹腔渗出液。(1)经肝门静脉注射法(图1a)麻醉满意后,取仰卧位,腹部术区备皮、消毒,铺无菌手术洞巾。作上腹部正中2.0 cm长的切口,逐层切开皮肤、皮下组织,打开腹膜,进入腹腔。用棉签掀起肝叶,暴露第一肝门部位,显露肝门静脉。在肝门静脉下1/3段,用1 mL一次性无菌注射器,将针体折曲15°,针头斜面向上,呈曲棍球杆头“L”形,进针深度约1.0 cm;穿刺成功后PV-E组、PV-S组分别注射收集的腹腔渗出液和0.9%氯化钠注射液(1 mL/只),持续时间1 min;注射完毕后退出针头,迅速用无菌棉签压迫针眼,压力大小以不出血且不阻断肝门静脉血流为宜,时间约5 min。观察确定无活动性出血后,关腹术终。(2)经下腔静脉注射法(图1b):VC-E组穿刺部位选取肝门静脉内后方的肝下下腔静脉,术前准备、手术步骤与剂量同肝门静脉注射法。
三、检测指标和方法
(一)血清内毒素、TNF-α及IL-6含量测定
1. 3组大鼠分别于肝门静脉、下腔静脉注射腹腔渗出液后1,2,4,6 h经腹主动脉取血,低温离心10 min(4℃,3 000 rpm)后取上清液,-20℃保存备用。
2. 动态比浊法测定血清内毒素变化:用于测定血清内毒素的血样采用含有少许肝素钠的无热原一次性采血管采集,3 000 rpm离心60 s分离得富血小板血浆,-30℃保存待用。检测时取富血小板血浆0.05 mL,加入0.45 mL样品处理液中,混匀后T01智能恒温仪上70℃保温10 min,取出后立刻放
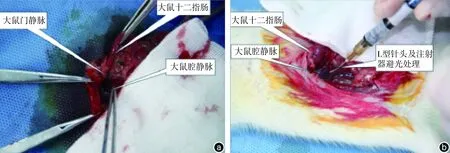
注:GOS为肠源性脓毒症。a:经肝门静脉注射腹腔渗出液;b:经下腔静脉注射腹腔渗出液
图1经肝门静脉和下腔静脉注射腹腔渗出液制备GOS大鼠模型
入冰水浴中,即为待测血浆样品。取待测血浆0.2 mL直接加入反应主剂中,溶解后使用微量加样器转移至10×75 mm标准玻璃反应管中(不要产生气泡),插入MB-80微生物快速动态测定系统中进行反应,反应结束后由标准曲线自动计算出待测血浆中内毒素含量。操作中注意避免微生物及细菌污染。
3. ELISA法检测血清TNF-α及IL-6含量变化:测定时,取-20℃冻存待检的血清复温30 min,具体操作步骤按照ELISA法检测试剂盒提供的说明书进行。
(二)肺泡灌洗液(bronchoalveolar lavage fluid,BALF)内毒素、TNF-α及IL-6含量测定
1.BALF采集与保存:动物处死后,取各组大鼠的左侧肺收集BALF。剪取5.0 cm长无菌输液器输液管(D=1.8 mm)作为气管插管,插入大鼠左侧主支气管内,并用4-0丝线结扎固定。5 mL注射器吸取预热至37℃的0.9%氯化钠注射液2.5 mL,经输液管-左支气管缓慢低压注入左肺,注入过程中可见肺组织充水后体积变大、颜色变苍白;再用注射器将肺内液体缓慢回吸,再次缓缓回注,如此过程反复进行5~10次,完成第1次灌洗过程。将回吸所得液体,注入离心管中,置于4℃冰浴保存;如此重复上述操作步骤,共3次,完成BALF的采集。将所收集的液体注入离心管中,离心(4℃,3 000 rpm,5 min)后取上清液置-20℃冰箱保存。
2.动态比浊法测定BALF内毒素含量,ELISA法检测TNF-α及IL-6含量变化(方法同血清样本的检测)。
(三)肺的大体形态学改变
大鼠采血后脱颈处死,取气管及支气管在内的双侧肺组织,观察其大体形态学改变。
(四)肺组织病理学改变
动物处死后,取各组大鼠的右肺中上叶,称重并计算湿/干重比值(wet and dry weight ratio,W/D)。取右肺下叶,经脱水、浸蜡、石蜡包埋、切片(厚度4 μm),苏木精-伊红(hematoxylin and eosin,HE)染色,光镜下(×200)观察肺组织病理学改变,并进行病理组织学评分(表1)。
四、统计学分析
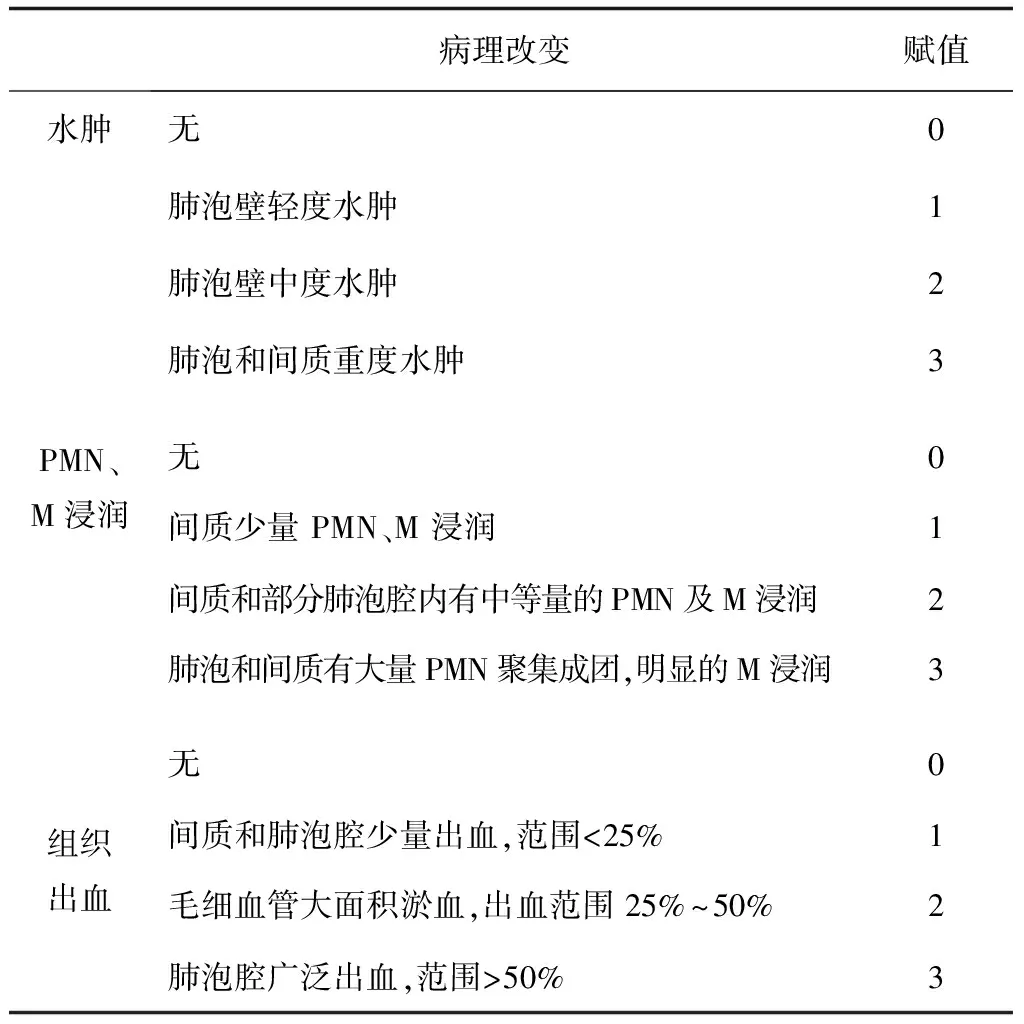
表1 肺病理组织学评分标准
注: PMN为多形核白细胞,M为单核细胞
结 果
一、各组大鼠血清内毒素、TNF-α及IL-6含量比较
PV-E组大鼠在经肝门静脉注射腹腔渗出液后1,2,4,6 h的血清内毒素、TNF-α及IL-6含量均高于同时相点的PV-S组,差异有统计学意义(P均<0.05);VC-E组大鼠的血清TNF-α及IL-6含量均低于同时相点的PV-E组,而血清内毒素含量高于同时相点的PV-E组,差异有统计学意义(P均<0.05)。见表2。
二、各组大鼠BALF中内毒素、TNF-α及IL-6含量比较
PV-E组大鼠经肝门静脉注射腹腔渗出液后1,2,4,6 h,BALF中内毒素、TNF-α及IL-6含量较相同时相点的PV-S组均增高,差异有统计学意义(P均<0.05);VC-E组大鼠腹腔渗出液注射后各时相点的BALF中,内毒素含量高于相同时相点的PV-E组,而TNF-α及IL-6则低于同时相点的PV-E组,差异有统计学意义(P均<0.05)。见表3。
三、肺组织W/D值变化
PV-E组大鼠经肝门静脉注射腹腔渗出液后1,2,4,6 h肺组织W/D值较同时相点的PV-S组明显增大,差异有统计学意义(P均<0.05)。VC-E组大鼠肺组织W/D值在建模后均低于PV-E组,差异有统计学意义(P均<0.05)。见表4。
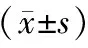
表2 PV-S组、PV-E组、VC-E组大鼠建模不同时相点血清内毒素、TNF-α及IL-6含量比较
注:PV-S组为肝门静脉对照组,PV-E组为肝门静脉渗液组,VC-E组为下腔静脉渗液组。GOS为肠源性脓毒症,TNF-α为肿瘤坏死因子-α,IL-6为白细胞介素-6。与同时相点PV-S组比较:aP<0.05;与同时相点PV-E组比较:bP<0.05
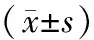
表3 PV-S组、PV-E组、VC-E组大鼠建模不同时间点BALF中内毒素、TNF-α及IL-6含量变化
注:PV-S组为肝门静脉对照组,PV-E组为肝门静脉渗组,VC-E组为下腔静脉渗液组。BALF为肺泡灌洗液,GOS为肠源性脓毒症,TNF-α为肿瘤坏死因子-α,IL-6为白细胞介素-6。与同时相点PV-S组比较:aP<0.05;与同时相点PV-E组比较:bP<0.05
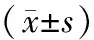
表4 PV-S组、PV-E组、VC-E组大鼠建模不同时相点肺组织湿/干重比
注:PV-S组为肝门静脉组,PV-E组为肝门静脉渗液组,VC-E组为下腔静脉渗液组。GOS为肠源性脓毒症。与同时相点与PV-S组比较:aP<0.05;与同时相点PV-E组比较:bP<0.05
四、肺组织形态学比较
(一)解剖结构比较
PV-S组未见明显水肿及淤血。PV-E组大鼠的肺组织呈暗红色,双肺体积明显增大、膨隆,广泛点、片状出血点及淤血,肺实变样改变;挤捏肺组织,气管内可见红色泡沫样液体,切开肺组织可见血性液体流出。VC-E组大鼠的肺组织表面出现出血点和肿胀,但肺损伤程度均较PV-E组轻。PV-E、VC-E组大鼠4个时相点的肺组织损伤程度随时间呈渐进性加重,但PV-E组大鼠损伤出现时间更早,程度更重。见图2。
(二)病理组织学变化
1. 肺组织石蜡切片HE染色结果:PV-S组肺泡结构清晰完整,肺泡间隙无水肿,肺泡腔内未见渗出及红细胞。VC-E 组肺泡结构破坏较严重,部分肺泡壁断裂;肺间质增厚,炎性细胞浸润,血管内皮细胞肿胀;肺泡腔内见较多渗出及红细胞。PV-E 组肺泡结构破坏严重,肺间质明显增厚,血管内皮细胞明显肿胀;肺泡腔内、细支气管壁及支气管细动脉周围均可见大量炎性细胞浸润,以中性粒细胞和淋巴细胞为主,并有大量渗出液和红细胞出现。见图3。
2.肺组织病理学评分:PV-E组大鼠在注射腹腔渗出液后1,2,4,6 h的肺组织病理学评分较同时相点的PV-S组增高(P均<0.05)。与PV-E组比较,VC-E组大鼠各时相点的肺组织病理学评分有所降低,差异有统计学意义(P均<0.05)。见表5。
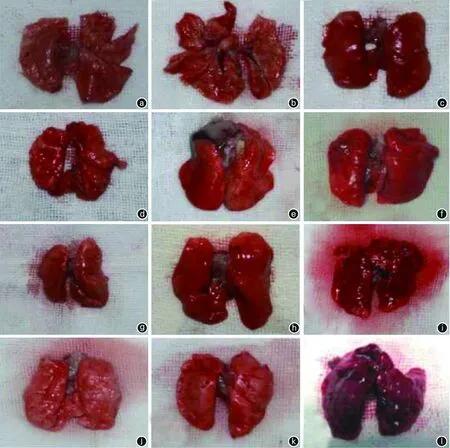
注:GOS为肠源性脓毒症。a、b、c分别为PV-S组、VC-E组和PV-E组建模1 h;d、e、f分别为PV-S组、VC-E组和PV-E组建模2 h;g、h、i分别为PV-S组、VC-E组和PV-E组建模4 h;j、k、l分别为PV-S组、VC-E组和PV-E组建模6 h。注:PV-S组为肝门静脉对照组,PV-E组为肝门静脉渗液组,VC-E组为下腔静脉渗液组
图2各组大鼠建模后不同时相点肺组织形态学比较
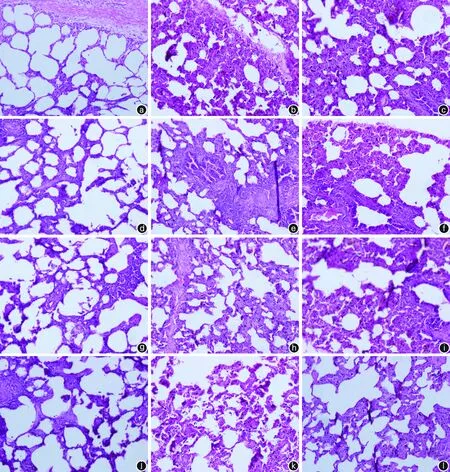
注:GOS为肠源性脓毒症。a、b、c分别为PV-S组、VC-E组和PV-E组建模1 h;d、e、f分别为PV-S组、VC-E组和PV-E组建模2 h;g、h、i分别为PV-S组、VC-E组和PV-E组建模4 h;j、k、l分别为PV-S组、VC-E组和PV-E组建模6 h。注:PV-S组经肝门静脉对照组,PV-E组为肝门静脉渗液组,VC-E组为经腔静脉渗液组
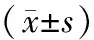
图3 各组大鼠建模后不同时相点肺组织病理学比较(石蜡切片,HE染色,×200)
注:PV-S组经肝门对照组,PV-E组为肝门静脉渗液组,VC-E组为下腔静脉渗液组。GOS为肠源性脓毒症。与同时间点与PV-S组比较:aP<0.05;与PV-E组比较:bP<0.05
讨 论
严重创伤、休克和感染等病理因素可使肠黏膜屏障功能被破坏,肠道内易位的细菌和内毒素作用经由肝、肺等组织“逐级放大”,引起全身炎症反应失控,最终导致MODS(其中以继发性ALI、ARDS最为常见[1,9])。因此,GOS对严重创伤、休克和感染等疾病的转归至关重要。目前亟需建立一种符合临床特征、凸显肝肺作为“放大器”作用的GOS建模。本研究采用CLP法制备肠源性腹腔渗出液,以其中存在的大量细菌和毒性物质作为媒介,建立一种GOS大鼠模型。
内毒素是革兰阴性细菌细胞壁外膜中以脂多糖(LPS)为主的成分,肝脏作为清除内毒素的主要脏器,也是遭受内毒素攻击的首要部位。正常情况下肠道中的少量内毒素被肠道吸收,经肝门静脉入肝脏后迅速被枯否氏细胞(Kupffer细胞)清除。本研究中,经肝门静脉注射GOS腹腔渗出液的PV-E组大鼠血清和BALF中内毒素水平均低于经下腔静脉注射渗出液的VC-E组。证明了肝脏对内毒素的吞噬作用。若过量的内毒素入血,超过了肝脏的解毒能力,则可进展为内毒素血症;血中内毒素水平升高又可加重肠黏膜屏障功能损害,形成恶性循环[10]。
内毒素为促炎介质产生的启动因素[11-12]。Kupffer细胞被其激活后可释放多种生物活性物质,包括细胞因子(TNF-α、IL-1、IL-6等)、趋化因子、过氧化物、一氧化氮(NO)、溶酶体酶和蛋白水解酶等,其中TNF-α是最重要的促炎介质。TNF-α是内毒素刺激单核巨噬细胞系统后最早释放的炎性细胞因子,可加重内毒素的细胞毒性作用,导致机体对内毒素的敏感性增强。同时TNF-α还可直接损伤肺血管内皮细胞,并动员、趋化、黏附、聚集、激活多形核中性白细胞(polymorphonuclear neutrophils,PMN),使肺内的PMN急剧增多并增强其吞噬能力,促进PMN脱颗粒和溶酶体酶释放,甚至致呼吸暴发,产生过量的氧自由基,破坏肺血管内皮细胞和肺上皮细胞。此外,内毒素还可激活核因子-κB,介导其他细胞因子(如IL-1、IL-6、IL-8)的合成与释放,启动炎症级联反应,进一步放大炎症效应,造成肺泡上皮细胞和毛细血管内皮细胞损伤,肺屏障功能遭到破坏而导致弥漫性肺水肿等肺部损伤[13-14]。本研究发现,经肝门静脉注射腹腔渗出液后,PV-E组大鼠的血清、BALF中TNF-α、IL-6和肺病理组织学评分显著高于经由下腔静脉注射的VC-E组,提示经肝门静脉注射腹腔渗出液后全身(肺部)炎症反应被增强,肝脏对GOS所致的全身炎症反应起到“放大效应”的作用。分析其原因,可能是由于肝脏内存在多种细胞可参与炎症反应,其中最主要的是Kupffer细胞。虽然Kupffer细胞的数量仅占全身吞噬细胞总量70%,但其吞噬能力占比高达95%,即促发全身炎症反应的潜在能力相当巨大。腹腔渗出液中各种炎症介质、毒性物质经肝门静脉到达肝脏后,作用于肝脏内Kupffer细胞,活化肝内单核-巨噬细胞系统生成大量炎症介质及细胞因子(TNF-α、IL-6等);产生的TNF-α可经血液循环播散至远隔组织器官,进而导致ALI甚至ARDS的发生。
本研究经肝门静脉注射采用CLP法制备的腹腔渗出液,并以不同静脉途径(下腔静脉)注射建模和同静脉途径0.9%氯化钠注射液注射作为对照,观察分析模型大鼠血清和BALF中内毒素、炎症介质变化和肺组织形态、病理组织学改变,反映出了肝脏对GOS所致肺损伤的放大效应。此建模方法将有利于研究GOS时肝、肺组织及其单核-巨噬细胞系统(Kupffer细胞与肺泡巨噬细胞)的病理及功能变化,了解GOS后肝、肺功能的损伤及其相互间作用的关系,探究调控细菌及内毒素入肝过程和Kupffer细胞主导的炎症瀑布反应机理等,为阐明GOS病理生理机制提供新思路、新方法。
1 王正国,梁华平.战创伤感染与脓毒症防治新策略[J/CD].中华卫生应急电子杂志,2015,1(1):1-2.
2 Lu XG,Kang X,Zhou FQ,et al. Effects of pyruvate-enriched peritoneal dialysis solution on intestinal barrier in peritoneal resuscitation from hemorrhagic shock in rats[J].J Surg Res,2015,193(1):368-376.
3 Xiaoguang Lu,Xin Kang,Libin Zhan,et al.Dai Huang Fu Zi Tang could ameliorate intestinal injury in a rat model of hemorrhagic shock by regulating intestinal blood flow and intestinal expression of p-VASP and ZO-1[J].BMC Complementary and Alternative Medicine,2014,14(1):80.
4 刘大全,李东华,刘洪斌,等.脓毒症大鼠肠道及腹水中菌群变化研究[J].中国实验诊断学,2011,15(5):812-817.
5 Fragoso IT,Ribeiro EL,Gomes FO,et al.Diethylcarbamazine attenuates LPS-induced acute lung injury in mice by apoptosis of inflammatory cells[J].Pharmacol Rep,2017,69(1):81-89.
6 Szabo G,Romics L Jr,Frendl G.Liver in sepsis and systemic inflammatory response syndrome[J].Clin Liver Dis,2002,6(4):1045-1066.
7 Milani Júnior R,Pereira PM,Dolhnikoff M,et al.Respiratory mechanics and lung morphometry in severe pancreatitis-associated acute lung injury in rats[J].Crit Care Med,2009,23(10):1882-1889.
8 Wichterman KA,Baue AE,Chaudry IH.Sepsis and septic shock: a review of laboratory models and proposal[J].J Surg Res,1980,29(2):189-201.
9 马晓媛,田李星,梁华平.中西医结合诊治脓毒症的现状及思考[J/CD].中华卫生应急电子杂志,2015,1(1):13-17.
10 王春妍,范玉强,胡东胜,等.大承气汤对急性肝损伤大鼠肠源性内毒素血症的干预作用[J].时珍国医国药,2009,20(9):2325-2326.
11 Jang AS,Lee JU,Choi IS,et al.Expression of nitric oxide synthase, aquaporin 1 and aquaporin 5 in rat after bleomycin inhalation[J].Intensive Care Med,2004,30(3):489-495.
12 王飞.PD-1对脓毒症小鼠肝脏枯否细胞功能的影响与机制研究
[D].上海:第二军医大学,2013.
13 Huang X,Tang J,Cai H,et al.Anti-Inflammatory Effects of monoammonium glycyrrhizinate on lipopolysaccharide-induced Acute lung injury in mice through regulating nuclear factor-kappa B Signaling Pathway[J].Evid Based Complement Alternat Med,2015:272474.
14 Chi X,Wei X,Gao W,et al.Dexmedetomidine ameliorates acute lung injury following orthotopic autologous liver transplantation in rats probably by inhibiting Toll-like receptor 4-nuclear factor kappa B signaling[J].J Transl Med,2015,13(1):190.
Amethodforpreparingratmodelofgutoriginsepsisviahepaticportalveininjection
WangShoujun1,2,KangXin1,LuXiaoguang1,YangYilun1,FanZhiwei1,BaiLizhi1,SongYi1.1
DepartmentofEmergencyMedicine,ZhongshanHospital,DalianUniversity,Dalian116001,China;2DepartmentofCareMedicine,CentralHospitalofWafangdianCity,Wafangdian116300,China
LuXiaoguang,Email:dllxg@126.com
ObjectiveTo establish a rat model of gut origin sepsis induced by portal vein injection.MethodsTwelve rats of 84 SD rats (250~300 g, 12 weeks) were used for preparation of peritoneal exudate of gut derived sepsis by cecal ligation and perforation (CLP). The other 72 rats were randomly divided into portal vein sham group (PV-S), portal vein exudate group (PV-E) and vena cava exudate group (VC-E), 24 rats in each group. Normal saline for 1 ml was injected into hepatic portal vein in PV-S group rats. The same amount of peritoneal exudate of gut origin sepsis was injected into rat body in PV-E group and VC-E group through the hepatic portal vein and inferior vena cava. Each group was divided into four subgroups according to intraperitoneal injection at 1, 2, 4 and 6 h. The abdominal aorta blood of subgroup was collected on different time points. The rats were executed and bronchoalveolar lavage fluid (BALF) was collected to detect the volume of endotoxin, tumor necrosis factor alpha (TNF-α) and interleukin-6 (IL-6) in serum and BALF, calculate the wet/dry weight ratio (W/D) and observe morphological and pathological changes of the lung.ResultsConcentrations of endotoxin, TNF-α,and IL-6 and lung pathology score and lung W/D of PV-E group rat were significantly higher than those of PV-S groupafter peritoneal exudate injection 1,2,4,6 h (P<0.05). Compared to PV-E group, the levels of endotoxin in VC-E group rats were increased and TNF-αand IL-6 in serum and BALF were decreased after peritoneal exudate injection 1, 2, 4, 6 h (P<0.05). Compared with PV-S group, the rats showed pulmonary edema, extensive and patchy hemorrhage and congestion in PV-E group. The W/D in PV-E group(1 h:8. 53±2.05, 2 h:9.41±1.24, 4 h:10.35±0.69, 6 h:11.05±1.95) was higher than that of PV-S group (1 h:5.16±1.13, 2 h:5.17±1.34, 4 h:5.14±2.04, 6 h:5.13±1.95) and VC-E group (1 h:6.71±0.73, 2 h:7.65±1.32, 4 h:8.40±0.43, 6 h:9.41±1.87,P<0.05). The degree of lung injury in group VC-E was lighter than that of PV-E group. Pulmonary histology showed a large number of neutrophils and monocytes, and even red blood cell infiltration, severe alveolar wall destruction and pulmonary interstitial edema in the PV-E group rats, and the histological score in PV-E group was higher than that in PV-S group (1 h:5.32±1.35 vs 0.25±0.02. 2 h:6.44±0.72 vs 0.23±0.04. 4 h:7.52±1.45 vs 0.27±0.02. 6 h:8.69±0.35 vs 0.22±0.05,P<0.05) and VC-E group (1 h:5.32±1.35 vs 3.37±0.73. 2 h:6.44±0.72 vs 4.82±1.32. 4 h:7.52±1.45 vs 6.47±0.43.6 h:8.69±0.35 vs 8.4±1.87,P<0.05).ConclusionsThe CLP method can be used to prepare the intestinal derived peritoneal effusion. A rat model of intestinal origin sepsis is successfully established by the portal vein injecting intestinal derived peritoneal effusion.
Gut origin sepsis; Cecal ligation and perforation; Portal vein injection; Lipopolysaccharide; Tumor necrosis factor-α; Interleukin-6
丁茂乾,姚元章,屈纪富,等.咪达唑仑联合瑞芬太尼治疗破伤风患者痉挛的疗效[J/CD].中华卫生应急电子杂志,2017,3(1):44-47.
10.3877/cma.j.issn.2095-9133.2017.01.006
国家自然科学基金(81673801,81473512,81202831,81173397)
116001 大连大学附属中山医院急诊医学科1;116300 瓦房店市中心医院重症医学科2
路晓光,Email:dllxg@126.com
2016-12-06)
(本文编辑:楚鹰)
