富营养化湖泊刚毛藻建群特征及其影响因素
2018-01-09郭亮亮李莉杰李敦海李根保中国科学院水生生物研究所淡水生态与生物技术重点实验室湖北武汉430072中国科学院大学北京00049
郭亮亮,李 露,李莉杰,李敦海,李根保* (.中国科学院水生生物研究所淡水生态与生物技术重点实验室,湖北 武汉 430072;2.中国科学院大学,北京 00049)
刚毛藻(Cladophora)是一种常见的丝状绿藻,属于绿藻门刚毛藻属,在全球范围内都有分布.当有充足光照时,可以生长在被水淹没或浸润的岩石上或者其他可以附着的基质上[1-3].刚毛藻具有分枝多、表面积大的特点[4].正是由于这一特点,刚毛藻可以为一些无脊椎动物、附着藻类和细菌等提供居住场所[5-8].同时, 刚毛藻在快速生长期会产生一些代谢产物排出体外,供上面的附着生物利用[9],附着生物也会分泌一些微量元素等供刚毛藻生长所需[8-10].因此,刚毛藻和附着在其丝状体上生长的生物组成一个小的生境,称为刚毛藻群落[11-12].刚毛藻群落中的附着藻类以硅藻门和绿藻门为主[12-14].当附着生物达到一定量时,会与刚毛藻竞争光照和营养,导致刚毛藻从基质上脱落下来,形成“藻垫”漂浮在水面上,随风漂移后堆积在沿岸带,对人类的生产和生活造成影响[15-16].
刚毛藻的生物量与水深有一定的关系.研究发现,刚毛藻的生物量随着水深的增加而降低[17-18].而光照、营养水平、基质类型以及捕食压力是影响以刚毛藻为主的底栖藻类群落在时间和空间上分布的重要环境因子,且环境因子之间有时会存在交互作用[19].当外界条件合适时,刚毛藻在 28d即可完成建群,并有稳定的群落结构[20].但是,关于富营养化水体中不同水深处刚毛藻建群特征的报道相对较少.
湖泊生态修复中,经常会出现丝状藻大量生长的现象,并最终影响湖泊中沉水植物的恢复[21-22].在对高原地区富营养化湖泊的野外调查中发现,滇池沿岸带的刚毛藻会出现季节性的消长[23].同时,室内研究发现低磷浓度及高光强条件下对寡枝刚毛藻的生长是不利的[24].在湖泊水体中,水深与光强具有紧密的相关性.本研究将水深作为主要探究因子,在草海沿岸带不同水深处挂放人工基质,研究刚毛藻的建群过程及其影响因素,为刚毛藻的控制提供实验依据.
1 材料与方法
1.1 实验设计
2016年4月1日,将作为刚毛藻群落生长基质的干净石板挂放于滇池草海“十二五”水专项示范工程区内(102.642ºE, 24.982ºN).用容量为330mL塑料瓶为石板提供浮力,以保证石板可以悬浮在固定水深.实验共设置5,25,45,65,85cm共5个水深.挂膜30d后开始第1次取样,以后每2周取样 1次,共取样 5次.每次每个深度随机取6~8块石板,即每个深度取 6~8个平行,用于观察建群情况和分析附着藻类的群落结构组成.水样采用100mL注射器分层取样,每个水层取300mL水样用来分析水质参数.
1.2 参数测定
水下光强用水下光量子仪(Spectrum Technologies Inc., USA)测定,为了便于分析,用不同水深处光强与水体表面光强的比值来表示不同水深处光强的相对大小.不同水深处光强的相对大小(Re-Light)为 L1/L0×100%,其中,L1为水面下某水深的光强,L0为水体表面的光强.水体温度(WT)、电导率(Cond)、pH值、溶解氧(DO)等水体理化指标用YSI (Yellow Springs Instruments,USA)现场测定,总氮(TN)、总磷(TP)、可溶性总氮(DTN)、可溶性总磷(DTP)、溶解性正磷酸盐(SRP)和氨氮(NH4+-N)的参数测定参照《水和废水监测分析方法(第四版)》[25].
生物量测定方法参照Stevenson等[12]的研究.采集后的石板,用蒸馏水轻轻洗去表面杂质,用直尺测量刚毛藻藻丝长度,以最长藻丝表征.用小刀刮下石块表面的刚毛藻群落.在 105ºC 下干燥48h即得到刚毛藻群落的干重.
1.3 附着藻类的定量与定性分析
刚毛藻上的附着藻类有蓝藻中的席藻属(Phormidium spp.)、颤藻属(Oscillatoria spp.)、伪鱼腥藻属(Pseudoanabaena spp.)等,绿藻中的丝藻属(Ulothrix spp.)、鞘藻属(Oedogonium spp.)、水绵(Spirogyra spp.)等,以及硅藻.由于附着蓝藻和绿藻很难与刚毛藻分开,所以本文只对硅藻进行了定量和定性分析.
将硅藻从刚毛藻群落中分离出来,样品处理参照Malkin等中的方法[11].将固定后的样品用摩尔比为50:50的浓硝酸-硫酸溶液消化4h,然后搅拌均匀,静置沉淀24h.小心吸去上层溶液,再加入去离子水洗涤沉淀,用玻璃棒搅拌后,再静置沉淀24h.反复多次,直至溶液pH值为6.0,则认为洗涤完成.对硅藻进行定量和定性分析时,将上述得到的沉淀与溶液充分混匀,吸取2mL,用去离子水定容至 10mL,在光学显微镜下进行硅藻鉴定与计数,最后换算为单位面积基质上硅藻的数量.每个深度计 3~4个平行.硅藻的鉴定参考《中国淡水藻类》[27].
1.4 数据处理与分析
刚毛藻群落生物量、藻丝长度以及硅藻密度用重复测量单因素方差分析.环境因子与刚毛藻群落生物量、藻丝长度以及附着硅藻密度之间的关系用多元逐步回归分析,环境因子与硅藻的物种组成关系用 Canoco4.5进行分析,用 Montecarlo假设检验来检验环境变量与硅藻组成的动态变化关系,显著性水平为 P<0.05.分析前,先用物种资料做去趋势对应分析(DCA)决定排序模型,模型选择主要根据分析结果中 Lengths of gradient第一轴的数值,若大于4.0,选用典范对应分析(CCA);若小于 3,用冗余分析(RDA).必要时对数据进行log10(x+1)转换.数据、图形处理分别利用SPSS 22和Origin 2016完成.
2 结果与分析
2.1 水体理化参数变化
实验期间,水体理化参数的变化范围如图1所示,实验结束时,水体中SRP浓度为(0.07±0.01)mg/L(图1A),NH4+-N 浓度为(0.20±0.05)mg/L(图1B).同一采样时间,不同水深处的水质差异不显著,而光照强度有显著性差异(P<0.001).光照强度随水深的增加而降低.5,25,45,65,85cm处的光强 分 别 为 表 面 光 强 的 (78±6)%,(48±8)%,(30±10)%,(18±8)%,(10±7)%(图1D).

图1 实验期间水体理化的变化Fig.1 Physical and chemical parameters during the experiment
2.2 刚毛藻群落生物量和藻丝长度
分析结果显示,刚毛藻群落的干重受建群时间和水深的影响(P<0.001).刚毛藻群落的干重随时间的变化趋势为先升高,一段时间内保持稳定,随后降低(图2A).从 4月 30日~5月 14日,水下25cm处刚毛藻群落的生物量显著高于其他水深的生物量(P<0.05).但5月30日取样时,5cm处刚毛藻群落的生物量最高,为(13.98±2.82)mg/cm2,是 25cm处刚毛藻群落生物量的 1.62倍(P=0.001).随后,刚毛藻群落的生物量有所下降(图2A).整个实验期间,65和85cm处刚毛藻群落的 生 物 量 较 少 ,分 别 为 (2.86±1.54),(1.39±0.71)mg/cm2.
如图2B所示,刚毛藻藻丝长度受建群时间和水深的影响(P<0.001).刚毛藻藻丝长度随时间的延长而增加(图2B).从4月30日到5月14日,水下25cm处刚毛藻藻丝显著长于其他水深处的长度(P<0.05).但是5月30日以后,5cm处刚毛藻藻丝逐渐超过 25cm 处的刚毛藻藻丝长度,在实验结束时达到最大值,为(11.8±1.7)cm(图2B).

图2 实验期间刚毛藻群落干重(A)及刚毛藻藻丝长度(B)的变化Fig.2 Dry weight of Cladophora community (A) and length of Cladophora (B) during the experiment
由研究结果知,刚毛藻群落生物量变化与刚毛藻藻丝变化基本一致.在滇池水体中,5,25cm处有利于刚毛藻群体的生长,而 65,85cm处刚毛藻群体生长受到限制.同时,由于65,85cm处刚毛藻群落生物量较小,相对来讲,营养盐是充足的.因此,在水面 65cm以下,限制刚毛藻群落增长的主要因素是光照强度.
2.3 附着硅藻
刚毛藻群落里的硅藻密度随着建群时间的延长呈现先上升后降低的趋势(图3).实验初期,在水下5和25cm处,硅藻密度显著大于其它水深处的硅藻密度(P<0.05).在5月30日时,水下25cm处硅藻密度是水下 5cm处硅藻密度的 2.16倍(P=0.001).在6月14日时,水下5cm处的硅藻密度最大,为 7.8×106cell/cm2(P<0.05).随后,硅藻密度降低.一方面大量附着硅藻的生长需要更多的营养盐;而另一方面,实验后期,水体 SRP和NH4+-N 浓度降低.因此,营养盐不足可能是导致附着硅藻密度降低的主要因素.而在整个实验期间,水下 85cm 处的附着硅藻密度一直较少.这主要是因为作为附着硅藻”载体”的刚毛藻在水下85cm处的生物量较少.

图3 实验期间刚毛藻群落中附着硅藻密度的变化Fig.3 Attached diatom density in the Cladophora community
如图4,在整个实验过程中,出现的硅藻主要有卵形藻属(Cocconeis spp.)、异极藻属(Gomphonema spp.)、小环藻属(Cyclotella spp.)、曲壳藻属(Achnanthes spp.)、舟形藻属(Navicula spp.)、窗纹藻属(Epithemia spp.)、菱形藻属(Nitzschia spp.)、桥弯藻属(Cymbella spp.)、针杆藻属(Synedra spp.)和脆杆藻属(Fragilaria spp.).其中,卵形藻和曲壳藻是真正营固着生活的藻类,而舟形藻、桥弯藻、窗纹藻等是兼具浮游和固着特性的藻类.

图4 实验期间不同水深处附着硅藻的群落组成变化Fig.4 Species composition of attached diatoms in different water depths during the experiment
实验前期,以舟形藻属(Navicula spp.)和曲壳藻属(Achnanthes spp.)居多,两类硅藻的细胞数之和占硅藻总细胞数的 69.2%~83.1%.实验中期和后期,以异极藻属(Gomphonema spp.)、曲壳藻属(Achnanthes spp.)、舟形藻属(Navicula spp.)和卵形藻属(Cocconeis spp.)居多,4类硅藻的细胞数之和占硅藻总细胞数的 52.1%~95.7%.这可能是因为刚毛藻快速生长阶段,会分泌大量次级代谢产物,使得附着硅藻优势种的多样性增加.
2.4 回归分析和相关分析
由表1知,相对光照强度以及SRP浓度是影响刚毛藻群落生物量的主要环境因子,2个环境因子解释了刚毛藻群落生物量变化的 68.1%,其中相对光照强度是最重要的环境因子,解释了刚毛藻群落生物量变化的 36.8%.相对光照强度、电导率和TP是影响刚毛藻藻丝长度的主要环境因子,3个环境因子解释了刚毛藻藻丝长度变化的 72.3%,其中相对光照强度解释了刚毛藻藻丝长度变化的23.5%(表2).影响附着硅藻密度的主要是NH4+-N浓度和相对光照强度,2个环境因子解释了附着硅藻密度变化的 73.6%(表 3),其中NH4+-N浓度是最重要的环境因子,解释了附着硅藻密度变化的66.9%.

表1 环境因子与刚毛藻群落生物量的多元回归统计结果Table 1 Multiple regression analysis of environmental factors and biomass of Cladophora community
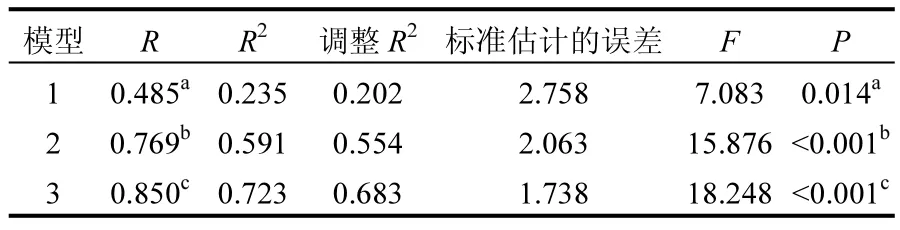
表2 环境因子与刚毛藻藻丝长度的多元回归统计结果Table 2 Multiple regression analysis of environmental factors and length of Cladophora

表3 环境因子与附着硅藻密度的多元回归统计结果Table 3 Multiple regression analysis of environmental factors and diatom density
如图5所示,RDA 2个排序轴第1轴和第2轴的特征值分别为0.51和0.11,两轴共解释了硅藻群落组成的 62.4%.其中,卵形藻属和异极藻属主要受水体磷(P)浓度影响;舟形藻属和曲壳藻属主要受水体氮(N)浓度影响;小环藻属和菱形藻属主要受水体浓度 NH4+-N浓度影响.同时大部分硅藻与水温呈负相关.分析结果显示, NH4+-N(P=0.002)和 pH 值(P=0.006)是显著影响硅藻群落组成的环境因子.

图5 附着硅藻群落组成与环境因子RDA双轴图Fig.5 Biplot of first and second RDA axis for species composition of diatom community and environmental factors
3 讨论
3.1 刚毛藻群落生物量
在整个实验阶段,水下65cm处的刚毛藻群落生物量鲜有增加,表明这是限制刚毛藻群落生物量增加的深度,而在水下 85cm 处,刚毛藻群落的生物量一直较少(1.39mg/cm2),可能是因为在这一水深刚毛藻的建群受到低光照强度的限制.但不同湖泊的限制水深不同.2001~2002年,对伊利湖的调查发现,水深在 0.5~10m 之间时,刚毛藻的生物量随水深的增加而降低,在0.5m水深处,刚毛藻的生物量最大,为(196.1±268.4)gDW/ m2,10m处的生物量最小,为(1.9±2.4)gDW/m2,研究人员认为这主要与不同水深处的日平均辐射有关[17].水下5cm 深度处,5月份刚毛藻群落的生物量较大,可能是因为从2016年5月中旬开始到7月初,昆明处于雨季,多云和雨天较多,光照强度相对 4月份较低,因此水下 5cm 处刚毛藻群落的生物量高于25cm处刚毛藻群落的生物量.室内研究表明,在光强为 50μmol/(m2·s)时,寡枝刚毛藻(C. oligoclona)的生长受到抑制[24].但是,在野外条件下,刚毛藻(C.oligoclona)表现出对强光的适应性.一方面是因为野外条件下,营养盐不受限制,有利于刚毛藻进行正常的生理代谢;另一方面,刚毛藻上的附着生物会降低其受到的光损害程度,增加刚毛藻对强光的耐受性(图6).研究表明,附着在植物体表面生长的硅藻会降低透射光的强度[28].实验结束时,水体的SRP(0.07mg/L)和NH4+-N(0.20mg/L)浓度降低,这可能是限制刚毛藻群落干重以及附着硅藻生物量增加的一个原因.

图6 刚毛藻及其附着生物的扫描电镜图Fig.6 SEM (scanning electron microscope) image of the Cladophora and its epiphytes
3.2 附着硅藻的密度
研究结果显示,附着硅藻群落的快速生长期滞后于刚毛藻群落的快速生长期.刚毛藻群落的快速生长期在5月30日左右,而硅藻的快速生长期在6月14日左右.这主要是在刚毛藻大量生长后,为附着硅藻提供了生长空间,使得其生物量大量增加[12,29-30].Malkin等研究发现,刚毛藻(C.glomerata)的快速生长期在6月上旬,2个星期后,附着硅藻群落的生物量开始大量增加[10],这与我们的结果类似.Stevenson等研究发现,在6~7月份刚毛藻的生物量积累高于附着硅藻的生物量积累,并在8月份达到最大值.随后刚毛藻的生物量降低,附着硅藻的生物量持续升高,10月份后,刚毛藻群落开始崩溃.整个调查期间,刚毛藻群落生物量的最高值(72.5mg/cm2)出现在 9月份[12].在我们的实验中,刚毛藻群落的生物量在 7月初开始降低.这可能是因为草海是富营养化湖泊,7月份微囊藻开始大量生长,使得水质变差,最终造成刚毛藻群落生物量的急剧降低.滇池外海刚毛藻在夏季出现生物量降低也可能是这个原因[23].同时,在附着硅藻密度最大时,刚毛藻群落的干重降低.这主要是因为大量的硅藻附着,影响了刚毛藻对光照和营养的吸收.Dodds等通过研究发现,当光照强度低于 200~500μmol/(m2·s)时,由于刚毛藻(C.glomerata)上附着生物中的色素对光的吸收,使得刚毛藻的光合速率降低[31].
3.3 附着硅藻的组成
水深虽然会影响附着硅藻的密度,但对刚毛藻上附着硅藻的种类组成影响甚少.附着硅藻的组成主要受NH4+-N浓度和pH值影响.Marks等研究发现,营养匮乏时(P<2µg/L,N=7µg/L),刚毛藻(C. glomerata)上附着硅藻的优势种为窗纹藻属;营养丰富时(P=150µg/L,N=300µg/L),刚毛藻上附着硅藻的优势种为曲壳藻属、舟形藻属和针杆藻属.加入N和P元素的处理组,曲壳藻属的相对丰度增加10倍,只添加N元素的处理组,曲壳藻属的相对丰度增加4倍,但在只添加P元素的处理组,曲壳藻属的相对丰度没有发生变化[26].兰波等研究发现NH4+-N和TP是影响洱海流域3个湖泊(洱海、西湖、茈碧湖)周丛藻类分布的主要环境因子,其中小环藻、脆杆藻、桥弯藻和异极藻与 NH4+-N呈正相关,而丝状绿藻上的附着硅藻主要与TP、SRP、pH值正相关[32].
总体来讲,刚毛藻群落生物量的增加以及群落的衰退主要受水下光照强度,即水深的限制.刚毛藻群落上的附着生物一方面保护刚毛藻不受强光损害;另一方面,由于其生物量的大量增加,影响刚毛藻对光以及营养的吸收,使刚毛藻生物量减少,进而造成刚毛藻群落的衰退.
4 结论
4.1 在滇池水体中,刚毛藻群落的生物量主要集中在水下0~25cm处.
4.2 刚毛藻群落中附着硅藻的优势种属为异极藻属、曲壳藻属、舟形藻属和卵形藻属,且附着硅藻的组成不受水深的影响.
4.3 SRP浓度和NH4+-N浓度是影响刚毛藻群落生物量、藻丝长度和附着硅藻密度的主要环境因子.
[1] Frossard V, Versanne J S, Aleya L. Factors supporting harmful macroalgal blooms in flowing waters: A 2-year study in the Lower Ain River, France [J]. Harmful Algae, 2014,33:19-28.
[2] Higgins S N, Malkin S Y, Howell E T, et al. An ecological review of Cladophora glomerata (Chlorophyta) in the Laurentian Great Lakes [J]. Journal of Phycology, 2008,44(4):839-854.
[3] Sheath R G, Cole K M. Biogeography of stream macroalgae in North-America [J]. Journal of Phycology, 1992,28(4):448-460.
[4] Jansson A M. The food-web of the Cladophora-belt fauna.Helgoländer wiss [J]. Meeresunters, 1967,15:574-588.
[5] Furey P C, Lowe R L, Power M E, et al. Midges, Cladophora,and epiphytes: shifting interactions through succession [J].Freshwater Science, 2012,31(1):93-107.
[6] Olafsson E, Aarnio K, Bonsdorff E, et al. Fauna of the green alga Cladophora glomerata in the Baltic Sea: density, diversity, and algal decomposition stage [J]. Marine Biology, 2013,160(9):2353-2362.
[7] Ward J M, Ricciardi A. Community-level effects of co-occurring native and exotic ecosystem engineers [J]. Freshwater Biology,2010,55(9):1803-1817.
[8] Zulkifly S B, Hanshew A, Young E B, et al. The epiphytic microbiota of the globally widespread macroalga Cladophora glomerata (Chlorophyta,Cladophorales) [J]. Amerian Journal of Botany, 2012,99(9):1541-1552.
[9] Cheney C, Hough R A. Factors controlling photosynthetic productivity in a population of Cladophora fracta (Chlorophyta)[J]. Ecology, 1983,64(1):68-77.
[10] Zulkifly S B, Graham J M, Young E B, et al. The Genus Cladophora Kutzing (Ulvophyceae) as a Globally Distributed Ecological Engineer [J]. Journal of Phycology, 2013,49(1):1-17.
[11] Malkin S Y, Sorichetti R J, Wiklund J A, et al. Seasonal abundance, community composition, and silica content of diatoms epiphytic on Cladophora glomerata [J]. Journal of Great LakesResearch, 2009,35(2):199-205.
[12] Stevenson R J, Stoermer E F. Seasonal abundance patterns of diatoms on Cladophora in Lake Huron [J]. Journal of Great Lakes Research, 1982,8(1):169-183.
[13] 向贤芬,兰 波,杨娇艳,等.洱海沿岸带刚毛藻群落的特性分析[J]. 水生生物学报, 2011,35(6):1049-1055.
[14] Mpawenayo B, Mathooko J. The structure of diatom assemblages associated with Cladophora and sediments in a highland stream in Kenya [J]. Hydrobiologia, 2005,544(1):55-67.
[15] Chun C L, Ochsner U, Byappanahalli M N, et al. Association of toxin-producing Clostridium botulinum with the macroalga Cladophora in the Great Lakes [J]. Environmental Science Technology, 2013,47(6):2587-94.
[16] Chun C L, Kahn C I, Borchert A J, et al. Prevalence of toxin-producing Clostridium botulinum associated with the macroalga Cladophora in three Great Lakes: Growth and management [J]. Science of The Total Environment, 2015,511:523-529.
[17] Higgins S N, Howell E T, Hecky R E, et al. The wall of green: the status of Cladophora glomerata on the northern shores of Lake Erie's eastern basin, 1995—2002 [J]. Journal of Great Lakes Research, 2005,31(4):547-563.
[18] Higgins S N, Pennuto C M, Howell E T, et al. Urban influences on Cladophora blooms in Lake Ontario [J]. Journal of Great Lakes Research, 2012,38:116-123.
[19] 裴国凤,刘国祥,胡征宇.云南高原湖泊沿岸带底栖藻类群落的分布 [J]. 武汉植物学研究, 2008,26(4):373-378.
[20] 裴国凤.淡水湖泊底栖藻类的生态学研究 [D]. 武汉:中国科学院研究生院, 2006:23-43.
[21] 李敦海,史龙新,李根保,等.丝状绿藻腐烂过程对水质和沉水植物黑藻生长的影响实验研究 [J]. 环境科学与管理, 2006,31(6):27-30.
[22] Irfanullah H M, Moss B. Factors influencing the return of submerged plants to a clear-water, shallow temperate lake [J].Aquatic Botany, 2004,80(3):177-191.
[23] 杨 凯,董 静,郭亮亮,等.滇池沿岸带刚毛藻种群结构及分布特征 [J]. 水生态学杂志, 2013,34(3):8-16.
[24] 郭亮亮,周维成,周起超,等.光照强度和磷浓度对寡枝刚毛藻生长的影响 [J]. 中国环境科学, 2015,35(7):2153-2159.
[25] 国家环境保护总局编.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:233-284.
[26] Marks J C, Power, M E. Nutrient induced changes in the species composition of epiphytes on Cladophora glomerata Kutz.(Chlorophyta) [J]. Hydrobiologia, 2001,450(1-3):187-196.
[27] 胡鸿钧,魏印心.中国淡水藻类系统分类及生态 [M]. 北京:科学出版社, 2006:300-416.
[28] Klančnik K, Gradinjan D, Gaberščik A. Epiphyton alters the quantity and quality of radiation captured by leaves in submerged macrophytes [J]. Aquatic Botany, 2015,120:229-235.
[29] Hardwick G, Blinn D, Usher H. Epiphytic diatoms on Cladophora glomerata in the Colorado River, Arizona: longitudinal and vertical distribution in a regulated river [J]. The Southwestern Naturalist, 1992,37(2):148-156.
[30] Lougheed V L, Jan Stevenson R. Exotic Marine Macroalga(Enteromorpha flexuosa) Reaches Bloom Proportions in a Coastal Lake of Lake Michigan [J]. Journal of Great Lakes Research,2004,30(4):538-544.
[31] Dodds W K. Community interactions between the filamentous alga Cladophora glomerata (L.) Kuetzing, its epiphytes, and epiphyte grazers [J]. Oecologia, 1991,85(4):572-580.
[32] 兰 波,向贤芬,贾延亭,等.洱海流域沿岸带石质基质上周丛藻类群落研究 [J]. 中国环境科学, 2011,31(11):1881-1887.
