CEP55在人胶质瘤组织的表达及对人胶质瘤U251细胞增殖和凋亡的影响
2018-01-08朱虹帆陈典刚吕胜青汤金梁王东林李光辉
朱虹帆 陈典刚 吕胜青 汤金梁 王东林 李光辉
(第三军医大学新桥医院: 1全军肿瘤研究所, 2神经外科, 3病理科,重庆 400037; 4重庆市肿瘤医院肿瘤内科,重庆 400030)
·脑胶质细胞瘤诊治研究·
CEP55在人胶质瘤组织的表达及对人胶质瘤U251细胞增殖和凋亡的影响
朱虹帆1陈典刚1吕胜青2汤金梁3王东林4李光辉1*
(第三军医大学新桥医院:1全军肿瘤研究所,2神经外科,3病理科,重庆 400037;4重庆市肿瘤医院肿瘤内科,重庆 400030)
目的检测中心体相关蛋白55(CEP55)在人胶质瘤组织中的mRNA和蛋白表达水平;抑制人胶质瘤U251细胞中CEP55表达,观察其对U251细胞增殖、凋亡的影响。方法实时荧光定量聚合酶连锁反应(q-PCR)、蛋白质印记法(Western Blot)检测40例不同级别人胶质瘤组织和10例正常脑组织中CEP55的表达;RNAi抑制U251胶质瘤细胞CEP55基因表达,采用细胞增殖毒性检测试剂盒(CCK-8)和胸腺嘧啶核苷类似物(edu)检测CEP55对U251细胞增殖的影响,采用流式细胞仪分析CEP55对细胞凋亡的影响。结果CEP55在40例人胶质瘤组织中表达显著高于正常脑组织(P<0.01),但高级别胶质瘤CEP55的表达与低级别胶质瘤没有显著差异(P>0.05)。在RNAi抑制U251细胞CEP55表达后,细胞的增殖显著受抑(P<0.01),细胞的凋亡显著增加(P<0.01)。结论人胶质瘤组织细胞较正常脑组织CEP55表达明显增高,抑制CEP55的表达抑制人胶质瘤U251细胞的增殖,同时促进人胶质瘤细胞的凋亡。
中心体相关蛋白55; 胶质瘤; U251细胞; 增殖; 凋亡
胶质瘤起源于神经胶质细胞,约占颅内中枢神经系统原发恶性肿瘤的80%,占中枢神经系统所有肿瘤的30%,是最常见的颅内原发肿瘤[1]。近30年,胶质瘤的发病率逐年增高,年增长率达1%~2%,且随着年龄的增长发病率呈上升趋势。尽管随着影像技术、手术、放疗、化疗和靶向治疗等各种治疗手段的发展,以及多学科综合治疗的实施,胶质瘤的2年生存率由10.4%提高到26.5%,胶质瘤的总体治疗效果仍欠佳,最终仍将导致患者的死亡。目前成人的高级别胶质瘤1年和5年生存率仍仅为30%和13%[2]。胶质瘤细胞有着复杂的基因突变、表达异常的遗传背景,胶质瘤的治疗抵抗、易复发可能与其导致的肿瘤细胞间广泛的异质性相关[3-4]。因此,对胶质瘤细胞发生、发展相关调控分子机制的研究既可促进对其生物学行为的深入理解,又能为不同的治疗新策略提供理论基础。
中心体相关蛋白55(centrosomal protein 55, CEP55)是新近发现的有丝分裂磷蛋白,是中心体相关蛋白中中间体环的重要组成部分,通过调节细胞膜的分裂和融合切开两个子代细胞,在细胞的胞质分裂中起着重要作用[5]。除胸腺和睾丸外,正常组织几乎不能检测到其表达。CEP55的过表达将造成细胞有丝分裂的缺陷,导致不稳定的多核细胞出现,并增强细胞的迁移和侵袭能力[6]。最近的研究证实,在人结肠癌、乳腺癌、肺癌有着CEP55的高表达,而CEP55的异常表达与这些肿瘤的发生和不良预后密切相关[7-9]。目前尚未有研究报道人胶质瘤细胞中CEP55表达情况及其在胶质瘤细胞中的具体作用。为此我们分析了不同级别胶质瘤组织及正常脑组织中CEP55表达情况,并对CEP55在人胶质瘤U251细胞中的作用做了初步研究。
材料与方法
一、组织标本
50例标本均来源于第三军医大学新桥医院神经外科手术标本,获得患者知情同意,均经病理学证实。其中正常脑组织10例,Ⅰ级胶质瘤组织7例,Ⅱ级胶质瘤组织13例,Ⅲ级胶质瘤组织10例,Ⅳ级胶质瘤组织10例(均按WHO分级标准)。标本收集后立即冻存于-80 ℃。
二、细胞培养
人类胶质瘤细胞系U251细胞由实验室保存,含10%胎牛血清的Gibco高糖培养液常规培养、传代,取对数生长期细胞进行实验。
三、CEP55逆转录干扰病毒
CEP55干扰病毒购自中国上海吉凯基因公司(5'-GTGGGAAAGGAAAGCTGAC-3)。
四、主要试剂及仪器
Western Blot凝胶试剂盒(Beyotime公司),CEP55一单抗(Abcam公司),鼠和兔二抗(博士德公司),聚偏二氟乙烯膜(PVDF)(博士德公司)、湿转仪为Bio Rad公司产品。荧光定量PCR仪(美国Life Technologies公司)。CEP55基因PCR上游引物-TT GGAACAACAGATGCAGGC,下游引物-GAGTGCAG CAGTGGGACTTT;内参(甘油醛-3-磷酸脱氢酶GAPDH)基因PCR上游引物-GAGCTACGAGCTGC CTGACG,下游引物-GTAGTTTCGTGGATGCCACAG(美国Thermo Fisher公司)。逆转录试剂盒和实时荧光定量聚合酶链式反应(q-PCR)试剂盒(日本Takara公司)。2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2, 4-二磺酸苯)-2H-四唑单钠盐(CCK-8)试剂盒(日本同仁公司),5-乙炔基-2'脱氧尿嘧啶核苷(edu)试剂盒(GeneCopoeia公司)。
五、q-PCR测定人正常脑组织和胶质瘤组织、U251细胞CEP55 mRNA表达
按照Trizol试剂盒说明书提取组织或细胞总RNA,逆转录,重复2次;将3次实验获得的各组cDNA进行实时定量PCR检测;PCR引物见前述,采用SYBR Premix PCR 试剂盒于荧光实时定量PCR仪CEP55的mRNA水平。
六、Western Blot检测人正常脑组织和胶质瘤组织、U251细胞CEP55蛋白表达
蛋白提取试剂盒提取组织或细胞总蛋白,测定浓度后按常规方法进行凝胶电泳,转印至PVDF膜,小鼠抗CEP55单抗标记,加入辣根过氧化物酶标记的相应二抗,增强化学发光显影,以GAPDH为参照。
七、CEP55干扰载体逆转率病毒感染U251细胞
取对数生长期U251细胞制备成单细胞悬液,计数,接种至25 mL培养瓶中。按病毒感染比率值10 ∶1取对照病毒和CEP55基因干扰病毒分别感染靶细胞,观察细胞绿色荧光产生。感染72 h后,去除含病毒载体的培养液,洗涤后,加入新鲜含10%胎牛血清Gibco高糖培养液继续培养,供进一步分析。
八、干扰组、对照组和空白组U251细胞增殖测定
按照干扰组为敲低CEP55的U251细胞,对照组为转染阴性病毒U251细胞,空白组为未转染病毒U251细胞分为3组,各组按照3个孔重复。CCK-8检测:各组细胞制备成单细胞悬液,计数后调整细胞浓度,以3000个/孔接种于96孔板中,加培养液至0.1 mL,常规培养,每3 d换液,CCK-8细胞增殖分析试剂盒测定细胞增殖曲线。edu检测:各组细胞制备成单细胞悬液,计数后调整细胞浓度,按照每孔2×105/孔接种于6孔板内,加培养液37 ℃过夜孵育后,每孔按照2 μL edu/1 mL培养液分别加入2 mL/孔混合液,37 ℃孵育6 h,按照试剂盒说明处理细胞,流式细胞仪分析。
九、流式细胞分析
采用凋亡试剂盒流式检测,按试剂说明标记各组人胶质瘤细胞,按照3个重复测定样本,流式细胞分析仪检测凋亡细胞比例。
十、统计学分析
采用GraphPad Prism 5统计学软件分析,P<0.05时认为差异有统计学意义。
结 果
一、CEP55在人胶质瘤组织中的表达显著高于正常脑组织
RT-PCR结果显示,CEP55在胶质瘤组织中的表达较正常脑组织明显升高,无论是在低级别还是高级别皆增高(P<0.01)。但在低级别与高级别之间,CEP55的表达无显著差异(P>0.05,图1A)。Western Blot检测结果与RT-PCR的结果一致,CEP55蛋白在胶质瘤组织中的表达高于正常组织(P<0.01),但并没有随胶质瘤等级的提高而表达增高(P>0.05,图1B、1C)。
二、干扰CEP55基因表达可抑制人胶质瘤细胞U251增殖
用RNAi沉默U251胶质瘤细胞CEP55基因表达后,通过Western Blot和RT-PCR对抑制结果进行验证。Western Blot结果显示干扰组CEP55表达显著低于空白组和阴性对照组(图2A);RT-PCR结果显示空白组、阴性对照组细胞CEP55 mRNA相对拷贝数无显著差异(P>0.05),而干扰组细胞CEP55 mRNA相对拷贝数显著低于空白组和阴性对照组(P<0.01,图2B)。
运用CCK-8比较干扰组、阴性对照组、未转染组细胞在不同时间点的增殖情况,同时以单培养基作为空白对照,结果显示:从第二天开始阴性对照组以及未转染组增殖速率明显快于干扰组;4 d后干扰组增殖曲线开始下降,而阴性对照以及未转染组增殖正常。干扰组以及阴性对照组数据分析结果表明两者之间有显著差异(P<0.01,图3A、3B),说明抑制人胶质瘤U251细胞CEP55基因的表达、活化可抑制细胞增殖。
流式细胞术分析edu结果显示干扰组增殖细胞比例显著低于阴性对照组和空白组(P<0.01,图3C)。再次证实了CEP55对U251细胞增殖的促进作用。
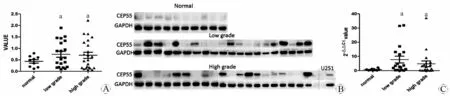
图1 CEP55在胶质瘤组织及正常脑组织中的表达检测
Fig 1 Expression of CEP55 in different grades of human glioma tissues and human normal brain tissues
A: Detection of CEP55 mRNA in variable grades of human glioma tissues and human normal brain tissues by RT-PCR analysis; B: Protein levels of CEP55 in GC and normal tissue samples determined by Western Blot; C: Statistical results of CEP55 expression by Western Blot.
aP<0.01,vsnormal group.
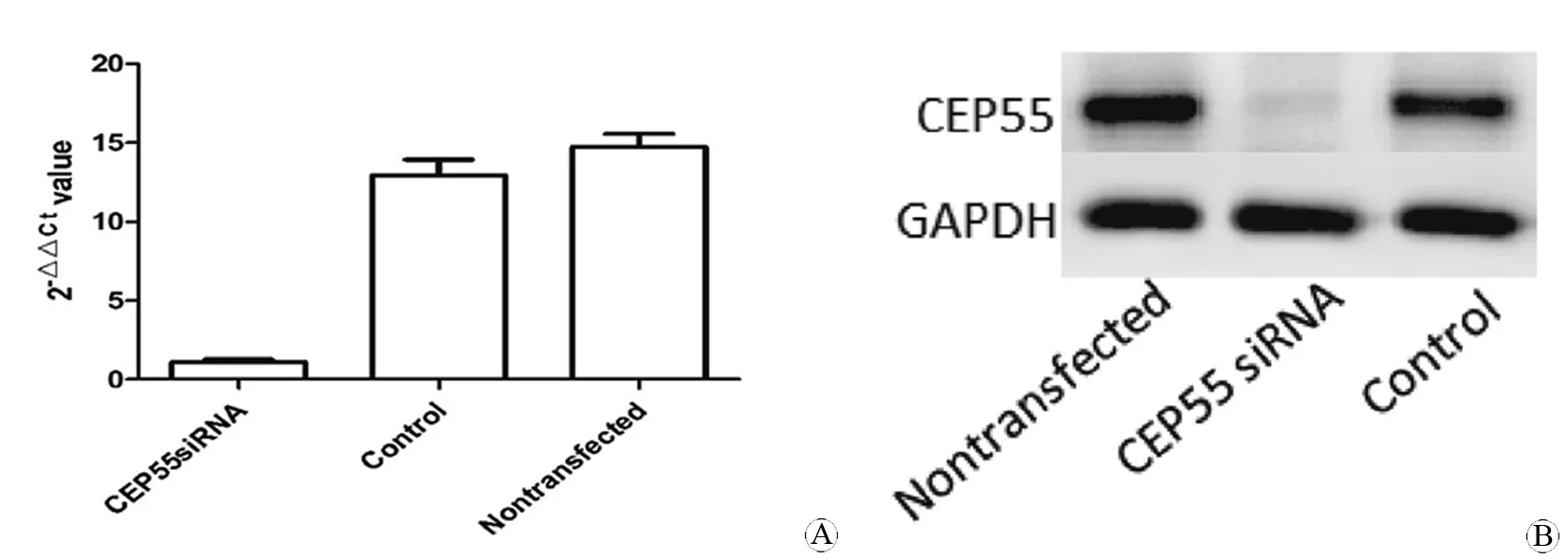
图2 siRNA转染前后人胶质瘤细胞U251中CEP55表达的检测
Fig 2 Expression of CEP55 in glioma cells U251 before and after siRNA transfection
A: mRNA expression of CEP55 measured by RT-PCR; B: Expression of CEP55 protein analyzed by Western Blot.
aP<0.01,vscontrol group.
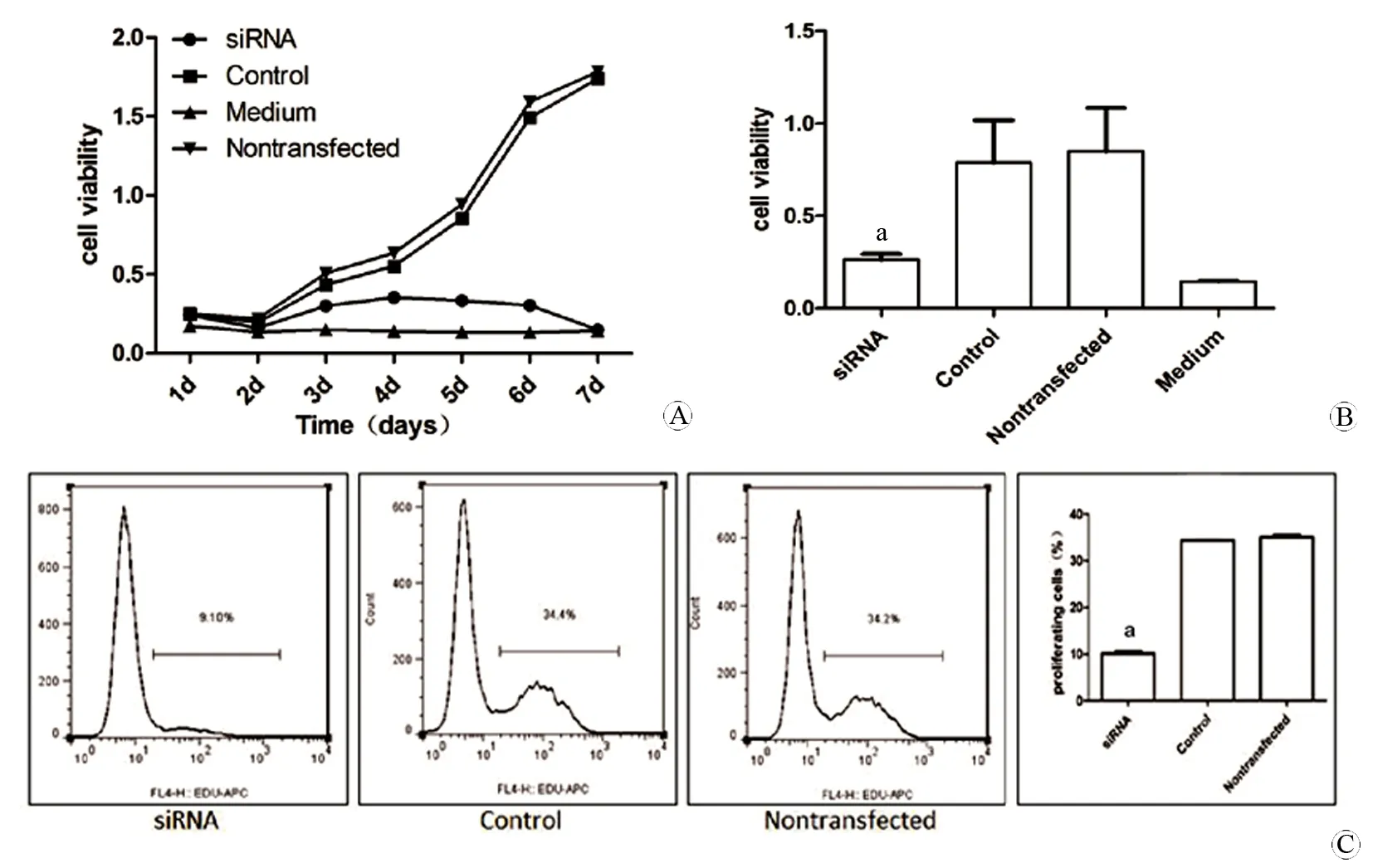
图3 CCK-8以及edu检测CEP55对胶质瘤细胞U251增殖的影响
Fig 3 Effect of CEP55 on the proliferation of glioma cells U251 detected by CCK-8 and edu
A: Seven-day proliferating curve of U251 cells after siRNA transfection by CCK-8; B: Statistical analysis of CCK-8 results among all groups; C: Proliferation of U251 cells measured by edu.
aP<0.01,vscontrol group.
三、抑制CEP55基因的表达促进人胶质瘤细胞U251的凋亡
流式细胞分析结果显示阴性对照组、空白组细胞凋亡率分别为12.8%、11.2%,干扰组凋亡率为35.0%,干扰组显著高于空白组和阴性对照组(P<0.01,图4)。说明抑制人胶质瘤U251细胞CEP55基因的表达及活化可诱导细胞凋亡。

图4 流式细胞术检测CEP55对胶质瘤细胞U251凋亡的影响
Fig 4 Apoptosis of glioma cell line U251 was measured by flow cytometry
aP<0.01,vscontrol group.
讨 论
中心体在正常细胞分裂中起重要作用,但如果多个中心体同时出现就会导致纺锤体形成的异常,从而影响细胞的分裂,导致染色体非整倍性的出现,这种现象常见于肿瘤的发生发展中[10-11]。中心体相关蛋白CEP55的异位表达或缺失都可导致中心体的异常,其在肿瘤的发生发展中可能起到重要的调节作用[10-11]。Tao等[6]发现,胃癌中CEP55表达显著增高。Chen等[12]对肝细胞肝癌组织及癌旁组织中的CEP55的表达量进行了检测,发现CEP55高表达的患者比不表达或低表达的患者预后更差。对于颅内原发最常见的胶质瘤是否存在CEP55的表达及表达水平尚不清楚。我们采用了RT-PCR和Western Blot方法分别检测了不同级别胶质瘤和正常脑组织的CEP55表达情况。结果显示胶质瘤细胞CEP55表达显著高于正常脑组织。但高级别和低级别胶质瘤之间CEP55的表达没有显著差异。该结果提示CEP55可能与胶质瘤的发生、发展相关,但与胶质瘤细胞的恶性程度没有一致性关系。
为了解其对胶质瘤细胞增殖的影响,我们采用siRNA慢病毒载体干扰胶质瘤U251细胞中CEP55表达,结果显示细胞CEP55受抑制后,细胞的生长于第4天开始变慢,增殖速度显著低于对照组。该结果提示CEP55在胶质瘤细胞增殖中发挥重要作用。Liu等[13]在发现人肺癌组织高表达CEP55的基础上抑制人肺癌A549、95D细胞株细胞CEP55的表达,细胞增殖显著受抑。Wang等[7]通过抑制高表达CEP55的乳腺癌细胞也证实了CEP55的促增殖作用。以上结果提示CEP55促进肿瘤细胞增殖是高表达该基因肿瘤的共同特征。此外,在CEP55受抑制后的U251细胞不仅出现增殖变慢,细胞体积也变大,胞核轮廓模糊,并出现较多漂浮死亡细胞。我们采用流式细胞分析细胞凋亡,结果显示U251细胞在CEP55干扰下调后,细胞凋亡明显增加,显著高于对照组。该结果提示CEP55不仅参与胶质瘤细胞增殖调控,而且与细胞的凋亡调节机制相关。
通过本研究,我们发现CEP55在胶质瘤组织和胶质瘤细胞系中的表达显著增高,抑制人胶质瘤U251细胞CEP55基因的表达可抑制细胞增殖,诱导细胞凋亡。其具体机制尚有待进一步研究探索。
1SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014 [J]. CA Cancer J Clin , 2014, 64(1): 9-29.
2《中国中枢神经系统胶质瘤诊断和治疗指南》编写组. 中国中枢神经系统胶质瘤诊断与治疗指南(2015) [J]. 医学杂志,2016, 96(7): 485-509.
3Cancer Genome Atlas Research Network, BRAT D J, VERHAAK R G, et al. Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas [J]. N Engl J Med, 2015, 372(26): 2481-2498.
4FRATTINI V, TRIFONOV V, CHAN J M, et al. The integrated landscape of driver genomic alterations in glioblastoma [J]. Nat Genet, 2013, 45(10): 1141-1149.
5VAN DER HORST A, SIMMONS J, KHANNA K K. Cep55 stabilization is required for normal execution of cytokinesis [J]. Cell Cycle, 2009, 8(22): 3742-3749.
6TAO J, ZHI X, TIAN Y, et al. CEP55 contributes to human gastric carcinoma by regulating cell proliferation [J]. Tumour Biol, 2014, 35(5): 4389-4399.
7WANG Y, JIN T, DAI X, et al. Lentivirus-mediated knockdown of CEP55 suppresses cell proliferation of breast cancer cells [J]. Biosci Trends, 2016, 10(1): 67-73.
8MALZKORN B, REIFENBERGER G. Practical implications of integrated glioma classification according to the World Health Organization classification of tumors of the central nervous system 2016 [J]. Curr Opin Oncol, 2016, 28(6): 494-501.
9JEFFERY J, SINHA D, SRIHARI S, et al. Beyond cytokinesis: the emerging roles of CEP55 in tumorigenesis [J]. Oncogene, 2016, 35(6): 683-690.
10FABBRO M, ZHOU B B, TAKAHASHI M, et al. Cdk1/Erk2- and Plk1-dependent phosphorylation of a centrosome protein, Cep55, is required for its recruitment to midbody and cytokinesis [J]. Dev Cell, 2005, 9(4): 477-488.
11CHANG Y C, CHEN Y J, WU C H, et al. Characterization of centrosomal proteins CEP55 and pericentrin in intercellular bridges of mouse testes [J]. J Cell Biochem, 2010, 109(6): 1274-1285.
12CHEN C H, LU P J, CHEN Y C, et al. FLJ10540-elicited cell transformation is through the activation of PI3-kinase/AKT pathway [J]. Oncogene, 2007, 26(29): 4272-4283.
13LIU L, MEI Q, ZHAO J, et al. Suppression of CEP55 reduces cell viability and induces apoptosis in human lung cancer [J]. Oncol Rep, 2016, 36(4): 1939-1945.
ExpressionofCEP55inhumangliomaanditseffectontheproliferationandapoptosisofgliomacelllineU251
ZHUHongfan1,CHENDiangang1,LVShengqing2,TANGJinliang3,WANGDonglin4,LIGuanghui1
1CancerResearchInstituteofPLA;2DepartmentofNeurosurgery;3DepartmentofPathology,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037;4DepartmentofOncology,CancerHospitalofChongqing,Chongqing400030, China
ObjectiveThe expression of centrosomal protein 55 (CEP55) in human glioma cells was detected and the effect of CEP55 on proliferation and apoptosis of human glioma cell line U251 cells was analyzed.MethodsThe expression of CEP55 was measured by quantitative real-time PCR and Western Blot in 40 human glioma tissues of variable grades and 10 normal brain tissues. The proliferation of glioma cell line U251 was measured by CCK-8 kits and edu kits and the apoptosis of glioma cell line U251 was measured by flow cytometry after CEP55 silencing.ResultsThe expression of CEP55 was increased significantly in 40 glioma tissues compared to 10 normal brain tissues (P<0.01). However, there was no statistical difference in the expression of CEP55 between patients with high grade glioma and lower grade glioma (P>0.05). The proliferation of U251 cells was inhibited markedly after CEP55 knockdown by RNAi (P<0.01); the apoptosis of U251 cells was profoundly increased after CEP55 knockdown (P<0.01).ConclusionThe expression of CEP55 is significantly increased in human glioma cells compared with normal brain tissue; the overexpression of CEP55 promotes the proliferation of glioma U251 cells and inhibits the apoptosis of U251 cells.
CEP55; Glioma; U251 cells; Proliferation; Apoptosis
1671-2897(2017)16-197-05
朱虹帆,住院医师,E-mail: garnett00@21cn.com
*通讯作者: 李光辉,副教授、副主任医师,E-mail: liguanghui_2000@aliyun.com
R 739.41
A
2016-11-15;
2017-01-05)
