川党参的基因组DNA提取与ISSR引物筛选
2018-01-06杨正久梁大敏董红梅
杨正久,钱 静,梁大敏,董红梅
(遵义医药高等专科学校 医学技术系,贵州 遵义 563006)
论著
川党参的基因组DNA提取与ISSR引物筛选
杨正久,钱 静,梁大敏,董红梅
(遵义医药高等专科学校 医学技术系,贵州 遵义 563006)
目的筛选最适党参基因组DNA的提取方法及ISSR (inter-simple sequence repeat)引物, 为研究党参种植资源遗传多样性及DNA鉴定奠定基础。方法以党参嫩叶作为材料,采用常规SDS法、改良CTAB法和试剂盒法3种提取方法基因组DNA,用优化的ISSR-PCR反应对100条引物进行筛选。结果以党参嫩叶为材料提取基因组DNA,改良CTAB法效果最佳。从公布的100条ISSR引物中筛选出10条引物,能扩增条带清晰、稳定性好、多态性高的DNA条带。结论以党参嫩叶为材料提取基因组DNA进行ISSR分子标志研究遗传多样性时应采用改良CTAB法,筛选出合适的引物在ISSR分子标志中很重要。
川党参;DNA提取;ISSR引物筛选
党参为桔梗科党参属植物,产于四川、重庆、贵州、湖北等地,历史悠久,品种较多,已大量人工栽种,味甘、性平,具有补中益气、养血补肺、生津和胃及健脾等作用[1-2]。党参种质遗传多样性在对党参的研究、评价、利用及新种质的培育中具有十分重要的作用。DNA分子标记技术已广泛用于各类种植资源遗传多样性的研究,常见的方法有RAPD(random amplified polymorphic DNA)、SSR(simple sequence repeat)、ISSR (inter-simple sequence repeat)、RFLP(restriction fragment length polymorphism)等,其中ISSR分子标记技术由于具有操作简单、快速、高效、成本低、稳定性高等优点,成为理想的分子标记技术[4-5]。但用ISSR分子标记技术进行种质资源遗传多样性研究时,需要提取一定纯度及浓度的基因组DNA,且还需对公开的100条引物进行筛选,得到适合党参ISSR分子标记的ISSR引物,才能进行ISSR分子标记研究种质资源遗传多样性。然而用不同的党参植物组织作为研究材料,其提取DNA的方法、ISSR引物均不一样,本文以党参的嫩叶为材料,对四川、重庆、遵义等地种植川党参个体基因组DNA提取方法与ISSR引物筛选进行了研究, 为进一步从DNA水平揭示其遗传多样性奠定了基础。
1 材料和方法
1.1 实验材料及来源
本研究所用的实验材料分别来自四川、重庆、遵义道真县及湖北等地的种植党参种子萌发的嫩叶(表1)。方法为:选取成熟种子,去除破损和杂色籽粒,用38 ℃温水置于沙堆上进行催芽,然后在25 ℃的恒温培养箱内,于放有滤纸的培养皿上萌发,待发芽至3~5 cm 高时,取幼苗嫩叶,置于-20 ℃冰箱保存备用。
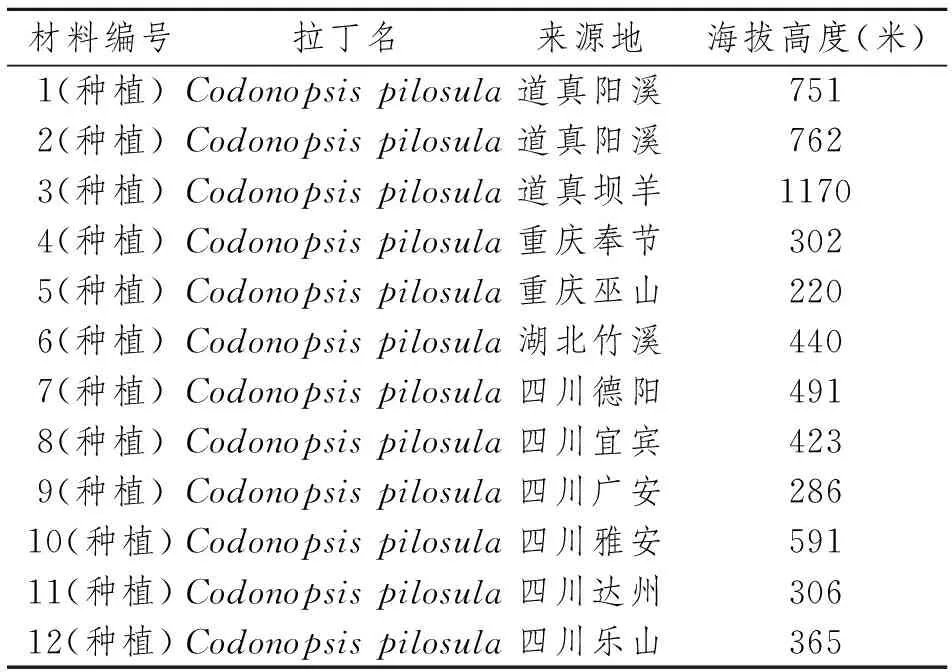
表1 实验材料及来源
1.2 仪器与试剂
主要仪器:光照培养恒温箱SPX-250B-G(上海博迅),GelDocXR+凝胶成像系统(BIO-RAD),艾本德普通PCR 仪,VE-180 型电泳槽(上海天能),EPS-300 型电泳仪(上海天能),TGL-16G 台式离心机(上海菲恰尔分析仪器有限公司)。主要试剂:丙烯酰胺、双丙烯酰胺、硝酸银、37%甲醛、TEMED、DNA提取试剂盒来自上海生工生物工程,产品编号B518231-0050,ISSR 引物采用加拿大哥伦比亚大学(UBC)公布的序列,由北京赛百盛基因技术有限公司合成。
1.3 党参基因组DNA的提取
常规SDS法:取党参实验材料200 g充分研磨→加入SDS提取液,2%体积的巯基乙醇,2 mL 10%的SDS,于65 ℃水浴20 min→加入等体积的饱和酚/氯仿/异戊醇(v/v/v=25/24/1)混匀并离心(12000 r/min)10 min→取上清加入等体积氯仿/异戊醇(v/v=24/1)混匀并离心(12000 r/min)10 min→去上层水相加入2倍体积的沉淀液,室温孵育30 min,12000 r/min离心15 min→70%乙醇洗涤2次→加入100 μL 1×TE液溶解DNA→4 ℃保存。
改良CTAB法[6-7]:取党参实验材料200 g于预冷的研钵中研磨成粉直至 “发白”→置于65 ℃的CTAB提取液保温45 min→室温下用氯仿/异戊醇(v/v=24/1)萃取,10000 r/min离心10 min(重复2次) →上清液用0.6倍体积的异戊醇于冰中静置30 min→8000 r/min(4 ℃)离心10 min,70%乙醇洗涤2次→加入500 μL 1×TE液溶解DNA→加入5 μL RNAase酶于37 ℃温育30 min去除RNA→70%乙醇洗涤2次→100 μL 1×TE液溶解→4 ℃保存。
试剂盒法:取党参实验材料200 g充分研磨后,按试剂盒说明书进行提取。
提取后的DNA经琼脂糖凝胶电泳测定其纯度,分光光度计测定其浓度,将提取的DNA稀释到终浓度40 ng/μL,用作PCR扩增的模板进行ISSR引物筛选。
1.4 ISSR引物的筛选与检测
选用提取的党参基因组DNA为模板,采用优化的PCR反应体系进行ISSR引物筛选。优化的PCR反应体系的总体积为20 μL:模板DNA 1 μL(约40 ng),ISSR引物1 μL(约5 pmol),PCRmix 18 μL。PCR上机扩增程序为: 94 ℃5 min预变性,94 ℃循环1 min,56 ℃退火 45 s, 72 ℃延伸 1 min,共35轮循环,循环结束后,72 ℃ 5 min,4 ℃保存。PCR结束后,对扩增产物的检测采用取非变性聚丙烯酰胺凝胶电泳,取扩增产物4 μL 进行电泳分离,以0.5×TBE 为缓冲液,稳压150 V,电泳至溴酚蓝距凝胶边缘2~3 cm处结束,最后进行银染法染色,照相及观察读带。
2 结 果
2.1 党参基因组DNA的提取
以党参鲜嫩叶片为材料,采用了传统SDS 法、改良CTAB 法和试剂盒法3种方法提取党参的基因组DNA ,经凝胶电泳检测其纯度,如图1。泳道1~6、7~12与13~18依次为材料1、3、5、6、8、10(表1)提取的基因组DNA,结果表明3种方法所提的DNA 纯度都较好,各点样孔及泳道都很干净,DNA无杂带,且DNA完整性好,无降解,DNA条带亮度与其含量有关,3种方法中,改良CTAB 法电泳条带最亮,试剂盒法次之,传统SDS法亮度最小(见图1),经紫外分光光度计检测其浓度,传统SDS 法提取的DNA平均浓度为0.83 μg/mL,改良CTAB 法提取的DNA平均浓度为4.21 μg/mL,试剂盒法提取的DNA平均浓度为2.24 μg/mL,3种方法提取基因组DNA的OD 260/280均在1.67左右。说明3种方法提取川党参基因组DNA的纯度均很高,但改良CTAB 法提取DNA的效率最高,符合ISSR研究要求。可见以党参鲜嫩叶片为材料,采用传统SDS 法、改良CTAB 法和试剂盒法3种方法提取基因组DNA时,改良CTAB 法最好。
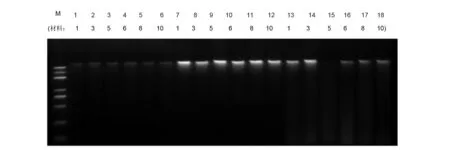
M: BM5000 DNA Marker; 1~6为常规SDS法,7~12为改良CTAB法,13~18为试剂盒法图1 基因组DNA提取电泳检测结果Fig 1 The result of genomic DNA detected by electrophoresis
2.2 ISSR引物的筛选
以改良CTAB法提取的两个党参基因组DNA为模板,从100条引物中初步筛选出10条扩增条带清晰、重复性好、多态性丰富的引物。见表2。
2.3 对所选引物进行PCR扩增检验
利用筛选出10 条引物和经优化的PCR优化体系对来自四川、重庆、湖北及遵义道真县的12个川党参样品进行扩增检验,所有引物扩增出的DNA条带清晰、重复性高、多态性丰富,具体扩增结果见表3。10条引物共扩增出136个清晰且能区分的DNA条带,平均每条引物扩增出13.6个DNA条带;多态性条带共有114个,每条引物平均扩增多态性条带为11.4个,占比率为83.82%;其中引物UBC811扩增的条带数及多态性条带数较为丰富(图2),DNA总条带数为19个,多态性条带数为16个。
表2筛选出的ISSR引物及退火温度
Tab 2 Sequence of the selected ISSR primers and annealing temperature

引物编号引物序(5'-3')退火温度(℃)*UBC807AGAGAGAGAGAGAGAGT50UBC809AGAGAGAGAGAGAGAGG52UBC811GAGAGAGAGAGAGAGAC54UBC816CACACACACACACACAT50UBC825ACACACACACACACACT50UBC826ACACACACACACACACC52UBC834AGAGAGAGAGAGAGAGYT52UBC835AGAGAGAGAGAGAGAGCC56UBC836AGAGAGAGAGAGAGAG-CA56UBC881GGGTGGGGTGGGGTG54
*:理论退火温度Ta=Tm = 4 ℃(G+C)+ 2 ℃(A+T)
3 讨 论
分子标记技术已飞速发展,并被广泛地应用于动植物的种植资源的鉴定及遗传多样性的研究。药用植物的遗传多样性涵盖了种内所有个体全部的基因和变异的总和,其研究是鉴定药用植物种质、评估基因资源的开发、研究优良药用形状、药用植物的引种栽培及资源保护提供理论依据与信息[11]。而党参大面积的种植通常采用种子和种根两种繁殖方式,零星种植也常采用野生种及半野生种的驯化栽培,导致党参种源复杂,遗传多样性丰富;但受到地理位置的阻隔,基因流动也受到一定的限制。目前有关于川党参的种植资源遗传多样性研究报道不多,因此党参种植资源遗传多样性的研究与基因资源的保护与利用刻不容缓。
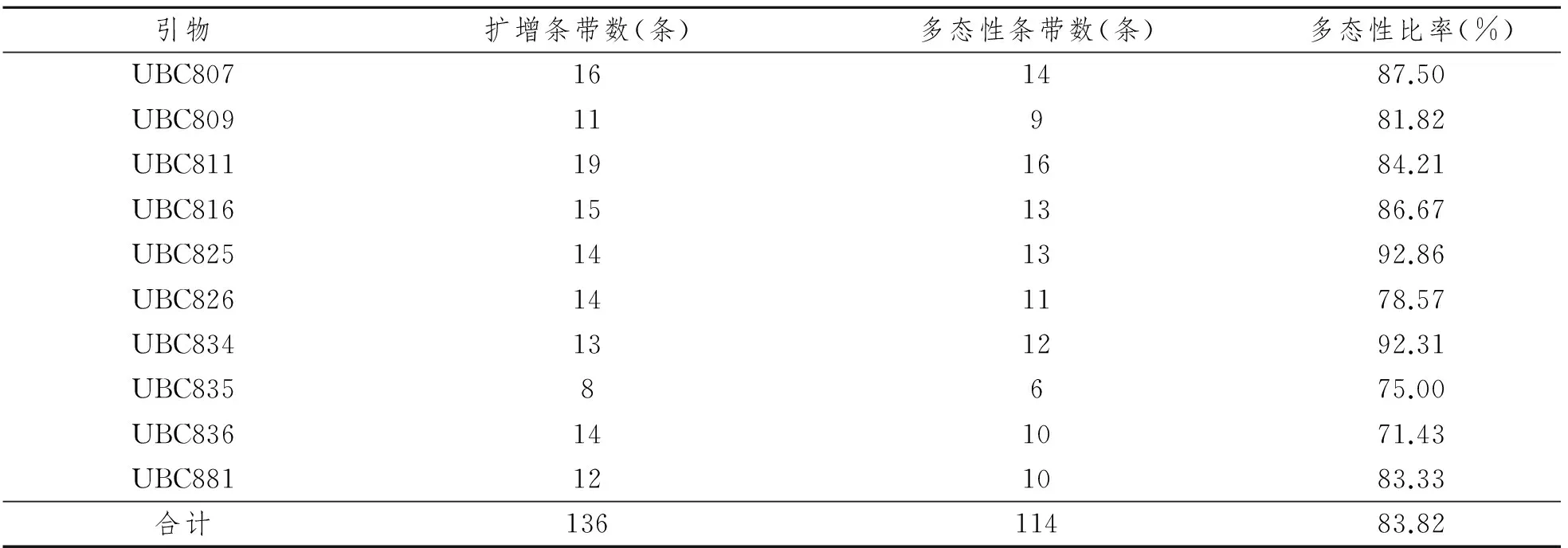
表3 引物扩增检验结果
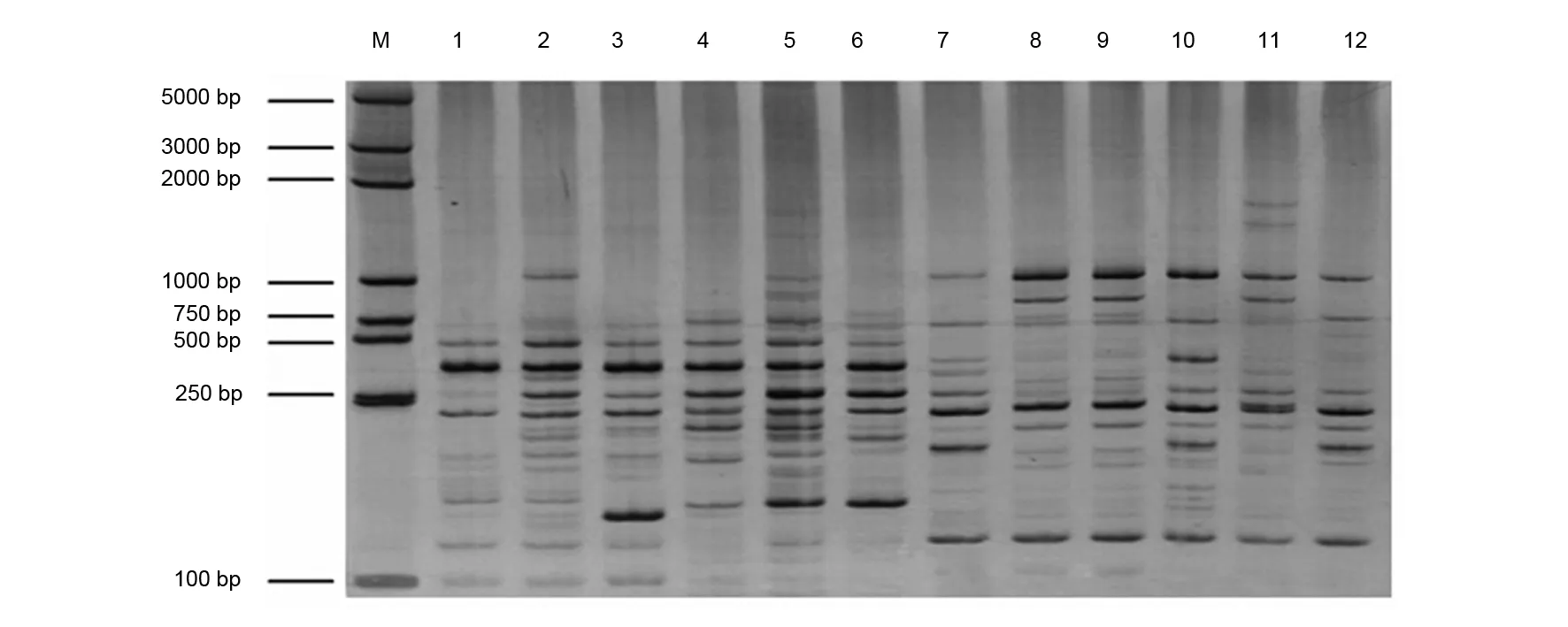
M: BM5000 DNA Marker;1~12:1~12号材料图2 引物UBC811扩增结果Fig 2 Amplification results with primer UBC811
ISSR标记根据生物广泛存在SSR的特点,利用在生物基因组常出现的SSR本身设计引物,无需预先克隆和测序。ISSR分子标记技术具有检测性灵敏、多态性丰富、反应体系稳定、结果可靠、成本低、操作简单、快速及所需模板量少等特点[12],而成为理想的分子标记技术。但是ISSR分子标记技术除了对模板DNA的浓度和纯度有一定的要求外,其选用的引物和PCR反应体系及条件也必需符合其扩增要求,加拿大哥伦比亚大学(UBC)公布的ISSR-PCR引物序列共有100条,并不是每条引物都适用所用的物种,且不同引物所要求的PCR反应体系及反应条件也不一样,因此针对特定的物种,筛选出合适的引物和优化ISSR反应体系与反应条件就显得尤为重要。
目前用于基因组DNA的提取方法主要有传统SDS 法、改良CTAB 法和试剂盒法。这3种方法中,虽然试剂盒法具有快速高效等优点而深受欢迎,但是由于成本较高,通常在实验室里首选的还是前两种方法。SDS法和CTAB法均是20世纪80年代后发展起来的DNA提取技术[8-9],经过30多年的发展在技术上得到了不断的改进,但更多是对提取液的配比进行调整,形成了各种针对不同物种不同配比的独特优化提取体系[10]。本研究表明,采用传统SDS 法、改良CTAB 法和试剂盒法均能从供试党参嫩叶材料中提取到纯度较高的基因组DNA,但是传统SDS 法提取DNA得率较低,这从电泳图谱上可以看出,其电泳带较淡,而改良CTAB 法和试剂盒法提取的DNA电泳带较亮,表明这两种方法提取DNA的得率均较高。另外值得一提的是本文中所采用的试剂盒法提取的党参基因组DNA在琼脂糖电泳中,总是存在拖尾现象(图1),可能是本研究中购买的试剂盒原因所导致。综合起来,本研究中以党参嫩叶为材料提取基因组DNA时,采用改良CTAB 法提取效果最佳。
[1] 朱恩圆. 中药党参的质量评价研究[D]. 南京: 中国药科大学,2001.
[2] 龚其海,赵万,余兰,等. 两种党参多糖对小鼠免疫功能影响的比较[J]. 遵义医学院学报,2012,4(34): 268 - 270.
[3] 陈璺,韩丰,杨建敏,等. 洛龙党参贮藏保鲜技术研究[J] .贵州农业科学,2009,37(9): 216-217.
[4] Nagaoka T, Ogihara Y. Applicability of inter-simple sequence repeat polymorphisms in wheat for use as DNA markers in comparison to RFLP and RAPD markers[J]. Theoret Appl Genetic, 1997, 94(5): 597-602.
[5]Gilbert JE, Lewis RV, Wilkinson MJ, et al. Developing an appropriate strategy to assess genetic variability in plant germplasm collections[J]. Theoret Appl Genetics, 1999, 98(6): 1125-1131.
[6] 周东新,祁建民,吴为人,等. 黄麻DNA提取与RAPD反应体系的建立[J]. 福建农业大学学报,2001(3): 334-339.
[7] 白风虎,李德芳,陈安国,等. 改良CTAB法用于提取红麻成熟叶片高质量DNA的研究[J]. 中国麻业科学,2007,29 (3): 158-165.
[8] 安娜,郭宏波,周铜水,等. 党参基因组DNA提取、ISSR-PCR反应体系优化及引物筛选[J]. 植物研究,2009, 29(3): 346-351.
[9] 高洁,李巧明. 羽叶金合欢的DNA 提取和SSR 引物筛选[J]. 云南植物研究,2008,30 (1) : 64-68.
[10] Guo HB, Lu BR, Wu QH, et al. Abundant genetic diversity in cultivated Codonopsis pilosula populations revealed by RAPD polymorphisms[J]. Genet Resour Crop Ev, 2007, 54(5): 917-924.
[11] 张少平,邱珊莲,张帅,等. 黄秋葵种质资源及相关品种选育研究进展[J]. 农学学报,2017,7(6) : 49-55.
[12] 钱韦, 葛颂, 洪德元. 采用RAPD和ISSR标记探讨中国疣粒野生稻的遗传多样性[J]. 植物学报, 2000, 42(7):741-750.
GenomicDNAextractingandISSRprimerscreeningofCodonopsistangshen
YANG Zhengjiu, QIAN Jing, LIANG Damin, DONG Hongmei
(DepartmentofMedicalTechnology,ZunyiMedicalandPharmaceuticalCollege,Zunyi563006,China)
ObjectiveIn order to study the genetic diversity and DNA identification of Codonopsis pilosula , DNA extracting methods and primers screening were explored.MethodsThe genomic DNA was extracted from the young leaves using the traditional SDS method, modified CTAB method and DNA isolation kit. The optimized ISSR-PCR reaction was used to screen 100 primers.ResultsThe modified CTAB method was better in extracting genomic DNA from the young leaves. Ten primers were selected to amplify the DNA bands with clear, stable and high polymorphism after screening 100 ISSR primers.ConclusionThe modified CTAB method and ten primers selected could be used in the study of genetic diversity by ISSR molecular markers.
Codonopsis tangshen; DNA extracting; ISSR primer screening
遵义市科技计划重点项目(遵义市科合社字[2013]16号)
杨正久 (1975-),男,副教授。E -mail: yang282@163.com
10.11724/jdmu.2017.06.04
Q7
A
1671-7295(2017)06-0536-04
杨正久,钱静,梁大敏,等.川党参的基因组DNA提取与ISSR引物筛选[J].大连医科大学学报,2017,39(6):536-539,543.
2017-09-12;
2017-11-13)
