MCT1和LDHB在荷乳腺癌小鼠髓系抑制性细胞中的表达及意义
2018-01-06蓝瑞隆陈瑞庆
蓝瑞隆,张 娜,陈瑞庆
(1.福建医科大学附属第一医院 中心实验室,福建 福州 350005;2.福建省个体化主动免疫治疗重点实验室,福建 福州 350005;3.福建省血液病研究所 福建省血液病学重点实验室 福建医科大学附属协和医院,福建 福州 350001)
论著
MCT1和LDHB在荷乳腺癌小鼠髓系抑制性细胞中的表达及意义
蓝瑞隆1,2,张 娜3,陈瑞庆1,2
(1.福建医科大学附属第一医院 中心实验室,福建 福州 350005;2.福建省个体化主动免疫治疗重点实验室,福建 福州 350005;3.福建省血液病研究所 福建省血液病学重点实验室 福建医科大学附属协和医院,福建 福州 350001)
目的比较正常小鼠和荷乳腺癌小鼠骨髓中髓系抑制性细胞(MDSCs)的含量,探讨其产生免疫抑制功能的可能机制。方法建立荷乳腺癌小鼠模型,利用BD FACSAria Ⅲ流式分选仪分选正常小鼠组和荷乳腺癌小鼠组骨髓中的MDSCs(CD11b+Gr-1+),比较其含量;q-PCR法检测两组MDSCs中MCT1及LDHB的mRNA水平。结果荷乳腺癌小鼠骨髓中MDSCs的比例为(48.92±3.13)%高于正常小鼠(25.13±1.95)%,差异有统计学意义(P<0.001);荷乳腺癌小鼠MDSCs中MCT1的mRNA相对表达量(0.010±0.005)为正常小鼠(0.003±0.001)的3.33倍,差异有统计学意义(P<0.05);荷乳腺癌小鼠MDSCs中LDHB的mRNA相对表达量(0.008±0.002)为正常小鼠(0.004±0.001)的2.00倍,差异极显著(P<0.01)。结论MDSCs在荷乳腺癌小鼠骨髓中的比例显著高于正常小鼠,其能量代谢关键分子MCT1、LDHB的表达也显著高于正常小鼠。MDSCs的能量代谢特点可能正是其发挥免疫抑制功能的重要基础。
MDSC; MCT1;LDHB;能量代谢;免疫抑制
髓系抑制性细胞(Myeloid-derived suppressor cells,MDSCs)是骨髓来源的具有异质性的细胞亚群,是巨噬细胞、树突状细胞或粒细胞的前体,在肿瘤、感染、炎症等病理条件下具有负向调控免疫应答的功能[1-3]。在肿瘤患者中,MDSCs可在IL-6、GM-CSF和 IL-1β等细胞因子的作用下,从骨髓迁移并募集至肿瘤的原发灶和转移灶。MDSCs主要通过产生精氨酸酶1(arginase-1,ARG1)、诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)、活性氧(reactive oxygen species,ROS)等效应分子发挥免疫抑制功能[4-9],既能抑制天然免疫反应,又能抑制适应性免疫反应。
能量代谢对于细胞的生物学功能发挥起着至关重要的作用,各项生物学功能依赖能量代谢水平的支持。单羧酸转运体1(monocarboxylate transporter 1, MCT1) 是一种膜表面转运蛋白,可将胞外的乳酸摄入到胞内,从而使得机体局部微环境的乳酸水平降低;乳酸脱氢酶B(lactate dehydrogenase B, LDHB)催化乳酸转化为丙酮酸,丙酮酸最终进入三羧酸循环彻底氧化分解[10-11]。已有许多报道证明MDSCs细胞亚群在许多人类肿瘤微环境中均大量扩增,在许多荷瘤小鼠中也大量存在。本研究从荷乳腺癌小鼠骨髓中分选出MDSCs(CD11b+Gr-1-),并检测其MCT1、LDHB的 mRNA水平,初步探讨MDSCs产生免疫抑制功能的可能机制。
1 材料和方法
1.1 主要试剂与耗材
q-PCR检测试剂盒和RNA提取试剂盒均购自Promega; PE-anti-Mouse CD11b Antibody(Cat. # 101207)和FITC-anti-Mouse Gr-1 Antibody (Cat. # 108405)均购自Biolegend;BALB/c小鼠购自上海莱克实验动物有限责任公司。
1.2 方法与步骤
1.2.1 乳腺癌动物模型建立:购买4~6周龄的雌性BALB/c小鼠,饲养条件为SPF级。取对数生长期的小鼠乳腺癌细胞4T1(3×106)接种于腹部皮下脂肪垫,建立小鼠乳腺癌原位模型。约2周后,可见直径约(13.00±2.00)mm大小的肿瘤。
1.2.2 分选小鼠骨髓中的MDSCs: 颈椎脱臼处死小鼠,取6只荷乳腺癌小鼠和6只正常小鼠后肢股骨和胫骨,去两端膨大的关节头至露出红色骨髓,用1 mL注射器吸取生理盐水冲出骨髓细胞。按照使用说明将PE-anti-Mouse CD11b Antibody和FITC-anti-Mouse Gr-1 Antibody 同时标记骨髓细胞,4 ℃孵育约40 min后离心弃上清,按约1.0×107/mL密度加入生理盐水重悬骨髓细胞,采用BD FACSAria Ⅲ分选出MDSCs(CD11b+Gr-1+)细胞亚群。
1.2.3 q-PCR检测MCT1、 LDHB的mRNA水平:参照试剂盒说明书提取分选出的MDSCs总RNA,利用ABI 7500 Real Time PCR System 行q-PCR检测。所需引物序列如下:MCT1(101 bp):F-5'-TGTGACCCACGACATCCAAA-3',R-5'- TGAACACCCGGTAGGTTTTCC-3';LDHB(102 bp)为:F-5'-ATTGCGTCCGTTGCAGATG-3',R-5' -TCCCAGAATGCTGATG-GCA-3';同时扩增内参β-Actin(138 bp):F-5'-ATGGAATCC- TGTGGCATCCAT-3',R-5'-TCCTGCATCCTGTCAGCAATG-3'。扩增条件:94 ℃ 5 min ,94 ℃ 30 s ,56 ℃ 30 s,72 ℃ 45 s ,35循环,采用2-ΔCt法计算各样本的MCT1和LDHB mRNA相对表达量。
1.3 统计学方法

2 结 果
2.1 流式分选结果
图1为正常小鼠和和荷乳腺癌小鼠骨髓中MDSCs(CD11b+Gr-1+)的分选结果示意图。
荷乳腺癌小鼠骨髓中MDSCs的比例(48.92±3.13)%是正常小鼠(25.13±1.95)%的1.95倍,差异具有统计学意义(P<0.001)。统计图见图2。
2.2 骨髓MDSCs中MCT1的mRNA水平
荷乳腺癌小鼠骨髓MDSCs中MCT mRNA的相对表达水平(0.010±0.005)是正常小鼠(0.003±0.001)的3.33倍,差异具有统计学意义(P<0.05)。统计图见图3。
2.3 骨髓MDSCs中LDHB的 mRNA水平
荷乳腺癌小鼠骨髓MDSCs中LDHB mRNA的相对表达水平(0.008±0.002)是正常小鼠(0.004±0.001)的2.00倍,差异具有统计学意义(P<0.01)。统计图见图4。
3 讨 论
MDSCs是源自骨髓祖细胞和未成熟髓细胞的异质细胞亚群。正常生理状态下,可以分化为成熟的粒细胞、树突状细胞和巨噬细胞,进而发挥正常的免疫功能[1-3]。在病理状态(如肿瘤、感染、炎症等)下,该群细胞成熟受阻,停留在各个不完全分化阶段,成为具有免疫抑制功能的MDSCs。已有许多报道证实,MDSCs在许多肿瘤(如乳腺癌、卵巢癌、脑胶质瘤、肾癌等)微环境中大量存在,和T-reg等组成机体免疫负性调节细胞,这是许多肿瘤预后不良的重要原因之一。

图1 流式分选正常小鼠和荷乳腺癌小鼠骨髓MDSCsFig 1 FACS for MDSCs from bone marrow of normal and tumor bearing mice
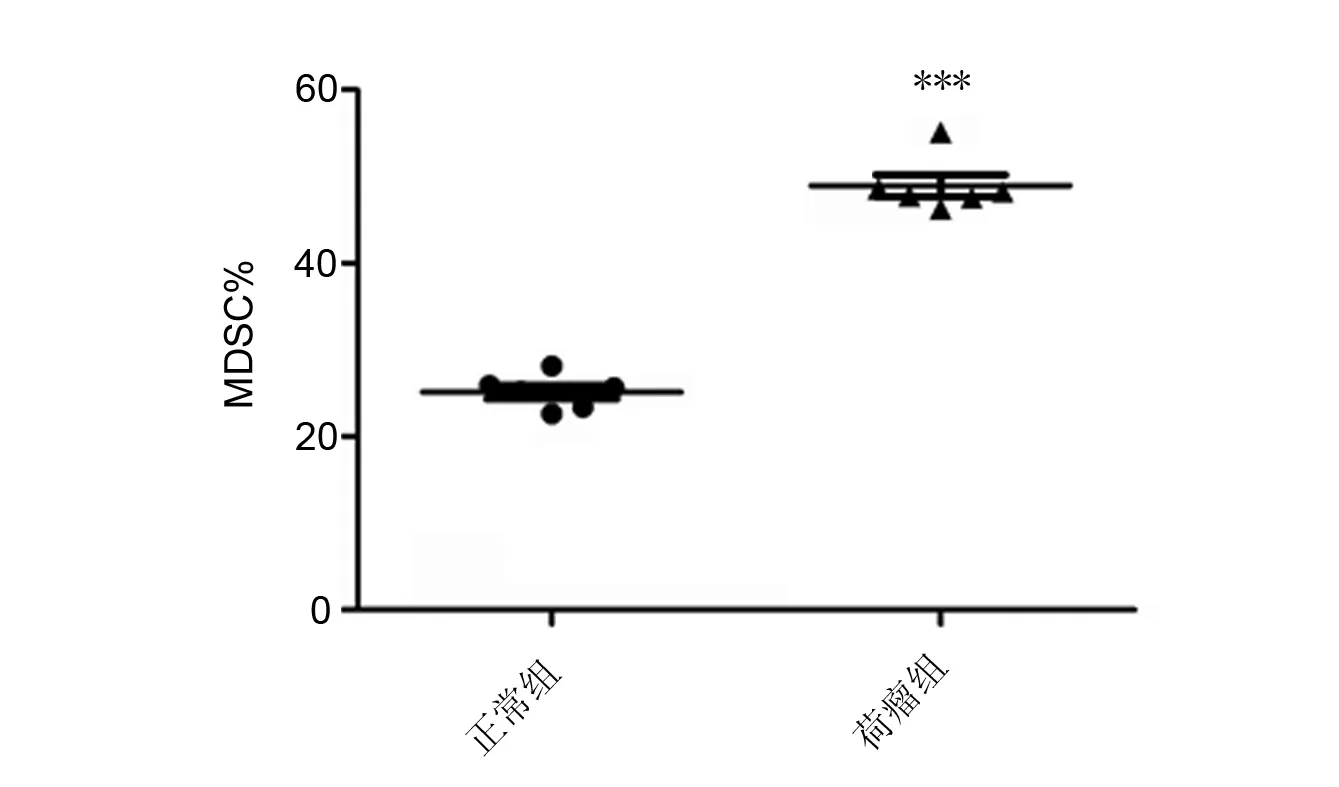
***与正常组比较,P<0.001图2 正常小鼠和荷乳腺癌小鼠骨髓细胞中MDSCs的含量Fig 2 MDSC ratios from bone marrow of normal and tumor bearing mice
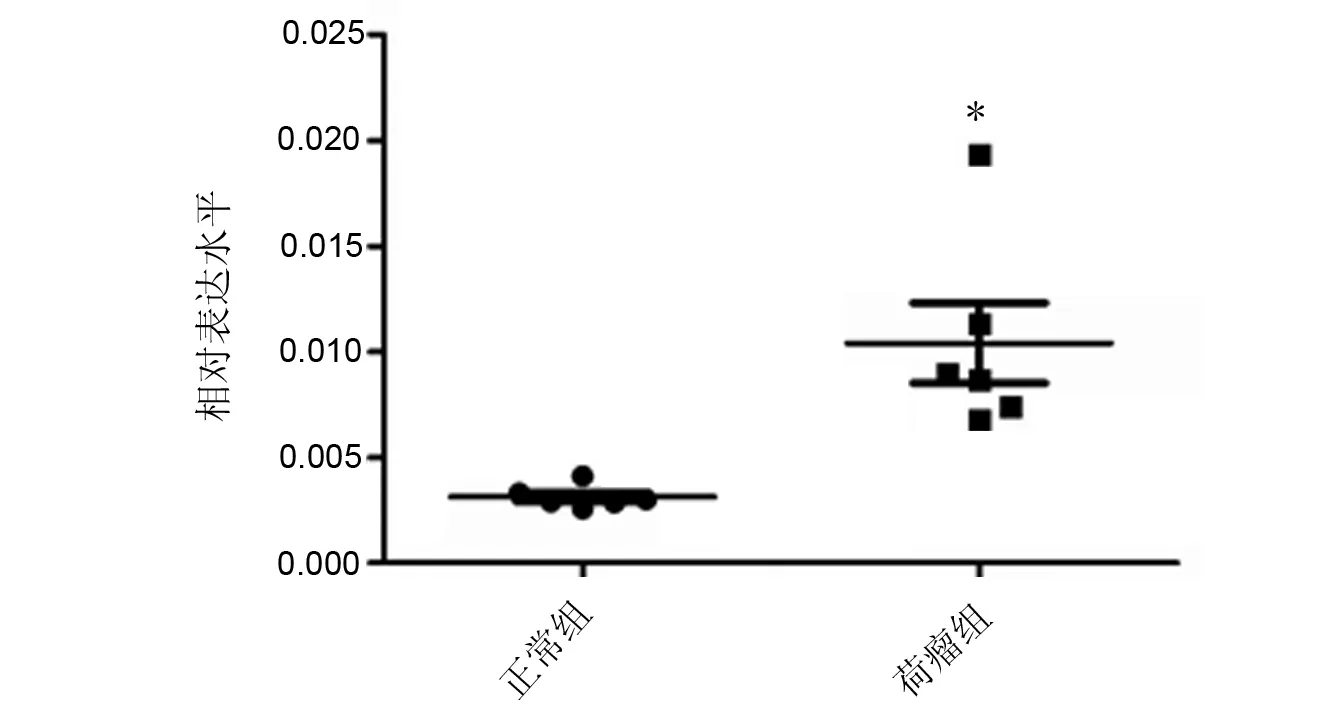
*与正常组比较,P<0.05图3 正常小鼠和荷乳腺癌小鼠骨髓MDSCs中MCT mRNA的表达水平Fig 3 MCT mRNA levels in MDSCs from bone marrow of normal and tumor bearing mice

**与正常组比较,P<0.01图4 正常小鼠和荷乳腺癌小鼠骨髓MDSCs中LDHB mRNA的表达水平Fig 4 LDHB mRNA levels in MDSCs from bone marrow of normal and tumor bearing mice
能量代谢涉及细胞生命活动的各个方面,深入了解MDSCs的能量代谢特点有助于揭示其如何发挥免疫抑制功能,但国内外鲜有相关研究。肿瘤细胞的快速增殖消耗了大量的葡萄糖,能源物质相对匮乏的肿瘤微环境对浸润其中的各种细胞是不利的;同时,也导致局部微环境大量乳酸堆积,这将不利于肿瘤的发生发展。
前期,课题组成员的研究结果表明[12]:鼻咽癌病人外周血中的MDSC数量显著高于正常人,且其能量代谢的重要分子MCT1也显著高于正常人。但是该研究的缺陷在于:正常人和鼻咽癌病人的身体状况较为复杂,这必定造成较大的异质性,且正常人血液MDSCs的比例相对较低,这都不利于我们后续探索性实验的开展。因此,在前期工作的基础上,进一步在动物模型上进行探讨。本研究结果表明:荷乳腺癌小鼠MDSCs 比例显著高于正常小鼠,同时其MCT1的表达显著高于正常小鼠,这与前期[12]在鼻咽癌病人外周血中得到的结果相似。可以推测:正是由于MDSCs高表达MCT1,可将大量的乳酸转运至胞内,肿瘤局部微环境中大量堆积的乳酸反而成了MDSCs重要的能源物质, MDSCs细胞表面的MCT1分子可能是乳酸的关键“清道夫”[13-14]。当然,乳酸被摄入后在胞内不断堆积也不利于MDSCs各项生物学功能的发挥,我们的研究表明:荷乳腺癌小鼠MDSCs的LDHB表达显著高于正常小鼠,这将很好的缓解了胞内的乳酸堆积,LDHB可将胞内的乳酸转变成丙酮酸,最终进入三羧酸循环进而被彻底氧化分解,提供各项生命活动所需的ATP。在局部肿瘤微环境中能源物质缺乏的情况下,MDSCs或许就是凭借高表达MCT1摄入大量堆积的乳酸,并由LDHB将后者进一步转变成丙酮酸后最终彻底氧化分解。正因如此,与正常小鼠相比,荷乳腺癌小鼠MDSCs不仅在数量上占据巨大优势,其代谢特点使其能够利用乳酸作为能源物质更好地发挥免疫抑制作用,而肿瘤微环境乳酸的降低也将促进肿瘤的发生发展。这些结果提示:从能量代谢的角度靶向消除或抑制MDSCs的免疫抑制功能将是一个不错的思路。
[1] Mackert JR, Qu P, Min Y, et al. Dual negative roles of C/EBPα in the expansion and pro-tumor functions of MDSCs[J]. Sci Rep, 2017, 7(1): 14048.
[2] Hüsecken Y, Muche S, Kustermann M, et al. MDSCs are induced after experimental blunt chest trauma and subsequently alter antigen-specific T cell responses[J]. Sci Rep, 2017, 7(1): 12808.
[3] He XY, Gong FY, Chen Y, et al. Calreticulin Fragment 39-272 Promotes B16 Melanoma Malignancy through Mye
loid-Derived Suppressor Cells In Vivo[J]. Front Immunol, 2017, 8: 1306.
[4] Bergenfelz C, Larsson AM, von Stedingk K, et al. Systemic Monocytic-MDSCs Are Generated from Monocytes and Correlate with Disease Progression in Breast Cancer Patients[J]. PLoS ONE, 2015, 10(5): e0127028.
[6] Messmann JJ, Reisser T, Leithäuser F, et al. In vitro-generated MDSCs prevent murine GVHD by inducing type 2 T cells without disabling antitumor cytotoxicity[J]. Blood, 2015, 126(9): 1138-1148.
[7] Sauer H, Wartenberg M, Hescheler J. Reactive Oxygen Species as Intracellular Messengers During Cell Growth and Differentiation[J]. Cell Physiol Biochem, 2001, 11(4): 173-186.
[8] Chandra D, Gravekamp C. Myeloid-derived suppressor cells[J]. Oncoimmunology, 2013, 2(11): e26967.
[9] Soong RS, Anchoori RK, Yang B, et al. RPN13/ADRM1 inhibitor reverses immunosuppression by myeloid-derived suppressor cells[J]. Oncotarget, 2016, 7(42): 68489-68502.
[10] Marie SK, Shinjo SM. Metabolism and brain cancer[J]. Clinics (Sao Paulo), 2011, 66(Suppl 1): 33-43.
[11] Semenza GL. Tumor metabolism: cancer cells give and take lactate[J]. J Clin Invest, 2008, 118(12): 3835-3837.
[12] 张娜, 蓝瑞隆, 钟光贤. MCT1在鼻咽癌病人外周血MDSC中的表达及意义[J]. 大连医科大学学报, 2016, 38(2): 114-117.
[13] Petersen C, Nielsen MD, Andersen ES, et al. MCT1 and MCT4 Expression and Lactate Flux Activity Increase During White and Brown Adipogenesis and Impact Adipocyte Metabolism[J].Sci Rep, 2017, 7(1):13101.
[14] Diehl K, Dinges LA, Helm O, et al. Nuclear factor E2-related factor-2 has a differential impact on MCT1 and MCT4 lactate carrier expression in colonic epithelial cells: a condition favoring metabolic symbiosis between colorectal cancer and stromal cells[J].Oncogene, 2017.DOI:10.1038/onc.2017.299.
ExpressionandsignificanceofMCT1andLDHBinMDSCsfrombonemarrowofbreastcancerbearingmice
LAN Ruilong1,2, ZHANG Na3, CHEN Ruiqing1,2
(1.CentralLaboratoryoftheFirstAffiliatedHospitalofFujianMedicalUniversity,Fuzhou350005,China; 2.FujianKeyLaboratoryofIndividualizedActiveImmunotherapy,Fuzhou350005,China; 3.FujianInsituteofHematology,FujianProvincialKeyLaboratoryonHematology,FujianMedicalUniversityUnionHospital,Fuzhou350001,China)
ObjectiveTo test the MDSCs ratios in bone marrow from normal and breast cancer bearing mice, and compare the mRNA levels of the key energy metabolism molecules-MCT1/LDHB and explore the possible mechanism of immunosuppression in MDSCs.MethodsMDSCs (CD11b+Gr-1+) in bone marrow was sorted by BD FACSAriaⅢ. MCT1/LDHB mRNA levels were detected with q-PCR.ResultsThe MDSCs ratio (19.77±4.77)% in breast cancer bearing mice was much higher than that (0.84±0.18)% in normal group (P<0.001).Both MCT1 and LDHB mRNA of MDSCs in tumor bearing group were significantly higher than that in normal group (P<0.05 andP<0.01, respectively).ConclusionsThe energy metabolism could play an role in the immunosuppression of MDSCs.
MDSC; MCT1; LDHB; energy metabolism; immunosuppression
福建省卫计委青年课题(2016-1-60);2016年福建医科大学启航基金(2016QH042)
蓝瑞隆(1986-),男,研究实习员。E-mail:lanruilong123@126.com
陈瑞庆,助理研究员。E-mail: crq209ted@163.com
10.11724/jdmu.2017.06.03
R73
A
1671-7295(2017)06-0532-04
蓝瑞隆,张娜,陈瑞庆.MCT1和LDHB在荷乳腺癌小鼠髓系抑制性细胞中的表达及意义[J].大连医科大学学报,2017,39(6):532-535.
2017-09-01;
2017-11-02)
