表面氮化纯铁生物学性能的研究
2018-01-06伍青芳刘恒全
伍青芳,毕 瑜,余 林,刘恒全
成都理工大学,材料与化学化工学院,四川 成都 610059
表面氮化纯铁生物学性能的研究
伍青芳,毕 瑜,余 林,刘恒全
成都理工大学,材料与化学化工学院,四川 成都 610059
采用气体软氮法对工业纯铁进行表面氮化.用X射线衍射、金相显微镜、扫描电镜分别对样品表面的结构及形貌进行分析,用相变温度分析仪测定纯铁表面氮化层相变温度,用显微硬度仪分析样品表面硬度,通过溶血率、血小板粘附实验表征纯铁表面血液相容性.结果表明:渗氮后铁表面有5 μm左右的白亮层,该白亮层为氮铁化合物层,由ε相和γ′相组成,具有较高硬度及脆性,从而使渗氮铁的硬度有显著提高;纯铁溶血率为3.81%,大于氮化处理铁的2.9%;血小板实验证明,表面氮化铁的血小板粘附率较低,表明经氮化处理的纯铁表面生物学性能有所改善.
气体软氮法;血液相容性;硬度;耐腐蚀.
心血管疾病已严重威胁着人们的生命健康,支架植入术为治疗心血管疾病带来突破性进展.但是,血管支架[1-3]作为异物长期存在血管内容易引起血栓及再狭窄等并发症,因此寻找一种短期起到血管支撑作用、后期能逐渐消失的血管支架材料成为近年来的研究热点[4-7].铁作为人体所需的微量元素之一,与人体有很好的生物相容性[8].铁的腐蚀是一个缓慢的过程,在它完全降解前可对血管起到支撑作用[9].Peuster等人[10]制作了一种可降解的纯铁支架,证明了铁基可作为血管支架.Waksman等人[11]将纯铁支架和钴铬合金支架进行比较发现,纯铁支架性能优于钴铬支架性能.Nie等人[12]发现,纳米晶的纯铁材料抗腐蚀能力优于微米晶的纯铁材料.由于纯铁在体内的降解速率是不可控的,因此纯铁表面处理对改变材料的物理化学及生物学性能来说十分关键.
气体氮化是一种低温热处理工艺,经氮化处理后的材料表面形变很小、氮化层硬度高、抗疲劳性能良好.因此,氮化处理工艺得到广泛的应用[13].本研究采用气体软氮化法对纯铁表面进行氮化处理,并对氮化处理后纯铁的性能进行了研究.
1 实验部分
1.1 氮化处理
实验材料为10 mm×10 mm×0.3 mm的工业纯铁片,经机械打磨抛光后,在可控气氛炉(BTF-1200C真空管式炉)中进行渗氮.首先通入氮气,设定气流量为200 mL/min,在70 min内将炉温度升至600 ℃,然后关闭氮气阀门,打开氨气阀门,氨气进气量为200 mL/min,保温2.5 h后关闭氨气阀门,打开阀门至炉冷却后取出样品.
1.2 分析测试
X射线衍射分析:将工业纯铁样品及表面氮化纯铁样品放入检测仪器(上海精密仪器,DX-2700型)中,然后开始扫描并记录数据.其中设置扫描步宽为0.05 °,扫描范围为5~80 °,管电压为40 kV,管电流为30 mA.
金相显微观察:将打磨抛光后的工业纯铁试样浸入100 mL的腐蚀液(乙醇(φ=90%)+硝酸(φ=10%)的混合溶液)中浸泡7~10 s,然后吹干,在金相显微镜下观察试样的组织形貌.
扫描电镜分析:将工业纯铁样品及经过氮化处理后的样品清洁并表面喷金,用扫描电镜(日本日立,S-530型)对试样的表面结构进行观察.
相变温度分析:将氮化处理的试样放入相变温度分析仪(彼奥德电子技术有限公司,PCA-1200型)中,拧紧阀门并打开真空泵.首先升温至50 ℃,1 min后开始拟合,然后升温至600 ℃,3 min后开始拟合.检测完成后自然降温冷却,待温度下降到100 ℃以内时先关闭真空泵,然后通入空气,最后打开阀门,取出样品.
显微硬度测试:将试样置于砧座和压针之间,当压针与检测面垂直时轻轻压下手柄,使压针压住试样,然后快速压下手柄,施加足够的力,使压针套筒的端面紧压在试样上,从表头读出硬度值(精确到0.5 HV).超出限度的下压力,会被弹簧平衡掉,而不会损坏硬度计.再次测量时,两相邻压痕中心间距离应不小于6 mm.
1.3 血液相容性
取新鲜抗凝兔血4 mL,加入5 mL浓度为0.9%的氯化钠溶液,将血稀释备用.将两组10 mm×10 mm的纯铁、不锈钢和氮化后的纯铁的薄膜样品分别放于不同试管中.一组加入10 mL的0.9%氯化钠溶液,作为阴性对照组.另一组加入10 mL的蒸馏水,作为阳性对照组.然后将所有样本同置于37 ℃水浴中保温30 min,再往各试管中加入稀释血0.2 mL,于37 ℃水浴继续保温60 min,经5 min离心后,取上清液在波长540 nm下测吸光度.材料的溶血率按下式计算:

(1)
式(1)中R为溶血率,A为试样吸光度,C1为阴性对照样吸光度,C2为阳性对照样吸光度.
将新鲜抗凝兔血在离心机上以800 r/min的离心速率离心15 min,取上清液得到富血小板血浆(PRP).不同样品经丙酮、无水乙醇和蒸馏水超声洗净,用PRP浸泡样品,在37 ℃的恒温水浴中培养15 min,然后用磷酸盐缓冲液(PBS)漂洗样品,用2%的戊二醛固定试样,再用乙醇梯度脱水,在光学显微镜下观察血小板粘附状况.
2 结果与讨论
2.1 结构分析
图1为工业纯铁和氮化处理后工业纯铁的XRD图谱.从图1可以看到,氮化样品表面的化合物层为呈六方晶系ε-FexN和立方γ'-Fe4N相的混合物,氮化处理后样品表面层为铁氮化合物白亮层,主要成分是ε-Fe2-3N相,厚度大约3~5 μm.
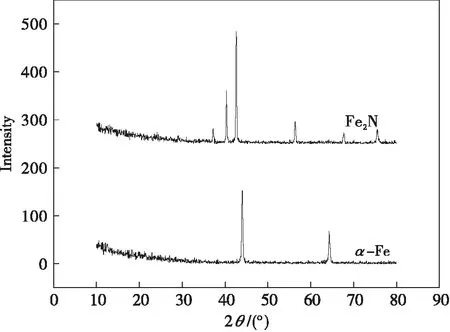
图1 不同样品的XRD图谱Fig.1 The XRD spectrum of various samples
2.2 形貌分析
图2为纯铁的金相图.从图2(a)可见,未经氮化处理的工业纯铁的组织为块状奥氏体.从图2(b)可见:经过氮化处理后的样品表面颜色变深(暗沉),纯铁表面形成致密化合物层,白亮层分布其中.气体氮化过程中形成的化合物层比较厚.在氮气供应及氮化时间相同的处理条件下,含有氮化物形成元素的工业纯铁复合层也较厚,这是因为由合金元素形成的氮化物或碳氮化物的氮含量比铁形成的高.
图3为氮化处理前后工业纯铁样品的SEM照片.从图3可以看到,工业纯铁经氮化处理后表面出现多孔的较为疏松的物质层.进一步观察照片图3(a)发现,疏松物质分布不均匀,呈不连续的网状.从图3(b)可以看到,工业纯铁表面平整均匀,可以清晰看到亚微米尺寸的氮化物晶粒.

图2 纯铁样品的金相照片,600×(a)氮化处理前;(b)氮化处理后Fig.2 The metallographic photograph of pure iron sample,600×(a)un-treated sample;(b) treated samples

图3 不同样品的表面形貌(a)氮化处理;(b)未处理Fig.3 The surface morphology of different samples(a)nitrogen treatment;(b) untreated
2.3 薄膜相变
图4为纯铁样品表面氮化层薄膜相变曲线.由图4可见,经过氮化处理的工业纯铁表面在470 ℃左右发生了相变.据文献报道[14],纯铁在740 ℃(共析点)以下时,当γ′相质量分数增加时,ε相质量分数将按比例降低.在纯铁表面渗氮过程中,随着时间的增加,γ′相可转变为六方结构,并在400~600 ℃下逐渐转变成立方γ′相.当氮化处理温度较低时,易发生氮化而生成Fe3N相;当氮化温度较高时,可生成较纯的γ′相即Fe4N相.由于氮化铁薄膜层的生成,在470 ℃附近出现了台阶,表明在纯铁表面有新相生成.
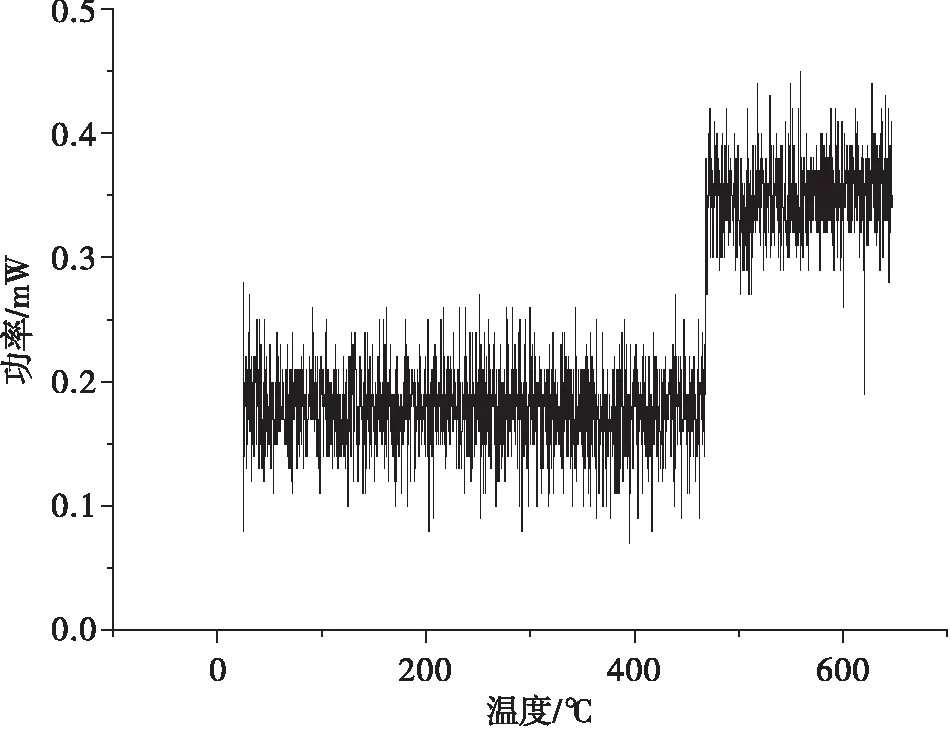
图4 氮化工业纯铁表面薄膜相变曲线Fig.4 The membrane phase transition curve of industrial pure iron
2.4 表面硬度
图5为氮化处理前后样品的硬度.从图5可见,氮化后样品表面的硬度值均比未氮化纯铁表面的高,但经过氮化处理后的样品不同地方的硬度差值超过300 HV.这是由于氮化铁的表面硬度由化合物层的厚度及化合物层中的ε-Fe2-3N相和γ′-Fe4N相氮化物的质量分数决定,表明此次实验所用的氮化处理方法并不完善,样品表面处理不均匀.

图5 不同样品的硬度Fig.5 Hardness of different samples
2.5 血液相容性
纯铁、氮化铁和不锈钢均符合溶血率小于5%这个标准[15],它们作为血液接触材料时不会破坏红细胞.图6为不同样品的溶血率.从图6可见,纯铁的溶血率为3.81%、氮化铁次之为2.9%.可降解的纯铁与渗氮铁相比,进行渗氮处理后的铁材料溶血率更低,更适合作为支架材料.这是因为渗氮处理后铁的耐腐蚀性能提高,与血液中离子交换的速率比纯铁的慢,所以溶血率也就更小.
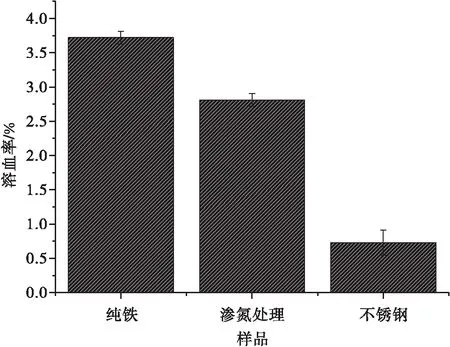
图6 不同样品的溶血率Fig.6 The hemolysis rate of different samples
图7为不同样品表面血小板黏附的光学显微镜观察结果.从图7可见:纯铁的血小板黏附率较高,其作为血管支架存在因血小板粘附而引起并发症的可能性;经渗氮处理后的铁基本不存在血小板黏附现象,表明样品表面的氮化层起到减少血小板吸附的作用.对铁进行渗氮处理在一定程度上可以提高支架血液相容性能,考虑血小板粘附因素时,渗氮处理铁比纯铁更适合作为血管支架的材料.

图7 不同样品表面血小板黏附显微图,600×(a)纯铁;(b)氮化纯铁Fig.7 Platelet adhesion on the surface of different samples,600×(a)pure iron;(b) pure iron nitride
3 结 论
纯铁通过渗氮处理后,其表面硬度显著提高.与未经氮化处理的纯铁相比,表面氮化纯铁的溶血率和血小板粘附率降低,血液相容性能提高.
[1] JOSEPH T P,NATHANIEL W T,JONATHAN N J,et al.Intravascular and hybrid intraoperative stent placement for baffle obstruction in transposition of the great arteries after atrial switch[J].Cathet Cardiovasc Intervent,2017,89(2):306-314.
[2] WANG Q,REN Y B,BABAR M S,et al. Design and characterization of a novel nickel-free cobalt-base alloy for intravascular stents [J].Materials Science & Engineering C,2017,77:565-571.
[3] KADOHIRA T,KOBAYASHI Y.Intravascular ultrasound-guided drug-eluting stent implantation [J].Cardiovascular Intervention and Therapeutics,2017,32 (1):1-11.
[4] MORAVEJ M,PURNAMA A,FISET M,et al.Electroformed pure iron as a new biomaterial for degradable stents:In vitro degradation and preliminary cell viability studies [J]. Acta Biomaterialia,2010,5(6):1843-1851.
[5] MARIOT P,M A LEEFLANG,L SCHAEFFER,et al.An investigation on the properties of injection-molded pure iron potentially for biodegradable stent application[J].Powder Technology,2016,294:226-235.
[6] ANDREA L,B OLIVER,TILMAN G,et al.Evaluation of High-yield purification methods on monodisperse PEG-grafted iron oxide nanoparticles[J]. Langmuir:The ACS Journal of Surfaces and Colloids,2016,17(32)4259-4269.
[7] HUANG T,CHENG Y,ZHENG Y F.In vitro studies on silver implanted pure iron by metal vapor vacuum arc technique [J]. Colloids and Surfaces B:Biointerfaces,2016,142:20-29.
[8] RANNA T,JEROME H,CARLO P,et al. The use of multiple pseudo-physiological solutions to simulate the degradation behavior of pure iron as a metallic resorbable implant: a surface-characterization study[J].Physical Chemistry Chemical Physics:PCCP,2016,29(18):19637-19646.
[9] ZHANG E,CHEN H Y,SHEN F. Biocorrosion properties and blood and cell compatibility of pure iron as a biodegradable biomaterial[J].Journal of Materials Science: Materials in Medicine,2010,7(21):2151-2163.
[10] PEUSTER M,WOHLSEIN P,BRÜGMANN M,et al.A novel approach to temporary stenting:degradable cardiovascular stents produced from corrodible metal-results 6~18 months after implantation into new zealand white rabbits[J]. Heart,2001,86:563-569.
[11] WAKSMAN R,PAKALA R,BAFFOUR R,et al.Short-term effects of biocorrodible iron stents in porcine coronary arteries [J]. Journal of Interventional Cardiology,2008,21:15-20.
[12] NIE F,ZHENG Y,WEI S,et al. In vitro corrosion,cytotoxicity and hemocompatibility of bulk nanocrystalline pure iron[J].Biomedical Material,2010,6(5):065015.
[13] 廖裕力,陈汉鸣.国外渗碳、氮化发展近况[J].机电工程技术,1978(1):5-10.
[14] 俞德刚.纯铁γ-Fe到α-Fe和共析钢的珠光体转变与过渡相界铁原子个体有序位移机制[J].材料热处理学报,2012,6(33):116-126.
[15] 查磊.表面修饰对镁合金AZ811生物相容性的影响[D].天津:天津医科大学,2010.
Studyonthebiologicalpropertiesofpureironviasurfacenitridemodification
WU Qingfang,BI Yu,YU Lin,LIU Hengquan
ChengduUniversityofTechnology,CollegeofMaterialsandChemistry&ChemicalEngineering,Chengdu610059,China
The gas soft nitrogen method is used to nitride industrial pure iron. The surface structure and morphology of the samples were charactorized by X ray diffraction,optical microscopy and scanning electron microscopy, respectively. The phase transformation temperature of nitrided samples was determined by phase change temperature analyzer, and the surface hardness of allsamples was obtained by
microhardness tester.Thehemolysis rate and platelet adhesion test were used to evaluate the blood compatibility. The results show that the nitrided iron surface is about 5 μm of the white layer, the white layer is composed of iron, ε phase , ′ phase, which has high hardness and brittleness. The hemolysis rate of iron was 3.81% Vs. 2.9% of nitrided iron, the result of plateletadhesion shows that the amount of nitrided iron surface is lower than the pure iron surface, so gas soft nitrogen method is suitable to apply surface modification of pure iron as potential biodegradable biomaterials.
gas soft nitrogen method;blood compatibility;hardness;corrosion resistance.
2017-11-09
1673-9981(2017)04-0240-06
R318.08
A
