产β-葡萄糖苷酶芽孢杆菌的筛选及水解大豆异黄酮糖苷研究
2018-01-05刘宏丽郭晓军狄聪颖郭威朱宝成
刘宏丽,郭晓军,狄聪颖, 郭威,朱宝成
(河北农业大学 生命科学学院,河北 保定 071000)
产β-葡萄糖苷酶芽孢杆菌的筛选及水解大豆异黄酮糖苷研究
刘宏丽,郭晓军,狄聪颖, 郭威,朱宝成
(河北农业大学 生命科学学院,河北 保定 071000)
为获得能高效水解大豆异黄酮糖苷的芽孢杆菌,利用七叶苷平板分离法从动物的新鲜粪便中筛选产β-葡萄糖苷酶的芽孢杆菌菌株,然后对酶活最高的菌株进行种属鉴定和水解大豆异黄酮糖苷的研究.结果显示:筛选到1株酶活力较高的芽孢杆菌R2-2,经鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens);该菌株有较高的糖苷水解能力,黄豆苷水解率最高达到53.65%,染料木苷为48.80%.
β-葡萄糖苷酶;芽孢杆菌;筛选;大豆异黄酮糖苷
大豆异黄酮(soybean isoflavones)具有较好的抗氧化、延缓衰老、防癌抗癌、增强免疫力及改善动物生产性能等功能[1-3],已被广泛应用于生物、饲料、医药和食品保健等领域.大豆中天然存在的大豆异黄酮通常以3种游离苷元、9种结合型糖苷形式存在,其中结合型糖苷约占总量的97%~98%,游离型苷元仅占2%~3%[4-5].豆粕中的大豆异黄酮以糖苷形式存在,而具有生理活性的成分主要是大豆异黄酮的游离苷元,只有转化为苷元,才能提高大豆异黄酮的活性[6].β-葡萄糖苷酶(β-glucosidase)可水解结合于末端非还原性的β-D-糖苷键,同时释放葡萄糖和相应配基[7].目前获得的高活性大豆异黄酮糖苷水解酶主要来源于植物和微生物[8-9].微生物法转化大豆异黄酮因具有反应条件温和、转化率高、不易变性、成本低、无污染等优点而成为研究热点.
本实验旨在筛选出产β-葡萄糖苷酶的芽孢杆菌,能够高效水解大豆异黄酮糖苷为游离苷元,为提高豆粕中大豆异黄酮的活性提供菌种材料.
1 材料与方法
1.1 材料
1.1.1 样品
新鲜獭兔粪样:来源于河北农业大学生命科学学院制药工程实验室.
1.1.2 培养基
纤维二糖培养基:酵母膏 2.5 g,纤维二糖 2.5 g,蛋白胨 2.5 g,(NH4)2SO41.0 g,KH2PO40.5 g,MgSO40.2 g,pH 7.2,蒸馏水1 000 mL[10].
七叶苷筛选培养基:酵母膏 5.0 g,蛋白胨 15.0 g,NaCl 5.0 g,琼脂20.0 g,体积分数为0.1%的七叶苷和3 g/L柠檬酸高铁铵,pH 7.0,蒸馏水1 000 mL[11].
产酶发酵培养基:蛋白胨10.0 g,酵母膏5.0 g,NaCl 3.0 g,Mandels微量元素溶液(1 000×),pH自然,蒸馏水1 000 mL.
1.2 产β-葡萄糖苷酶芽孢杆菌的筛选
1.2.1 富集培养
取新鲜粪便样品1.0 g置于99.0 mL加玻璃珠的灭菌生理盐水中,振荡30 min,接种于纤维二糖培养基中,37 ℃、180 r/min培养24 h.
1.2.2 筛选
取1.0 mL富集培养液进行梯度稀释,然后取10-7~10-4倍稀释液涂布七叶苷筛选平板,37 ℃倒置培养2~3 d,观察并挑选出菌落周围或背面显现黑色的菌落.将初筛分离得到的菌株接种于产酶发酵培养基,培养48 h后离心取上清液,采用DNS法测定酶活力[11-12].每个菌株进行3次重复.选取酶活力最高的菌株进行后续研究.酶活单位采用国际定义方法:在实验条件下,1 mL酶液每min分解底物生成1 μmol葡萄糖所需酶量定义为1个酶活单位,用U/mL表示.
1.3 菌株种属鉴定
1.3.1 形态特征
将菌株接种于NB培养基及NA平板培养基上,分别进行菌体及菌落形态观察.菌株革兰氏染色、芽孢染色参考文献[13]进行.
1.3.2 16S rRNA基因序列测定、分析及系统进化树构建
细菌基因组DNA 的提取和 16S rRNA基因的扩增参照杨继业[14]的方法,PCR产物送交北京华大基因科技股份有限公司进行测序.与EzBioCloud数据库中的核苷酸序列进行在线同源性序列分析,选取同源性较高的序列,采用MEGA.5软件进行多序列比对,建立进化树.
1.3.3 生理生化特性测定
根据菌株的16S rRNA基因序列分析的初步结果,依据文献[15]进行生理生化特征的测定,观察并记录结果.
1.4 水解大豆异黄酮糖苷研究
大豆异黄酮糖苷水解方法参考文献[16].
大豆异黄酮糖苷水解率计算公式W=(A-B)/A×100%.
式中,W为大豆异黄酮水解率;A为酶解前大豆异黄酮糖苷含量;B为酶解后大豆异黄酮糖苷含量.
高效液相色谱分析条件为色谱柱:Waters C18柱(150 mm×4.6 mm,5μm);流速:0.8 mL/min;检测波长:260 nm;进样量:20 μL;柱温:30 ℃;流动相:体积分数为0.1%的冰醋酸+乙腈∶甲醇∶水=30∶10∶60(体积比).
2 结果与分析
2.1 β-葡萄糖苷酶产生菌的筛选
由于七叶苷(6,7-2-羟基-香豆素-β-D-葡萄糖苷)被β-葡萄糖苷酶分解会释放出七叶素(6,7-2-羟基-香豆素),七叶素能与Fe3+反应形成黑色化合物,可依据菌落背面或周围显现黑色来筛选产β-葡萄糖苷酶的菌株,如图1.经纤维二糖培养基富集培养后,利用七叶苷分离培养基分离筛选、纯化获得18株产酶较高的菌株.

图1 菌株筛选结果Fig.1 Screening results of aesculin separation culture medium
将初筛获得的菌株进行产酶发酵,提取粗酶液,按照酶活测定方法绘制葡萄糖标准曲线,测定菌株酶活,进行复筛.葡萄糖标准曲线的线性回归方程及相关系数为Y=0.009X+0.004,R2=0.998.各菌株的β-葡萄糖苷酶活性见表1,选取酶活最高且产芽孢的R2-2进行后续研究.

表1 各菌株发酵液的β-葡萄糖苷酶活力测定结果
2.2 产酶菌株的种属鉴定
2.2.1 形态特征
菌株R2-2的菌落、菌体和芽孢观察结果如图2所示,其形态特征见表2.

a.菌落;b.菌体(×1 000);c.芽孢(×2 000).图2 菌株R2-2的菌落、菌体和芽孢Fig.2 Colony,mycelium and spore of strain R2-2

项目形态项目形态菌落形状圆形菌体形态杆状菌落大小中偏小革兰氏染色+菌落颜色白色,边缘灰色菌体大小(1.82~1.93μm)×0.65μm菌落边缘不规则异染粒染色+光学特性不透明芽孢形态圆柱形或椭圆形菌落表面干燥,有火山口芽孢着生位置端生或次端生
+代表阳性;-代表阴性.
2.2.2 16S rRNA基因序列测定、分析及系统进化树的构建
经测定,菌株R2-2的16S rRNA基因序列的长度为1 275 bp.将基因序列提交NCBI数据库获得登录号MF000350.与EzBioCloud数据库中的核苷酸序列进行在线同源性序列分析.采用 MEGA.5软件进行多序列比对,用邻位连接法构建发育树(图3),结果显示菌株R2-2与Bacillusamyloliquefaciens亲缘关系最接近.

图3 R2-2菌株16S rRNA基因序列系统发育树Fig.3 Phylogenetic tree of 16S rRNA sequence of strain R2-2
2.2.3 生理生化实验
各菌株部分生理生化实验结果见表3.根据菌株R2-2的形态学特征、16S rRNA 比对分析和生理生化实验结果,参照中国典型培养物保藏中心、中国科学院微生物研究所提供的菌属特征描述,可将菌株R2-2鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens).

表3 菌株R2-2部分生理生化实验结果
2.3 水解大豆异黄酮糖苷
大豆异黄酮酶解前后产物的HPLC图谱及分析见图4、表4.
由图4a知黄豆苷出峰时间为4 min左右,染料木苷出峰时间为5 min左右,黄豆苷元出峰时间为9 min左右,染料木素出峰时间为15 min左右.由图4b可知大豆异黄酮酶解前图中含有黄豆苷和染料木苷峰,而黄豆苷元和染料木素的峰非常小,未见黄豆黄苷与黄豆黄素.这是因为黄豆黄素苷类主要存在于大豆胚芽中,在豆粕的提取物中检测不到[17].有少量苷元存在是由于大豆自身含有少量的大豆β-葡萄糖苷酶,有一定的水解能力,但酶活较低[18].将酶解后异黄酮产物进行HPLC检测,结果如图4c,仍可见到黄豆苷、染料木苷的峰,同时检测到黄豆苷元和染料木素的峰,可以认定实验菌株所产β-葡萄糖苷酶具有水解大豆异黄酮糖苷的能力.
经计算(表4)酶解之后大豆异黄酮糖苷含量明显减少,苷元含量明显增加.经菌株R2-2所产β-葡萄糖苷酶水解,黄豆苷的峰面积从54.20%降低到25.12%,水解率达到53.65%.染料木苷的峰面积从41.92%降低到21.59%,水解率达到48.8%.黄豆苷元的峰面积由2.02%增加到22.08%;染料木素的峰面积由1.5%增加到16.88%.大豆异黄酮糖苷总水解率达51.40%.黄豆苷元的含量增加了10.93倍,染料木素含量增加了11.25倍,游离型苷元含量明显增加.由结果可知实验所得菌株具有较高的糖苷水解能力,可大大提高大豆异黄酮的活性.
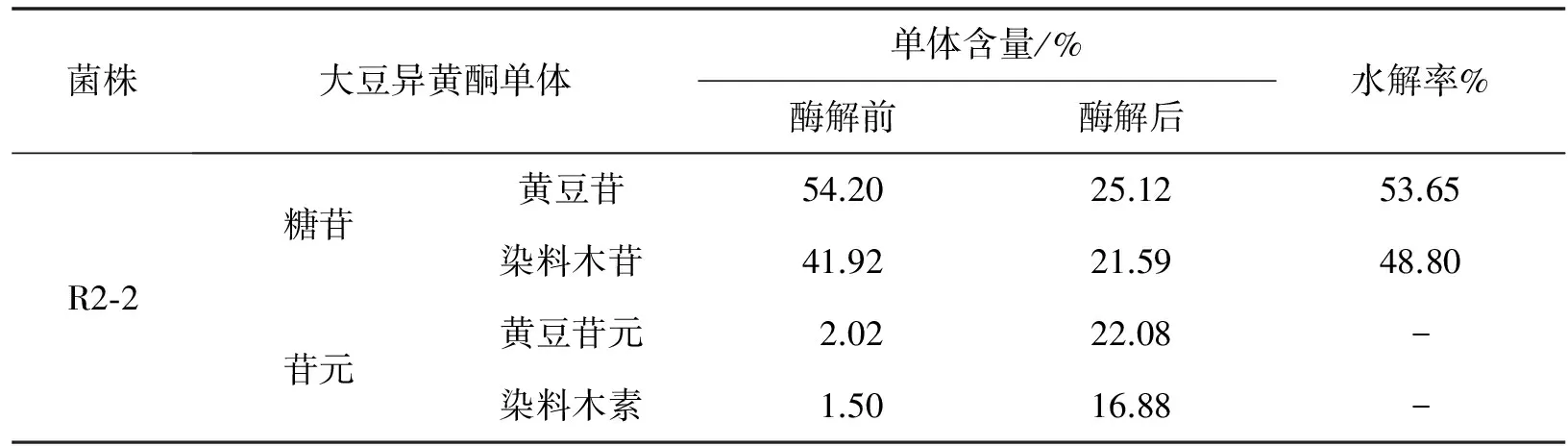
表4 大豆异黄酮酶解前后单体变化及糖苷水解率

a.大豆异黄酮标准品;b.大豆异黄酮酶解前;c.大豆异黄酮酶解后.1.黄豆苷;2.染料木苷;3.黄豆苷元;4.染料木素.图4 大豆异黄酮酶解前后HPLC色谱图Fig.4 HPLC chromatogram before and after enzymatic hydrolysis of soybean isoflavone
3 讨论
大豆异黄酮苷元可促进动物生长、提高繁殖能力、增强机体免疫,是一种优质的生物活性物质.豆粕中的大豆异黄酮主要为糖苷形式[19],糖苷形式的大豆异黄酮不能被哺乳动物肠道直接吸收,必须经微生物产生的糖苷酶除去糖基,生成的苷元才能发挥生物活性[20].用于转化大豆异黄酮糖苷的酶有β-葡萄糖苷酶、β-半乳糖苷酶等,研究最多的是β-葡萄糖苷酶[21].国内外对产β-葡萄糖苷酶菌株的筛选及研究多集中在真菌(如曲霉[22-23]、木霉[24-25]、酵母菌[26-27]等)、双歧杆菌[9,28]、乳酸杆菌[29],对芽孢杆菌的研究较少.曲霉、木霉等真菌是好氧菌,而豆粕发酵为厌氧发酵;酵母菌虽然是兼性厌氧菌,但酶活较低[27];双歧杆菌和乳酸杆菌的产酶能力往往受到营养成分和培养条件的影响[30].以上各菌在应用于豆粕发酵时均会受到不同的限制,不利于实际生产.
Bau′等[31]检测了开菲尔发酵剂发酵豆乳过程中大豆异黄酮成分含量变化,黄豆苷元增加了9倍,染料木素增加了4.8倍.Raimondi[28]利用22株双歧杆菌转化黄豆苷,B.adolescentisMB243菌株转化48 h时β-葡萄糖苷酶酶活为0.47 U/mg,培养7 d黄豆苷水解率100%,苷元增加97%.本实验利用菌株R2-2发酵的粗酶液进行大豆异黄酮糖苷水解,反应30 min黄豆苷和染料木苷的水解率即达到53.65%和48.80%.黄豆苷元和染料木素的含量分别增大了10.93倍和11.25倍,水解大豆异黄酮糖苷效果显著.王彩肖[32]等诱导S1酵母菌产β-葡萄糖苷酶活力提高到0.011 3 U/mL.陈红漫[33]等筛选到1株β-葡萄糖苷酶的芽孢杆菌ZL-110,酶活为0.277 U/mL.实验筛得解淀粉芽孢杆菌R2-2酶活达0.283 U/mL,不低于以上报道.本实验利用七叶苷显色原理从动物粪便中筛选到产β-葡萄糖苷酶的芽孢杆菌R2-2.芽孢杆菌由于具有其他菌属不具备的生产和应用的优越性,如适应性强、繁殖周期短、兼性厌氧等,有利于进行菌剂的工业生产,为进一步豆粕发酵研究奠定菌种基础,对豆粕的综合利用和提高其附加值具有重要意义.
[1] 李万林,钟姣姣,王少龙,等.大豆异黄酮生理功能及其检测方法的研究进展[J].饮料工业,2014,17(4):54-59.
LI W L,ZHONG J J,WANG S L,et al.Research progresses in physiological functions of and detection methods for soybean isoflavones[J].Beverage Industry,2014,17(4):54-59.
[2] 何恩铭,沈瑞池,林志楷,等.大豆异黄酮抗肿瘤效应研究进展[J].亚热带植物科学,2013,42(4):356-360.DOI: 10.3969/j.issn.1009-7791.2013.04.019.
HE E M,SHEN R C,LIN Z K,et al.A review on anti-tumor effects of soy isoflavones[J].Subtropical Plant Science,2013,42(4):356-360.DOI: 10.3969/j.issn.1009-7791.2013.04.019.
[3] 罗佳捷,范觉鑫,张彬.大豆异黄酮在动物生产中的研究进展[J].饲料博览,2012,1:9-11.DOI: 10.3969/j.issn.1001-0084.2012.01.004.
LUO J J,FAN J X,ZHANG B.Research progress of soybean isoflavone in animal production[J].Feed Review,2012,1:9-11.DOI: 10.3969/j.issn.1001-0084.2012.01.004.
[4] KUMAR N B,CANTOR A,KATHY A R D,et al.The specific role of isoflavones on estrogen metabolism in premenopausal women[ J].Cancer,2002,94(4): 1166 -1174.DOI: 10.1002/cncr.10320.
[5] 金凤燮.天然产物生物转化[M].北京:化学工业出版社,2009:223 -243.
[6] ROUTLEDGE E J,PARKER J,ODUM J,et al.Some alkyl hydroxy benzoate preservatives (parabens) are estrogenic [J].Toxicology and Applied Pharmacology,1998,153 (1): 12-19.
[7] 杨晓宽.β-葡萄糖苷酶研究进展[J].河北科技师范学院学报,2012,26(1):77-81.DOI: 10.3969 / J.issn.1672-7983.2012.01.016.
YANG X K.Research progress onβ-glucosidase[J].Journal of Hebei Normal University of Science & Technology,2012,26(1):77-81.DOI: 10.3969 / J.ISSN.1672-7983.2012.01.016.
[8] HESSLER P E,LARSEN P E,CONSTANTINOU A I,et al.Isolation of isoflavones from soy-based fermentations of the erythromycin-producing bacterium Saccharopolyspora erythraea[J].Appl Microbiol Biotechnol,1997,47: 398-404.DOI: 10.1007/s002530050947.
[9] TSANGALIS D,ASHTON J F,MCGILL A E J,et al.Enzymatic transformation of isoflavone phytoestrogens in soy milk byβ-glucosidase-producingBifidobacteria[J].J Food Sci,2002,67:3104-3113.DOI: 10.1111/j.1365-2621.2002.tb08866.x.
[10] 潘艳,张益波,郭志敏,等.β-葡萄糖苷酶高产菌株筛选、诱变及其发酵的研究[J].食品研究与开发,2012,33(5):149-152.DOI:10.3969/j.issn.1005-6521.2012.05.043.
PAN Y,ZHANG Y B,GUO Z M,et al.Study on screening and mutation ofβ-Glucosidase-producing strain[J].Food Research and Development,2012,33(5):149-152.DOI: 10.3969/j.issn.1005-6521.2012.05.043.
[11] 黄琴,朱婷,蒋承建,等.产β-葡萄糖苷酶的菌种的筛选鉴定及其酶学特性[J].基因组学与应用生物学,2011,30(5):590-595. DOI: 10.3969/gab.030.000590.
HUANG Q,ZHU T,JIANG C J,et al.Isolation,identification and the enzymatic characteristics of the strain producingβ-glucosidase[J].Genomics and Applied Biology,2011,30(5):590-595.DOI: 10.3969/gab.030.000590.
[12] 施特尔马赫.酶的测定方法[M].钱嘉渊,译.北京:中国轻工业出版社出版,1992:102-119.
[13] 沈萍,陈向东.微生物学实验[M].第4版.北京:高等教育出版社,2007.
[14] 杨继业,郭晓军,郭威,等.产有机酸芽孢杆菌的筛选、鉴定及产芽孢条件优化[J].饲料工业,2015,369(4):44-51.DOI:10.13302/j.cnki.fi.2015.04.010.
YANG J Y,GUO X J,GUO W,et al.Screening and identification of a strain ofBacillussp.producing organic acids and optimization of its spore production conditions[J].Feed Industry,2015,369(4):44-51.DOI:10.13302/j.cnki.fi.2015.04.010.
[15] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[16] 齐斌,刘贤金.产大豆异黄酮β-葡萄糖苷酶菌株的筛选及酶学性质研究[J].食品科学,2007,28(8): 290-293.DOI: 10.3321/j.issn:1002-6630.2007.08.069.
QI B,LIU X J.Study on screen of soybean isoflavoneβ-glucosidase-producing strain and its enzymatic properties[J].Food Science,2007,28(8): 290-293.DOI: 10.3321/j.issn:1002-6630.2007.08.069.
[17] 潘利华,罗建平,罗水忠,等.高活性大豆异黄酮糖苷酶的分离原料筛选、纯化及性质研究[J].食品科学,2009,30(1):164-168.DOI:10.3321/j.issn:1002-6630.2009.01.039.
PAN L H,LUO J P,LUO S Z,et al.Seleetion of plant source used for separating isoflavone-glucosidase with high aetivity and its purification and properties[J].Food Science,2009,30(1):164-168.DOI:10.3321/j.issn:1002-6630.2009.01.039.
[18] 高荣海,刘长江,李长彪,等.大豆异黄酮糖苷水解研究进展[J].粮食与油脂,2006(8): 10-12.DOI: 10.3969/j.issn.1008-9578.2006.08.003.
GAO R H,LIU C J,Ll C B,et al.Research advance on hydrolyzation of soybean isonavone glycoside[J].Cereals & Oils,2006(8): 10-12.DOI:10.3969/j.issn.1008-9578.2006.08.003.
[19] 崔洪斌.大豆生物活性物质的开发与应用[M].北京:中国轻工业出版社,2001:178-179.
[20] 于卓腾.大豆黄酮对仔猪肠道微生物的影响和雌马酚产生菌的分离及其特性的研究[D].南京农业大学,2007.
YU Z T.Effects of daidzein on the gastrointestinal mcicrobial community of piglets and isolation and study characterisation of equol-producing bacteria[D].Nanjing Agricultural University,2007.
[21] 杨守凤,徐建雄.β-葡萄糖苷酶转化大豆异黄酮及其保健功能的研究进展[J].饲料研究,2014,01:6-12.
[22] 刘德海,马焕,谢复红,等.一株产β-葡萄糖苷酶烟曲霉菌株的鉴定及其产酶特性[J].中国酿造,2015,34(6):118-122.DOI:10.11882/j.issn.0254-5071.2015.06.026.
LIU D H,MA H,XIE F H,et al.Identification ofβ-glucosidase producingAspergillusfumigatusand its enzyme production characteristics[J].China Brewing,2015,34(6):118-122.DOI:10.11882/j.issn.0254-5071.2015.06.026.
[23] 朱婧,覃拥灵,陈桂光,等.β-葡萄糖苷酶高产菌株的选育及酶法转化葡萄糖生产龙胆低聚糖[J].食品与发酵工业,2010,36(4):21-25.DOI:10.13995/j.cnki.11-1802/ts.2010.04.024.
ZHU J,QIN Y L,CHEN G G,et al.Selection of the highβ-glucosidase mutant and production of gentiooligosaccharid[J].Food and Fermentation Industries,2010,36(4):21-25.DOI:10.13995/j.cnki.11-1802/ts.2010.04.024.
[24] 张秋卓,蔡伟民.纤维素酶高产菌株的复合交替诱变选育[J].工业微生物,2008,38(6):32-37.DOI:10.3969/j.issn.1001-6678.2008.06.007.
ZHANG Q Z,CAI W M.Selecuion of high cellulase-yielding mutant by compound mutagenesis[J].Industrial Microbiology,2008,38(6):32-37.DOI:10.3969/j.issn.1001-6678.2008.06.007.
[25] KRISHNA S H,PRASANTHI K,CHOWDARY G V.Simultaneous saccharification and fermentation of pretreated sugar cane leaves to ethanol[J].Process Biochemistry,1998,33(8):825-830.DOI.org/10.1016/S0032-9592(98)00051-X.
[26] RICCARDO N B,GIOVANNI S,ROSA P,et al.Selection,characterization and compareson of β-glucosidase from mould and yeasts employable for enological application[J].Enzyme and Microbial Technology,2004,35:58-66.
[27] 蒋文鸿.昌黎与济源产区高产β-葡萄糖苷酶野生非酿酒酵母的筛选及鉴定[D].杨凌:西北农林科技大学,2014.
JIANG W H.Screening and identification of high producingβ-glucosidase wild non-saccharomyces Yeast strain from JIYUAN and CHANGLI[D].Yangling: Northwest A & F University,2014.
[28] RAIMONDI S,RONCAGLIA L,LUCIA M D,et al.Bioconversion of soy isoflavones daidzin and daidzein byBifidobacteriumstrains[J].Appl Microbiol Biotechnol,2009,81:943-950.DOI:1007/s00253-008-1719-4.
[29] SUBROTA HATI,SHILPA VIJ,BRIJ PAL SINGH.et al.β- Glucosidase activity and bioconversion of isoflavones during fermentation of soymilk[J].J Sci Food Agric,2015,95: 216-220.DOI:10.1002/jsfa.6743.
[30] OTIENO D O,ASHTON J F,SHAH N P.Evaluation of enzymic potential for biotransformation of isoflavone phytoestrogen in soymilk byBifidobacteriumanimalis,LactobacillusacidophilusandLactobacilluscasei[J].Food Research International,2006,39(4): 394-407.DOI.:org/10.1016/j.foodres.2005.08.010.
[31] BAU′ T R,GARCIA S,IDA E I.Changes in soymilk during fermentation with kefir culture: oligosaccharides hydrolysis and isoflavone aglycone production[J].Food Sci Nutr,2015,66(8): 845-850.DOI:10.3109/09637486.2015.1095861.
[32] 陈红漫,赵璐,杨佳影,等.一株产胞外中性β-葡萄糖苷酶菌株的鉴定及酶学特性研究[J].食品科学,2009,30(15):160-163.DOI:10.3321/j.issn:1002-6630.2009.15.036.
CHEN H M,ZHAO L,YANG J Y,et al.Identification of a novelBacillusstrain capable of producing neutralβ-G lucosidase and characterization of its enzy matic properties[J].Food Science,2009,30(15): 160-163.DOI:10.3321/j.issn:1002-6630.2009.15.036.
[33] 王彩肖,武伟伟,李艳.产β-D-葡萄糖苷酶酵母菌的筛选及产酶性质研究[J].酿酒科技,2014,10:14-18.DOI:10.13746/j.njkj.2014.0167.
WANG C X,WU W W,LI Y.Screening of yeast strains with high-yield ofβ-D-glucosidase and study on theirβ-D-glucosidase-producing properties[J].Liq-Mak Sci Technol,2014,10:14-18.DOI:10.13746/j.njkj.2014.0167.
ScreeningofBacillusstrainsproducingβ-glucosidaseandstudyonhydrolysisofsoybeanisoflavoneglycosides
LIUHongli,GUOXiaojun,DICongying,GUOWei,ZHUBaocheng
(College of Life Sciences,Agricultural University of Hebei,Baoding 071000,China)
In order to obtainBacillusstrains capable of efficiently hydrolyze soybean isoflavone glycosides,this study screenedBacillusstrains producingβ-glucosidase from fresh feces of animals with the help of Aesculin separation culture medium.Then the strains with relatively higherβ-glucosidase activity were identified and the ability of hydrolyzing isoflavone glucosides were studied.The results showed that a strains ofBacillusR2-2 with relatively higherβ-glucosidase activity was screened out.The identity of strains R2-2 wasBacillusamyloliquefaciens.Strain R2-2 showed rather high efficiency in hydrolyzing isoflavone glucosides.The daidzin hydrolysis rate reached 53.65%,and genistin hydrolysis rate was 48.80%.
β-glucosidase;Bacillus; screen; soybean isoflavone glycosides
10.3969/j.issn.1000-1565.2017.06.010
2017-03-28
河北省重点研发计划农业关键共性技术攻关专项(16226604D);河北省技术创新引导计划科技型中小企业技术创新资金专项(15C1303121015);沧州市科技支撑计划项目(161201007D);保定市科学技术研究与发展计划项目(16ZN007)
刘宏丽(1990—),女,河北衡水人,河北农业大学在读硕士研究生.E-mail:1559239136@qq.com
朱宝成(1962—),男,河北沧州人,河北农业大学教授,博士生导师,主要从事农牧微生物应用技术研究.
E-mail:zhu2222@126.com
S816
A
1000-1565(2017)06-0621-09
赵藏赏)
