25-羟基维生素D3对肉鸡生长性能、骨骼矿化及肠道维生素D受体基因表达的影响
2018-01-05张金龙陈冠华王志祥瞿红侠韩进诚陈建成
张金龙 , 张 宁 , 杨 雪 , 陈冠华 , 王志祥 , 瞿红侠 , 韩进诚 *, 陈建成
(1.河南农业大学牧医工程学院,河南郑州 450002;2.商丘师范学院生命科学学院,河南商丘476000;3.河南正本清源科技发展股份有限公司,河南商丘 476000)
25-羟基维生素D3对肉鸡生长性能、骨骼矿化及肠道维生素D受体基因表达的影响
张金龙1,2, 张 宁1,2, 杨 雪1,2, 陈冠华1,2, 王志祥1, 瞿红侠2, 韩进诚2*, 陈建成3
(1.河南农业大学牧医工程学院,河南郑州 450002;2.商丘师范学院生命科学学院,河南商丘476000;3.河南正本清源科技发展股份有限公司,河南商丘 476000)
为研究25-羟基维生素D3(25-OH-D3)对1~28日龄白羽肉鸡生长性能、骨骼矿化以及肾脏1α-羟化酶、肠道细胞核维生素D受体(nVDR)和细胞膜维生素D受体(mVDR)基因表达的影响,试验选用1日龄罗斯308白羽肉鸡公雏240只,随机分成4个处理,每个处理6个重复,每个重复10只鸡。Ⅰ组为基础日粮组(不添加维生素D),Ⅱ组为正对照组(基础日粮中添加1000 IU/kg的维生素D3),Ⅲ、Ⅳ组为试验组(分别饲喂在基础日粮中添加500、1000 IU/kg的25-OH-D3)。结果显示:(1)与基础日粮Ⅰ组相比,Ⅲ、Ⅳ组1~28日龄肉鸡体增重、采食量提高,料重比降低(P<0.05);与正对照Ⅱ组相比,Ⅲ、Ⅳ组1~28日龄肉鸡体增重、采食量、料重比差异不显著(P>0.05)。(2)与基础日粮Ⅰ组相比,Ⅲ、Ⅳ组28日龄肉鸡胫骨、股骨和跖骨重量、灰分重量及钙、磷含量得到显著改善(P<0.05);与正对照Ⅱ组相比,Ⅲ组胫骨、股骨和跖骨灰分重量提高(P<0.05);Ⅳ组与正对照Ⅱ组28日龄肉鸡骨骼矿化无显著差异(P>0.05)。(3)与基础日粮Ⅰ组及正对照Ⅱ组相比,Ⅲ组28日龄肉鸡肾脏1α-羟化酶mRNA表达水平提高234.72%和243.73%(P<0.01);与试验Ⅲ组相比,试验Ⅳ组肾脏1α-羟化酶mRNA表达水平降低10.46%(P<0.05)。(4)与基础日粮Ⅰ组及正对照Ⅱ组相比,Ⅲ组28日龄肉鸡十二指肠nVDR mRNA表达水平无显著差异(P>0.05);与试验Ⅲ组相比,试验Ⅳ组十二指肠nVDR mRNA表达水平降低32.56%(P<0.05)。(5)与基础日粮Ⅰ组相比,Ⅲ组28日龄肉鸡十二指肠mVDR mRNA表达水平提高25.29%(P<0.05);与正对照Ⅱ组相比,试验Ⅲ组mVDR mRNA表达水平无显著差异(P>0.05);与试验Ⅲ组相比,试验Ⅳ组mVDR mRNA表达水平降低24.50%(P<0.05)。试验表明:日粮中添加500 IU/kg的25-OH-D3可显著提高肉鸡肾脏1α-羟化酶和十二指肠mVDR mRNA表达水平,改善肉鸡生长性能和骨骼矿化。
25-羟基维生素D3;生长性能;骨骼矿化;维生素D受体;肉鸡
This experiment was to evaluate the effects of dietary 25-hydroxycholecalciferol (25-OH-D3)levels on growth performance and bone mineralization,as well as the mRNA expression levels of 1α-hydroxylase in the kidney,nuclear vitamin D receptor (nVDR),and membrane vitamin D receptor (mVDR)in the duodenum of broiler chickens from 1 to 28 days of age.A total of 240 one-day-old male birds were randomly assigned to 4 groups with 6 replicates per group and 10 birds per replicate.Diet 1 was the basal diet without vitamin D.Diet 2 was the control diet with 1000 IU/kg vitamin D3.Diet 3 and 4 were the basal diet supplemented with 500 IU/kg and 1000 IU/kg 25-OH-D3.The results showed as follows:(1) The broilers fed 500 IU/kg and 1000 IU/kg 25-OH-D3had greater body weight gain (BWG),feed intake (FI)and lower feed conversion ratio (FCR) compared with the birds fed the basal diet(P < 0.05).No significant differences in growth performance were observed in broilers fed diets with 25-OH-D3and birds fed the control diet (P > 0.05).(2)The weight,ash weight,and the content of calcium and phosphorus in tibia,femur,and metatarsus of broilers fed 500 IU/kg and 1000 IU/kg 25-OH-D3were higher than those of birds fed the basal diet (P < 0.05).The leg bone ash weight of broilers fed 500 IU/kg 25-OH-D3was greater than that of birds fed the control diet(P < 0.05).By contrast,no significant differences in leg bone mineralization were observed between the birds fed 1000 IU/kg 25-OH-D3and the birdsfed the control diet(P > 0.05).(3)The mRNA expression level of 1α-hydroxylase in the kidney of birds fed the diet with 500 IU/kg 25-OH-D3increased by 234.72%and 243.73%compared with the birds fed the basal diet and control diet(P < 0.01).By contrast,the mRNA expression level of 1α-hydroxylase in the kidney of birds fed the diet with 1000 IU/kg 25-OH-D3decreased by 10.46%compared with the birds fed the diet with 500 IU/kg 25-OH-D3(P < 0.05).(4)No significant difference in the mRNA expression level of nVDR in the duodenum were observed among the birds fed the diet with 500 IU/kg 25-OH-D3,the basal diet and the control diet (P > 0.05).(5)The mRNA expression level of nVDR in the duodenum of birds fed the diet with 1000 IU/kg 25-OH-D3decreased by 32.56%compared with the birds fed the diet with 500 IU/kg 25-OH-D3(P<0.05).The mRNA expression level of mVDR in the duodenum of birds fed the diet with 500 IU/kg 25-OH-D3increased by 25.29%compared with the birds fed the basal diet(P < 0.05).No significant difference in the mVDR mRNA expression level was observed between the birds fed the diet with 500 IU/kg 25-OH-D3and the birds fed the control diet (P > 0.05).The mVDR mRNA expression level in the duodenum of birds fed the diet with 1000 IU/kg 25-OH-D3decreased by 24.50%compared with the birds fed the diet with 500 IU/kg 25-OH-D3(P < 0.05).These data indicated that 500 IU/kg 25-OH-D3could up-regulate the mRNA expression of 1α-hydroxylase in the kidney and nVDR in the small intestine and improve the growth performance and bone mineralization of broiler chickens.
25-hydroxycholecalciferol;growth performance;bone mineralization;vitamin D receptor;broiler chicken
维生素D可调节动物肠道钙、磷的吸收,但在现代集约化饲养条件下,家禽缺乏紫外线照射,因此饲料业中通常添加外源性维生素D3(VD3)或其衍生物来调节家禽体内钙、磷的代谢,以维持肉鸡正常生长 (Mitchell等,1997;Edwards 等,1994)。瞿红侠等(2015)研究表明,以生长性能和骨骼矿化指标来评价25-OH-D3的生物学效价约为VD3的1.81倍。日粮中用25-OH-D3代替VD3可增加肉鸡体增重(Fritts等,2003)、改善骨骼的矿化(Janocha等,2009)、促进肠道发育和提高免疫力(Gabriela 等,2013;Chou 等,2009)。
维生素D3经过肝脏25-羟化酶、肾脏1α-羟化酶转化为最终活性产物 1,25-(OH)2-D3,1,25-(OH)2-D3可通过血液进入肠道上皮细胞,与两种受体结合后调节肠道磷吸收,两种受体分别为肠道上皮细胞核受体 (nVDR)和细胞膜受体(mVDR),1,25-(OH)2-D3分别与nVDR、mVDR结合后,促进小肠黏膜对钙、磷的吸收,增加血液中钙、磷离子浓度,维持机体钙、磷平衡(赵成毅等,2012;Tunsophon 等,2010;Nemere等,2004)。
研究发现,基础日粮中25-OH-D3适宜添加量为 500 IU/kg左右 (陈冠华等,2017;Han等,2016;瞿红侠等,2015)。本试验旨在研究基础日粮中添加500 IU/kg和1000 IU/kg的 25-OH-D3对1~28日龄肉鸡生长性能、骨骼矿化以及肾脏1α-羟化酶、nVDR、mVDR 基因表达的影响,为进一步研究奠定基础。
1 材料与方法
1.1 试验动物 选取1日龄健康、体重均匀的罗斯308肉鸡公雏240只,随机分为4组,每组6个重复,每重复10只。试验期为1~28日龄。肉鸡进行笼养(200 cm×50 cm×35 cm)。 饲喂粉状配合饲料,自由采食,充足饮水,按常规免疫程序进行免疫接种。
1.2 试验日粮与试验设计 本试验采用的基础日粮营养水平参考NRC(1994)和《鸡饲养标准》(NY/T 33—2004)中肉鸡营养需要推荐值。Ⅰ组饲喂基础日粮(不添加维生素D),Ⅱ组为正对照(基础日粮中添加1000 IU/kg的VD3),Ⅲ、Ⅳ组为试验组(分别饲喂在基础日粮中添加500、1000 IU/kg的25-OH-D3)。基础日粮组成及营养水平见表1。VD3添加剂购自桐乡市天和诚食品科技有限公司,25-OH-D3添加剂购自山东海能生物工程有限公司。
1.3 样品收集与分析
1.3.1 生长性能测定 在28日龄时空腹称重,试验期间每天记录各重复肉鸡采食量、死亡鸡数,死亡鸡只称重扣除采食量。统计试验期采食量,计算采食量、体增重和料重比(采食量/体增重)。
1.3.2 血浆指标测定 28日龄时,每重复选取1只与重复平均体重相近的肉鸡进行屠宰试验。用1 mg/mL肝素钠溶液润湿注射器,心脏采血5 mL,3000 r/min离心10 min,血浆冷冻保存(-20℃)。用岛津CL-8000全自动生化分析仪测定血浆钙浓度和血浆无机磷浓度。

表1 基础日粮组成及营养水平(风干基础)
1.3.3 骨骼指标测定 在28日龄时进行屠宰试验,每重复取1只,剥离胫骨、股骨和跖骨。将骨骼放入样品袋密封,冷冻保存(-20℃)。将左侧骨骼(胫骨、股骨和跖骨)在沸水中煮3~5 min,去除残余肌肉、腓骨,剥离干净后,烘箱中105℃烘干24 h,用分析天平称量骨骼重量。用游标卡尺测定腿部左侧骨骼长度和直径(骨骼长度1/2处)。将骨骼压碎,放入坩埚,在茂福炉中600℃灰化36 h,测定灰分重量。骨骼样品分别采用EDTA滴定法测定钙(Ca)含量,钼黄比色法测定磷(P)含量。
1.3.4 肠道和肾脏总RNA的提取、反转录和PCR扩增 28日龄时屠宰,每重复取1只,分别收集肉鸡十二指肠前1/2处黏膜样品和右侧肾脏组织样品,-80℃保存。
以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,根据GenBank公布的鸡肾脏1α-羟化酶、肠道nVDR、肠道mVDR和GAPDH mRNA序列,使用Primer 5.0软件设计引物,引物序列及参数详见表2。引物由上海生工生物工程技术服务有限公司合成。
取80 mg左右样品,按照宝生物工程(大连)有限公司的Takara RNAiso Plus(Code No.9108)说明书提取总RNA,用1%的琼脂糖凝胶电泳检测RNA质量,使用超微量核酸蛋白测定仪检测OD值及RNA浓度。

表2 PCR引物序列及参数
按照Takara逆转录试剂盒 (Code No.RR047A)说明书进行基因组去除反应(42℃、5 min)和反转录反应(37 ℃、15 min,85 ℃、5 s),将RNA逆转录成cDNA,-20℃保存。
使用 Takara荧光定量试剂盒 (Code No.RR820A)进行实时荧光定量PCR(qPCR),qPCR反应体系为10μL,反应程序:95℃预变性1 min,95℃变性 10 s,60℃退火 30 s,72℃延伸 30 s,40个循环。记录Ct值,试验结果采用2-△△Ct法对数据进行统计分析(Livak等,2001)。
1.4 统计分析 以每重复为试验单元,用SAS 9.2数据统计软件对试验数据进行GLM分析,Duncan’s法进行多重比较,P<0.05为差异显著,结果均以“平均值±标准差”表示。
2 结果与分析
2.1 25-OH-D3对1~28日龄肉鸡生长性能的影响 由表3可知,与基础日粮Ⅰ组相比,Ⅲ、Ⅳ组肉鸡体增重分别提高 81.25%、72.83%(P<0.05);采食量提高 39.57%、33.57%(P < 0.05);料重比降低23.04%、22.54%(P<0.05)。与正对照Ⅱ组相比,Ⅲ、Ⅳ组1~28日龄肉鸡体增重、采食量、料重比差异不显著(P>0.05)。Ⅲ组肉鸡的血浆钙、磷含量显著高于正对照Ⅱ组(P<0.05),但与试验Ⅳ组差异不显著(P>0.05)。

表3 25-OH-D3对1~28日龄肉鸡生长性能的影响
2.2 25-OH-D3对28日龄肉鸡骨骼参数的影响
2.2.1 25-OH-D3对28日龄肉鸡胫骨矿化的影响 由表4可知,与基础日粮Ⅰ组相比,Ⅲ、Ⅳ组肉鸡的胫骨骨重、长度、直径、灰分重量、灰分含量及钙、磷含量显著提高(P<0.05);与正对照Ⅱ组相比,Ⅲ、Ⅳ组除直径及灰分重量外骨骼参数差异不显著(P > 0.05)。
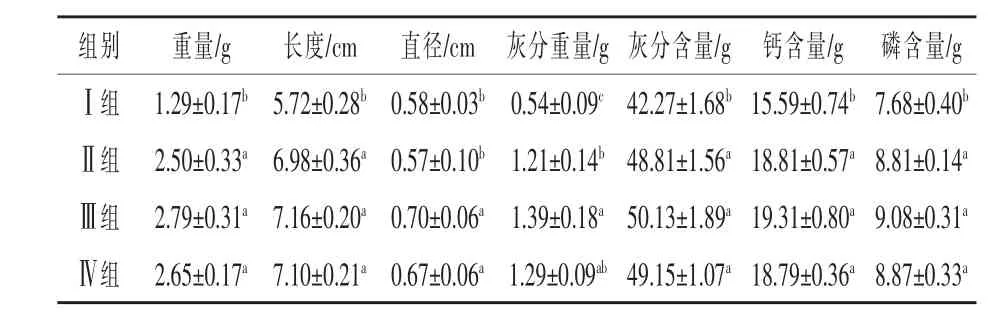
表4 25-OH-D3对28日龄肉鸡胫骨矿化的影响
2.2.2 25-OH-D3对28日龄肉鸡股骨矿化的影响 由表5可知,与基础日粮Ⅰ组相比,Ⅲ、Ⅳ组股骨骨重、长度、灰分重量、灰分含量及钙、磷含量显著提高(P<0.05);与正对照Ⅱ组相比,Ⅲ组股骨重量、直径及灰分重量显著提升(P<0.05)。
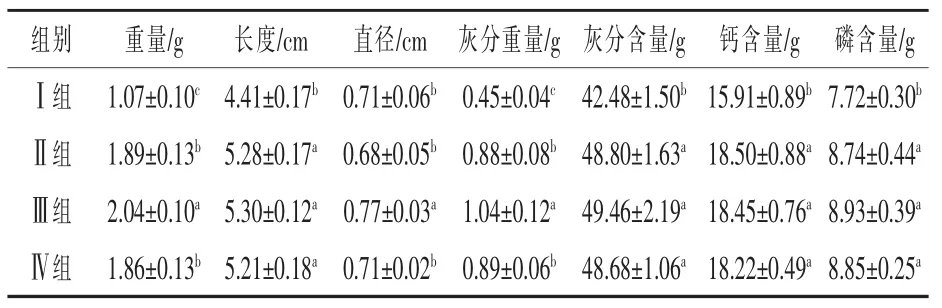
表5 25-OH-D3对28日龄肉鸡股骨矿化的影响
2.2.3 25-OH-D3对28日龄肉鸡跖骨矿化的影响 由表6可知,与基础日粮Ⅰ组相比,Ⅲ、Ⅳ组跖骨骨重、长度、灰分重量、灰分含量及钙、磷含量显著提高(P<0.05);与正对照Ⅱ组相比,Ⅲ组跖骨灰分重量显著提升(P<0.05)。

表6 25-OH-D3对28日龄肉鸡跖骨矿化的影响
2.3 25-OH-D3对28日龄肉鸡肾脏及肠道相关基因表达的影响
2.3.1 25-OH-D3对28日龄肉鸡肾脏1α-羟化酶mRNA表达的影响 由图1可知,与基础日粮Ⅰ组相比,Ⅲ、Ⅳ组1α-羟化酶mRNA表达水平分别提高234.73%和199.73%(P<0.05);与正对照Ⅱ组相比,Ⅲ、Ⅳ组1α-羟化酶mRNA表达水平分别显著提高了 243.72%和207.79%(P<0.05)。与试验Ⅲ组相比,试验Ⅳ组1α-羟化酶mRNA表达水平显著降低了10.46%(P<0.05)。
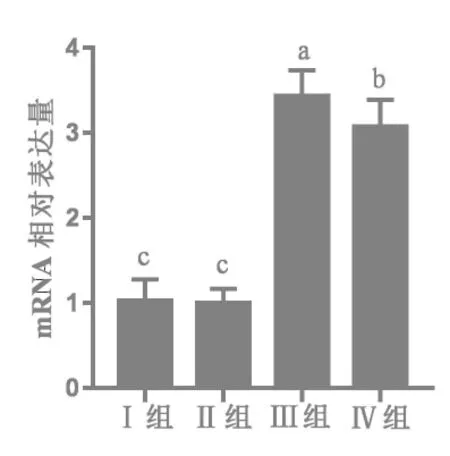
图1 25-OH-D3对28日龄肉鸡肾脏1α-羟化酶 mRNA表达的影响
2.3.2 25-OH-D3对28日龄肉鸡十二指肠nVDR mRNA表达的影响 由图2可知,与基础日粮Ⅰ组及正对照II组相比,Ⅲ、Ⅳ组十二指肠nVDR mRNA表达水平未受显著影响(P>0.05);但与Ⅲ组相比,试验Ⅳ组十二指肠中nVDR mRNA表达水平下降32.56%(P<0.05)。
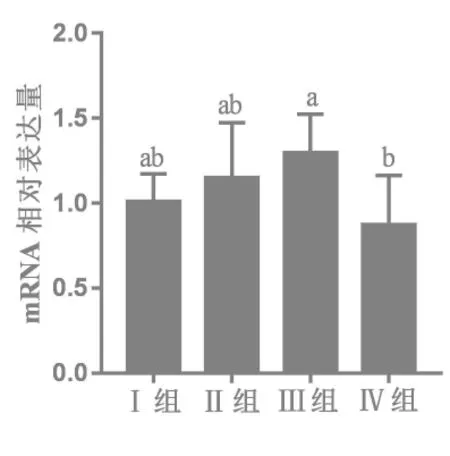
图2 25-OH-D3对28日龄肉鸡十二指肠nVDR mRNA表达的影响
2.3.3 25-OH-D3对28日龄肉鸡十二指肠mVDR mRNA表达的影响 由图3可知,与基础日粮Ⅰ组相比,Ⅲ组十二指肠mVDR mRNA表达量提高25.29%(P < 0.05);与正对照Ⅱ组相比,Ⅲ、Ⅳ组十二指肠mVDR mRNA表达量未受显著影响 (P>0.05);而与Ⅲ组相比,试验Ⅳ组十二指肠中mVDR mRNA表达量降低24.50%(P<0.05)。
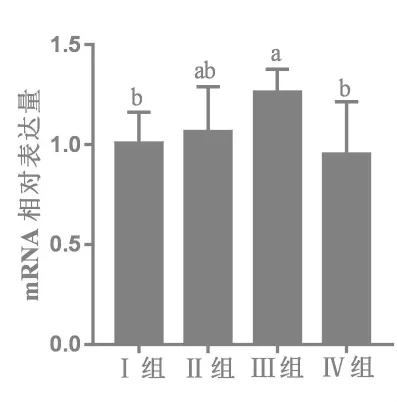
图3 25-OH-D3对28日龄肉鸡十二指肠mVDR mRNA表达的影响
3 讨论
3.1 25-OH-D3对1~28日龄肉鸡生长性能的影响 Han等(2016)研究表明,当基础日粮中添加400 IU/kg 25-OH-D3时可显著提高1~21日龄肉鸡体增重和采食量,降低料重比和死亡率。Goodgame 等(2011)发现,日粮中 25-OH-D3水平由100 IU/kg增加到800 IU/kg时,7~21日龄肉鸡体重和采食量显著提高;当25-OH-D3水平上升至3200 IU/kg时,肉鸡生长性能未受显著影响。进一步研究发现,肉鸡日粮中25-OH-D3适宜添加水平约为500 IU/kg(陈冠华等,2017)。本试验结果表明,基础日粮中添加500 IU/kg 25-OHD3能显著增加28日龄肉鸡体增重和采食量,降低料重比;但1000 IU/kg 25-OH-D3对生长性能无显著影响。
3.2 25-OH-D3对28日龄肉鸡骨骼矿化的影响骨骼矿化是评定家禽维生素D作用效果的敏感指标。研究表明,在肉鸡基础日粮中添加适量VD3、25-OH-D3或 1α-羟基维生素 D3均能显著提高肉鸡骨骼的重量、长度、灰分重、灰分百分含量及钙、磷含量(陈冠华等,2017;王建国等,2015;Han 等,2013)。 Han 等(2016)研究显示,日粮中25-OH-D3水平由50 IU/kg提高到400 IU/kg时,21日龄肉鸡股骨和胫骨重量、长度、灰分重量、灰分含量、钙含量和磷含量显著提高。Goodgame等(2011)报道,25-OH-D3水平由 100 IU/kg 增加到800 IU/kg时能显著提高21日龄肉鸡胫骨和趾骨灰分含量,但进一步提高25-OH-D3水平对骨骼矿化无显著影响。另外,研究发现,日粮中25-OH-D3水平由400 IU/kg提高到3000 IU/kg时,未能显著影响北京鸭胫骨的重量、长度、灰分含量、磷含量、钙含量等指标(石文标等,2013)。陈冠华等(2017)报道,肉鸡日粮中添加500 IU/kg的25-OH-D3可以维持骨骼矿化。本试验取得类似的结果,与基础日粮组相比,500 IU/kg的25-OHD3可显著改善肉鸡腿骨矿化,并达到正对照组水平;但继续提升25-OH-D3水平到1000 IU/kg时,肉鸡骨骼矿化没有得到进一步改善。
3.3 25-OH-D3对28日龄肉鸡肾脏及肠道相关基因表达的影响 维生素D在动物体内可转化为 1,25-(OH)2-D3,从而促进钙、磷的吸收和骨骼矿化。25-OH-D3可直接在肾脏1α-羟化酶的羟基化作用下快速转化为1,25-(OH)2-D3。本试验通过在日粮中添加25-OH-D3上调了1α-羟化酶mRNA的表达量,表明1α-羟化酶在 25-OH-D3转化为 1,25-(OH)2-D3的过程中起着重要作用。
在动物肠道上皮细胞中,维生素D需要与两种维生素D受体结合后发挥作用。这两种受体分别为细胞核维生素D受体(nVDR)和细胞膜维生素D受体 (mVDR)。据报道,nVDR在动物肝脏、肾脏、骨骼、肠道等多种组织中表达,维生素D对多数组织中nVDR基因表达具有调节作用。王宝维等(2014)研究表明,日粮中VD3的水平提高到800 IU/kg时,鹅肝脏nVDR mRNA表达量显著线性提升;但VD3添加水平上升到3200 IU/kg时,nVDR mRNA表达量显著降低。顾海燕等(2009)研究表明,1,25-(OH)2-D3可提升成骨细胞nVDR mRNA表达量。龙艳丽(2014)研究显示,腹腔注射VD3可显著影响乌骨鸡小肠nVDR表达。但张巍等(2009)研究表明,添加维生素D对大鼠肾脏nVDR mRNA表达无显著影响。研究表明,日粮中添加25-OH-D3衍生物1α-OH-D3可显著提升肉鸡肠道nVDR mRNA表达量(王建国,2016)。本试验结果显示,添加500 IU/kg 25-OH-D3可提升肠道nVDR mRNA表达量,但差异不显著;25-OH-D3水平提高到 1000 IU/kg时,十二指肠nVDR mRNA相对表达量显著下降。表明25-OH-D3对nVDR基因表达的调节作用受到剂量的影响。
在动物体内,mVDR在1,25-(OH)2-D3调节肠道无机磷吸收过程中也起到重要作用(梁芬芬等,2012;Nemere 等,2004)。 但鲜见 25-OH-D3调节细胞膜维生素D受体mVDR基因表达的报道。本试验发现,与基础日粮组相比,添加500 IU/kg 25-OH-D3组肉鸡十二指肠中mVDR mRNA表达量显著提高25.29%。但日粮中25-OH-D3水平提高到1000 IU/kg时,肉鸡十二指肠中mVDR mRNA表达量受到显著抑制。
4 结论
4.1 日粮中添加500 IU/kg的25-OH-D3可显著改善肉鸡生长性能,增强胫骨、股骨和跖骨矿化。
4.2 日粮中添加500 IU/kg的25-OH-D3可显著提升肉鸡肾脏1α-羟化酶和十二指肠mVDR mRNA表达水平,趋于提高十二指肠中nVDR mRNA表达量。
[1]陈冠华,张金龙,王建国,等.肉仔鸡对25-羟基维生素D3的需要量[J].动物营养学报,2017,29(7):1 ~ 13.
[2]陈冠华,张金龙,张宁,等.VD3对不同生长阶段肉鸡生长性能、骨骼矿化和钙磷利用的影响[J].中国家禽,2017,2:33 ~ 38.
[3]顾海燕,李婵娟,王全,等.1,25二羟维生素D3对小鼠成骨细胞增殖分化及维生素D受体表达的影响[J].中华实用儿科临床杂志,2009,24(19):1484~1486.
[4]梁芬芬.1,25-(OH)2-D3膜相关快速反应类固醇结合蛋白参与的钙磷相关作用[J].中国医师杂志,2012,14(10):1429 ~ 1431.
[5]龙艳丽.体外注射VD3和LPS对丝羽乌骨鸡维生素D受体及β-防御素基因表达的影响:[硕士学位论文][D].四川:四川农业大学,2014.
[6]瞿红侠,王建国,陈冠华,等.肉鸡日粮中25-羟基维生素D3与维生素D3生物学效价比较[J].中国饲料,2015,20:25 ~ 28.
[7]石文标.北京鸭维生素D3与25-羟维生素D3的需要量及其相对生物学效价的研究:[硕士学位论文][D].北京:中国农业科学院,2013.
[8]王宝维,王迪,葛文华,等.维生素D3对1~4周龄青农灰鹅血清生化指标、免疫性能及维生素D受体mRNA表达量的影响 [J].动物营养学报,2014,26(7):1760 ~ 1768.
[9]王建国,陈冠华,黄凯,等.肉鸡日粮中1α-羟基维生素D3与维生素D3的生物学效价评估[J].中国家禽,2015,37(8):19 ~ 24.
[10]王建国.1α-羟基维生素D3对肉鸡生长性能、骨骼发育、血浆生化指标及肠道磷转运蛋白mRNA表达的影响:[硕士学位论文][D].河南:河南农业大学,2016.
[11]张巍,常立文,王淑荣,等.日光暴露方式及维生素D摄入与大鼠肾脏维生素D受体表达及骨矿化改变[J].临床儿科杂志,2009,27(7):662~665.
[12]赵成毅,刘少喻,李青,等.1,25-羟基维生素D3通过其核受体与膜受体协同调节骨代谢机制的研究进展[J].中华骨科杂志,2012,32(8):788~791.
[13]Chou SH,Chung T K,Yu B.Effects of supplemental 25-hydroxycholecalciferol on growth performance,small intestinal morphology,and immune response of broiler chickens[J].Poultry Science,2009,88(11):2333 ~ 2341.
[14]Edwards H M,Elloot M A,Sooncharernying S,et al.Quantitative requirement for cholecalciferol in the absence of ultraviolet light[J].Poultry Science,1994,73(2):288 ~ 294.
[15]Fritts C A,Waldroup PW.Effect of source and level of vitamin D on live performance and bone development in growing broilers[J].Journal of Applied Poultry Research,2003,12(1):45 ~ 52.
[16]Gabriela G V,Rene M L,Ernesto A G.Use of 25-hydroxycholecalciferol in Diets of Broiler Chickens:Effects on Growth Performance,Immunity and Bone Calcification[J].Journal of Poultry Science,2013,50(1):60 ~ 64.
[17]Goodgame S D,Mussini F J,Lu C,et al.Evaluation of a Fermentation Source of 25-hydroxycholecalciferol in Broiler Diets1[J].International Journal of Poultry Science,2011,10(4):295 ~ 299.
[18]Han JC,Chen G H,Wang JG,et al.Evaluation of Relative Bioavailability of 25-Hydroxycholecalciferol to Cholecalciferol for Broiler Chickens[J].Asian-Australasian Journal of Animal Sciences,2016,29(8):1145 ~ 1151.
[19]Han JC,Qu H X,Wang JQ,et al.The effects of dietary cholecalciferol and 1α-hydroxycholecalciferol levels in a calcium-and phosphorus-deficient diet on growth performance and tibia quality of growing broilers[J].Journal of Animal&Feed Sciences,2013,22(2):158 ~ 164.
[20]Janocha A,Osek M,Klocek B,et al.Effect of adding 25-hydroxycholecalciferol in plant diets with and without fish meal on rearing results and bones of broiler chickens[J].Annals of Animal Science,2009,9(4):415 ~ 423.
[21]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402 ~ 408.
[22]Mitchell R D,Edwards H M,Mcdaniel G R.The effects of ultraviolet light and cholecalciferol and its metabolites on the development of leg abnormalities in chickens genetically selected for a high and low incidence of tibial dyschondroplasia[J].Poultry Science,1997,76(2):346 ~ 354.
[23]Nemere I,Farachcarson M C,Rohe B,et al.Ribozyme knockdown functionally links a 1,25-(OH)2-D3membrane binding protein (1,25D3-MARRS)and phosphate uptake in intestinal cells[J].Proceedings of the National Academy of Sciences,2004,101(19):7392 ~ 7397.
[24]Tunsophon S,Nemere I.Protein kinase C isotypes in signal transduction for the 1,25D3-MARRS receptor (ERp57/PDIA3)in steroid hormonestimulated phosphate uptake[J].Steroids,2010,75(4 ~ 5): 307 ~ 313.■
S816.7
A
1004-3314(2017)24-0024-06
10.15906/j.cnki.cn11-2975/s.20172406
国家自然科学基金项目(31101732);河南省教育厅项目(16A230003)
*通讯作者
