肉鸭消化道酵母益生菌酸胁迫耐受性及其机理研究
2018-01-05胡先勤胡骏鹏王学东廖汉江段胜浩郑红生
刘 琼, 胡先勤*, 胡骏鹏, 王学东,廖汉江, 段胜浩, 郑红生
(1.武汉轻工大学,湖北武汉 430023;2.宜昌安琪酵母股份有限公司,湖北宜昌 443003;3.武汉永生鸭业有限公司,湖北武汉 430077)
肉鸭消化道酵母益生菌酸胁迫耐受性及其机理研究
刘 琼1, 胡先勤1*, 胡骏鹏2, 王学东1,廖汉江2, 段胜浩1, 郑红生3
(1.武汉轻工大学,湖北武汉 430023;2.宜昌安琪酵母股份有限公司,湖北宜昌 443003;3.武汉永生鸭业有限公司,湖北武汉 430077)
从肉鸭消化道内分离出的7株酿酒酵母益生菌中,筛选出高耐酸性的菌株,并探究酵母细胞内Na+、K+浓度及H+-ATPase活性与环境pH的相关性。结果显示:不同酵母菌株酸胁迫耐受性存在差异。酵母菌株通过泵出H+吸收K+来维持胞内pH稳定,表明膜H+-ATPase和K+在酵母菌株耐酸中发挥作用。7株酿酒酵母细胞膜H+-ATPase活性与其生长环境的pH呈负相关。Y-2和Y-7两株酵母菌株相对于其他菌株耐酸性更佳,可作为后续肉鸭专用饲用酵母益生菌的备选菌株。
肉鸭;酵母菌;酸胁迫耐受性;H+-ATPase
This experiment aimed to screen low pH resistant strains from 7 Saccharomyces cerevisiaes which separated from the digestive tract of the meat duck.Moreover,the relationship between the Na+,K+concentration,the activity of H+-ATPase and the pH of yeast cells were explored.The results showed that the ability of acid tolerance of different strains was variance.The S.cerevisiae strains could maintain a neutral cytoplasmic pH by pumping H+and absorbing K+,which proved the function of H+-ATPase and K+in its acidic tolerance.The H+-ATPase activity showed a negative correlation with the growth pH of 7 S.cerevisiae strains.The tolerance to low pH of test strains Y-2 and Y-7 were better than others,which could be used as a follow-up for alternative special probiotic candidate fodder yeast strains for duck.
meat duck;yeast;acid stress tolerance;H+-ATPase
近年来,益生菌作为抗生素的替代品及其优势引起了业界的广泛关注。与抗生素相比,益生菌具备天然、无副作用和无污染等优点,但其饲用效果还不够稳定,从优选菌株角度改善其应用效果显得十分迫切。酵母菌在动物体内作为益生菌的应用广泛,其作为益生菌应用于动物饲料中,可减少抗生素使用带来的弊端,有效降低原料中粗纤维,提高蛋白质等营养组分的含量 (Sekler等,1993;Patrizia 等,1981),并且可预防、治疗动物肠道紊乱等疾病,从而改善动物消化道环境。动物消化道的低pH对益生菌有潜在的灭活作用,抵御不良环境的同时,保证足够的活菌数是益生菌在动物肠道内发挥益生作用的前提 (成妮妮等,2004)。作为优良酵母益生菌的备选菌株,其必须可耐受对其不利的动物消化道高酸性环境 (张秋华等,2010;辛亚平等,2010)。一般微生物在生长繁殖时胞质pH在中性左右,如Spermatosopis acidophila在pH 1.0时生长最适,但胞内pH仍维持在中性 (张秋华等,2010)。对极端嗜酸的Dunaliella acidophila研究发现,K+能促进H+-ATPase的活性,作用部位为细胞质膜内侧(辛亚平等,2010)。H+-ATPase在酵母细胞中起碱化胞质的作用,对细胞内pH的调控起到关键作用,环境pH对该酶的表达量有一定影响(Mason等,1998;Foster等,1995;Serrano 等,1986)。 本试验旨在从肉鸭消化道内分离出的7株酿酒酵母中,通过pH应激处理选取耐低pH最佳的高抗性菌株,并探究低pH与酵母菌株胞内Na+、K+金属离子浓度及细胞膜H+-ATPase活性的相关性,为开发高抗性、专一型的酵母益生菌制剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品来源 本实验室从肉鸭肠道分离保存的7株酿酒酵母(张霞等,2015)。
1.1.2 培养基 琼脂培养基、YPD培养基均为国产。
1.1.3 试剂 GENMED Bradford蛋白质浓度定量试剂盒 (Genmed Scientifics INC.U.S.A),GENMED酵母氢ATP酶(H+-ATPase)活性酶连续反应光谱法定量检测试剂盒 (Genmed Scientifics INC.U.S.A),钠标准溶液、钾标准溶液、硝酸、氯化铯、乳酸等均为国产。
1.2 试验方法
1.2.1 酵母菌的培养 将7株酿酒酵母分别接种于YPD培养基中,28℃、160 r/min 2次培养 (以获得第二代酵母细胞)至对数期(107~108个/mL)。
1.2.2 酵母菌酸胁迫耐受性 取适量制备好的菌悬液,在600 nm波长处用液体YPD培养基调节其 OD 值为 0.6(Garcíahernández等,2012),备用,在灭好菌的液体YPD培养基中加入适量乳酸(85.0% ~90.0%), 调节其 pH分别为 2.0、3.0、4.0、5.5(空白组),分别取 1 mL调节好浓度的菌液接种于不同pH液体YPD培养基中,摇床培养,24 h后,梯度稀释菌液,固体YPD涂布,计数(cfu/mL),计算其存活率,平行3组。酵母菌存活率(S)的计算公式为:
S/%=(cfu/mL)YPD+乳酸/(cfu/mL)YPD×100。
1.2.3 酵母培养液中Na+、K+浓度测定 取制备好的酿酒酵母发酵液5 mL,3000 r/min离心10 min,取上清液再用定量滤纸过滤后(约为4 mL),作为原样品液低温贮存。加热消化,直至无色透明为止。加入适量水加热去除多余的硝酸。待烧杯液体接近2~3 mL时,冷却,用去离子水洗并转移到10 mL刻度试管中,加水定容至刻度。取适量质量浓度为1000 mg/L的Na+、K+标准储备液,配制标准系列使用液,浓度分别为1.0、2.0、3.0、4.0、5.0μg/mL。将消化样液、试剂空白液、标准稀释液分别导入火焰,测其发射强度。样品中元素含量计算公式为:
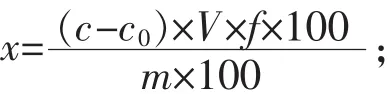
式中:x为试样中元素的含量,mg/100g;c为测定用试样液中元素的浓度,μg/mL;c0为试剂空白液中元素的浓度,μg/mL;V为试样液定容体积,mL;f为试样液稀释倍数;m为试样的质量,g。
1.2.4 酵母菌细胞H+-ATPase活性测定 使用GENMED酵母氢 ATP酶(H+-ATPase)活性酶连续反应光谱法定量检测试剂盒进行测定。取10 mL待测的新鲜真菌/酵母细胞(OD600=0.4~0.8),移入到预冷的15 mL锥形离心管中,置于冰槽里5 min,离心(1000 g,4 ℃,5 min),抽去上清液,加入250μL GENMED裂解液,充分混匀,移入预冷的1.5 mL离心管中,加入100 mg GENMED强化液,强力涡旋振荡15 s,置于冰槽里1 min(重复五次),加入250μL GENMED裂解液,充分混匀,离心(16000 g,4 ℃,15 min),移取 500 μL 上清液到新的预冷的1.5 mL离心管,移取10μL进行蛋白质定量检测(使用GENMED Bradford蛋白质浓度定量试剂盒-MS30030.1)。移取730μL GENMED缓冲液到新的比色皿,加入20μL GENMED酶促液,100μL GENMED反应液,100μL GENMED底物液,放进28℃培养箱里静置3 min,加入50μL待测样品,混匀,即刻放进分光光度仪检测:340 nm读数0~30 min。酶活计算公式为:

式中:A为样品活性,mg;r1为样品读数;r0为背景读数;x为样品稀释倍数;6.22为毫摩尔吸光系数;t为反应时间,min。
2 结果与分析
2.1 不同pH环境培养酵母菌存活率 通过低pH冲击试验,采用平板涂布计算酿酒酵母在不同pH环境的存活率。由表1可知,7株酿酒酵母均可在低酸性环境中生长,且在不同pH环境中的存活率随pH下降而降低。其中,Y-2和Y-7两株酿酒酵母菌株在较低pH环境中的存活率均高于其余5株。由此可知,酿酒酵母培养环境pH对酵母生长有显著影响,且不同酵母菌株对环境酸胁迫耐受性有显著差异。
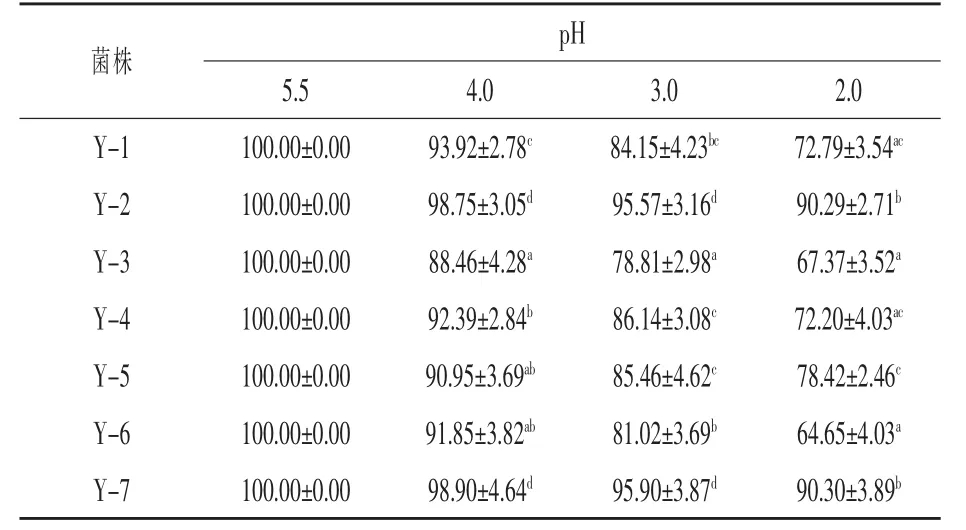
表1 不同pH环境中菌株的存活率%
2.2 酵母培养液中Na+、K+浓度 从图1和图2中可以看出,7株酿酒酵母培养液中,Na+、K+浓度均随pH的降低而降低,由此可知,高酸性的外界生长环境对酵母菌胞内环境有一定影响。在酵母如何维持细胞内环境稳定的机理研究中提到最多的是质子泵和Na+-K+泵,有研究认为,酵母在高酸性环境中生长时,其细胞可通过将胞内H+排出,吸收环境中的K+来维持胞内pH稳定。酵母处于高酸性环境中时,酵母细胞膜上的Na+-K+泵即ATPase的大亚基以亲Na+态与Na+结合,水解ATP释放能量,改变酵母细胞膜电位,使膜内电位负值增大,释放的能量可将Na+运输到细胞外,同时从外界环境将K+运输到细胞内,维持酵母细胞内离子平衡。Na+浓度的降低可能是由于酵母细胞处于高酸性环境中时活菌数减少导致其从胞内释放到环境中的Na+减少。K+浓度的降低表明酵母在处于高酸性环境中时确实有大量K+进入细胞,维持胞内酸碱环境的稳定,从而使得酵母细胞可以在高酸性的恶劣环境中存活。7株酿酒酵母中,Y-2和Y-7酿酒酵母菌培养液中Na+浓度均高于其余几株酿酒酵母菌培养液中Na+浓度,而K+浓度均低于其余几株,Y-2和Y-7菌株在高酸性环境中,运输Na+、K+的能力较其余几株菌株强,因此推断,Y-2和Y-7菌株的酸胁迫耐受性相对其他菌株更佳。
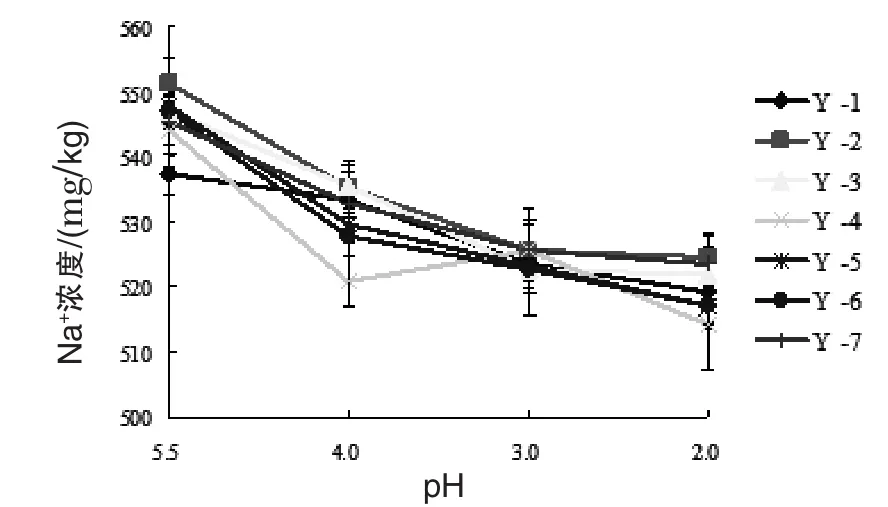
图1 7株酵母在不同p H环境培养24 h后培养液中Na+浓度
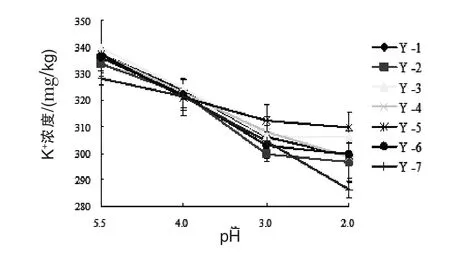
图2 7株酵母在不同pH环境培养24 h后培养液中K+浓度
2.3 菌株低pH处理后H+-ATPase活性 酵母细胞膜的H+-ATPase可通过消耗ATP形式的能量,在酵母细胞膜内外建立起跨膜的质子电化学势梯度,从而为各种离子及小分子物质进行跨膜运输提供足够的动力,保证酵母细胞内环境的稳定。从表2进行分析,结果表明7株酿酒酵母细胞膜的H+-ATPas活性均与其生长环境的pH呈负相关,pH 2.0时酶的活性最高,pH 5.5时则最低。由此可知,不同酿酒酵母菌株胞膜的H+-ATPas表达量存在差异,且7株酿酒酵母中,酵母菌株Y-2和Y-7酶活力高于其他几株。故推断该酵母菌株可在高酸性环境生长,其细胞膜H+-ATPase发挥了重要作用。H+-ATPase反应的最适的pH为6.0左右,因此推断,酵母细胞膜的H+-ATPase活力随环境pH的降低而增高的原因是其在较低pH环境下酶表达量有所增加导致的,即酿酒酵母在处于低pH环境中时会促使其H+-ATPase表达量增加(张国顺等,2004)。
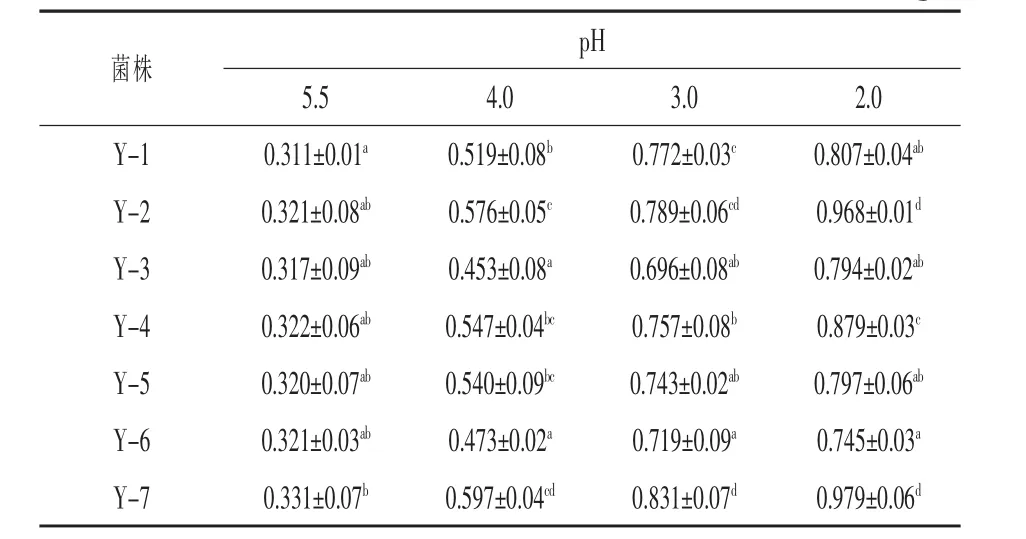
表2 7株酵母在不同pH环境培养24 h后细胞H+-ATPase活性mmol/mg
3 讨论
酵母菌经过长期衍变得到了在复杂条件下较为迅速适应外界环境的应激能力 (Arthur等,1976),处于温和环境中能较为快速的进行繁殖,在恶劣的环境中能够完成基本的生存,低pH对大多数生物有毒害作用。本试验对肉鸭消化道分离出的7株酿酒酵母进行低pH冲击试验,考察了7株肉鸭原酵母菌株的酸胁迫耐受性,并对其耐酸机理进行了初步探讨。7株酿酒酵母均可在较低pH环境中生长,但不同酵母菌株对环境酸胁迫耐受性表现出显著差异,供试7株酿酒酵母菌株中,Y-2和Y-7两株菌株表现出较强的耐酸性。
目前报道较多的是细菌的耐酸机理,如质子泵、大分子的保护和修饰、细胞膜组分的变化、胞内碱性物质的产生、细胞浓度、代谢途径的改变和其他调节因子对耐酸都有作用 (Argyri等,2013;Cotter等,2003)。 本试验针对酵母细胞内Na+、K+浓度变化和膜H+-ATPase活性进行分析。7株酿酒酵母中Y-2和Y-7两株菌株细胞内Na+、K+浓度和膜H+-ATPase活性变化均与其存活率结果一致。
4 结论
肉鸭消化道酵母菌株的酸胁迫耐受性存在差异,不同菌株的耐酸性与酵母细胞内Na+、K+浓度变化及细胞膜H+-ATPase活性有密切关系。本研究中Y-2和Y-7酵母菌株的酸胁迫耐受性最佳。
[1]成妮妮,吕嘉枥.益生菌的生理功能及提高其存活力的方法[J].食品工业科技,2004,25(2):146 ~ 147.
[2]辛亚平,昝林森,杜双田,等.几株纤维素分解菌对统糠的混合发酵研究[J].畜牧兽医杂志,2010,29(5):25 ~ 28.
[3]张国顺,洪青,刘智,等.一株特耐酸酵母R1的分离及其耐酸机理研究[J].微生物学报,2004,44(5):631 ~ 635.
[4]张秋华,张敏.酵母菌发酵杂粕生产生物菌体蛋白饲料初探[J].中国饲料,2010,2:32 ~ 34.
[5]张霞,王学东,李彪,等.肉鸭消化道酵母益生菌的分离与鉴定[J].饲料工业,2015,22:59 ~ 64.
[6]Argyri A A,Zoumpopoulou G,Karatzas K A G,et al.Selection of potential probiotic lactic acid bacteria from fermented olives by invitro,tests[J].Food Microbiology,2013,33(2):282 ~ 291.
[7]Arthur H,Watson K.Thermal adaptation in yeast:growth temperatures,membrane lipid,and cytochrome composition of psychrophilic,mesophilic,and thermophilic yeasts[J].Journal of Bacteriology,1976,128(1):56 ~ 68.
[8]Cotter PD,Hill C.Surviving the acid test:responsesof gram-positive bacteria to low pH[J].Microbiology and Molecular Biology Reviews,2003,67(3):429 ~ 453.
[9] Foster J W,Hall H K.Adaptive acidification tolerance response of Salmonella typhimurium.[J].Critical Reviews in Microbiology,1995,21 (4):771~778.
[10]Garcíahernández Y,Rodríguez Z,Brandao L R,et al.Identification and in vitro screening of avian yeasts for use as probiotic.[J].Research in Veterinary Science,2012,93(2):798 ~ 802.
[11]Mason A B,Kardos T B,Monk B C.Regulation and pH-dependent expression of a bilaterally truncated yeast plasma membrane H+-ATPase[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,1998,1372(2):261 ~271.
[12]Patrizia Albertano,Gabriele Pinto,Salvatore Santisi,et al.Spermatozopsis acidophila Kalina (Chlorophyta,Volvocales),a little known alga from highly acidic environments[J].Giornale Botanico Italiano,1981,115(2 ~ 3):65 ~ 76.
[13]Sekler I,Pick U.Purification and Properties of a Plasma Membrane H+-ATPase from the Extremely Acidophilic Alga Dunaliella acidophila.[J].Plant Physiology,1993,101(101):1055 ~ 1061.
[14]Serrano R,Kiellandbrandt M C,Fink G R.Yeast plasma membrane ATPase is essential for growth and has homology with (Na++K+),K+-and Ca2+-ATPases[J].Nature,1986,319(6055):689 ~ 693.■
S816.7
A
1004-3314(2017)24-0035-04
10.15906/j.cnki.cn11-2975/s.20172408
武汉市应用基础研究计划(2014020101010073);武汉轻工大学大学生科研项目(xsky2016001)
*通讯作者
