菌草种质资源AFLP多样性分析
2018-01-04梅嘉洺葛红柳刘翠翠朱专为ALAMIntikhab阳宴清卢运海
梅嘉洺++葛红柳++刘翠翠+朱专为++ALAM+Intikhab++阳宴清++卢运海
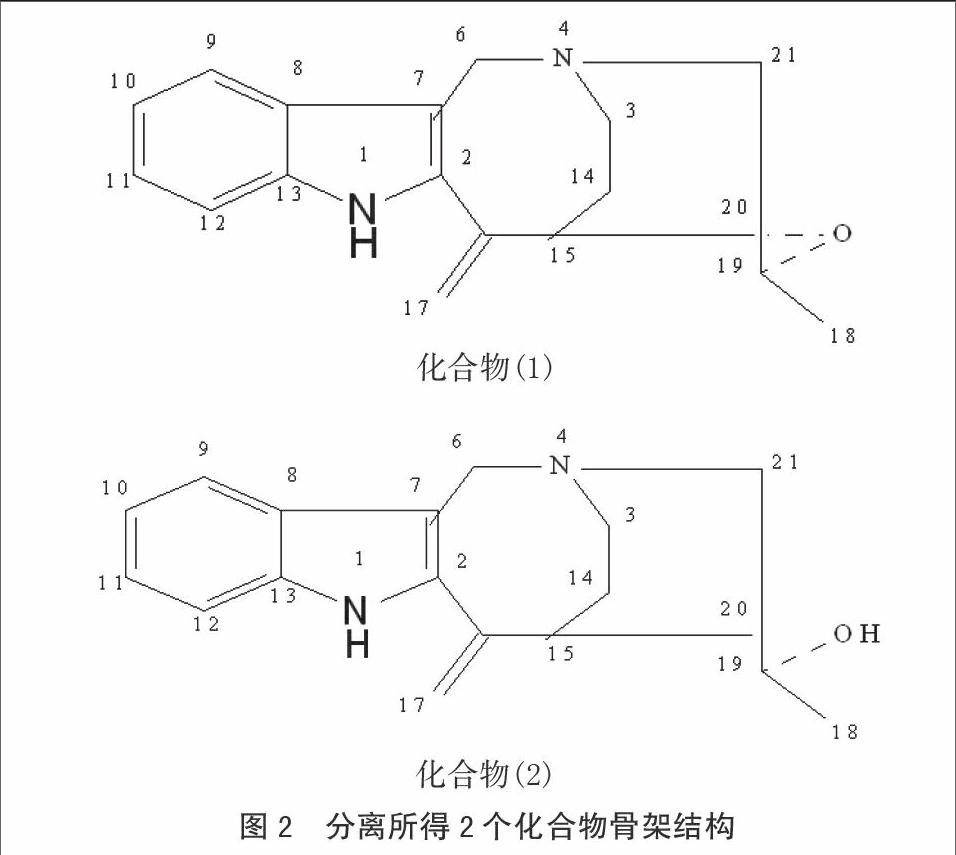

摘 要 利用AFLP技术对48份菌草种质资源进行了遗传多样性分析。首先,在海南象草等4份菌草材料上检测了20个AFLP引物组合的扩增情况。然后,从中筛选出6个扩增效果较好的组合用来进一步分析48份菌草种质材料的DNA,共产生了208个多态性条带。用NTSYS-pc 2.1软件结合UPGMA聚类分析方法对数据进行分析,结果显示,48份种质材料间遗传相似系数(SM)在0.48~0.98,在遗传相似系数为0.57时可将48份材料分成4个类群。以上研究结果表明,AFLP分子标记技术的分析结果能直观地表现菌草种质材料之间的亲缘关系,为菌草种质资源的收集和评价提供了一项新的技术手段。
关键词 菌草 ;AFLP ;分子标记 ;种质资源 ;遗传多样性
中图分类号 S326 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.11.007
Diversity Analysis of JUNCAO Germplasms by AFLP Markers
MEI Jiaming1,2) GE Hongliu1) LIU Cuicui1)
ZHU Zhuanwei1) ALAM Intikhab1) YANG Yanqing1) LU Yunhai1)
(1 Key Laboratory of Ministry of Education for Genetics, Breeding and Multiple Utilization of Crops,
College of Crop Science, Fujian Agriculture and Forestry University, Jinshan, Fuzhou 350002;
2 China National Engineering Research Center of JUNCAO Technology, Fuzhou 350002, China)
Abstract In this study, AFLP technique was used to study the genetic diversity of 48 JUCAO germplasms. A total of 20 combinations of AFLP primer pairs were firstly tested on a subset of four samples. Then six combinations of AFLP primer pairs were selected and analyzed the DNA of 48 JUNCAO germplasms and a total of 208 polymorphic DNA fragments were obtained. The genetic similarity coefficient (SM) was estimated among all accessions by NTSYS-pc 2.1 software and ranged from 0.48 to 0.98. The 48 JUNCAO materials were separated into four clusters when the SM was 0.57. The results showed that the AFLP technique could more directly reveal the genetic difference among different accessions, and be served as a new technique for the collection and evaluation of JUNCAO germplasms.
Keywords JUNCAO ; AFLP ; molecular marker ; germplasm ; genetic diversity
菌草(JUNCAO)的概念最早是由福建農林大学林占熺研究员[1]于1986年提出,是指可用来做食用菌、药用菌培养基的草本植物。菌草技术(JUNCAO Technology)是指“以草代木”用菌草栽培食(药)用菌以及菌料加工等综合性新技术[1-2]。利用菌草技术及相关技术形成的产业被称作菌草产业(JUNCAO Industry)[1-2]。可以用作菌草的植物种类很多,既包括芒萁、五节芒、类芦、芦竹、芦苇等野生的草本植物,也包括巨菌草、象草、紫象草、香根草、紫花苜蓿、串叶草、绿洲系列芦竹等人工栽培的草本植物,广义的菌草还包括玉米、高粱、甘蔗等作物[1]。某些菌草品种还可用于生产生物燃料、造纸、生态治理等[3-5]。目前菌草技术已在我国多个省份得到推广,并被传播到世界上100多个国家[5]。随着菌草技术的不断改进和菌草产业的不断壮大,有关菌草种质资源的收集、保存、鉴别和利用等工作变得越来越迫切和重要。然而由于菌草的种类繁多、来源广泛,所以使得菌草在种质资源的收集、保存和评价等方面有一定的盲目性。因此,运用分子标记技术来研究菌草种质资源的遗传多样性显得尤为重要。
目前有关菌草种质资源遗传多样性的研究报道很少。梅嘉洺等[6]首次在菌草上利用PCR-RFLP技术对46份种质资源的PEPC基因进行了多样性分析,之后有李婵等[7]、赵永红等[8]和黄晓霞等[9]分别在菌草上用iPBS、SCoT和SRAP标记技术做了遗传多样性分析。研究结果表明,4种技术虽然操作简单,并且都能将所分析的菌草种质材料区别开,但每个单个反应所产生的分子标记数量较少,并且iPBS、SCoT和SRAP技术所用的引物特异性差,因而会降低其结果的可重复性。AFLP(amplified fragment length polymorphism,扩增片段长度多态性)是由荷兰科学家Vos等在1995年发明的分子标记技术[10],它是基于PCR(聚合酶链式反应)的一种选择性扩增限制性DNA片段的方法,可在一次单个反应中检测到大量的片段,是一种高效能的DNA指纹技术,它同时具有RFLP技术的高重复性和PCR技术的简便快捷等优点,因而被广泛应用于多种植物的亲缘关系鉴定、遗传资源多样性分析以及遗传图谱构建等方面的研究[10-31]。本研究利用AFLP分子标记技术对48份菌草种质资源遗传多样性进行了分析,为菌草的种质资源研究提供了一种新的技术手段,获得的结果可为菌草种质资源的收集、评价和利用提供科学的理论指导和依据。endprint
1 材料与方法
1.1 材料
本研究所使用的菌草材料(表1)主要来自于福建农林大学国家菌草工程技术研究中心的种质资源圃,其中的西充1号芦竹采集于四川西充。取样时,采集各品种幼嫩叶片约5 g,装入编号的塑料袋中,放入-80℃冰箱保存备用。本研究所用到的引物(表2)由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 DNA的提取和检测
基因组DNA的提取采用了改良后的CTAB法[33]。首先将提取到的每个材料的总DNA在1.2%的琼脂糖凝胶上进行电泳检测其长度及质量,然后在Nanodrop 2000(Thermo Fisher)分光光度计上测定所提取DNA样品的浓度,最后根据测定浓度将每个样本的DNA浓度稀释至200 ng/μL作为备用母液,所有材料的DNA样本均保存于-20℃冰箱中备用。
1.2.2 AFLP分析
(1)限制性酶切与链接 基因组DNA采用Eco RI 和Mse I酶切,酶切体系总体积为20 μL,其中包括模板DNA 6 μL、10×Buffer 2 μL、Eco RI 和Mse I 各2 μL、ddH2O 8 μL,混匀后37℃水浴3 h。再加入Eco RI 接头(AdaptEco,5 μM)1 μL、Mse I接头(AdaptMse,45 μM)1 μL、10×T4 DNA ligase Buffer 3 μL、T4 DNA ligase(TakaRa,350 U/μL)1 μL、ddH2O 4 μL,混匀后放置在PCR反应仪上16℃连接过夜。
(2)预扩增 反应体系总体积为20 μL,其中包括模板DNA(上述链接产物)2 μL、2×Taq PCR Startmix(Genstar)10 μL、预扩增F引物(PreampEc_F,10 μM)1 μL、预扩增R引物(PreampMs_R,10 μM)1 μL、ddH2O 6 μL,混匀后放置在PCR反应仪上进行扩增反应。反应条件为94℃ 4 min;94℃ 30 s,50℃ 30 s,72℃ 1 min,30个循环;72℃ 7 min;4℃保存。
(3)选择性扩增 PCR反应的总体积为20 μL。其中包含了DNA模板(上述预扩增产物稀释液)5 μL、AFLP选择性引物E(10 μM)1 μL、AFLP选择性引物M(10 μM)1 μL、2×Taq PCR Startmix(Genstar)10 μL,ddH2O 3 μL。混匀后放置在PCR反应仪上进行扩增反应,反应条件为94℃ 3 min;94℃ 30 s,65℃(每轮循环递减0.7℃)30 s,72℃ 1 min,12个循环;94℃ 30 s,55℃ 30 s,72℃ 1 min,25个循环;72℃ 10 min; 4℃保存。
(4)聚丙烯酰胺凝胶电泳和成像分析 将选择性扩增产物与等体积的变性剂loading buffer混和,在PCR反应仪上94℃变性5 min后立即放入冰浴中冷却至加样电泳。取4 μL加样于已经预电泳15 min的6%的变性聚丙烯酰胺胶,在1 500 V的电压下垂直电泳90 min,然后用快速银染法检测选择性扩增产物[34],对染色结果进行拍照、分析和保存。
1.3 统计分析
在电泳图谱上选择清晰、稳定、多态的扩增条带,根据其在不同样本上分离情况进行统计:有条带的记为1,无条带的记为0,构建(0,1)矩阵。然后利用NTSYS-pc 2.1软件中的子程序SIMQUAL对矩阵进行样本间的相似性系数(SM)计算,再用子程序SAHN中的非加权类平均法(UPGMA)进行聚类分析,最后用Tree plot绘制出树状聚类图。
2 结果与分析
2.1 AFLP反应过程的检测
为确保AFLP反应获得可靠的结果,对48份菌草种质材料DNA的预扩增产物进行了1.2%琼脂糖电泳检测(图1)。结果显示,每个样本DNA的预扩增产物都给出了所期望的拖带;除了1号样本外,其余47份材料DNA的预扩增产物在电泳图上显示相对均匀。据此,将1号样本DNA的预扩增产物稀释50倍,而其余47份样本DNA的预扩增产物稀释100倍,作为DNA模板用于下一步的选择性扩增反应。
2.2 遗传多样性分析
首先在4个代表性菌草种质材料(海南象草,绿洲2号,甘蔗MOL-6081,聚穗高粱)上试用了20对引物组合,結果表明,所试用每个引物组合都能在4个菌草材料上扩增出50~100条强度不同、清晰、相对均匀、多态的DNA片段来,引物组合之间没有观察到明显的区别,因此无需进行引物组合筛选。然后,随机选用了6对引物组合对表1中的48份菌草种质材料进行了AFLP分析,图2显示引物组合E-AC/M-CA在48份菌草种质材料上的PCR选择性扩增结果图。在48个样本上,分析单个AFLP引物组合扩增结果可以获得20~62个多态性DNA片段(表3),分析6个AFLP引物组合共获得了208个多态性片段,平均每个引物组合获得34.7个多态性片段。聚丙烯酰胺胶电泳胶的染色质量的好坏直接影响到可读多态性DNA片段的数目。
2.3 菌草种质的聚类分析
对48份菌草种质资源上获得的208条AFLP多态片段进行UPGMA聚类分析,所得到的结果如图4所示。聚类结果表明,所研究的48份材料之间的遗传相似性系数(SM)分布在0.48~0.98,在遗传相似性系数为0.57时可将48份菌草种质材料分成1、2、3、4四大类群(图3)。
第1大类群中包括了25份种质材料,是最大的一个类群,该类群的所有成员都属于狼尾草属(Pennisetum),又可分为两个亚类群:第一个亚类包括巨菌草1号、巨菌草、王草、杂交象草、海南象草、象草N85、象草、桂牧1号、细茎象草、漳州象草、热研4号粗茎象草、桂闵引象草、南牧2号、莱牧1号、桂草1号、矮象草、红象草、莱牧、杂交狼尾草、巴西蔗、象草N51、台湾甜草、高丹草变种等23份材料,它们之间的相似系数都在0.95以上;第二亚类仅包括狼尾草和美洲狼尾草两份材料,二者之间的相似系数为0.965。而两个亚组之间的相似系数仅为0.58,表明狼尾草和美洲狼尾草两个材料和类群内的其它23份材料之间的亲缘关系较远。endprint
第2大类群中包括了11份种质,其中彼特草、闵牧42、甘蔗MOL-6081和甘蔗LA-Purple等4个甘蔗属(Saccharum)材料形成一个小组,它们之间的相似系数在0.772~0.946;两个高粱属(Sorghum)材料(聚穗高粱和散穗高粱)形成一个小组,两者之间的相似系数为0.958;类群内的其余5份材料,如81.95象草(Pennisetum)、五节芒(Miscanthus)、莆田芦苇(Phragmitas)、薏苡(Coix)、斑毛(Saccharum)等,相互之间亲缘关系相距则较远,相似系数在0.571~0.639。
第3大类群仅包括了类芦(Neyraudia)和海南水竹(Phyllostachys)2份种质材料,两份材料之间的亲缘关系较远,相似系数仅为0.61。
第4大类群中包括了芦竹属(Arundo)的10份种质材料,其中绿洲7号和其余材料的遗传距离最远(SM= 0.792)。绿洲1、2、4、5、7、8号及花叶芦竹聚合成1个亚组,而绿洲3号、4号和西充1号芦竹聚合成另一个亚组,两个亚组之间的相似系数为0.888.
3 讨论与结论
AFLP分子标记同时汇集了RFLP和PCR技术的优点,只需要少量的起始DNA样本(100~200 ng)就可以产生大量的分子标记信息,而且引物设计不需要事先知道基因组的DNA序列,产生的结果重复性好、灵敏度高,不需要特别昂贵的仪器和耗材,操作步骤也相对简单,因而很适合在那些基因组研究进展比较滞后的植物上使用[10-32]。菌草的种类多、来源广,其中的狼尾草属和芦竹属植物,虽然有许多被开发利用的潜力[1-5],但目前还很少有人去系统的研究它们。本研究利用6对AFLP引物组合分析了48份菌草种质材料,共获得了208个多态片段,将48份材料全部区别开来,展示了AFLP技术在这些植物上的应用潜力。本研究的聚类分析结果验证了先前利用PCR-RFLP[6]、iPBS[7]、SCoT[8]和SRAP[9]技术所获得的遗传多样性分析结果;同时,与先前的研究结果[6-9]相比较,本研究使用的AFLP技術更能揭示属间的遗传变异(图3);但是,狼尾草属(Pennisetum)内,狼尾草和美洲狼尾草两份材料和属内的其它材料之间的差异较先前的结果[6-9]更加明显。此外,本研究较先前的研究增加了1份新的材料(西充1号芦竹),采集于四川西充市郊,聚类分析显示它和绿洲3号、6号聚合在同一个亚组,但它们间的相似系数仅为0.93,证明目前收集到的芦竹属材料还不能全面的代表我国芦竹的遗传资源,因此,芦竹的资源收集工作还具有很大潜力。
相比传统的利用含有3个特异碱基的选择性引物进行选择性扩增的AFLP技术[10-32],本研究选用了只含有2个特异碱基的选择性引物进行选择性扩增(表2),这样可以增加扩增出的AFLP片段数目,在品种检测或区分时更具有指纹效应,因而效率更高。但是,由此所产生的大量的DNA扩增片段需要和具有更高分辨率的电泳技术及更灵敏的染色技术相配合。未来可以将该技术结合荧光染色技术及自动或半自动DNA分析仪(如双色红外荧光检测设备LiCOR 4300),从而弥补传统银染技术的结果不稳定、分辨率不高、使用有毒试剂等缺点,获得更加高效、可靠和稳定的结果。
总之,本研究利用6对AFLP引物组合分析了48份菌草种质材料,展示了AFLP标记技术在菌草种质材料的区分和鉴定方面的应用潜力,为菌草种质资源的管理和评价提供了一个新的技术选项。
参考文献
[1] 林占熺. 菌草学(第三版)[M].北京:国家行政学院出版社,2013.
[2] 林兴生,林占熺,林冬梅,等. 低温胁迫5种菌草的抗寒性评价[J]. 草业学报,2013,22(2):227-234.
[3] 阳宴清,王 咏,朱美兰,等. 芦竹愈伤组织诱导及再生体系的建立[J].草业科学,2016,33(7):1332-1341.
[4] WANG Yong, ZHU Meilan, YANG Yanqing, et al. Exogenous Application of Abscisic Acid (ABA) Enhances Chilling Tolerance in Seedlings of Napier Grass (Pennisetum purpureum Schum.)[J]. Agricultural Science & Technology, 2017, 18(3): 417-423.
[5] 赵 凡. 发展菌草业 造福全人类——记菌草技术发明人林占熺[J]. 科技成果管理与研究,2015,12:49-50.
[6] 梅嘉洺,黄小霞,王 咏,等. 46份菌草种质资源 PEPC基因的 PCR-FLP多样性分析[J].热带农业科学,2015,35(11):45-50,60.
[7] Li C, Zhao Y H, Mei J M, et al. Genetic Diversity of JUNCAO Germplasms Detected by iPBS Markers[J]. Agricultural Science & Technology, 2016, 17(9): 2 000-2 004,2 058.
[8] 赵永红,李 婵,梅嘉洺,等. 菌草种质资源SCoT遗传多样性分析[J].热带农业工程,2016,40(2):29-34.
[9] Huang Xiaoxia, Liu Cuicui, Ge Hongliu, et al. Analysis of Genetic Diversity of JUNCAO Germplasms by SRAP Markers[J]. Agricultural Science & Technology, 2017, 18(9): 1 595-1 600.endprint
[10] Vos P, Hogers R, Bleeker M, et a1. AFLP: a new technique for DNA fingerprinting[J]. Nucleic Acids Research, 1995, 23(21): 4 407-4 414.
[11] 罗海燕,应东山,黄建峰等. 78份杧果种质资源AFLP分析[J].热带作物学报,2015,36(12):2130-2137.
[12] 纵 丹,员 涛,周安佩等.滇杨优树遗传多样性的AFLP分析[J]. 西北林学院学报,2014,29(4):104-108.
[13] 劳方业,刘 睿,何慧怡,等. 崖城系列甘蔗亲本遗传多样性的AFLP标记分析[J]. 分子植物育种,2008,6(3):517-522
[14] 杜 艳,王 娟,陈 冲,等. 耧斗菜野生资源的AFLP遗传多样性分析[J]. 北方园艺,2017,5:85-88.
[15] 孙凤梅,沈晓霞,沈宇峰,等. 薏苡AFLP体系的建立与优化[J]. 浙江农业学报,2014,26(1):14-19.
[16] 昝逢刚,应雄美,吴才文,等. 98份甘蔗种质资源遗传多样性的AFLP分析[J]. 中国农业科学,2015,48(5):1 002-1 010.
[17] 李 伟,林富荣,郑勇奇,等. 10个南方皂荚群体遗传多样性的AFLP分析[J].林业科学研究,2017,30(1):46-52.
[18] 田松杰,石云素,宋燕春,等. 利用AFLP技术研究玉米及其野生近缘种的遗传关系[J]. 作物学报,2004,30(4):354-359.
[19] 李鸿雁,李志勇,辛 霞,等. 49份野生扁蓿豆種质资源的AFLP遗传多样性分析[J]. 中国草地学报,2016,38(4):20-26.
[20] 杨春生,卢永彬,林燕芳,等. 广西毛竹种质资源AFLP分析[J]. 广西植物,2014,34(6):742-746,787.
[21] 何桂芳,刘玉皎,袁 宏. 青海蚕豆种质资源的AFLP多样性分析[J]. 安徽农业科学,2011,39(7):3 824-3 826.
[22] 王春梅,任 健,兰平秀,等. 山蚂蝗属植物遗传多样性的AFLP分析[J]. 热带作物学报,2017,3:521-528.
[23] Costa R, Pereira G, Garrido I, et al. Comparison of RAPD, ISSR, and AFLP Molecular Markers to Reveal and Classify Orchardgrass (Dactylis glomerata L.) Germplasm Variations[J]. PLoS One, 2016, 11(4): e0152972.
[24] El-Esawi M A, Germaine K, Bourke P, et al. AFLP analysis of genetic diversity and phylogenetic relationships of Brassica oleracea in Ireland[J]. C R Biol, 2016, 339(5-6): 163-170.
[25] Ma H Y, Li S J, Feng N N, et al. First genetic linkage map for the mud crab (Scylla paramamosain) constructed using microsatellite and AFLP markers[J]. Genet Mol Res. 2016, 15(2): gmr.15026929.
[26] Arias M, Hernandez M, Remondegui N, et al. First genetic linkage map of Taraxacum koksaghyz Rodin based on AFLP, SSR, COS and EST-SSR markers[J]. Sci Rep, 2016, 6: 31 031.
[27] Aichi-Yousfi H, Bahri B A, Medini M, et al. Genetic diversity and population structure of six species of Capparis in Tunisia using AFLP markers[J]. C R Biol, 2016, 339(11-12): 442-453.
[28] Blanco E Z, Bajay M M, Siqueira M V, et al. Genetic diversity and structure of Brazilian ginger germplasm (Zingiber officinale) revealed by AFLP
(下转第47页)endprint
