基于数学模拟研究曼氏无针乌贼(Sepiella japonica)在不同温度下进食后胃内容物特性变化及胃排空规律*
2018-01-04平洪领余方平史会来
平洪领 余方平 张 涛 史会来
(浙江省海洋水产研究所 浙江省海水增养殖重点实验室 舟山 316021)
胃排空率(GER, gastric evacuation rat)是研究鱼类的生理生态、能量学的一项必需而且重要的参数,它指的是鱼类摄食后, 食物从胃排到肠道的速率(Principeet al, 2007; 曾令清等, 2011)。该参数难以在野外研究中直接获得, 但如果将在实验室内测得的排空率与野外连续取样所获的胃含物结合起来, 就可以较为容易得到鱼类胃排空率, 目前这种估算自然环境中水生生物的日摄食率的方法已被广泛应用(Jobling, 1981; 张波等, 2001a, b)。20世纪60年代以来, 国外在鱼类胃排空率方面做了大量研究工作(Elliott, 1972; Persson, 1979; Hopkinset al, 1990;Kristiansen, 1998; Hurst, 2004), 但我国直到20世纪末才开始出现相关研究, 起步时间相对较晚(张波等,2000; 孙耀等, 2005; 曾令清等, 2011, 2012; 朱伟星等, 2015), 目前国内外关于头足类胃排空率的研究鲜有报道, 仅见于欧洲横纹乌贼(Sepia officinalis)(Quintelaet al, 2002a, b), 但是国内尚未见在头足类中开展相关研究报道。
近年来国内外相关研究表明, 鱼类的胃排空率除了受实验方法以及鱼体自身生理状况影响外, 还包括诸多其他外界因素, 如食物种类(Persson, 1979;Hopkinset al, 1990; Pääkkönenet al, 1997, 1999)、温度(Persson, 1979, 1981; 张波等, 2001; Quintelaet al,2002a; 孙耀等, 2005; 刘立明等, 2013)、摄食频率(覃志彪等, 2011; 孙晓锋等, 2011; 赵海祥, 2012)以及饥饿时间(曾令清等, 2012)等因素的影响, 其中温度和食物最受关注(张波等, 2001a, b)。但目前尚不清楚外界因素如何引发鱼类机体生理功能的改变, 并最终控制胃排空率的内在机制。现有研究工作也很少涉及到消化道内环境的变化, 如水分含量、pH值及消化酶活性的改变; 当然, 综合考虑到外界因素(如温度)变化导致内环境的改变, 进而影响到胃排空速率的研究就更为少见。
曼氏无针乌贼(Sepiella japonica)是我国重要的海洋渔业经济种类, 广泛分布于福建、浙江沿海海域,作为浅海洄游性头足类, 历史上曾经列为东海的“四大海产”之一, 仅在浙江省的年产量最高曾超过 6万吨(董正之, 1988)。其摄食食物种类多样化, 对食物没有明显的选择性, 食性组成主要取决于海域饵料生物品种及其易得性, 主要是甲壳动物、小型鱼类及少量软体动物(郭新等, 1986)。目前尽管在消化系统组织细胞学和酶化学(陆伟进, 2012)、人工配合饲料开发(叶坤, 2012; 罗云云, 2013)等方面已有研究报道。但是有关曼氏无针乌贼胃排空动力学及消化生理学研究尚未受到关注。本文采用胃内容物法探究不同温度下曼氏无针乌贼的胃排空过程, 分别用线性、指数和平方根模型对实验数据进行拟合, 以确定其最优胃排空数学模型, 同时检测摄食后不同时间点胃内容物pH、水分含量及消化酶的变化, 得出胃排空与消化道内环境之间存在的内在规律, 以及与外界水温波动之间的关系, 为进一步研究曼氏无针乌贼的摄食规律、消化生理学及人工饲料开发与利用提供理论参考。同时, 探究不同温度下曼氏无针乌贼的胃排空时间可以更高效地指导生产管理的投饵工作, 提高饵料转化率和推进生态健康养殖等方面的研究。在渔业资源修复实践方面, 可根据实验条件下摄食量为评估自然环境下曼氏无针乌贼的摄食量提供理论参考。还可为评估舟山海域曼氏无针乌贼环境容纳量和饵料资源利用情况、预测自然海域乌贼增殖放流量提供基础数据。
1 材料与方法
1.1 实验材料
本实验于2015年12月在浙江省海洋水产研究所海水增养殖重点实验室完成, 实验所用曼氏无针乌贼为2015年8月人工繁育的F2代同生群体, 由于采用的样本为经过驯化养殖的 F2代群体, 所以能够很好地适应实验条件下的饲喂过程。随机选取600尾胴长(8.23±0.63)cm、体质量(76.04±6.45)g的成体乌贼,暂养于60个200L微流水养殖桶中, 每个养殖桶放养10尾乌贼。实验分别在 15ºC、20ºC 及 25ºC 三个水温条件下进行, 15ºC为自然海水温度, 20ºC和25ºC温度组各用一个 1000W 功率的可控温加热棒将温度升至设定标准(升温速度 1ºC/d), 将温差控制在±0.5ºC 范围内, 在设定水温条件下暂养7d。
1.2 实验方法
首先开展预实验, 以确定曼氏无针乌贼达到饱食状态所需要的进食时间、胃内容全部排出的时间及适宜的水温条件。经观察发现向暂养10尾乌贼的养殖桶内连续投喂冰鲜葛氏长臂虾(Palaemon gravieri)10min, 出现剩余饵料, 20min后仍然有部分残饵, 故设置30min为饱食进食时间。对饱食后的10尾乌贼停食24h后, 解剖观察到所有乌贼胃内均无残余饵料, 因此认定曼氏无针乌贼的胃排空时间应该在 24h之内。设置 15ºC、20ºC、25ºC 和 30ºC 四个养殖水温进行投喂后解剖观察, 发现除 30ºC时的空胃率较高外, 其他三个温度条件下均能正常进食, 故本文排除30ºC条件下的胃排空率研究。
在实验开始前 24小时, 停止投喂并保证乌贼的胃内容物已彻底排空。实验开始时, 用冰鲜的饵料葛氏长臂虾一次性饱食投喂, 待30分钟后再清除残饵。为了降低在取样过程中对剩余时间点乌贼的应激反应, 实验设计每个养殖桶的 10只乌贼作为一个取样时间点的样品。
1.3 取样及测定方法
在每个取样时间点, 将 10只乌贼同时从养殖桶中取出后, 迅速处死并置于冰盘上, 用剪刀沿腹部中线剪开, 将其内脏团暴露出, 再用止血钳将胃贲门部和幽门部分别夹紧, 从前后端用剪刀剪断, 置于培养皿, 再将胃壁剪开, 使其内容物全部流出, 称量胃内容物湿重。胃内容物用于检测内容物pH值、消化酶活性、水分含量以及干重。
乌贼胃内容物的 pH测定参照麦康森(2011)和Morales等(2013)的方法。胃内容物的水分含量测定参照国家行业标准《饲料中水分和其他挥发性物质含量的测定》(标准编号 GB/T6435-2006)。胃蛋白酶、胰蛋白酶及淀粉酶活力的测定使用试剂盒(南京建成生物工程), 将酶活力定义为: 在本反应体系中每毫克蛋白质与底物反应 1min (温度 37ºC), 消耗 1μg底物即为1个酶活力单位(以U/g prot表示)。所有样品中的酶蛋白含量的测定采用全自动生化分析仪。
用电子天平称量胃内容物的湿重后, 将其置于60℃恒温烘箱中, 持续烘干至恒重。可由下列公式计算胃内容物的残余百分比:

公式中,P表示摄食后第t小时胃内容物重量占其总摄食量的比例(%),Wt表示实验乌贼胃内容物在t小时的重量,W0表示乌贼在饱食状态下的总摄食量。
作者采用下列线性模型、指数模型和平方根模型,拟合乌贼的胃内容物重量变化规律。

式中,St为瞬时胃内残余饵料湿质量=胃内残余饵料湿重(g)/乌贼体重(g)×100,S0为乌贼开始时摄入的饵料重量,A为常数值,t为乌贼摄食后的时间(h)。作者采用回归曲线相关系数的二次方值(R2), 检验上述三种胃排空率的函数模型对不同温度下实测值的拟合程度, 并对各拟合模型的判定系数(R2)、残差标准差(SDR)、残差平方和(RSS)进行比较, 以选择最佳的胃排空率模型。
1.4 数据处理分析
所有实验数据均采用Excel 2010进行常规计算。采用SPSS 17.0软件对实验数据进行单因素方差分析(One-Way ANOVA), 如果温度条件相同而在不同时间点的胃排空率差异显著, 要进行Duncan多重比较。三种数学模型的参数(S0,A)均采用Origin 2016统计软件进行曲线拟合而得到。统计数值全部用平均值±标准差(M±SD)表示,P<0.05表示差异显著。
2 结果
2.1 不同温度下曼氏无针乌贼胃内容物变化特征
由表 1可知, 用于 3个温度实验组的曼氏无针乌贼体重无显著差异(P>0.05), 但初始摄食量存在显著差异(P<0.05)。15ºC、20ºC 和 25ºC 实验组摄食后 0h胃内容物湿重分别为 2.71g、2.92g和 3.23g,25ºC时的摄食量比15ºC增加了19.2%, 初始摄食量呈现随温度的升高而增加的趋势。随摄食后时间的增加, 曼氏无针乌贼胃内容物重量(湿重和干重)呈显著减少的阶段性变化特征, 在摄食后 0—4h之间,胃内容物重量显著降低(P<0.05), 摄食后第 4小时15ºC、20ºC 和 25ºC 胃内容物干重百分比分别为50.8%、41.9%和 45.5%, 消化处理的食物量基本超过 50%, 说明曼氏无针乌贼摄食后食物在胃部立即进行消化处理, 并很快通过胃部进入肠道。通过表1可以看到, 在摄食后6—8h和10—12h时间段胃内容物重量变化不显著(P<0.05), 说明在摄食 6h后胃排空率降低。综上所述, 曼氏无针乌贼胃排空率的变化过程由快变慢。
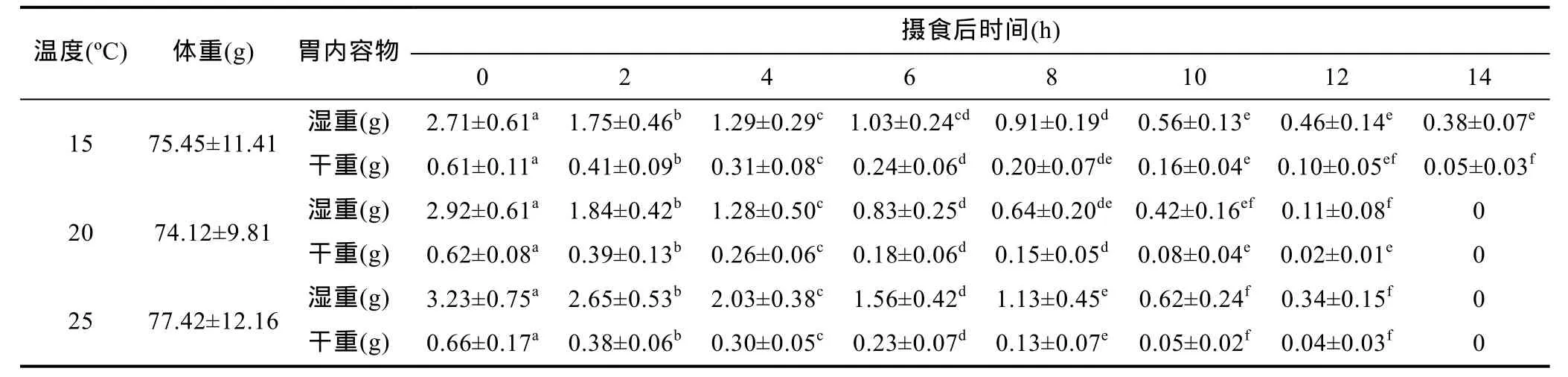
表1 曼氏无针乌贼摄食14h内胃内容物重量的变化Tab.1 The change of three temperature fitted to gastric evacuation data in S. japonica
2.2 曼氏无针乌贼胃排空率模型选择和胃排空的时间
采用线性、指数和平方根三种模型估算3个温度条件下曼氏无针乌贼的胃排空率(如图 1所示), 通过分析各模型的相关系数R2和显著性检验P值, 可以确定3种数学模型均能很好地拟合3个温度条件下胃内容物的实验数据。同时, 为了确定3个温度条件下曼氏无针乌贼胃排空率的最佳模型, 以相关系数R2值、残差平方和(RSS)以及残差标准差(SDR)为标准,对3种数学模型进行进一步比较, 结果见表2。首先,以相关系数R2值为标准, 可以得知在3个温度条件下用平方根模型分别拟合胃内容物湿重和干重数据的结果均优于线性和指数数学模型; 而且平方根模型拟合胃内容物干重数据的R2值均大于湿重数据结果,但指数模型拟合的结果却完全相反, 拟合湿重的相关系数R2均大于干重数据结果。说明平方根模型适于拟合胃内容物干重数据, 而指数模型拟合胃内容物的湿重数据效果较好。其次, 以RSS和SDR为标准, 两者具有相同的评价意义, 在3个温度条件下以湿重和干重表示胃内容物的最优数学模型均依次为平方根模型、指数模型和线性模型。因此, 通过综合比较R2、RSS值和SDR值, 可以得出在本实验条件下, 描述曼氏无针乌贼胃排空规律的最优数学模型是平方根模型; 同时也说明温度并没有影响对最优模型的选择。
2.3 胃内容物水分、pH及消化酶变化
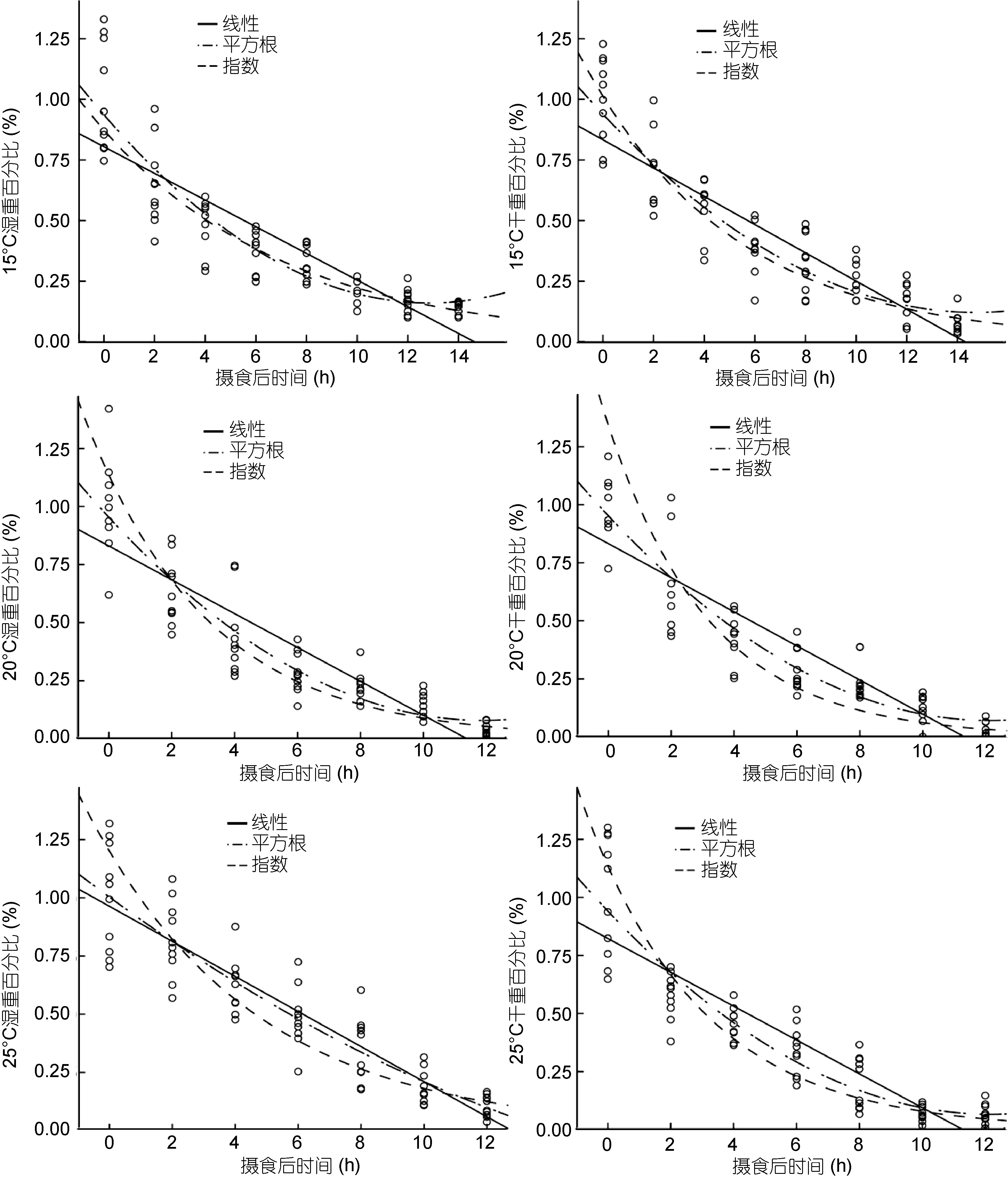
图1 采用线性、指数和平方根模型对曼氏无针乌贼胃内容物的湿重和干重百分比的拟合结果Fig.1 Fitting results of percent to wet and dry weight of digesta in S. japonica using different mathematical models
3个温度条件下, 曼氏无针乌贼摄食后胃内容物水分含量变化如图2所示。在15ºC和20ºC温度组的胃内容物水分含量变化趋势一致, 均表现为摄食后0—10h水分含量缓慢降低, 随后呈显著升高趋势(P<0.05)。而25ºC温度组在摄食后0—4h水分含量基本不变, 在 4—12h则呈现逐步升高趋势。曼氏无针乌贼胃内容物pH值变化如图3所示, 在3个温度条件下呈现相同的变化规律, 均为先缓慢下降后缓慢升高。在摄食后第8h时pH值降到最低值6.4左右, 在胃内容物完全排空14和12h时均分别恢复到第0h时水平。

表2 曼氏无针乌贼胃内容物干重与湿重的变化规律三种拟合模型比较结果Tab.2 The results of comparison on different mathematical models fitted to digesta in S. japonica

图2 曼氏无针乌贼摄食后胃内容物水分变化Fig.2 The change of digesta moisture in gastric of S. japonica after feeding

图3 曼氏无针乌贼摄食后胃内容物pH变化Fig.3 The change of pH in gastric contents of S. japonica after feeding
曼氏无针乌贼胃内容物消化酶变化如图 4所示,3个温度条件下, 胃内容物中胃蛋白酶和胰蛋白酶的比活力在摄食后 4h内迅速显著升高(P<0.05); 在4—8h之间, 保持在相对稳定状态, 各时间点之间没有显著性差异(P>0.05); 但是, 3个温度组之间在相同时间点存在显著差异(P<0.05), 并且酶活力的大小关系为 25ºC > 20ºC > 15ºC; 摄食 8h 之后, 两种消化酶的比活力呈显著下降趋势(P<0.05)。而淀粉酶的比活力在胃排空的过程中没有显著变化(P>0.05), 保持相对稳定的状态。

图4 曼氏无针乌贼摄食后胃内容物消化酶比活力的变化Fig.4 Variation of specific activity of enzymes in gastric contents of S. japonica after feeding
3 讨论
3.1 曼氏无针乌贼的胃排空方式
胃排空的方式主要有三种, 分别为先快后慢型、随时间直线下降型以及先慢后快再慢型。第三种方式由于食物中存在不可消化的残留部分, 胃排空曲线最后变平。由表1可知, 在本实验条件下曼氏无针乌贼呈先快后慢的排空特征, 在摄食后 0—4h之间, 胃内容物重量显著降低(P<0.05), 胃内容物干重的 50%以上被排空, 说明食物在进入胃部后快速通过; 而在摄食后6—8h和10—12h时间段胃内容物重量变化不显著(P<0.05), 说明在摄食6h后胃排空率降低。曼氏无针乌贼为食游泳生物的肉食性动物(杨纪明等,2000; 罗云云, 2013), 食量较大, 消化力旺盛, 摄食后食物在胃内消化时间短, 故排空时间短。乌贼对食物没有十分明显的选择性, 其食性组成主要取决于海域饵料生物品种及其易得性(郭新等, 1986), 主要包括小型的鱼类和甲壳类(主要为虾和蟹), 以及少量的软体动物。已有关于曼氏无针乌贼的解剖学和组织学研究结果表明: 摄食时用颚片将食物切碎, 食道穿过脑较细, 进入胃部的食物颗粒相对较小。胃部组织特点和细胞结构都与其食性相适应, 其胃是典型的“D”型, 胃的环肌层特别发达, 内壁有很厚的护膜,主要胃肌细胞和分泌型细胞有纤毛, 有助于分泌消化酶和机械挪动, 因此胃是机械研磨消化食物的最主要场所(陆伟进, 2012)。
3.2 温度对曼氏无针乌贼的胃排空率的影响
确定水生生物胃排空的最优模型需要考虑较多因素, 除了数学模型的选择, 还要考虑胃内容物的表达方法、环境因素(如温度等)、食物种类及饥饿时间等因素。由于水生生物胃排空方式的复杂多样性, 在选择何种最佳模型来拟合胃排空数据时一直存在争议(曾令清等, 2011)。目前国内外研究中, 已有十多种建立的胃排空率模型, 线性模型、指数模型和平方根模型为最常使用(张波等, 2001a, b)。不同胃排空模型有着各自的生物学意义, 任一种单一模型无法适合所有条件下的胃排空率。上述3种数学模型的使用有一个前提, 即: 设定食物由胃进入肠道的过程较为平滑而且连续, 但实际上, 在胃排空过程中, 其内容物是以“脉冲”方式经过胃而进入前肠(张波等, 2001 a,b)。目前来看, 由于缺乏生理学基础, 尚未有公认的一种数学模型与排空过程有着最好的拟合效果, 因此尚需对具体生理因素的参数进一步完善。虽然如此,研究水生生物胃排空的生理机制对完善胃排空模型仍有更好的帮助。由表2可知, 通过比较拟合模型的R2、RSS和SDR, 本文所使用的3种数学模型(线性,指数, 平方根)均对曼氏无针乌贼的胃排空实验数据有着较好的拟合效果。综合结果表明: 平方根模型为最优模型, 其次为指数模型, 线性模型最差。而胃内容物的表达方式对曼氏无针乌贼胃排空最优数学模型的选择没有影响, 但是平方根模型适于拟合胃内容物干重数据, 而指数模型拟合胃内容的湿重数据效果较好; 另外, 在温度并没有影响曼氏无针乌贼胃排空最优数学模型的选择。选用平方根最优数学模型,依据数学求导公式可知, 曼氏无针乌贼的胃排空速率为随摄食后时间增加而减小的一元函数式:这也与表 1描述曼氏无针乌贼胃内容物重量变化特征的结果一致。根据平方根模型计算在 15ºC、20ºC 和 25ºC 水温时曼氏无针乌贼50%胃内容干重排出的理论时间分别为4.4h、3.7h和3.6h, 而完全排空的时间分别为13.8h、12h和12h。同时, 由表1可知, 曼氏无针乌贼在第0h时的摄食率随温度的升高而增加。表明升高温度不仅促进曼氏无针乌贼的摄食量, 而且增加了胃排空率, 在 25ºC 曼氏无针乌贼的胃排空率最佳。已有研究表明曼氏无针乌贼在 24ºC时的呼吸代谢、摄食量及成活率都表现出最佳状态(Yinet al, 2013)。温度对胃排空的影响已在许多鱼类得到了较为详细的研究(Persson, 1981;Pääkkönenet al, 1997; 张波等, 2001a, b; 孙耀等,2005), 结果表明, 当水温升高时, 胃排空率随之加快,而当温度接近极限温度时, 排空率曲线会变平或者下降。温度可能通过五个方面的因素来影响排空率(Kapooret al, 1976): 摄食率、消化酶活性、胃肠道活动、消化液分解速率、肠道吸收率, 这与本文的研究结果一致。本文预实验中 30ºC时的空胃率较高, 也暗示 30ºC已达到曼氏无针乌贼正常摄食的上限温度。已有报道曼氏无针乌贼在 32ºC时呼吸代谢水平受到严重影响, 肝脏超氧化物歧化酶活性最低, 处于应激状态(Yinet al, 2013)。
3.3 温度对曼氏无针乌贼胃内容物中的水分、pH值和消化酶的影响
动物主要通过食物中的水分、吞饮和消化道分泌这三种途径来获得水分(Kristiansenet al, 2001)。当食物进入曼氏无针乌贼的胃部以后, 会导致水分含量产生变化。胃内容物的水分具有维持渗透压平衡、调节 pH值和食物消化过程的重要功能(朱伟星等,2015)。在本实验中, 整个胃排空过程中水分含量呈现先逐渐下降后快速上升的趋势, 这与曼氏无针乌贼具有强大的肝胰腺有关, 肝管直接与胃部相连, 胆汁和胰腺分泌物具有较高的浓度, 发挥重要的渗透调节作用(Buckinget al, 2006)。同时, 在25ºC时水分含量呈现稳步升高的趋势, 说明在此温度条件下不断有胆汁和胰腺分泌物注入胃部, 胃内容物一直保持较高的渗透压。胃内pH值常取决于胃壁HCl分泌量及胆汁和胰液的作用, 而后两者可以中和胃内的酸以提高pH值(樊红平等, 2006)。胃内容物pH的变化对食物的酸化过程起着重要作用, 进而也影响到胃排空的率(朱伟星等, 2015)。本文实验中曼氏无针乌贼在摄食后6h内pH显著下降(P<0.05), 随后显著上升(P<0.05), 在胃内容物完全排空时恢复到初始值,这与 Deguara等(2003)对金头鲷(Sparus aurata)的研究结果一致。而温度对 pH值的变化规律没有影响,这可能是因为内容物的缓冲能力发挥着作用。
本试验结果表明, 曼氏无针乌贼在胃排空过程中胃蛋白酶和胰蛋白酶均呈现先升高后降低的变化趋势; 而淀粉酶在食物摄入至从胃部排出的过程, 都没有发生显著变化(P>0.05), 并且淀粉酶活力大小也远低于胃蛋白酶和胰蛋白酶, 这与曼氏无针乌贼是食肉性动物的食性相吻合, 摄食的食物主要为高蛋白的物质, 而碳水化合物则相对较少, 故蛋白酶的比活力远远超过淀粉酶的比活力(陆伟进, 2012)。温度对胃蛋白酶和胰蛋白酶的活性有显著影响(P<0.05),随温度的升高而增加; 而温度对淀粉酶活性没有影响(P>0.05)。在探讨温度对幼体曼氏无针乌贼(4.08±0.26g)消化酶活性的研究中得到一致结果(Penget al,2011)。
4 结论
本实验通过 3种常用数学模型(线性、平方根及指数模型)对曼氏无针乌贼排空过程进行曲线拟合;并探究了不同温度对曼氏无针乌贼胃排空过程的影响。同时, 探究了三个温度条件下胃排空过程中胃内容物的水分、pH和消化酶的变化规律。研究结果表明曼氏无针乌贼的最优数学模型为平方根模型, 三个温度下曼氏无针乌贼胃排空过程中胃内容物的水分含量、pH值和消化酶比活力存在显著差异(P<0.05)。在25ºC水温条件下, 更有利于曼氏无针乌贼的胃排空过程, 同时建议在饲喂管理中按照 3.6h的间隔进行投喂。本研究结果为进一步研究摄食规律、消化生理学及人工饲料开发与利用提供理论参考。同时, 探究不同温度下曼氏无针乌贼的胃排空时间可以更高效地指导生产管理的投饵工作, 提高饵料转化率和推进生态健康养殖等方面的研究。
叶 坤, 2012. 曼氏无针乌贼配合饲料中蛋白质和脂肪需要量的研究. 厦门: 集美大学硕士学位论文, 4—5
朱伟星, 华雪铭, 钟国防等, 2015. 斑点叉尾对全植物蛋白饲料的胃排空及消化道内容物特性研究. 水产学报, 39(4):529—538
刘立明, 王爱敏, 王勇强等, 2013. 温度和体质量对仿刺参消化道排空时间和排便量的影响. 海洋科学, 37(9): 43—48
孙 耀, 刘 勇, 于 淼等, 2005. 东、黄海 鳀鱼的胃排空率及其温度影响. 生态学报, 25(2): 215—219
孙晓锋, 冯 健, 陈江虹等, 2011. 投喂频率对尼罗系吉富罗非鱼幼鱼胃排空、生长性能和体组成的影响. 水产学报,35(11): 1677—1683
麦康森, 2011. 水产动物营养与饲料学. 北京: 中国农业出版社, 244—297
杨纪明, 谭雪静, 2000. 渤海 3种头足类食性分析. 海洋科学,24(4): 53—55
张 波, 孙 耀, 唐启升, 2000. 黑鲷的胃排空率. 应用生态学报, 11(2): 287—289
张 波, 孙 耀, 唐启升, 2001a. 鱼类的胃排空率及其影响因素. 生态学报, 21(4): 665—670
张 波, 郭学武, 孙 耀等, 2001b. 温度对真鲷排空率的影响.海洋科学, 25(9): 14—15
陆伟进, 2012. 曼氏无针乌贼消化系统组织细胞学和酶化学的研究. 宁波: 宁波大学硕士学位论文, 25—33
罗云云, 2013. 植物蛋白替代鱼粉在曼氏无针乌贼配合饲料中的应用研究. 厦门: 集美大学硕士学位论文, 29—45
赵海祥, 2012. 投饲频率对瓦氏黄颡鱼幼鱼胃排空、生长效益及体组成的影响. 南宁: 广西大学硕士学位论文, 15—29
郭 新, 范广钻, 郏国生, 1986. 浙江近海曼氏无针乌贼食性的初步研究. 浙江水产学院学报, 5(2): 171—175
董正之, 1988. 中国动物志: 软体动物门, 头足纲. 北京: 科学出版社, 1—43
覃志彪, 赵海祥, 赵华林等, 2011. 投饲频率对瓦氏黄颡鱼(Pelteobagrus vachelli)幼鱼胃排空、生长效益及体组成影响. 海洋与湖沼, 42(4): 506—511
曾令清, 李凤杰, 李秀明等, 2012. 饥饿对南方鲇幼鱼胃排空及其数学模型选择的影响. 水产学报, 36(8): 1263—1269
曾令清, 李凤杰, 曹振东等, 2011. 南方鲇幼鱼的胃排空特征及其数学模型. 水产学报, 35(2): 231—237
樊红平, 侯水生, 黄 苇等, 2006. 鸡、鸭消化道pH和消化酶活的比较研究. 畜牧兽医学报, 37(10): 1009—1015
Bucking C, Wood C M, 2006. Gastrointestinal processing of Na+,Cl–, and K+during digestion: implications for homeostatic balance in freshwater rainbow trout. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology, 291(6): R1764—R1772
Deguara S, Jauncey K, Agius C, 2003. Enzyme activities and pH variations in the digestive tract of gilthead sea bream.Journal of Fish Biology, 62(5): 1033—1043
Elliott J M, 1972. Rates of gastric evacuation in brown trout,Salmo truttaL. Freshwater Biology, 2(1): 1—18
Hopkins T E, Larson R J, 1990. Gastric evacuation of three food
types in the black and yellow rockfishSebastes chrysomelas(Jordan and Gilbert). Journal of Fish Biology, 36(5): 673—681
Hurst T P, 2004. Temperature and state-dependence of feeding and gastric evacuation in juvenile Pacific halibut. Journal of Fish Biology, 65(1): 157—169
Jobling M, 1981. Mathematical models of gastric emptying and the estimation of daily rates of food consumption for fish.Journal of Fish Biology, 19(3): 245—257
Kapoor B G, Smit H, Verighina I A, 1976. The alimentary canal and digestion in teleosts. Advances in Marine Biology, 13:109—239
Kristiansen H R, 1998. Effects of handling, discrete meals and body weight on the individual variation of gastric emptying parameters. Aquaculture Research, 29(10): 717—729
Kristiansen H R, Rankin J C, 2001. Discrimination between endogenous and exogenous water sources in juvenile rainbow trout fed extruded dry feed. Aquatic Living Resources, 14(6): 359—366
Morales G A, Márquez L, de Rodrigañez M Set al, 2013. Effect of phytase supplementation of a plant-based diet on phosphorus and nitrogen bioavailability in sea breamSparus aurata. Aquaculture Nutrition, 20(2): 172—182
Pääkkönen J P J, Marjomäki T J, 1997. Gastric evacuation rate of burbot fed single-fish meals at different temperatures.Journal of Fish Biology, 50(3): 555—563
Pääkkönen J P J, Myyrä R, Marjomäki T J, 1999. The effect of meal size on the rate of gastric evacuation of burbot,Lota lota(L.). Ecology of Freshwater Fish, 8(1): 49—54
Peng S M, Yin F, Shi Z Het al, 2011. Optimum water temperature for the growth of juvenile common Chinese cuttlefish,Sepiella maindroni(De Rochebrune 1884).Journal of Shellfish Research, 30(2): 205—209
Persson L, 1979. The effects of temperature and different food organisms on the rate of gastric evacuation in perch (Perca fluviatilis). Freshwater Biology, 9(2): 99—104
Persson L, 1981. The effects of temperature and meal size on the rate of gastric evacuation in perch (Perca fluviatilis) fed on fish larvae. Freshwater Biology, 11(2): 131—138
Principe N D, Kraft C E, Mills E L, 2007. Gastric evacuation and daily ration of naturally produced age-0 Chinook salmon in Lake Ontario. Transactions of the American Fisheries Society, 136(5): 1206—1215
Quintela J, Andrade J P, 2002a. Effects of temperature on gastric evacuation rates inSepia officinalis(Linnaeus, 1758) in laboratory conditions. Bulletin of Marine Science, 71(2):681—689
Quintela J, Andrade J P, 2002b. Diel feeding rhythms, daily ration and gastric evacuation rates ofSepia officinalisin the Ria Formosa lagoon (South Portugal). Bulletin of Marine Science, 71(2): 665—680
Yin F, Sun P, Peng S Met al, 2013. The respiration, excretion and biochemical response of the juvenile common Chinese cuttlefish,Sepiella maindroniat different temperatures.Aquaculture, 402—403: 127—132
