海洋褐藻羊栖菜(Sargassum fusiforme)中马尾藻甾醇、岩藻甾醇的分类纯化及抗菌、抗氧化活性研究*
2018-01-04丁国芳徐银峰
孙 瑜 丁国芳 徐银峰
(浙江海洋大学 浙江省海洋生物医用制品工程技术研究中心 舟山 316022)
羊栖菜(Sargassum fusiforme)属于圆子纲、墨角藻目、马尾藻科、马尾藻属, 是一种广泛分布在中国、韩国和日本沿海的海洋褐藻, 在我国北起辽东半岛,南至雷州半岛均有分布。褐藻不仅作为食物, 而且作为草药已被人们广泛消费。研究表明, 褐藻中含有多种生物活性物质, 其中所含的甾醇具有抗菌和抗氧化活性(Ayyadet al, 2003)。Kavita等(2014)报道了从琉璃苣红色海藻提取的 24Δ5甾醇, 具有对人类致病细菌的抗菌活性。Cheng等(2013)研究了来自海洋海绵(Haliclona crassiloba)的多羟基甾醇, 此多羟基甾醇对一些革兰氏阳性菌株显示抑菌活性, 最小抑制浓度(MIC)范围为 4—32μg/mL。此外, Lee等(2003)报道了从海藻中分离出的一种胆固醇化合物, 其抗氧化酶肝细胞溶质超氧化物歧化酶(SOD)过氧化氢酶、谷胱甘肽过氧化物酶和谷胱甘肽过氧化物酶GSH-px活性分别为33.9%、21.6%和39.2%。
传染病在世界范围内引起的发病率和死亡率仍居高不下, 抗微生物剂被认为是用于治疗传染病的领先药物。然而, 由于抗菌素耐药性的发展、抗药性菌株的出现以及抗性临床分离物的快速全球传播,细菌感染的治疗仍然是一个重要的且具有挑战性的问题(Urakamiet al, 2014; Banerjeeet al, 2015)。针对耐药菌的一种潜在替代疗法是使用抗氧化药物。抗氧化药物可以治愈和预防一些由自由基引起的疾病。自由基是在身体中产生的高度反应性化学物质, 具有损害细胞、细胞器、DNA、脂质、蛋白质和其他生物分子的潜力, 导致癌症、心血管和神经变性疾病。因此, 从生物系统中去除自由基对于细胞的可持续性至关重要。抗氧化剂也称为自由基清除剂, 可以清除一 些 自 由 基 (Ahmedet al, 2015; Anastácioet al,2015)。
马尾藻甾醇(Saringosterol)和岩藻甾醇(Fucosterol)是从褐藻中分离纯化的两种甾醇化合物, 其结构式见图1。据报道这两种化合物作为药物具有抗动脉粥样硬化、抗肥胖、抗锥虫和抗结核作用(Junget al,2013; Kimet al, 2014; Zhenet al, 2015), 但马尾藻甾醇和岩藻糖醇的抗菌活性尚未见报道。本文采用经典的抗菌和抗氧化模型对马尾藻甾醇和岩藻甾醇进行抗菌活性和抗氧化活性研究。

图1 马尾藻甾醇和岩藻甾醇结构Fig.1 The structure of saringosterol and fucosterol
1 材料与方法
1.1 实验材料
羊栖菜(Sargassum fusiforme)采于浙江省舟山市东港海边。熔点采用毛细管测定。红外光谱仪FT-IR1730 (Bruker公司), 核磁共振光谱仪 AV-300(Bruker公司)。高分辨率质谱仪 MALDI-TOF/TOF(Bruker Daltonik 德国)。DPPH (2,2-二苯基-1-苦基肼基)、ABTS (2,2′-连氮基-双(3-乙基苯并噻唑-6-磺酸)、金黄色葡萄球菌(Staphylococcus aureus)、变异链球菌(S. mutans)、大肠杆菌(Escherichia coli)、甲氧西林抗性金黄色葡萄球菌、甲氧西林耐药金黄色葡萄球菌、喹诺酮抗性金黄色葡萄球菌、喹诺酮抗性金黄色葡萄球菌购自Sigma公司。其他化学试剂均为国产分析纯。
1.2 甾醇的分离与纯化
将干燥的褐藻羊栖菜用 95%乙醇回流 1h, 重复三次。所得乙醇萃取物过滤, 并在真空下浓缩。将混合物用水溶解, 依次用正己烷和乙酸乙酯萃取得到粗提物。将正己烷层进行硅胶柱分离, 用正己烷-乙酸乙酯(10:1, 8:1, 6:1, 4:1, 2:1, 1:1)和乙酸乙酯-甲醇(4:1,2:1, 1:1)进行洗脱, 得到十个亚级分(sfr): sfr.1至sfr.10。将次级分7和8进行等度半制备HPLC分离,采用正己烷-乙酸乙酯(5:1), 得到白色固体。经现代分析光谱确定为岩藻甾醇。岩藻甾醇的熔点和光谱数据如下。Mp. 122-124°C; IR (KBr) cm–1: 3409, 2956, 1641,1473, 1383, 1052, 1029;1H-NMR (CDCl3,500 MHz):δ0.71(3H, s, H-18), 0.97(3H, d,J=6.42 Hz, H-21),1.09(3H, s, H-19), 1.60 (3H, d,J=6.62 Hz, H-29),2.18(1H, m, H-25), 3.59(1H, m, H-3), 5.24(1H,q,J=6.81 Hz, H-28), 5.39(1H, br d,J=5.12 Hz, H-6);10.15 (1H, s, -OH);13C-NMR (CDCl3, 100 MHz):δ145.98(C-24), 140.72(C-5), 120.98(C-6), 115.52(C-28),72.04(C-3), 57.87(C-14), 56.08(C-17), 49.79(C-9),43.10(C-13), 42.40(C-4), 40.13(C-12), 37.62(C-1),37.11(C-10), 36.51(C-20), 35.43(C-22), 34.67(C-25),32.10(C-8), 31.98(C-2), 31.65(C-7), 28.73(C-16),2575(C-23), 25.05(C-15), 22.43(C-27), 22.19(C-26),21.34(C-11), 20.10(C-19), 19.04(C-21), 13.28(C-29),11.98 (C-18); ESI-HRMS C29H48O+([M+H]+)的计算值:413.3705, 实测值: 413.3709。综合分析上述数据与文献报道一致(Sheuet al, 1997)。
马尾藻甾醇的熔点和光谱数据如下。Mp.158.6—161.3°C; IR (KBr) cm–1: 3393, 2941, 1640,1472, 1380, 1060, 1040;1H-NMR (CDCl3,500MHz):δ0.66—1.12 (15H, m, (-CH3)5), 1.02—1.73 (20H, m,(-CH2)10), 2.91-3.45 (6H, m, (-CH)6), 5.30 (1H, q,J=6.82Hz, H-28), 5.42 (1H, br d,J=5.16Hz, H-6), 10.21(1H, s, -OH);13C-NMR (CDCl3, 100MHz):δ145.09,140.69, 121.88, 115.86, 71.74, 58.32, 56.74, 50.16,44.03, 42.89, 41.80(C-4), 38.13, 37.83, 36.49, 35.98,31.95, 31.93, 30.75, 30.12, 27.70, 27.58, 27.04, 22.30,21.67, 21.20, 19.36, 15.34, 14.68, 13.34; ESI-HRMS C29H48O2+([M+H]+)的计算值: 428.3654, 实测值:428.3647。综合分析上述数据与文献报道一致(Wächteret al, 2001)。
1.3 体外抗菌活性评价
实验选取金黄色葡萄球菌(S. aureus4220, 503和209), 变异链球菌(S. mutans3065和 3289)和大肠杆菌大肠杆菌(E. coli1924和1356)。耐药性临床分离株的菌株是多重耐药金黄色葡萄球菌(MRSA CCARM 3167和MRSA CCARM 3506)和喹诺酮抗性金黄色葡萄球菌(QRSA CCARM 3505和 QRSA CCARM 3519)。从几个诊所住院的各种患者收集临床分离物,遵循双重连续稀释技术(Songet al, 2012; Kauret al,2014), 以测试在初步测试(革兰氏阳性菌和革兰氏阴性菌)中总甾醇、马尾藻甾醇、岩藻甾醇和药物对敏感微生物的最小抑制浓度(MIC), 得到耐药革兰氏阳性细菌的临床分离株。将溶于二甲基亚峰的总甾醇、马尾藻甾醇和岩藻甾醇加入到培养基(用于变形链球菌的脑心浸液和用于其他细菌的MüllereHinton琼脂)中, 得到50—200mg/kg和0.5—64mg/mL的终浓度。将完全抑制微生物生长的测试物质的最低浓度记录为MIC(以mg/mL表示), 在37°C孵育20h后读取MIC值。得到细菌最终应用量为105CFU/mL。诺氟沙星和氧氟沙星用作阳性药物对照。所有实验进行三次。
1.4 DPPH自由基清除活性判定
参考Aktumsek等(2013)报道的方法测定总甾醇、马尾藻甾醇和岩藻甾醇的DPPH自由基清除活性。称取24mg DPPH溶解在100mL甲醇中, 制备得到自由基储备溶液, 置于冰箱备用。另用甲醇稀释DPPH储备溶液, 溶液要求在517nm处获得约0.96±0.02的吸光度。在试管中, 将DPPH (3mL)工作溶液与总固醇、马尾藻甾醇和岩藻甾醇(0.5—2.5mg/mL)或标准溶液混合到100μL。在517nm下测试吸光度30min。通过下式计算抗氧化剂或自由基清除效应的百分比: 抗氧化活性(%)=[(Ac-As)/Ac]×100其中, Ac和As分别是对照和样品的吸光度。对照组含有100μL甲醇代替植物样品。
1.5 ABTS…+脱色测定
参考Re等(1999)报道的ABTS…+脱色测定马尾藻甾醇和岩藻甾醇的抗氧化作用。取 9.5mL ABTS(7mmol/L)与 245μL 硫酸钾(100mmol/L)反应, 并用蒸馏水定容至10mL, 制备ABTS…+自由基溶液。溶液遮光室温下保持 18h, 然后用 0.1mol/L磷酸钾缓冲液(pH 7.4), 735nm处的吸光度为0.65±0.02。用甲醇中制备总甾醇马尾藻甾醇和岩藻甾醇, 稀释度为0.4—2.0mg/mL。将样品(10μL)置于试管中, 并与3.0mL ABTS自由基溶液充分混合。在735nm处记录其吸光度。采用下式计算样品的抗氧化活性百分比:抗氧化活性(%)=[(Ac-As)/Ac]×100其中Ac和As分别是对照和样品的吸光度。通过加入10μL甲醇代替样品制备对照组。
1.6 超氧自由基测定
参考 Jin等(2014)的方法测定总甾醇、马尾藻甾醇和岩藻甾醇的超氧自由基清除能力。将样品溶解在不同浓度的蒸馏水中。然后, 将0.1mL试样溶液, 1mL含有 NADH (557μmol/L)的 16mmol/L Tris-HCl (pH 8.0), 1mL 含有 PMS (45μmol/L)的 16mmol/L Tris-HCl(pH 8.0), 1mL 含有 NBT (108μmol/L)的 16mmol/L Tris-HCl (pH 8.0)混合。将反应混合物在室温下温育5min, 并通过分光光度计针对空白样品在 560nm 测吸光度。反应混合物的吸光度降低表明超氧化物阴离子清除活性增加。采用以下方程式计算清除超氧化物阴离子自由基的能力: 超氧化物清除速率(%)=[1–A1/A0]×100%。其中A0是没有样品的混合溶液的吸光度;Ai是与反应溶液混合的测试样品的吸光度。
1.7 羟自由基清除测定
羟基自由基测定根据 Ghiselli等(1988)的方法测量。将总甾醇、马尾藻甾醇和岩藻甾醇用 DMSO配成0.5—6.0mg/mL。将0.1mL样品溶液与0.6mL缓冲液[0.2mol/L磷酸盐缓冲液(pH 7.4)]反应, 0.12mmol/L EDTA和2.60mmol/L脱氧核糖, 0.05mL 2.0mmol/L抗坏血酸, 0.2mL 0.4mmol/L硫酸亚铁铵和 0.05mL的20mmol/L H2O2加入到反应溶液中。将反应溶液在37°C下孵育15min, 然后加入1mL硫代巴比妥酸(1%)和1mL三氯乙酸(2.0%)。然后, 混合物在100°C下反应15min, 并用冰冷却。在530nm处测吸光度来检测羟基自由基的存在。对照组含有所有没有样品的反应试剂, 并测量为A0。Ai是样品的结果, 并且Aj包含所有样品, 用不同毫升磷酸盐缓冲液(20mmol/L pH 7.4,含有0.1mmol氯化铁, 0.1mmol EDTA, 2.8mmol脱氧核糖)代替磷酸盐缓冲液(20mmol/L pH 7.4) 0.1mL 1mmol Vit C和0.5mL 20mmol/L过氧化氢。通过下式计算羟基自由基清除率: 羟基清除率(%)=[1–(Ai–Aj)/A0]×100%。
2 结果与分析
2.1 化学分析
总甾醇、马尾藻甾醇和岩藻甾醇通过胆固醇定量法反应显示出阳性反应, 这是甾醇物质的特征反应。通过IR,1H-NMR和13C-NMR和质谱表征了马尾藻甾醇的化学结构。马尾藻甾醇的IR光在3393cm–1谱带为-OH, 在 2941cm–1为-CH3和 1640cm–1为-C=C-。在1H-NMR 10.21×10–6一般作为宽谱带为-OH 峰, 在0.66×10–6(3H, s, H-18)和 1.04×10–6(3H, s, H-19)处显示两个-CH3质子。=CH质子在5.42 (1H, br d, H-6)处显示为宽谱带, 在多个峰处显示3.50 (1H, m, H-3),这是以羟基甾醇为母核的特征Δ5-3β-。在13C-NMR谱中145.09(C-24), 140.69(C-5), 42.89(C-13), 36.49(C-10)处观察到马尾藻甾醇的四个-C-基团。121.88(C-6),115.86(C-28), 71.74(C-3), 58.32(C-14), 56.74(C-17),50.16(C-9), 35.98(C-20), 34.67(C-25), 31.93, 在41.80(C-4), 38.13(C-12), 37.83(C-1), 34.75(C-22),30.12(C-2), 27.70(C-7), 27.58(C-16), 27.04(C-23),24.12(C-15), 22.30, 在 21.67(C-27), 21.20(C-26),19.36(C-19), 15.34(C-21), 14.68(C-29), 13.34(C-18)处为六个-CH3-。
2.2 总甾醇、马尾藻甾醇和岩藻甾醇的抗菌活性
通过在体外用不同菌株的最小抑制浓度(MIC)评价抗菌活性(Winanset al, 1999)。实验结果如表1所示, 总甾醇在30、60和80mg/kg对金黄色葡萄球菌(S.aureus4220, 503和209)和变异链球菌(S. mutans3065和 3289)显示抑菌活性。马尾藻甾醇和岩藻甾醇在4—32mg/kg对金黄色葡萄球菌(S. aureus4220, 503和209)和变异链球菌(S. mutans3065和3289)具有高抑菌活性, 但活性低于诺氟沙星和氧氟沙星。总甾醇、马尾藻甾醇和岩藻甾醇对革兰氏阴性菌株大肠杆菌(1924和1356)均为显示抑菌活性。
2.3 对耐药革兰氏阳性菌株的临床分离株
表 2显示, 马尾藻甾醇和岩藻甾醇对多种耐药性革兰氏阳性细菌的许多临床分离物的抗细菌作用。在4—32mg/mL剂量下, 马尾藻甾醇和岩藻甾醇对多重耐药性革兰氏阳性细菌的临床分离物具有高度活性。而且诺氟沙星在64mg/kg剂量下对QRSA没有抑菌活性。氧氟沙星64mg/mL剂量下对MRSA没有抑菌活性。
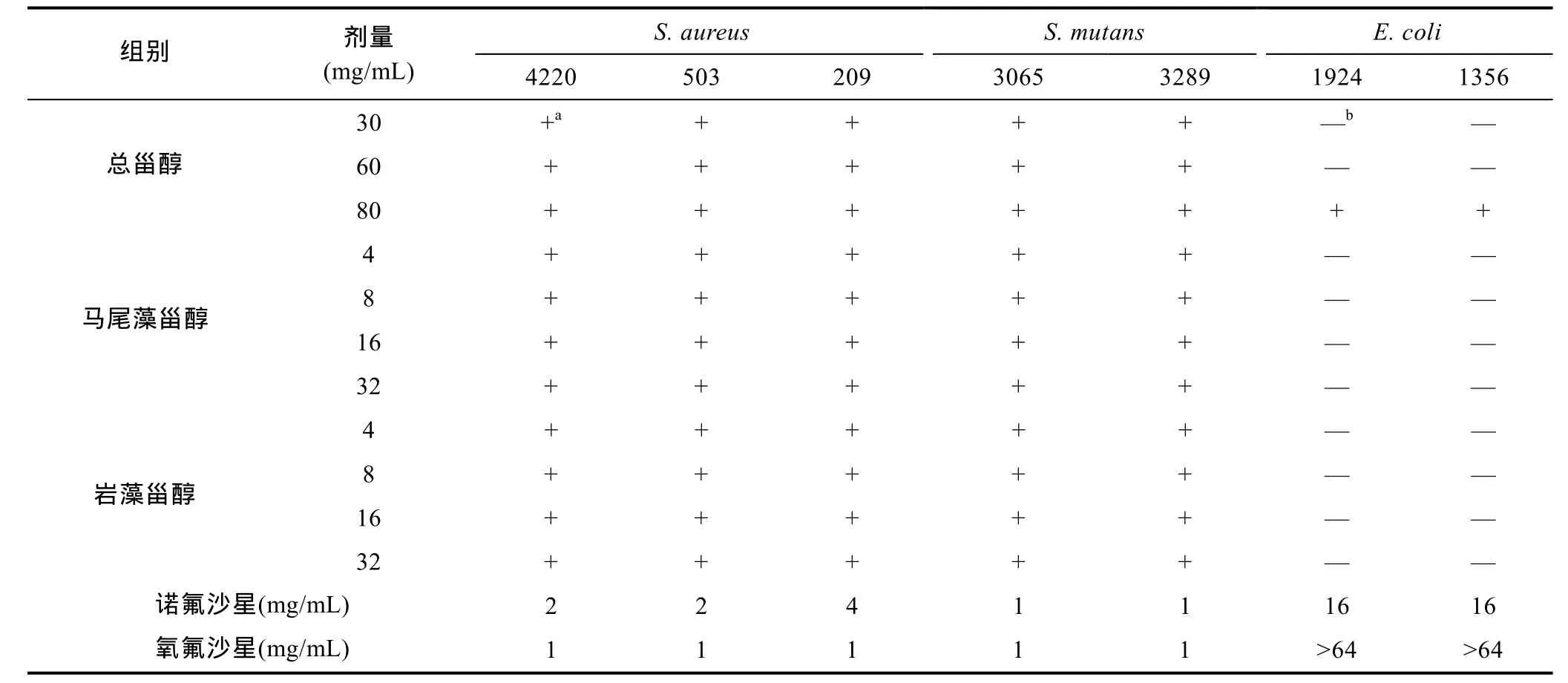
表1 总甾醇、马尾藻甾醇和岩藻甾醇抑制活性Tab.1 Inhibitory activity of the total sterols, saringosterol and fucosterol
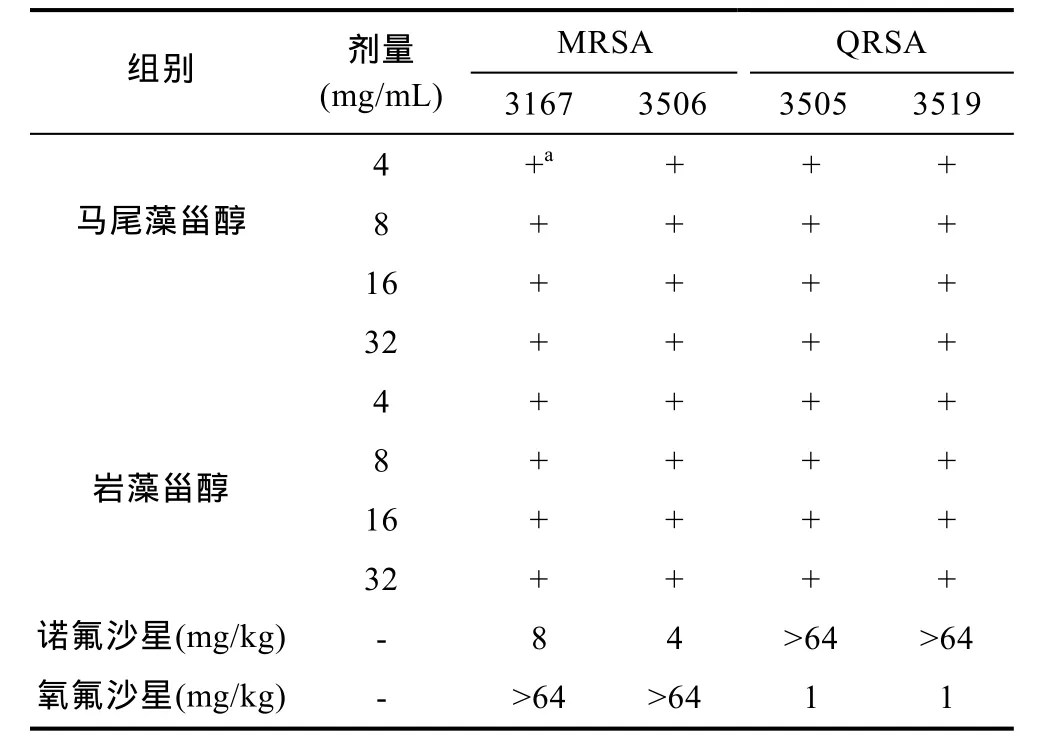
表2 对多重耐药革兰氏阳性细菌菌株的临床分离物的MIC值Tab.2 MIC values against clinical isolates of multidrug-resistant Gram-positive bacterial strains
2.4 DPPH自由基清除活性
产生的若干自由基和氧物质可通过其氧化作用损伤蛋白质、DNA和脂质等并引发衰老、动脉粥样硬化和癌症等症状。因此, 自由基的去除对于生物系统细胞可持续性而言非常重要。抗氧化剂, 被称为自由基清除剂具有捕获自由基物质的作用(Alamet al,2013)。通过 DPPH自由基清除试验检测了总甾醇、马尾藻甾醇和岩藻甾醇的自由基清除或抗氧化作用。结果如图 2a所示。结果表明, 总甾醇、马尾藻甾醇和岩藻甾醇对抑制这些自由基的形成具有显着的效果。总甾醇的清除效果低于马尾藻甾醇和岩藻甾醇。在 2.5mg/mL的浓度下, 马尾藻甾醇、岩藻甾醇和总甾醇对DPPH自由基的清除率分别为84.7%、81.5%和73.2%。
2.5 根据ABTS…+部分脱色测定的抗氧化活性
ABTS自由基测定是适用于亲脂性和亲水性抗氧化剂, 包括羟基肉桂酸酯, 类胡萝卜素和血浆抗氧化剂的脱色测定(Zhanget al, 2013)。通过用过硫酸钾氧化 ABTS产生 ABTS…+形成自由基单分子, 再进行还原反应。图2b中显示了总甾醇、马尾藻甾醇和岩藻甾醇的ABTS自由基清除作用, 总甾醇、马尾藻甾醇和岩藻甾醇表现出令人满意的 ABTS自由基清除作用, 其浓度排列总甾醇<岩藻甾醇<马尾藻甾醇。在2.5mg/kg的浓度下, 马尾藻甾醇, 岩藻甾醇和总甾醇的清除率分别为86.9%、82.4%和70.7%。
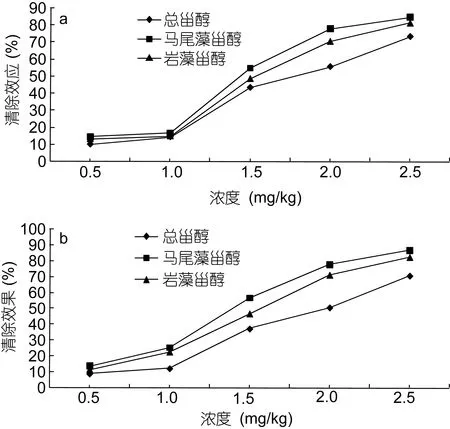
图2 总甾醇、马尾藻甾醇和岩藻甾醇对DPPH自由基(a)和ABTS自由基(b)的清除活性Fig.2 Scavenging activity of total sterols, saringosterol and fucosterol on DPPH radical (a) and ABTS radical (b)
2.6 超氧自由基测定
超氧化物基团是通过许多生物学和光化学反应产生的高毒性物质。超氧自由基可以分解形成单线态氧和羟基(Chenet al, 2015)。总甾醇、岩藻甾醇和马尾藻甾醇对超氧化物阴离子的清除效果显示在图 3a中。总甾醇、岩藻甾醇和马尾藻甾醇表现出具有剂量效应关系的显着清除活性。总甾醇、马尾藻甾醇和岩藻甾醇对超氧化物自由基的清除效应为的总甾醇<岩藻甾醇<马尾藻甾醇, 并且在2.5mg/kg的浓度下的影响为分别为60.3%、44.5%和34.6%。
2.7 羟基自由基测定
羟基自由基是反应性较强并且能诱导邻近的双分子分解, 因此消除羟基自由基增强抗氧化能力。羟基容易在酸的存在下 Fe(II)络合物与 H2O2的反应产生的双分子的氧化损伤。水杨酸具有吸收-OH以产生着色材料的能力。添加的羟基自由基清除剂与水杨酸竞争, 使得着色材料的含量下降。该方法用于评价天然化合物的羟基自由基清除能力(Yanget al, 2011;Lapshinaet al, 2015)。总固醇、马尾藻甾醇和岩藻甾醇的清除效果见图3b中。清除羟基自由基的活性是随浓度增加而加强, 且马尾藻甾醇和岩藻甾醇的清除效果总是远低于总甾醇。在2.5mg/kg的浓度下, 总甾醇、马尾藻甾醇和岩藻甾醇对羟基自由基的清除率分别为85.8%, 65.6%和45.3%。
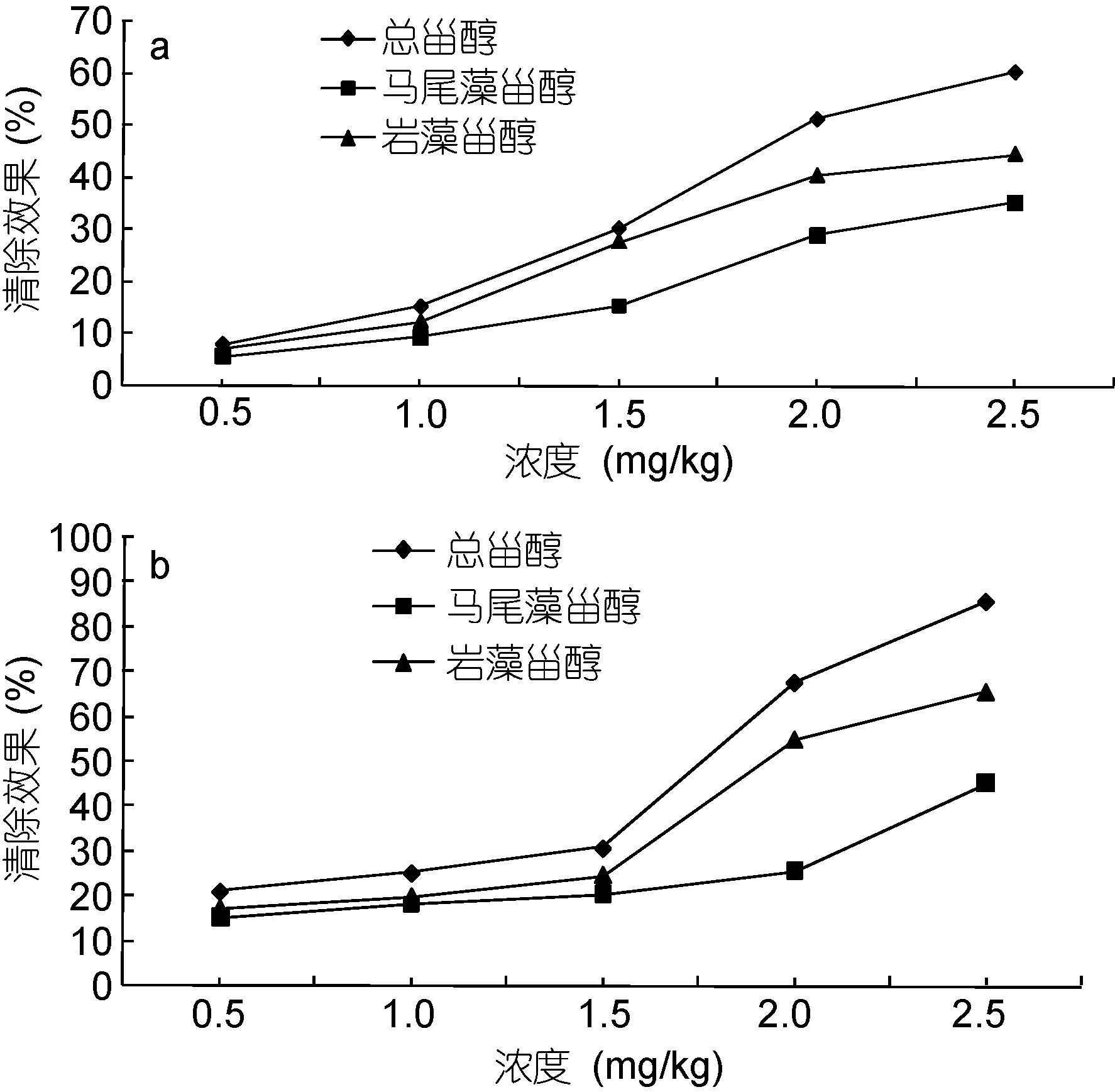
图3 总甾醇、马尾藻甾醇和岩藻甾醇对超氧化物基团(a)和羟基自由基(b)的清除作用Fig.3 Scavenging effects of total sterols, saringosterol and fucosterol on superoxide radicals (a) and hydroxyl radicals (b)
3 结论
总甾醇、马尾藻甾醇和岩藻甾醇对革兰氏阳性和革兰氏阴性细菌均具有抑菌活性。马尾藻甾醇和岩藻甾醇MIC为4—32mg/mL对于金黄色葡萄球菌和变异链球菌具有高活性。而总甾醇对革兰氏阴性菌株大肠杆菌(1924和1356)显示出抗菌作用。但是, 马尾藻甾醇和岩藻甾醇在4-32mg/mL体外对革兰氏阴性菌株没有表现出抗菌作用。马尾藻甾醇和岩藻甾醇对多重耐药性革兰氏阳性细菌的临床分离物具有高度活性。另外, DPPH自由基、ABTS自由基、超氧化物自由基和羟基自由基测定中的所有数据表明, 总甾醇、马尾藻甾醇和岩藻固醇的抗氧化活性与它们清除DPPH自由基、ABTS自由基、超氧自由基和羟基的能力有关。
Ahmed D, Khan M M, Saeed R, 2015. Comparative analysis of phenolics, flavonoids, and antioxidant and antibacterial potential of methanolic, hexanic and aqueous extracts fromAdiantum caudatumleaves. Antioxidants, 4(2): 394—409
Aktumsek A, Zengin G, Guler G Oet al, 2013. Screening forin vitroantioxidant properties and fatty acid profiles of fiveCentaureaL. species from Turkey flora. Food Chem Toxicol,49(11): 2914—2920
Alam M N, Bristi N J, Rafiquzzaman M, 2013. Review onin vivoandin vitromethods evaluation of antioxidant activity.Saudi Pharm J, 21(2): 143—152
Anastácio A, Carvalho I S, 2015. Development of a beverage benchtop prototype based on sweet potato peels:optimization of antioxidant activity by a mixture design. Int J Food Sci Nutr, 67(5): 496—506
Ayyad S E, Sowellim S Z, El-Hosini M Set al, 2003. The structural determination of a new steroidal metabolite from the brown algaSargassum asperifolium. Z Naturforsch C,58(5—6): 333—336
Banerjee K, Banerjee S, Das Set al, 2015. Probing the potential of apigenin liposomes in enhancing bacterial membrane perturbation and integrity loss. J Colloid Interface Sci, 453:48—59
Chen Y L, Mao W J, Tao H Wet al, 2015. Preparation and characterization of a novel extracellular polysaccharide with antioxidant activity, from the mangrove-associated fungusFusarium oxysporum. Mar Biotechnol (NY), 17(2):219—228
Cheng Z B, Xiao H, Fan C Qet al, 2013. Bioactive polyhydroxylated sterols from the marine spongeHaliclona crassiloba. Steroids, 78(14): 1353—1358
Ghiselli A, Nardini M, Baldi Aet al, 1988. Antioxidant activity of different phenolic fractions separated from an Italian red wine. J Agric Food Chem, 46(2): 361—367
Jin W H, Zhang W J, Wang J,et al, 2014. A study of neuroprotective and antioxidant activities of heteropolysaccharides from sixSargassumspecies. Int J Biol Macromol, 67: 336—342
Jung H A, Jin S E, Ahn B Ret al, 2013. Anti-inflammatory activity of edible brown algaEisenia bicyclisand its constituents fucosterol and phlorotannins in LPS-stimulated RAW264.7 macrophages. Food Chem Toxicol, 59: 199—206
Kaur G, Gupta P, Harjai Ket al, 2014. Synthesis of new thiobarbituric acid derived spiroheterobicyclic compounds and their antimicrobial activity. Drug Dev Res, 75(3):202—210
Kavita K, Singh V K, Jha B, 2014. 24-Branched Δ5 sterols fromLaurencia papillosared seaweed with antibacterial activity against human pathogenic bacteria. Microbiol Res, 169(4):301—306
Kim K B W R, Kim M J, Ahn D H, 2014. Lipase inhibitory activity of chlorophylla, isofucosterol and saringosterol isolated from chloroform fraction ofSargassum thunbergii.Nat Prod Res, 28(16): 1310—1312
Lapshina E A, Zamaraeva M, Cheshchevik V Tet al, 2015.Cranberry flavonoids prevent toxic rat liver mitochondrial damagein vivoand scavenge free radicalsin vitro. Cell Biochem Funct, 33(4): 202—210
Lee S, Lee Y S, Jung S Het al, 2003. Anti-oxidant activities of fucosterol from the marine algaePelvetia siliquosa. Arch Pharm Res, 26(9): 719—722
Re R, Pellegrini N, Proteggente A,et al, 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med, 26(9-10):1231—1237
Sheu J H, Wang G H, Sung P Jet al, 1997. Cytotoxic sterols from the formosan brown algaTurbinaria ornata. Planta Med,63(6): 571—572
Song M X, Zheng C J, Deng X Qet al, 2012. Synthesis and bioactivity evaluation of rhodanine derivatives as potential anti-bacterial agents. Eur J Med Chem, 54: 403—412
Urakami T, Hamada Y, Magarihuchi Het al, 2014. Enterococcal endocarditis complicated with ruptured infected-intracranial aneurysm: with pharmacokinetic-pharmacodynamic documentation in proof of the successful antimicrobial treatment. J Infect Chemother, 20(12): 810—813
Wächter G A, Franzblau S G, Montenegro Get al, 2001.Inhibition ofMycobacterium tuberculosisgrowth by saringosterol fromLessonia nigrescens. J Nat Prod, 64(11):1463—1466
Winans K A, King D S, Rao V Ret al, 1999. A Chemically synthesized version of the insect antibacterial glycopeptide,diptericin, disrupts bacterial membrane integrity.Biochemistry, 38(36): 11700—11710
Yang Y L, Liu D, Wu Jet al, 2011. In vitro antioxidant activities of sulfated polysaccharide fractions extracted fromCorallina officinalis. Int J Biol Macromol, 49(5):1031—1037
Zhang X, Chen H X, Zhang Net al, 2013. Extrusion treatment for improved physicochemical and antioxidant properties of high-molecular weight polysaccharides isolated from coarse tea. Food Res Int, 53(2): 726—731
Zhen X H, Quan Y C, Jiang H Yet al, 2015. Fucosterol, a sterol extracted fromSargassum fusiforme, shows antidepressant and anticonvulsant effects. Eur J Pharmacol, 768: 131—138
