PaCLR介导PaLECT2激活脂多糖刺激的香鱼(Plecoglossus altivelis)单核巨噬细胞功能*
2018-01-04史雨红马海玲梁亚芳
史雨红 马海玲 梁亚芳 陈 航 陈 炯
(宁波大学海洋学院 生物化学与分子生物学实验室 宁波 315211)
LECT2 (leukocyte cell-derived chemotaxin 2)为白细胞源趋化因子, 分子量为 16kDa, 含三个分子内二硫键, 以持续性方式在肝中特异表达, 随后分泌到血液中(Yamagoeet al, 1996)。哺乳动物研究表明,LECT2是一种多功能的细胞因子, 它与肿瘤发生、肝损伤、脓毒血症、肾淀粉样病变及造血干细胞动员等生理病理过程紧密相关(Saitoet al, 2004; Luet al,2013a; Lanet al, 2014; Luet al, 2016)。据报道, LECT2在鱼类中广泛存在, 多种水产经济鱼类如鲤鱼(Fujikiet al, 2000)、虹鳟(Kokkinoset al, 2005)、大黄鱼(Liet al, 2008)和香鱼(Chenet al, 2010)等中均有鉴定报道。鱼类 LECT2基因表达与病原菌感染紧密相关(Linet al, 2007; Liet al, 2008; 施晓峰等, 2010; Chenet al,2010; Weiet al, 2011), 揭示 LECT2 可能在鱼类抗菌免疫反应中具有重要的作用。我们的研究表明, 重组香鱼 LECT2成熟肽(rPaLECT2m)能体外趋化香鱼头肾来源的单核巨噬细胞(monocytes/macrophages,MO/MΦ), 诱导白介素 1β (interleukin-1β, IL-1β)、肿瘤坏死因子 α (tumor necrosis factor α, TNFα)、白介素 10 (interleukin-10, IL-10)和粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)等细胞因子及模式识别受体(pattern recognization receptor,PRR)等基因表达, 增强 MO/MΦ 吞噬和杀菌能力(Zhanget al, 2011; Luet al, 2013b)。随后, 我们对鳗弧菌感染的香鱼进行腹腔注射 rPaLECT2m处理, 发现感病香鱼的存活率提高、组织载菌量减少、组织病理损伤减轻, 去除MO/MΦ后, 这种促病情改善的作用被抑制, 揭示鱼类中 LECT2增强机体免疫能力的作用是通过MO/MΦ介导的(Chenet al, 2014b)。
MO/MΦ能表达多种 PRRs, 如 Toll样受体(toll like receptor, TLR)及多类 C型凝集素受体(C-type lectin receptor, CLR), 这些 PRRs介导MO/MΦ识别微生物表面保守但不存在于宿主中的病原相关分子模式(pathogen-associated molecular pattern, PAMP),通过下游的信号途径, 调节各种免疫反应基因的表达从而清除病原体(Kerriganet al, 2009)。CLR家族成员拥有一个或多个糖基识别结构域(carbohydraterecognition domains, CRDs), 介导对病原的黏附、摄取和杀灭, 调控免疫反应(Kerriganet al, 2009)。近年来, 鱼类 CLRs基因的研究日益受到重视, 一些同源基因已被克隆和研究(Soaneset al, 2004; Linet al,2009; Aoet al, 2015; Yanget al, 2015; Zhanget al,2015; Chenet al, 2016)。我们采用酵母双杂交和免疫共沉淀方法, 鉴定 PaLECT2能与一种香鱼 CLR(PaCLR)相互作用(Chenet al, 2010); 进一步研究揭示, PaLECT2可通过PaCLR受体介导激活静息状态下的香鱼MO/MΦ (Maet al, 2016)。然而, 病理状态下PaLECT2/PaCLR途径是否发挥作用尚不得而知。
脂多糖(lipopolysaccharide, LPS)是革兰氏阴性细菌细胞壁的主要组成部分, 可作为单核巨噬细胞的一种有效的激活剂(Swainet al, 2008), 本研究拟采用LPS刺激静息态香鱼 MO/MΦ模拟病理状态, 阐明PaCLR是否介导 PaLECT2激活病理状态下的 MO/MΦ, 揭示 LECT2在鱼类炎症反应中的作用机制。
1 材料与方法
1.1 实验材料与试剂
健康香鱼(Plecoglossus altivelis) (40—50g)购自浙江省宁波市宁海县凫溪香鱼养殖基地, 大小均匀,体表无伤。实验进行之前在实验室条件下(水温 20±1ºC, 保证溶氧量适宜及水质清洁无菌)暂养2周。引物由上海英俊生物有限公司合成; 总 RNA抽提试剂RNAiso和 SYBR Premix Ex Taq试剂盒均购自TaKaRa公司; 二抗(辣根过氧化物酶标记山羊抗小鼠IgG)购自碧云天生物技术研究所; Ficoll购自GE公司;LPS (Escherichia coli055: B5)和荧光素FITC购自美国Sigma。细胞培养基RPMI 1640购自上海英俊生物有限公司。胎牛血清(FBS)、硫酸链霉素和青霉素均购自美国Gibco公司。
1.2 rPaLECT2m蛋白和PaCLR抗体制备
rPaLECT2m的制备及纯化方法参照文献(Zhanget al, 2011)。PaCLR抗体(anti-PaCLR)制备方法参照文献(Maet al, 2016)。
1.3 香鱼头肾MO/MΦ的分离与培养
香鱼头肾 MO/MΦ的分离和培养参照文献(Chenet al, 2014b)。简述如下: 香鱼麻醉后尾静脉取血后取头肾。用细胞洗脱培养基I将香鱼头肾用100μm孔径筛网研磨过滤。滤液(1:2)铺在 Ficoll表面,2000r/min水平离心 25min。吸取中间白膜层, 用细胞洗脱培养基I重悬, 2000r/min水平离心8min。沉淀用上述的培养基II洗一次, 1000r/min离心5min。显微镜下血球计数板计数, 最后细胞稀释至 2×107/mL,平铺于 35mm细胞培养皿。24ºC过夜培养后将培养液换成完全培养基, 用于后续实验。
1.4 实时定量 PCR(real-time quantitative PCR,qPCR)检测香鱼MO/MФ细胞因子表达
采用qPCR检测香鱼MO/MФ中TNFα、IL-1β、IL-10和粒细胞集落刺激因子G-CSF的表达变化, 以18S rRNA为内参(Maet al, 2016)。以10μg/mL的LPS处理香鱼MO/MФ 30min之后用PBS洗涤去除, 然后用200μg/mL anti-PaCLR封闭40min, isoIgG作为对照;随后加入rPaLECT2m (2.5μg/mL)孵育3.5h, PBS组为对照, 收集细胞并提取总 RNA 合成 cDNA。TNFα,IL-1β, IL-10和G-CSF的扩增引物见文献(Chenet al,2014b; Maet al, 2016)。qPCR 程序为: 94ºC 180s(预变性); 94ºC 30s, 60ºC 30s, 72ºC 30s(扩增段, 40 个循环); 94ºC 30s, 72ºC 60s, 95ºC 30s(熔解段)。每个样品重复四次, 使用2–ΔΔCT方法计算在不同样品基因的相对表达水平。
1.5 流式细胞术检测香鱼MO/MΦ吞噬作用
香鱼 MO/MΦ吞噬实验参考文献(Maet al,2016)。简述如下: 香鱼 MO/MΦ LPS处理、anti-PaCLR封闭和 PaLECT2m孵育如 1.4。收集对数生长期大肠杆菌DH5α并用异硫氰酸荧光素(FITC)对其进行标记(记作E. coli-FITC)。之后(MOI=10)加入E. coli-FITC处理30min。PBS洗涤3次, 用0.4%台盼蓝使粘附到细胞表面的荧光猝灭。流式细胞仪(Beckman Coulter, Fullerton, CA, USA)对吞噬作用进行检测, 图像分析采用FlowJo软件。相对平均荧光强度(MFI)=处理组MFI /无细菌组MFI, 以PBS组相对MFI为100%。
1.6 平板计数法评估香鱼MO/MΦ杀菌能力
采用平板计数法评估香鱼 MO/MΦ对细菌的吞噬活性。LPS处理香鱼MO/MΦ、anti-PaCLR封闭和PaLECT2m孵育如1.3。将大肠杆菌(MOI=10)添加至香鱼MO/MΦ, 24ºC培养30min。非内化的大肠杆菌用无菌PBS洗涤除去。吞噬组用1% Triton X-100溶液裂解后涂布于 LB琼脂培养基。杀菌组继续培养1.5h, 然后再裂解涂布于 LB琼脂培养基, 平皿置于37ºC培养18h后, 进行菌落计数。细菌存活率=杀菌组/吞噬组×100%表示, 实验重复3次。
1.7 数据分析
数据以平均值±SD表示, 数据显著性分析采用SPSS 13.0软件 one-way ANOVA方法进行分析,P<0.05为显著差异。
2 结果
2.1 抗体封闭PaCLR对rPaLECT2m激活LPS刺激的香鱼MO/MΦ细胞因子表达的影响
与PBS处理组相比, 香鱼MO/MΦ经LPS刺激后, IL-1β、TNFα、IL-10和G-CSF基因mRNA表达上调倍数分别为 12、15、1.9和 5.8, 而 LPS+rPaLECT2m 处理后 IL-1β、TNFα、IL-10和 G-CSF基因 mRNA表达水平分别上调约为 PBS处理组的350、160、12和 38; 用 anti-PaCLR封闭细胞上的PaCLR后, LPS+rPaLECT2m再处理香鱼MO/MΦ, 其IL-1β、TNFα、IL-10和G-CSF基因mRNA表达上调约为PBS处理组的75、31、3.1和9.2(图1)。
2.2 抗体封闭PaCLR对rPaLECT2m激活LPS刺激的香鱼MO/MΦ吞噬能力的影响
与PBS处理组相比, LPS处理和LPS+anti-PaCLR处理对香鱼 MO/MΦ吞噬能力均无显著影响(图2A)。与PBS处理组相比, LPS+rPaLECT2m处理显著增强香鱼 MO/MΦ吞噬E.coli-FITC的能力, 其相对MFI约为PBS处理组增加了88.9%(图2B); 用抗体封闭PaCLR后, LPS+rPaLECT2m再处理香鱼MO/MΦ,吞噬E.coli-FITC的能力相对于PaCLR未封闭组下降了约 35.6%(图 2C, 图 2D)。
2.3 抗体封闭PaCLR对rPaLECT2m激活LPS刺激的香鱼MO/MΦ杀菌能力的影响
实验分为5组, 其中PBS处理组、LPS处理组,LPS+anti-PaCLR处理组, LPS+rPaLECT2处理组和LPS+anti-PaCLR+rPaLECT2m处理组细菌存活率分别为 34.0%±2.9%, 32.9%±1.5%, 36.5%±3.6%,16.5%±2.6%和27.9%±2.9%(图3)。与LPS处理组相比, 抗体封闭PaCLR对LPS刺激的香鱼MO/MΦ杀菌能力无显著性影响; 与 LPS处理组相比, LPS+rPaLECT2m处理显著增强了香鱼MO/MΦ的杀菌能力,然而抗体封闭PaCLR后, rPaLECT2m对LPS刺激的香鱼MO/MΦ杀菌能力的增强效应被显著抑制。
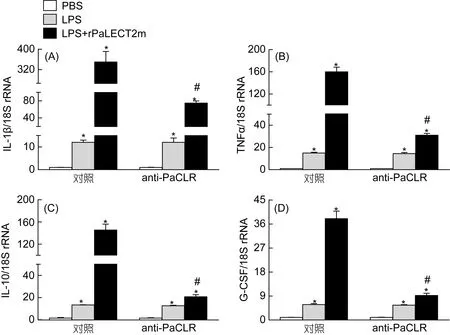
图1 抗体封闭PaCLR对rPaLECT2m激活LPS刺激的香鱼MO/MΦ中IL-1β (A), TNFα (B), IL-10 (C) and G-CSF (D)基因mRNA表达的影响Fig.1 Effect of PaCLR blockage on rPaLECT2m activation of mRNA expression of IL-1β (A), TNFα (B), IL-10 (C) and G-CSF (D)from LPS-stimulated ayu MO/MΦ
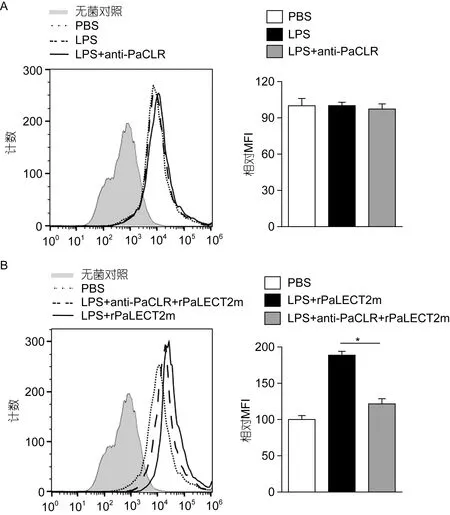
图2 封闭PaCLR对rPaLECT2m激活LPS的香鱼MO/MΦ吞噬功能的影响Fig.2 Effect of PaCLR blockage on rPaLECT2m activation of phagocytosis of LPS-stimulated ayu MO/MΦ
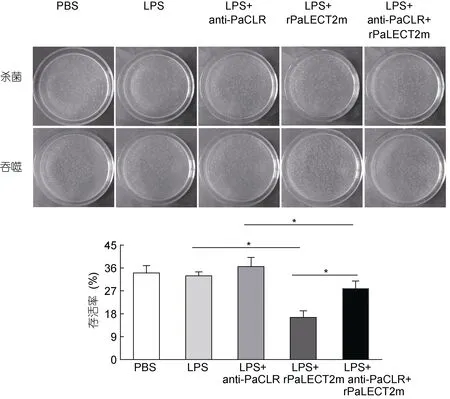
图3 抗体封闭PaCLR对rPaLECT2m激活LPS刺激的香鱼MO/MΦ杀菌能力的影响Fig.3 Effect of PaCLR blockage on rPaLECT2m activation of bacterial killing of LPS-stimulated ayu MO/MΦ
3 讨论
LECT2是一个新近鉴定的多功能细胞因子, 它可作用于鱼类 MO/MΦ, 趋化静息态的 MO/MΦ, 增强其细胞因子表达、吞噬和杀菌能力(Zhanget al,2011; Luet al, 2013b; Maet al, 2016)。PaCLR是PaLECT2在香鱼 MO/MΦ上的受体, 并介导PaLECT2激活静息态MO/MΦ (Chenet al, 2010; Maet al, 2016)。然而, 由于病理条件下MO/MΦ的状态往往与静息态时不同, 因此有必要针对病理状态开展研究。LPS是革兰阴性菌的胞壁主要组成成分, 在革兰氏阴性菌感染的发病机理中起着十分重要的作用(Swainet al, 2008), 前人研究表明, LPS刺激能导致免疫细胞发生形态、功能和胞内基因表达等的变化,合成并释放一系列炎症介质, 参与机体的炎症级联反应, 从而引起感染性休克、器官损伤和系统性炎症反应综合症等(Morriset al, 2015)。本文采用LPS刺激来模拟病理状况, 研究PaCLR是否介导rPaLECT2激活LPS刺激的香鱼MO/MΦ。
小鼠中的研究表明, LECT2处理静息态小鼠MΦ后, C3、G-CSF、IFNγ、IL-10、CXCL-10、IL-1β 和TNFα等基因mRNA表达均上调; 与之相比, LECT2处理LPS刺激的小鼠MΦ后, 上述基因mRNA表达水平进一步增加2—40倍不等(Luet al, 2013a), 揭示小鼠LECT2在病理条件下能激活MΦ中多种重要免疫相关基因的表达。鱼类中研究发现, rPaLECT2m处理上调静息态香鱼MO/MΦ细胞因子IL-1β、TNFα、IL-10和G-CSF基因mRNA的表达, 增强MO/MΦ吞噬和杀菌能力(Zhanget al, 2011; Luet al, 2013b; Maet al, 2016)。本研究中, 我们发现 rPaLECT2m处理LPS刺激的香鱼MO/MΦ后, IL-1β、TNFα、IL-10和G-CSF等基因mRNA表达分别为rPaLECT2m处理的静息态MO/MΦ中的1.60、1.77、1.58和1.38倍, 和小鼠中报道的变化趋势一致, 揭示, rPaLECT2处理可能也不抑制香鱼极早期的炎性反应。
新近研究表明, 哺乳动物中 LECT2的受体有两个, 分别为 CD209a和 c-Met, 其中 CD209a介导LECT2激活在小鼠 MΦ, 增强保护性免疫(Luet al,2013a; Chenet al, 2014a)。鱼类中, PaCLR被鉴定为PaLECT2在香鱼MO/MΦ上的一个受体, 它的结构和小鼠CD209a有一定相似性(Chenet al, 2010), 它能介导 LECT2激活静息态香鱼 MO/MΦ功能(Maet al,2016)。本研究表明, 抗体封闭PaCLR后, rPaLECT2m对LPS处理的香鱼MO/MΦ细胞因子表达、吞噬和杀菌能力增强效应显著受到抑制, 揭示 PaCLR介导PaLECT2对病理条件下的香鱼MO/MΦ功能。
4 结论
综上所述, rPaLECT2m激活 LPS刺激香鱼MO/MΦ细胞因子表达、吞噬和杀菌功能。抗体封闭PaCLR后显著抑制上述作用, 因此, 无论在静息状态还是LPS刺激作用下PaCLR都介导了PaLECT2激活香鱼MO/MΦ功能。
施晓峰, 曲 朦, 王航俊等, 2010. 赤点石斑鱼LECT2基因的克隆与组织表达分析. 厦门大学学报(自然科学版), 49(5):694—700
Ao J Q, Ding Y, Chen Y Yet al, 2015. Molecular characterization and biological effects of a C-type lectin-like receptor in large yellow croaker (Larimichthys crocea). International Journal of Molecular Sciences, 16(12): 29631—29642
Chen C K, Yang C Y, Hua K Tet al, 2014a. Leukocyte cell-derived chemotaxin 2 antagonizes MET receptor activation to suppress hepatocellular carcinoma vascular invasion by protein tyrosine phosphatase 1B recruitment.Hepatology, 59(3): 974—985
Chen J, Chen Q, Lu X Jet al, 2014b. LECT2 improves the outcomes in ayu withVibrio anguillaruminfection via monocytes/macrophages. Fish & Shellfish Immunology,41(2): 586—592
Chen J, Lu X J, Yang H Yet al, 2010. An interaction between a C-type lectin receptor and leukocyte cell-derived chemotaxin 2 of ayu,Plecoglossus altivelis. Fish & Shellfish Immunology, 28(1): 245—248
Chen S X, Ma H L, Shi Y Het al, 2016. Molecular and functional characterization of a novel CD302 gene from ayu(Plecoglossus altivelis). Fish & Shellfish Immunology, 55:140—148
Fujiki K, Shin D H, Nakao Met al, 2000. Molecular cloning of carp (Cyprinus carpio) leucocyte cell-derived chemotaxin 2,glia maturation factor β, CD45 and lysozyme C by use of suppression subtractive hybridisation. Fish & Shellfish Immunology, 10(7): 643—650
Kerrigan A M, Brown G D, 2009. C-type lectins and phagocytosis. Immunobiology, 214(7): 562—575
Kokkinos P A, Kazantzi A, Sfyroera Get al, 2005. Molecular cloning of leukocyte cell-derived chemotaxin 2 in rainbow trout. Fish & Shellfish Immunology, 18(5): 371—380
Lan F, Misu H, Chikamoto Ket al, 2014. LECT2 functions as a hepatokine that links obesity to skeletal muscle insulin resistance. Diabetes, 63(5): 1649—1664
Li M Y, Chen J, Shi Y H, 2008. Molecular cloning of leucocyte cell-derived chemotaxin-2 gene in croceine croaker(Pseudosciaena crocea). Fish & Shellfish Immunology,24(2): 252—256
Lin A F, Xiang L X, Wang Q Let al, 2009. The dc-sign of zebrafish: insights into the existence of a CD209 homologue in a lower vertebrate and its involvement in adaptive immunity. Journal of Immunology, 183(11): 7398—7410
Lin B, Chen S W, Cao Zet al, 2007. Acute phase response in zebrafish uponAeromonas salmonicidaandStaphylococcus aureusinfection: striking similarities and obvious differences with mammals. Molecular Immunology, 44(4):295—301
Lu X J, Chen J, Yu C Het al, 2013a. LECT2 protects mice against bacterial sepsis by activating macrophages via the CD209a receptor. The Journal of Experimental Medicine,210(1): 5—13
Lu X J, Chen Q, Rong Y Jet al, 2016. LECT2 drives haematopoietic stem cell expansion and mobilization via regulating the macrophages and osteolineage cells. Nature Communications, 7: 12719
Lu X J, Hang X Y, Yin Let al, 2013b. Sequencing of the first ayu(Plecoglossus altivelis) macrophage transcriptome and microarray development for investigation the effect of LECT2 on macrophages. Fish & Shellfish Immunology,34(2): 497—504
Ma H L, Shi Y H, Zhang X Het al, 2016. A transmembrane C-type lectin receptor mediates LECT2 effects on head kidney-derived monocytes/macrophages in a teleost,Plecoglossus altivelis. Fish & Shellfish Immunology, 51:70—76
Morris MC, Gilliam EA, Li L, 2015. Innate immune programing by endotoxin and its pathological consequences. Frontiers in Immunology, 5: 680
Saito T, Okumura A, Watanabe Het al, 2004. Increase in hepatic NKT cells in leukocyte cell-derived chemotaxin 2-deficient mice contributes to severe concanavalin a-induced hepatitis.Journal of Immunology, 173(1): 579—585
Soanes K H, Figuereido K, Richards R Cet al, 2004. Sequence and expression of C-type lectin receptors in atlantic salmon(Salmo salar). Immunogenetics, 56(8): 572—584
Swain P, Nayak S K, Nanda P Ket al, 2008. Biological effects of bacterial lipopolysaccharide (endotoxin) in fish: a review.Fish & Shellfish Immunology, 25(3): 191—201
Wei J G, Guo M L, Cui H Cet al, 2011. A new leukocyte cell-derived chemotaxin-2 from marine fish grouper,Epinephelus coioides: molecular cloning and expression analysis. Fish & Shellfish Immunology, 31(4): 600—605
Yamagoe S, Yamakawa Y, Matsuo Yet al, 1996. Purification and primary amino acid sequence of a novel neutrophil chemotactic factor LECT2. Immunology Letters, 52(1):9—13
Yang G J, Lu X J, Chen Qet al, 2015. Molecular characterization and functional analysis of a novel C-type lectin receptor-like gene from a teleost fish,Plecoglossus altivelis. Fish &Shellfish Immunology, 44(2): 603—610
Zhang R C, Chen J, Li C Het al, 2011. Prokaryotic expression,purification, and refolding of leukocyte cell-derived chemotaxin 2 and its effect on gene expression of head kidney-derived macrophages of a teleost fish, ayu(Plecoglossus altivelis). Fish & Shellfish Immunology, 31(6):911—918
Zhang X H, Shi Y H, Chen J, 2015. Molecular characterization of a transmembrane C-type lectin receptor gene from ayu(Plecoglossus altivelis) and its effect on the recognition of different bacteria by monocytes/macrophages. Molecular Immunology, 66(2): 439—450
