允饲植物源复方制剂对草鱼(Ctenopharyngodon idellus)的免疫增强作用研究*
2018-01-04黄锦炉李爱华钱雪桥谭晓晨王正凯
黄锦炉 李爱华 钱雪桥① 谭晓晨 王正凯
(1. 中国科学院水生生物研究所 武汉 430072; 2. 广东海大集团股份有限公司畜牧水产研究中心 广州 511400)
草鱼(Ctenopharyngodon idellus)是我国最重要的淡水养殖品种之一, 2015年养殖产量超过 568万吨,占淡水鱼年产量的20.9%, 位居淡水鱼年产量之首。近年来, 受致病性微生物、养殖环境恶化以及异常气候变化等因素的多重影响, 二龄草鱼幼鱼因免疫力和抗病力下降而导致死亡率升高的现象非常普遍,严重时死亡率可达10%—30%, 常规抗生素药物手段不仅难以达到理想的治疗效果, 由于用药引起的药残和诱发耐药性等公共卫生问题也引起人们担忧。因此, 针对二龄草鱼幼鱼期免疫力和抗病力低下的问题寻找安全有效的防治方案, 已成为草鱼养殖相关行业共同面对且急需解决的技术难点。
天然植物作为免疫增强剂符合发展无公害渔业、生产绿色水产品的需求(秦志华等, 2015; Nianet al,2016)。多种天然植物也被证明对包括草鱼(肖家顺,2010)、鲫鱼(刘华忠等, 2004)、鲤鱼(曹丽萍等, 2008)、花鲈(刘钢, 2005)、罗非鱼(Christybapitaet al, 2007;张照红等, 2011)、牙鲆(李霞等, 2011)等多个养殖鱼种具有良好的免疫增强和促生长作用, 或具有良好的体外抗菌活性(刘健等, 2009)和疾病治疗应用前景(姜德山等, 2003; 汪开毓等, 2012)。然而, 基于农业部第1773公告《饲料原料目录》(农业部畜牧业司, 2012)比较分析, 众多被发现对养殖鱼种具有生物活性的天然植物品种中, 绝大多数因不(完全)符合允饲要求而受到政策性的应用限制, 有关完全符合允饲要求的天然植物的功能与应用研究却鲜见报道。本研究基于前期基础试验, 选择白芍(Radix paeoniaeAlba)、杜仲(Eucommia ulmoides)和知母(Rhizoma anemarrhenae)三种允饲天然植物组成的复方制剂作为研究对象, 通过在草鱼配合饲料添加配伍和剂量差异的复方制剂,以关键非特异性免疫指标群来评估其对草鱼的免疫调节, 从而筛选出对草鱼具有良好免疫增强效果的允饲植物源复方制剂, 旨在为提升二龄草鱼幼鱼免疫力和抗病力探索安全、高效的技术方案。
1 材料与方法
1.1 试验材料
1.1.1 试验仪器与试剂 超净工作台(苏净集团安泰公司); 分光光度计(中国菁华仪器有限公司);HZS-H水浴振荡器(哈尔滨东明医疗仪器厂); 高速冷冻离心机(Sigma公司), 移液枪(Eppendorf)。淋巴细胞分离液(购自天津灏洋生物制品公司); 溶菌酶测定试剂盒、SOD测定试剂盒(购自南京建成生物工程研究所)。MEM 培养基(购自 SIGMA); 四甲基偶氮唑盐MTT(购自 SIGMA)。
1.1.2 试验鱼和攻毒菌株 试验草鱼购自百容良种场, 体重规格100±5g; 攻毒菌株为嗜水气单胞菌, 测试菌株为金黄色葡萄球菌, 均由本实验室保存提供。
1.2 试验方法
1.2.1 允饲植物源复方制剂的配制 参考农业部第 1773公告《饲料原料目录》(农业部畜牧业司, 2012),筛选白芍、杜仲、知母三种允饲植物为组分, 将上述三种允饲植物分别加水浸泡 30min, 第一次水熬35min, 将水提物倒出, 再加水熬 35min, 过滤, 将 2次水提物全并浓缩成1mL (相当于1g允饲植物), 然后与豆粕(CP 43%)混合烘干, 最后将含有水提物的豆粕过80目粉碎机获得单种允饲植物微粉。按不同混合比例将三种允饲植物的超微粉配制成复方制剂A、B、C, 分别按2%、4%的比例添加于相同营养配方中(如表1), 制成粒径为3.0mm的膨化颗粒饲料。
1.2.2 试验分组与管理 从3000尾试验草鱼中随机捞取2100尾, 每组100尾分成21个组, 各试验组投喂的饲料编号见表2。每组试验鱼先进行5—7d的驯养, 确保各组日均投饵率达到 3%时, 即可进行正式试验。正式试验期间, 每天投喂3餐, 日均投饵率为3%。
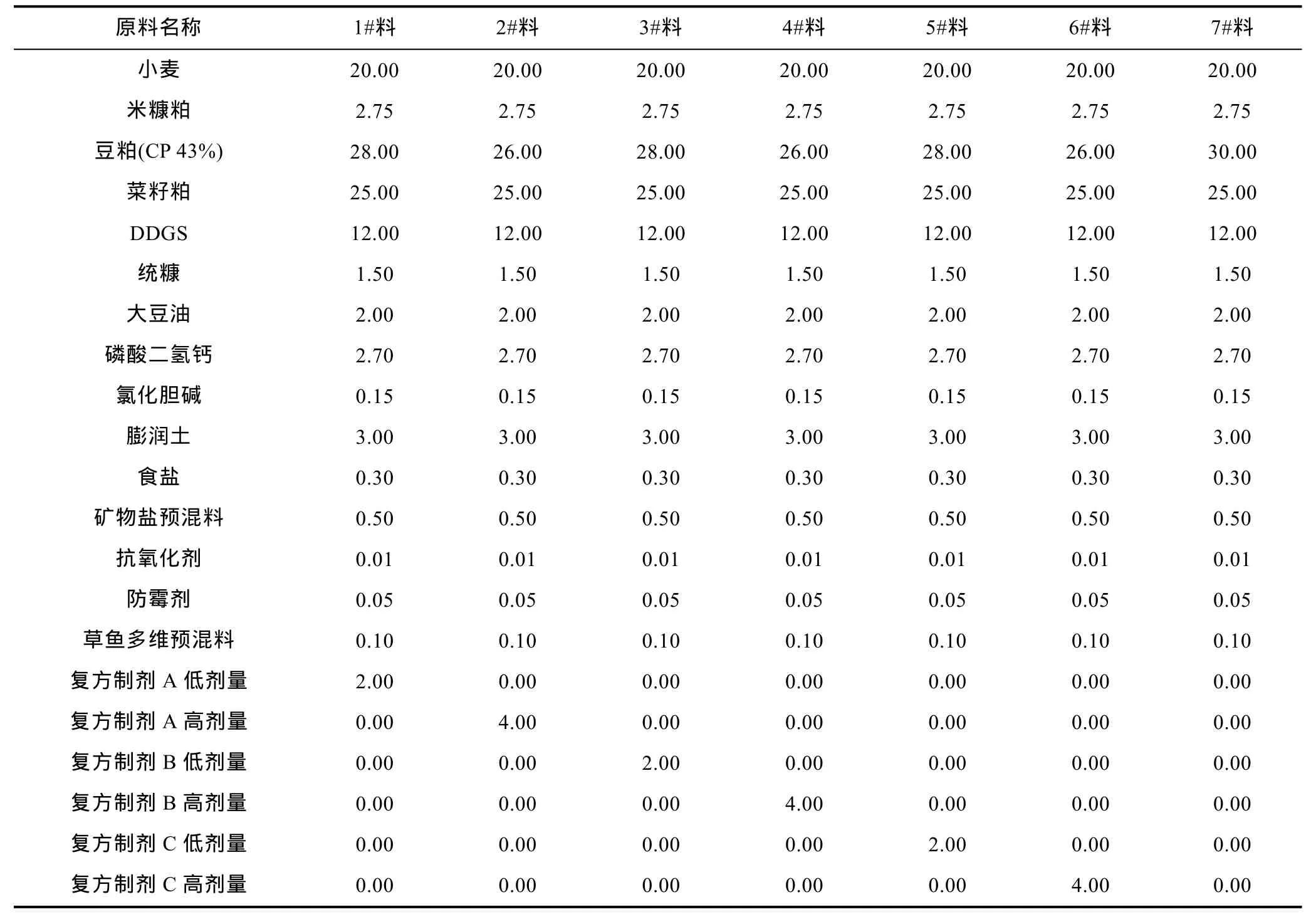
表1 含复方制剂的草鱼配合饲料配方表Tab.1 Feed formulation enriched with herbal compound for C. idellus
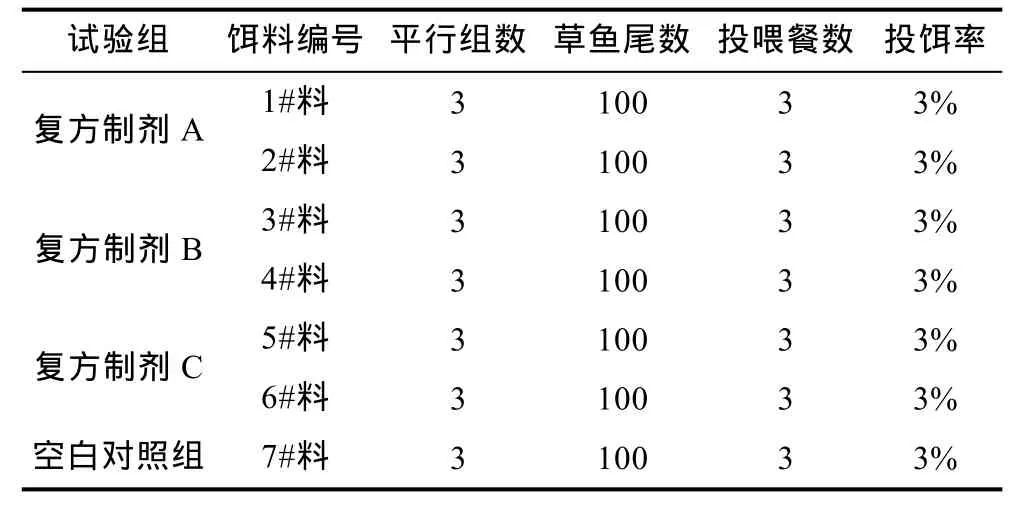
表2 试验鱼分组表Tab.2 The trial groups
1.2.3 血液采集与预处理 在试验第7、14、21、28天时, 用无菌注射器采试验鱼尾静脉血, 所采血液分为两份, 一份为肝素钠抗凝血, 用于白细胞数量、红细胞数量、血红蛋白含量和白细胞吞噬活性的测定;另一份为非抗凝血, 用于血清溶菌酶含量和血清SOD活性的测定。
1.2.4 血液生理指标测定 草鱼血液白细胞数量、红细胞数量分别采用血细胞计数板计数, 草鱼血液血红蛋白含量采用改良沙利氏法检测, 具体操作方法参照《动物生理学实验指导》进行(王国杰, 2008)。
1.2.5 白细胞吞噬活性的测定 参照 Seeley等(1990)方法, 取 100µL制备的白细胞悬液通过 MTT染色法, 测定白细胞金黄色葡萄球菌悬液 520nm处吸光值, 从而判定白细胞吞噬金黄色葡萄球菌能力。
1.2.6 血清溶菌酶、SOD活性的测定 分别采用溶菌酶试剂盒和SOD试剂盒(南京建成生物技术有限公司)测定, 方法参照试剂盒说明书进行。
1.2.7 免疫保护效果评估 在试验第 29天, 用0.04%(V/V)的乙醚对草鱼进行轻度麻醉, 通过腹腔注射的方式对草鱼进行嗜水气单胞菌活菌悬液攻毒,攻毒剂量为 2×LD50/(0.2mL…尾)。在活菌攻毒后连续14天内, 观察记录各试验组草鱼发病死亡情况。最后按以下公式试算各组的相对成活率。

2 结果
2.1 复方制剂对草鱼血液白细胞数量的影响
试验第7天时, 1#料、2#料组草鱼血液白细胞数量分别为 122×108个/L和 119×108个/L, 均极显著的高于 3#料组、4#料组、5#料组、6#料组和对照组的(P<0.01); 试验14天时, 1#料、2#料组草鱼血液白细胞数量分别下降 16.4%和 9.2%, 均极显著高于 3#料组、4#料组、5#料组、6#料组和对照组的(P<0.01);试验第21天时, 1#料、2#料组草鱼血液白细胞数量分别下降28.1%和29.4%, 均显著高于3#料组、4#料组、5#料组、6#料组和对照组的(P<0.05), 而3#料组、4#料组草鱼血液白细胞数量显著低于 5#料组、6#料组和对照组(P<0.05); 试验第28天时, 1#料、2#料组草鱼血液白细胞数量显著高于对照组(P<0.05), 而3#料组、4#料组、5#料组草鱼血液白细胞数量显著低于对照组(P<0.05)。由此说明, 日均投饵率为 3.0%时, 复方制剂A以2%、4%在饲料中添加, 与其他复方制剂相比, 连续投喂7—14天可极显著的促进草鱼血液白细胞的增殖(P<0.01)。如图1。
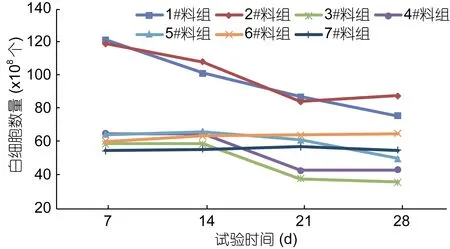
图1 试验期间草鱼血液白细胞数量变化Fig.1 Changes in the number of white blood cells of C. idellus during test
2.2 复方制剂对草鱼血液红细胞数量的影响
试验期间, 对照组草鱼血液红细胞数量在合理范围内变化, 参考范围值为(11.5—16.7)×108个/L。试验第 7天时, 1—6#料组与对照组草鱼血液红细胞数量组间差异不显著(P>0.05); 试验第14天时, 6#料组草鱼血液红细胞数量显著低于对照组(P<0.05), 1—5#料组与对照组草鱼血液红细胞数量组间差异不显著(P>0.05); 试验第21天时, 1#料组草鱼血液红细胞数量显著高于对照组(P<0.05), 3#料组、5#料组草鱼血液红细胞数量极显著低于对照组(P<0.01), 2#、4#料组草鱼红细胞数量与对照组差异不显著(P>0.05)。由此说明, 日均投饵率为3.0%时, 复方制剂A、复方制剂B分别依次以2%、4%在饲料中添加, 与对照组相比,连续投喂 7—14天对草鱼血液红细胞数量影响差异不显著(P>0.05)。如图2。
2.3 复方制剂对草鱼血液血红蛋白含量的影响
试验期间, 对照组草鱼血液血红蛋白在合理范围内变化, 参考范围值为50—52mg/L; 1#料、2#料组草鱼血液血红蛋白含量在各个检测时间点的检测值均极显著高于对照组的(P<0.01)。试验第7、14天时,1#组草鱼血液血红蛋白含量与 3#、4#料组差异不显著(P>0.05)。试验第21时, 3#、4#、5#料组草鱼血液血红蛋白含量显著低于对照组的(P<0.05)。试验时28天时, 3#、4#、5#、6#料组草鱼血液血红蛋白含量与对照组的差异不显著(P>0.05)。由此说明, 日均投饵率为 3.0%时, 复方制剂 A、复方制剂 B分别依次以2%、4%在饲料中添加, 与对照组相比, 连续投喂 7—14天对草鱼血液血红蛋白生成与运输的无异常抑制。如图3。
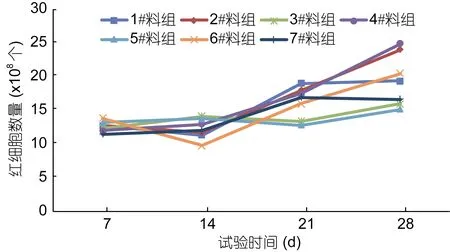
图2 试验期间草鱼血液红细胞数量的变化Fig.2 Changes in the number of red blood cells of C. idellus during test

图3 试验期间草鱼血红蛋白含量的变化Fig.3 Changes in the hemoglobin content of C. idellus during test
2.4 复方制剂对草鱼白细胞吞噬活性的影响
试验期间, 对照组草鱼血液白细胞吞噬指数维持在0.342—0.356, 1#、2#料组草鱼血液白细胞吞噬指数呈现升高后缓慢下降的变化趋势, 但在各个时间节点的检测值均极显著高于4#、5#、6#料组和对照组(P<0.01)。试验第 7、14时。4#、5#、6#料组草鱼血液白细胞吞噬指数均显著高于对照组(P<0.05)。试验第28天时, 4#、5#、6#料组草鱼血液白细胞吞噬指数与对照组差异不显著(P>0.05)。由此说明, 日均投饵率为3.0%时, 复方制剂A、复方制剂C分别依次以2%、4%在饲料中添加, 与对照组相比, 连续投喂7—14天对草鱼血液白细胞吞噬活性具有显著(P<0.05)或极显著(P<0.01)的增强作用。如图4。
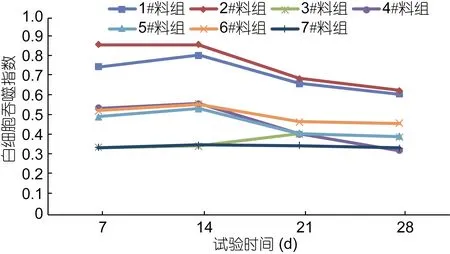
图4 试验期间草鱼白细胞吞噬指数的变化Fig.4 Changes in the phagocytic index of white blood cell of C.idellus during test
2.5 复方制剂对草鱼血清溶菌酶活性的影响
试验期间, 对照组草鱼血清溶菌酶活性数维持在25.23—25.89U/L, 1—6#料组草鱼血清溶菌酶活性均出现不同程度的升高, 尤其以1#、2#料组草鱼溶菌酶活性升高幅度最明显, 其峰值为第 14天时的47.32U/L和43.25 U/L, 且均极显著高于同期其他试验组的(P<0.01)。试验第 21、28天时, 与 1#、2#料组草鱼血清溶菌酶活性变化规律不同的是, 3—6#料组草鱼血清溶菌酶活性出现不同程度的下降。由此说明,日均投饵率为3.0%时, 复方制剂A、复方制剂B(0.2%添加量)、复方制剂 C分别依次以2%、4%在饲料中添加, 与对照组相比, 连续投喂 7—14天可显著(P<0.05)或极显著(P<0.01)的增强草鱼血清溶菌酶活性。如图5。

图5 试验期间草鱼血清溶菌酶活性的变化Fig.5 Changes of serum lysozyme activity of C. idellus during test
2.6 复方制剂对草鱼血清SOD含量的影响
试验期间, 对照组草鱼血清 SOD活性数维持在92.4—93.0U/L, 1—6#料组草鱼血清SOD活性均出现不同程度的升高, 1—6#料组草鱼血清SOD活性的变化趋势呈现明显的先升后降特点。试验第 14天时,1#、2#料组草鱼血液溶菌酶活性升高幅度最明显, 其峰值为第14天时的148.7U/L和143.7U/L, 且均极显著高于同期其他试验组的(P<0.01)。试验第 28天时,3#、6#料组草鱼血清SOD活性与4#、5#料组的差异不显著(P>0.05), 与对照组的差异也不显著(P>0.05)。由此说明, 日均投饵率为3.0%时, 复方制剂A、复方制剂B、复方制剂C分别依次以2%、4%在饲料中添加, 与对照组相比, 连续投喂 7—14天对草鱼血清SOD 活性具有显著(P<0.05)或极显著(P<0.01)的增强作用。如图6。

图6 复方制剂对草鱼血清SOD活性的影响Fig.6 Changes of serum SOD activity of C. idellus during test
2.7 复方制剂对草鱼的免疫保护效果
经测定, 用于本次攻毒的嗜水气单胞菌, 在25℃恒温水温条件下, 24h对相似体重规格草鱼的LD50为4.3×106cfu/ml。试验第 29天时, 按每尾草鱼注射0.2ml含8.6×106cfu/ml嗜水气单胞菌活菌悬液, 注射后连续14天记录结果显示, 1#料组和2#料组草鱼的存活率分别达到49%、55%, 4#料和6#料组草鱼的存活率分别为 28%和 19%。对照组草鱼存活率仅为4%(如图7)。由此说明, 日均投饵率为3.0%时, 复方制剂A以2%、4%在饲料中添加, 连续投喂28天, 与对照组和复方制剂B、复方制剂C相比, 可明显提高草鱼抗嗜水气单胞菌的感染能力。
3 讨论
3.1 允饲植物源复方制剂具有良好应用开发前景
草鱼是我国最重要的淡水养殖品种之一, 多种天然植物对其具有良好的免疫调节、生长和消化调节作用(姜德山等, 2003; 祖国掌等, 2008; 肖家顺, 2010;吴春艳等, 2015), 这对筛选符合预期功能的天然植物理论研究提供宝贵的方法和方向借鉴。以农业部公告1773号《饲料原料目录》规定的 115种允饲天然植物名录为基准, 不难发现多数被证实具有生物活性的天然植物并不完全符合允饲要求, 同时以允饲天然植物作为新型功能型饲料原料进行应用开发则具有广阔的前景。白芍含有活性萜苷类, 具有平肝止痛、养血调经、敛阴止汗之功效, 具有补血功效(国家药典委员会, 2010; Jinet al, 2016), 杜仲含有100多种活性成分, 能直接刺激网状内皮系统、增强吞噬细胞的活性, 清除体内有害自由基, 并对抗糖皮质激素类化合物氢化可的松的免疫抑制作用, 从而调节细胞免疫功能, 具有助阳功效(徐诗伦, 1985; Liuet al,2016), 知母具有清热泻火、生津润燥等功效(杨丽蓉,2002)。本研究选用白芍、杜仲、知母作为草鱼免疫增强剂组分的开发对象, 完全符合《饲料原料目录》允饲要求, 其中以杜仲为主方的复方制剂 A连续使用7—14天, 对包括草鱼白细胞吞噬活性、溶菌酶活性和 SOD活性等非特异性指标的作用显著增强(P<0.05), 这说明复方制剂A既符合草鱼的健康养殖要求, 也契合作为允饲天然植物源免疫增强型饲料添加剂进行应用转化的商业价值前景。
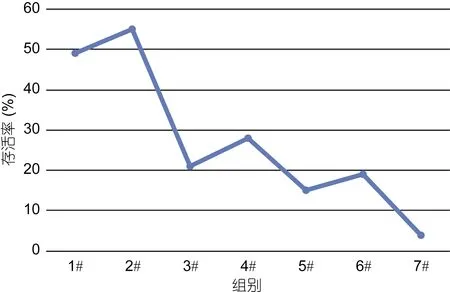
图7 复方制剂对草鱼免疫保护效果Fig.7 Effect of immune protection with herbal compound on C. idellus
3.2 允饲植物源复方制剂对重要免疫指标的影响分析
白细胞数量与机体非特异性免疫机能的高低密切相关(刘蕾, 2014)。当病原菌侵入机体后, 白细胞从血管内游出, 向炎症区域集中, 对病原菌等异物进行杀灭、吞噬, 而当机体的抵抗力变低, 感染严重时,白细胞数量会减少, 当血管受损严重时, 大量红细胞也会外渗, 细胞数量减少(Collet, 2014)。本研究结果表明, 复方制剂A以2%、4%在饲料中添加, 按日均投饵率为 3.0%, 试验期间草鱼血液白细胞数量出现先升高后缓降的趋势, 但白细胞数量仍极显著高于复方制剂 B、复方制剂 C和对照组(P<0.01), 而随着投喂时间分别延长至21天、28天, 复方制剂B两个添加剂量对应投喂组草鱼血液白细胞数量显著低于对照组的(P<0.05)。红细胞是一种血细胞, 含有血红蛋白, 具有携带和运输氧、免疫黏附作用, 而血红蛋白是鱼体血液中负责运载氧的一种蛋白质, 红细胞数量和血红蛋白含量常用于评判机体是否贫血的指标群。本研究结果显示, 复方制剂A两个添加剂量均对草鱼血液红细胞数量和血红蛋白含量均无异常抑制作用, 而复方制剂B(2%)、复方制剂C(4%)则可引起草鱼血液红细胞数量异常下降。SOD分布于细胞质和线粒体中, 具有促使超氧自由基分解的功能。正常健康机体内自由基的形成和清除处于一种动态平衡中, 即产生超氧自由基的能力和 SOD清除超氧自由基的能力应该平衡, 一旦这种动态平衡遭到破坏,使得超氧自由基在体内积累过多或过少, 机体就会患病或衰老(龚珊等, 2001; 王高学等, 2006)。因此,SOD活性是评估机体非特异性免疫水平的常用指标(王庆奎等, 2011; 张明明等, 2011)。本研究结果表明,复方制剂A以2%、4%在饲料中添加, 按日均投饵率为3.0%, 试验期间草鱼血清SOD活性显著高于复方制剂B、复方制剂C和对照组(P<0.05)。鱼类血清溶菌酶是一种重要的非特异性防御因子, 溶菌酶活性是决定吞噬细胞对所吞噬的致病菌能否被杀灭的物质基础之一, 可以因机体接触抗原性物质或者免疫刺激剂而上升(王国杰, 2008)。血浆中溶菌酶活性变化与循环系统中白细胞数目变化相一致, 白细胞数目多, 溶菌酶活性就增加, 二者呈正相关(Muonaet al, 1992)。本研究结果表明, 复方制剂A以2%、4%在饲料中添加, 按日均投饵率为 3.0%, 试验期间草鱼血清溶菌酶活性显著高于复方制剂B、复方制剂C和对照组(P<0.05)。综上所述, 复方制剂 A对草鱼的免疫增强效果优于复方制剂B、复方制剂C和对照组。
3.3 允饲植物源复方制剂的作用机理分析
本研究结合杜仲、白芍和知母天然活性, 创新性的将三种允饲天然植物以免疫增强功能为预期进行科学配伍, 制备复方微粉并添加于草鱼商品饲料中连续投喂, 其中以杜仲为主要组分的复方制剂 A对草鱼的非特异性免疫机能具有显著的增强作用, 其对提升草鱼抵抗嗜水气单胞菌感染的保护效果最明显, 其中以复方制剂A按4%比例添加饲料连续投喂28天对草鱼的保护率高达55%。由此可见, 复方制剂A作用机理上, 符合“通过增强鱼体免疫机能而提升鱼体抗感染作用”的特征。这与其他非允饲天然植物(如板蓝根、大黄、黄岑等)的免疫调节机理相似(罗庆华等, 2007; 田海军, 2010)。
4 结论
综上所述, 本试验发现, 以杜仲、白芍和知母三种允饲天然植物为组分组成的复方制剂, 对草鱼均具有不同程度的非特异性免疫增强效果。其中复方制剂A以2%和4%剂量添加于饲料中连续投喂7天、14天, 其对草鱼的非特异性免疫增强作用和免疫保护作用优于复方制剂B、C和对照组。
王庆奎, 赵海运, 吕志敏等, 2011. 口服当归多糖对点带石斑鱼非特异性免疫力的影响. 安徽农业科学, 39(22):13857—13860
王国杰, 2008. 动物生理学实验指导. 第4版. 北京: 中国农业出版社, 6
王高学, 白 冰, 崔 婧等, 2006. 灰树花多糖对鲫鱼免疫功能的影响. 水产科学, 25(1): 9—12
田海军, 2010. 复方中草药添加剂对草鱼免疫功能的影响. 贵州农业科学, 38(8): 158—159, 163
刘 钢, 2005. 复方中草药添加剂对花鲈(Lateolabrax japonicus)幼鱼生长、消化吸收和机体生化组成影响的研究. 大连: 大连水产学院硕士学位论文, 1—63
刘 健, 王海雁, 赵淑江, 2009. 牛津杯法测定五倍子对大黄鱼病原弧菌的体外抑菌活力. 海洋科学, 33(11): 44—47
刘 蕾, 2014. 五倍子对鳙鱼消化机能及免疫机能的影响. 吉林: 吉林农业大学硕士学位论文, 1—157
刘华忠, 罗 萍, 刘定忠, 2004. 复方中草药对彭泽鲫促生长作用的研究. 水利渔业, 24(1): 56—57
农业部畜牧业司, 2012. [2012-06-01]. 饲料原料目录.http://www.moa.gov.cn/zwllm/zcfg/nybgz/201206/t20120614_2758749.htm
李 霞, 马驰原, 李雅娟等, 2011. 中草药对牙鲆免疫力的影响. 东北农业大学学报, 42(3): 60—67
杨丽蓉, 2002. 知母的化学成分及药理作用研究进展. 国外医学中医中药分册, 24(4): 207—210
肖家顺, 2010. 大蒜素/陈皮复方制剂对草鱼生长及免疫性能的影响. 福州: 福建农林大学, 1—54
吴春艳, 汪开毓, 任思宇等, 2015. 垂盆草(Sedum sarmentosum)水提物对草鱼(Ctenopharyngodon idellus)脂肪性肝损伤治疗效果研究. 海洋与湖沼, 46(4): 901—908
汪开毓, 姚 璐, 谢嘉宾等, 2012. 独活活性单体对中型指环虫的杀灭作用及其成分鉴定. 水生生物学报, 36(1):93—101
张明明, 文 华, 蒋 明等, 2011. 饲料菜粕水平对吉富罗非鱼幼鱼生长、肝脏组织结构和部分非特异性免疫指标的影响. 水产学报, 35(5): 748—755
张照红, 林 旋, 张伟妮等, 2011. 复方中草药对奥尼罗非鱼血液非特异性免疫功能的影响. 水产科学, 30(1): 1—5
国家药典委员会, 2010. 中华人民共和国药典(一部). 北京:中国医药科技出版社, 96—97
罗庆华, 贺建华, 刘清波等, 2007. 杜仲大蒜复方添加剂对草鱼免疫力的影响. 安徽农业科学, 35(28): 8910—8911,8932
姜德山, 李丙文, 2003. 中草药治疗草鱼出血病. 中兽医学杂志, (1): 23
祖国掌, 李槿年, 张传亮等, 2008. 中草药复方对草鱼鱼种肠道菌群与血液有形成分的影响. 中国微生态学杂志, 20(1):4—6
秦志华, 董文宾, 姜令绪等, 2015. 紫锥菊提取物对大菱鲆(Scophthalmus maximus)的非特异性免疫功能的影响. 海洋与湖沼, 46(3): 665—669
徐诗伦, 1985. 杜仲的细胞免疫作用研究. 中草药, 16(9):15—17
曹丽萍, 丁炜东, 张 柳等, 2008. 香菇多糖和黄芪多糖对鲤免疫细胞的活性和IL-1β体外诱生表达的影响. 水产学报,32(4): 628—635
龚 珊, 蒋星红, 周晓鸥等, 2001. 超氧化物歧化酶(SOD)对免疫功能的抑制. 中国血液流变学杂志, 11(4): 262—264,269
Christybapita D, Divyagnaneswari M, Michael R D, 2007. Oral administration ofEclipta albaleaf aqueous extract enhances the non-specific immune responses and disease resistance ofOreochromis mossambicus. Fish & Shellfish Immunology,23(4): 840—852
Collet B, 2014. Innate immune responses of salmonid fish to viral infections. Developmental & Comparative Immunology,43(2): 160—173
Jin Z L, Gao N N, Xu W Zet al, 2016. Receptor and transporter binding and activity profiles of albiflorin extracted fromRadix paeoniaeAlba. Scientific Reports, 6: 33793
Liu B, Li C P, Wang W Qet al, 2016. Lignans extracted fromEucommia ulmoidesOliv. Protects against AGEs-induced retinal endothelial cell injury. Cell Physiol Biochem, 39(5):2044—2054
Muona M, Soivio A, 1992. Changes in plasma lysozyme and blood leucocyte levels of hatchery-reared Atlantic salmon(SalmosalarL.) and sea trout (Salmo truttaL.) during parr-smolt transformation. Aquaculture, 106(1): 75—87
Nian S H, Liu E H, Fan Y,et al, 2016. Orthogonal separation protocol for the simultaneous preparation of four medically active compounds from Anemarrhenae Rhizoma by sequential polyamide and macroporous resin adsorbent chromatography. Journal of Separation Science, 39(16):3195—3204
Seeley K R, Gillespie P D, Weeks B A, 1990. A simple technique for the rapid spectrophotometric determination of phagocytosis by fish macrophages. Marine Environmental Research, 30(1): 37—41
