低氮低热量肠外营养与肠内营养支持对胃癌患者免疫功能与炎性因子的影响①
2018-01-04朱国兵
朱国兵,潘 毅,罗 东
(隆昌县人民医院消化内科,四川 隆昌 642150)
低氮低热量肠外营养与肠内营养支持对胃癌患者免疫功能与炎性因子的影响①
朱国兵,潘 毅,罗 东
(隆昌县人民医院消化内科,四川 隆昌 642150)
目的:探讨低氮低热量肠外营养与肠内营养支持对胃癌患者免疫功能与炎性因子的影响。方法:选择2014-10~2016-10于我院行胃癌手术治疗的68例患者作为研究对象,以随机数字表将其均分为两组,即研究组与对照组各34例。对照组应用全胃肠外营养干预,研究组则给予低氮低热量肠外营养与肠内营养支持。结果:研究组术后免疫球蛋白指标IgM、IgA、IgG均高于对照组与术前(P<0.05);研究组炎性反应因子CRP低于对照组与术前(P<0.05),TNF-α、IL-2高于对照组(P<0.05)。结论:低氮低热量肠外营养与肠内营养支持在胃癌患者中具有显著的应用效果,可以有效提高患者的机体免疫力,抑制炎症反应,适于临床推广。
低氮低热量;肠外营养;肠内营养;胃癌;免疫功能;炎性因子
胃癌属于临床常见的恶性肿瘤之一,现主要采取手术治疗。然而,无论任何手术均具有一定的创伤性,刺激机体产生一系列的应激反应,主要表现为免疫反应与炎症反应,继而加重了患者的营养消耗情况。众所周知,营养支持是保证手术患者术后恢复效果的关键[1]。因此,探寻一种有效的营养支持方式强化胃癌患者的免疫功能,降低炎性因子表达十分必要。2014-10~2016-10我院对34例胃癌手术患者应用了低氮低热量肠外营养与肠内营养支持,收效满意,现报道如下。
1 资料与方法
1.1 一般资料
选择2014-10~2016-10于我院行胃癌手术治疗的68例患者作为研究对象,以随机数字表将其均分为两组,即研究组与对照组各34例。入组标准:所有患者均经组织病理检查证实;术前2个月内未应用了糖皮质激素与免疫抑制剂;未应用输血治疗;患者对本次研究内容知情,已签署同意书。排除标准:癌细胞已发生转移;合并严重脏器功能障碍;术前放化疗治疗;合并全身感染或免疫功能缺陷;药物过敏史;水电解质及酸碱失衡。对照组:男38例,女30例;年龄42~74岁,平均(63.5±4.5)岁;体重44~70kg,平均(62.5±5.8)kg。研究组:男37例,女31例;年龄42~74岁,平均(63.6±4.3)岁;体重44~70kg,平均(62.3±5.7)kg。两组在性别、年龄、体重对比中,差异无统计学意义(P>0.05)。
1.2 方法
两组患者术后2d进行静脉营养支持,营养液均由配制中心配制,3L/袋;采用外周中心静脉置管输入肠外营养液,成份包括:葡萄糖、多种微量元素、电解质、水溶性与脂溶性维生素、复方氨基酸等。对照组实施全胃肠外营养支持,静脉营养液热量为30~35kcal/kg·d,其中包括非蛋白热量28~32/kg·d,氮量0.19~0.21g/kg·d。研究组则应用低氮低热量肠外营养与肠内营养支持,静脉营养热量为20kcal/kg·d,其中包括非蛋白热量16~20kcal/kg·d,氮量0.09~0.11g/kg·d。
1.3 观察指标
观察对比两组术前与术后7d的免疫球蛋白因子、炎性反应因子的变化。⑴免疫球蛋白因子包括免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM);⑵炎性反应因子包括肿瘤坏死因子-α(TNF-α)、白细胞介素(IL-2)、C反应蛋白(CRP)。
1.4 统计学方法
2 结果
2.1 两组术前与术后7d的免疫球蛋白因子变化
两组术前免疫球蛋白因子IgA、IgG、 IgM指标对比无统计学意义(P>0.05);研究组术后7d时免疫球蛋白因子IgA、IgG、 IgM指标均高于对照组与术前(P<0.05)。见表1。
2.2 两组术前与术后7d的炎性反应因子的变化
两组术前炎性反应因子CRP、IL-2、TNF-α对比差异无统计学意义(P>0.05);研究组术后7d时炎性反应因子CRP低于对照组与术前(P<0.05),IL-2、TNF-α高于对照组与术前(P<0.05)。见表2。
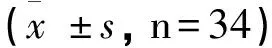
表1 两组术前与术后7d的免疫球蛋白因子变化
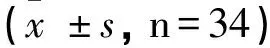
表2 两组术前与术后7d的炎性反应因子的变化
3 讨论
胃癌属于消化系统常见肿瘤之一,其病因主要与幽门螺杆菌感染、饮食生活因素、环境因素、癌前病变及遗传因子相关。目前,外科手术是治疗胃癌的首选措施。多项研究指出,多数胃癌患者面临着营养缺失的问题,加之手术带来的创伤,易在术后出现营养不良及免疫功能异常等情况,对疾病预后带来了严重的影响[2,3]。营养支持是保证胃癌患者术后康复质量的关键,术后科学、合理的营养支持可以有效调节患者的免疫功能,改善炎症因子表达。反之,营养支持不规范且不合理时可以增加患者的机体应激反应,不利于康复[4]。
肠内营养是促使肠蠕动与胃肠激素正常分泌的重要干预方法,且能够调控肠黏膜屏障作用,保证肠黏膜的完整性,抑制肠道菌群移位,继而降低感染概率。然而,由于胃癌手术患者机体功能虚弱,对肠内营养操作的耐受力较差,极易出现腹泻、腹痛及腹胀等情况,限制了肠内营养干预的实施。虽然传统全胃肠外营养亦能够帮助患者补充营养,但研究发现,多数胃癌患者对营养输入的调控能力较差,易诱发感染,加重应激反应[5]。因此,探寻一种规范、科学、的营养支持来强化胃癌术后的营养支持实施效果十分必要。
低氮低热量肠外营养与肠内营养支持均有效的营养支持方案,相较于传统标准热量营养,可以有效降低葡萄糖负荷,纠正术后高血糖所致的高分解代谢,改善脏器代谢异常,继而缓解手术对免疫功能及炎性因子的影响[6]。有学者指出,低氮低热量肠外营养能够在平衡负氮的同时补充足够的热量降低感染与代谢类并发症的概率,提高机体免疫功能[7]。本文研究结果与上述结果基本相符,研究组术后7d时免疫球蛋白因子IgA、IgG、 IgM指标均高于对照组与术前(P<0.05)。可见,低氮低热量肠外营养与肠内营养支持可以强化胃癌患者的免疫功能,为预后奠定了良好的基础。此外, CRP、IL-2、TNF-α是临床常见的炎性因子,其指标可以有效提示机体的炎性水平。IL-2是免疫应答调控因子,CRP是组织损伤及微生物入侵机体等炎症刺激下所产生的肝细胞合成相蛋白,TNF-α则具有抗肿瘤作用[8]。本文研究结果显示,研究组术后7d时炎性反应因子CRP低于对照组与术前(P<0.05),IL-2、TNF-α高于对照组与术前,对比差异具有统计学意义(P<0.05)。可见,低氮低热量肠外营养与肠内营养支持能够抑制机体炎症因子表达,纠正局部炎症反应,强化预后效果,这与部分结果相符[9,10]
总之,低氮低热量肠外营养与肠内营养支持在胃癌患者中具有显著的应用效果,可以有效提高患者的机体免疫力,抑制炎症反应,适于临床推广。
[1]龙晓静,孙德强,曾英,等.食管癌术后早期肠内营养联合肠外营养与全肠外营养支持的临床疗效比较[J].中国医药导报,2016,16(5):126-129
[2]戴华佳,侯克柱,蔡祖金,等.免疫营养支持对胃癌围手术期患者免疫功能及炎性因子的影响[J].海南医学院学报,2016,32(9):849-852
[3]钟武装,肖丽萍,蔡敏捷.早期肠内营养对老年胃癌患者术后免疫功能的影响[J].中国老年学杂志,2013,22(2):280-282
[4]郑国良,郑志超,赵岩,等.强化谷氨酰胺的低氮低热量肠外营养支持在存在营养风险的胃癌术后应激期的临床应用[J].现代生物医学进展,2013,14(13):2479-2484,2492
[5]刘维群,韩晓红,何泽生,等.老年胃癌患者术后低氮低热量肠外营养联合肠内营养的应用研究[J].浙江中西医结合杂志,2013,18(6):436-439
[6]康凯,舒晓亮,姬舒荣,等.低氮低热量肠外营养对腹部手术病人疗效及预后影响的Meta分析[J].肠外与肠内营养,2013,24(6):332-337
[7]应晶晶,戴宁.低热量肠内营养联合肠外营养对消化道肿瘤术后的临床疗效分析[J].中国医药导报,2013,30(31):37-40
[8]王斌,杨玉波,陈佳祺.低氮低热量肠外营养在消化道恶性肿瘤术后的应用研究[J].实用医学杂志,2014,24(19):3131-3133
[9]刘彩虹,丁胜福.低氮低热量肠外营养支持在危重患者的临床应用[J].医学综述,2015,18(10):1804-1806
[10]赵建军,毕新宇,黄振,等.不同营养支持治疗方式对肝癌术后恢复的前瞻性对照研究[J].医学研究杂志,2014,20(4):75-79
Effectsoflownitrogenheatparenteralnutritionandenteralnutritionsupporttoimmunefunctionandinflammatoryfactorsinpatientswithgastriccancer
ZHUGuo-bing,PANYi,LUODong
(The People’s Hospital of Sichuan Longchang County,Longchang 642150, China)
ObjectiveTo study the effects of low nitrogen heat parenteral nutrition and enteral nutrition support to immune function and inflammatory factors in patients with gastric cancer.Methods68 patients with gastric cancer treated in our hospital from October 2014 to October 2016 were randomly divided into two groups: experimental group (34 cases) and control group (34 cases). Total parenteral nutrition intervention was applied to control group, and low nitrogen heat parenteral nutrition and enteral nutrition support were administrated to experimental group.ResultsImmunoglobulin IgM, IgA and IgG in experimental group were higher than control group before and after treatment (P<0.05); the level of inflammatorycytokines CRP in experimental group was lower than control group before and after treatment (P<0.05), while TNF-α and IL-2 were higher than control group (P<0.05).ConclusionLow nitrogen heat parenteral nutrition and enteral nutrition support in patients with gastric cancer had obvious application effect, can effectively improve patient's immunity, restrict inflammation, and is suitable for clinical promotion.
low nitrogen low quantity of heat;parenteral nutrition;enteral nutrition;gastric cancer;immune function;inflammatory cytokines
朱国兵(1974~)男,四川隆昌人,学士,副主任医师。
R735.2
B
1008-0104(2017)06-0099-02
2017-07-02)
