“赤霞珠”葡萄营养系果实中黄酮类物质变化研究
2018-01-03刘政海董志刚李晓梅唐晓萍李六林
刘政海, 董志刚, 李晓梅, 谭 伟, 谭 敏, 唐晓萍*, 李六林*
1.山西农业大学园艺学院, 山西 太谷 030801; 2.山西省农业科学院果树研究所, 山西 太谷030800
“赤霞珠”葡萄营养系果实中黄酮类物质变化研究
刘政海1, 董志刚2, 李晓梅2, 谭 伟2, 谭 敏2, 唐晓萍2*, 李六林1*
1.山西农业大学园艺学院, 山西 太谷 030801; 2.山西省农业科学院果树研究所, 山西 太谷030800
黄酮类物质是葡萄与葡萄酒中重要的生理活性物质,对葡萄酒的感官品质起决定作用。以酿酒葡萄“赤霞珠”(Cabernet Sauvignon, CS)5个营养系为试验材料,分析黄酮类物质的含量差异,为提高黄土高原产区葡萄酒品质提供材料。结果表明:在转色后80 d时“赤霞珠”葡萄营养系可溶性固性物和可滴定酸含量差异不显著,而CS191平均单粒重显著高于其他4个营养系。CS191在转色后80 d时,果皮和种子中总类黄酮、原花色素含量显著高于其他营养系。在转色后80 d时,营养系间果皮中黄烷醇含量差异不显著,但此时期CS170果皮中黄烷醇含量显著高于其他4个营养系。CS191在完熟时果实中总类黄酮和原花色素含量高于其他营养系,CS170果皮中黄烷醇和花色苷含量较其他营养系含量高,均可作为黄土高原地区栽培的高黄酮物质含量的“赤霞珠”品系。
“赤霞珠”葡萄;营养系;果皮;种子;黄酮
葡萄酒的质量首先取决于葡萄原料,优良的酿酒品种对提高葡萄酒品质、酿造特色葡萄酒有关键作用。酿酒品种“赤霞珠”(Cabernet Sauvignon)是世界上公认的优良酿酒品种,与“蛇龙珠”、“品丽珠”为姐妹系[1]。葡萄果实中含有大量酚类活性物质,特别是黄酮多酚[2]。黄酮化合物主要包括总类黄酮、黄烷醇、原花色素、花色苷等,主要存在于葡萄果皮和葡萄籽中[3],通过酿酒的浸渍和酒精发酵过程进入酒体,对红葡萄酒的色泽、口感、香气、抗氧化、抗菌有重要作用[4]。果实中黄酮物质含量主要受葡萄品种、栽培环境和酿造工艺的影响,其中葡萄品种是决定因素[5]。营养系选种是基于品种内基因型发生微小变异而进行的育种,其中酿酒葡萄营养系选种已在国内外都取得了重大成果[6~8]。例如德国通过对“雷司令”不同营养系选择对比,选育出产量提高了36%的品系[9];张宗勤[10]对欧洲葡萄“无核白”10个营养系的性状研究表明,“无核白”W3营养系成熟果实果皮中白藜芦醇含量是“无核白”的4.86倍;唐美玲等[11]对烟台地区不同“蛇龙珠”营养系果实品质分析发现,不同营养系在果穗重、可溶性固形物含量、酸度、VC含量及主要香气物质等方面有明显差异。目前对酿酒葡萄营养系酚类物质含量差异的研究报道已经非常普遍,但对转色后不同时期果实中果皮和种子中黄酮类物质含量变化差异的研究尚未有报道。已有研究表明“赤霞珠”各品系在果实性状及酿酒品质存在差异[12,13]。本研究以“赤霞珠”5个营养系转色后果实为试验材料,研究了不同营养系在转色后不同时期果皮和种子中总类黄酮、黄烷醇、原花色素、花色苷含量的变化,以期初步明确不同营养系在不同着色期黄酮类物质代谢的差异,为选育高黄酮类物质含量的“赤霞珠”品系提供理论依据,并为在黄土高原栽培“赤霞珠”品系提供材料依据。
1 材料与方法
1.1 材料
1.1.1试验材料 田间试验开始于2016年7月,取样地点为山西农业科学院果树研究所,试验材料为“赤霞珠”葡萄5个营养系,分别为:赤霞珠169(CS169)、赤霞珠170(CS170)、赤霞珠191(CS191)、赤霞珠338(CS338)、赤霞珠685(CS685),于2011年栽培建园,架势为倾斜式单龙蔓“厂字形”立架栽培,行距为0.8 m×2.5 m。
1.1.2试验仪器 双光束紫外分光光度计(UV1902型,上海奥析科学仪器有限公司);数显双列六孔水浴锅(HH-6型,上海皖宁公司)。
1.2 试验方法
1.2.1果实单粒重、可溶性固形物和可滴定酸含量的测定 采样方法依据对角线法则[14],各营养系选取9棵葡萄树,每棵树在阴阳面各选一穗果,分别在转色后20 d、40 d、60 d、80 d(达到生产成熟)在每穗葡萄上、中、下各选取2粒葡萄。参考Poudel等[15]的方法测定果实单粒重、可溶性固形物、可滴定酸含量。每个营养系每个成长期随机取30粒果实,采用质量法测得单粒重;将30粒完全破碎后通过0.1 mol/L NaOH滴管滴定测定可滴定酸含量;利用数显折射仪(PR-101,日本Atago公司)测定可溶性固形物,3次重复。
1.2.2黄酮类物质含量的测定 取200 g葡萄果实液氮冷冻后于-80℃冰箱保存。从冰箱中取冷冻葡萄100 g,对果实进行果皮和种子的剥离后,取2 g果皮和2 g种子分别放于100 mL棕色容量瓶中,用70%酒精暗处浸提24 h后过滤,滤液即为黄酮类物质提取液。
将提取液按照氯化铝比色法测定总类黄酮含量:在20 mL刻度试管中加入4 mL蒸馏水,吸取1 mL样品黄酮提取液(空白加入70%乙醇1 ml),与0.3 mL 5 g/100 mL NaNO2溶液混合;5 min后加入0.3 mL 10 g/100 mL AlCl3·6H2O溶液,混合摇匀; 5 min后加入2 mL 1 mol/L NaOH,待反应液充分混匀,避光放置15 min后在510 nm波长处测定吸光度,根据儿茶素(0~100 mg/L)标准曲线计算总类黄酮含量。
采用香草醛-盐酸法测定黄烷醇:吸取1 mL 95%的乙醇置于20 mL刻度试管中,再吸取0.5 mL样品黄酮提取液(以70%乙醇代替样品做空白),摇匀,加入5 mL香草醛-盐酸显色液(通过甲醇定容的1%香草醛和浓盐酸以1∶1混匀),摇匀,30℃水浴40 min,测定500 nm处吸光度,结果以儿茶素等价表示(mg/g·FW)。
采用正丁醇-盐酸比色法测定原花色素含量:吸取0.5 mL样品黄酮提取液(以70%乙醇代替样品做空白)于20 mL试管中,依次加入0.2 mL 2%硫酸铁铵溶液、6 mL 5%正丁醇-盐酸液,摇匀,95℃水浴40 min,测定546 nm处吸光度,结果以标准原花色素等价表示(mg/g·FW)[16]。
花色苷含量采用pH示差法测定[17],称取0.4 g果皮于100 mL棕色容量瓶中,用1%盐酸-无水甲醇于暗处浸提24 h后,分别取 1.0 mL提取液,用pH 1.0和pH 4.5的缓冲液定容至10 mL,避光平衡2 h后,用紫外分光光度计测定其在520 nm和700 nm处的吸光度。以蒸馏水为空白对照。
总花色苷含量(mg/100 g)=A×VF×MW×1 000/(ε×C);
A=(A520-A700)pH 1.0-(A520-A700)pH 4.5
式中:VF为稀释倍数;MW为花青素-3-葡萄糖苷分子量(449.2);ε为花青素-3-葡萄糖苷的摩尔消光系数(29 600);C为提取液浓度(0.2 g/50 mL)。
1.3 统计分析方法
采用Excel 2016进行各指标的数据分析,通过SAS 9.0进行显著性分析。
2 结果与分析
2.1 果实平均单粒重、可溶性固形物与可滴定酸含量的变化
表1显示“赤霞珠”葡萄营养系在转色后80 d时,CS191的平均单粒重显著高于其他4个营养系;但在转色后80 d时,5个营养系葡萄可溶性固形物含量和可滴定酸含量差异均不显著。
2.2 果实中黄酮类物质的含量比较
2.2.1果实中总类黄酮含量的变化 从图1A可以看出“赤霞珠”葡萄在转色后果皮中总类黄酮含量呈先下降后上升的趋势。在果实转色后20 d时,CS191果皮中总类黄酮含量为2.06 mg/g,显著低于CS169;而在转色后40 d和60 d时,CS191果皮中含量显著高于CS338;当转色80 d后时,CS191果皮中含量显著高于其他4个营养系。种子中总类黄酮含量在转色后一直下降(图1B),其中在转色后20 d时,CS191果皮中含量显著高于CS169、CS170、CS338;在转色后40 d时,CS191含量显著高于其他4个营养系;而转色后80 d时,CS191、CS338和CS685种子中含量显著高于CS170。

表1 “赤霞珠”葡萄营养系转色后果实的平均单粒重、可溶性固形物与可滴定酸含量Table 1 Average weight per berry, soluble solids and titratable acids content of “Cabernet Sauvignon” clones after veraison.
注:同一行中不同小写字母表示在P<0.05水平差异显著。
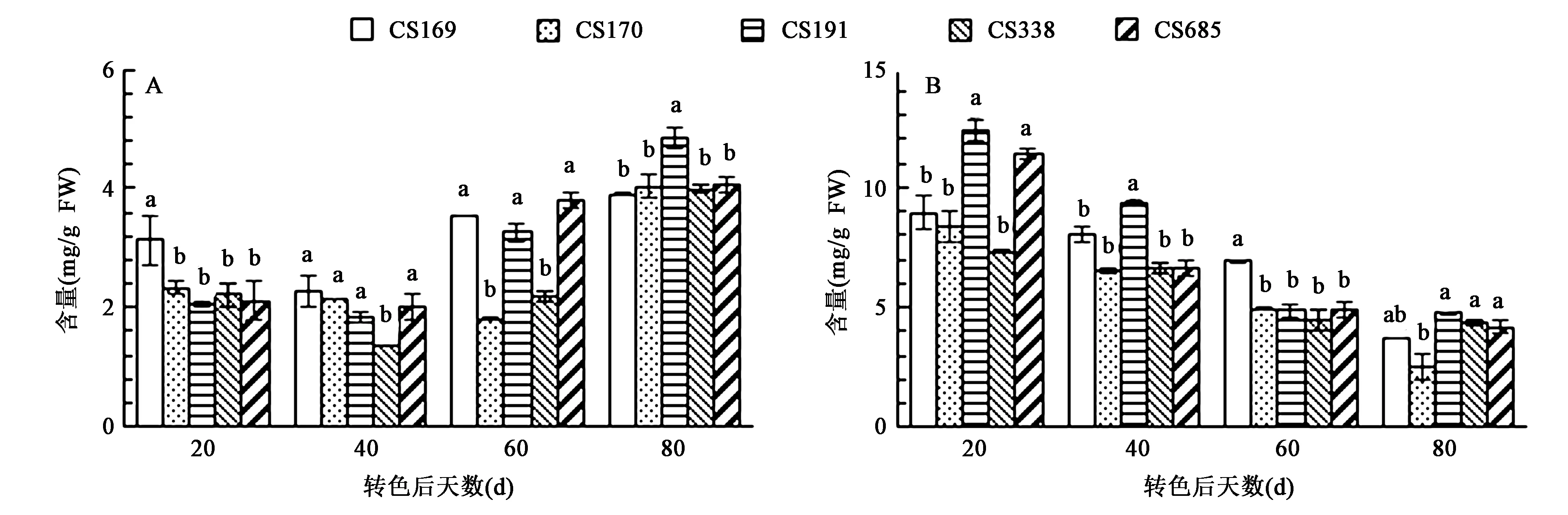
图1 “赤霞珠”葡萄营养系转色后果皮(A)和种子(B)中总类黄酮含量Fig.1 Total flavonoid content in skins(A) and seeds(B) of “Cabernet Sauvignon” clones after veraison.注:同一时期不同小写字母表示在P<0.05水平差异显著。
2.2.2果实中黄烷醇含量的变化 “赤霞珠”葡萄营养系果皮中黄烷醇含量在转色后逐渐上升(图2A)。在转色后20 d时,“赤霞珠”5个营养系果皮中黄烷醇含量均在8 mg/g以上;在转色后60 d时,5个营养系果皮中黄烷醇含量差异不显著;当转色后80 d时,CS170含量显著高于其他4个营养系,分别比CS191、CS685、CS338、CS169高13.2%、26.17%、51.82%、77.76%。5个营养系种子中黄烷醇含量在转色后一直下降(图2B),在转色后80 d时5个营养系种子中黄烷醇含量差异均不显著。
2.2.3果实中原花色素含量的变化 在果实转色后,“赤霞珠”营养系葡萄果皮中原花色素含量逐渐增加(图3A)。在转色后20 d、40 d、60 d时,CS191果皮中含量与其他营养系差异不明显;当转色后80 d时,成熟的CS191果皮中原花色素含量为8.28 mg/g,显著高于CS169和CS338。在转色后种子中黄烷醇含量较低(图3B),且在各时期5个营养系含量均低于0.8 mg/g,其中转色后80 d时,CS191种子中原花色素含量最高,分别比CS338、CS685、CS170、CS169高2.86%(P>0.05)、16.13%(P>0.05)、63.64%(P<0.05)、125%(P<0.05)。
2.2.4果皮中花色苷含量的变化 各营养系葡萄在转色后随着果皮颜色的加深果皮中花色苷含量增加(图4)。其中在转色后20 d时,5个营养系花色苷含量均较低,此时CS170果皮含量为2.98 mg/g;当转色后40 d时,CS191含量与其他4个营养系差异不显著;当转色后60 d时,CS191分别比CS170、CS169、CS685、CS338高出4.64%(P>0.05)、14.07%(P>0.05)、29.43%(P<0.05)、50.65%(P<0.05);在转色80 d时CS170含量显著高于CS169和CS338。
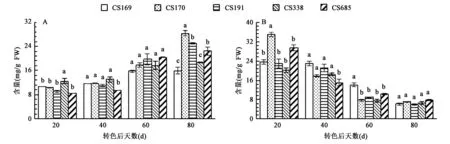
图2 “赤霞珠”葡萄营养系转色后果皮(A)和种子(B)中黄烷醇含量Fig.2 Flavanol content in slins(A) and seeds(B) of “Cabernet Sauvignon” clones after veraison.注:同一天数处理不同小写字母表示在P<0.05水平差异显著。
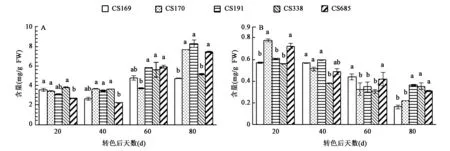
图3 “赤霞珠”葡萄营养系转色后果皮(A)和种子(B)中原花色素含量Fig.3 Proanthocyanidins content in skins(A) and seeds(B) of “Cabernet Sauvignon” clones after veraison.注:同一天数处理不同小写字母表示在P<0.05水平差异显著。
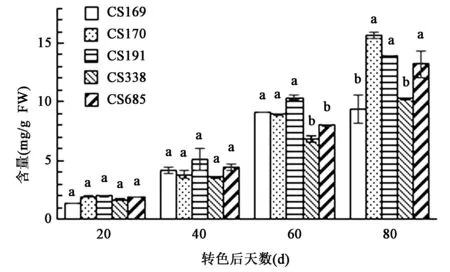
图4 “赤霞珠”葡萄营养系转色后果皮中花色苷含量Fig.4 Anthocyanins content in skins of “Cabernet Sauvignon” clones after veraison.注:同一天数处理不同小写字母表示在P<0.05水平差异显著。
3 讨论
葡萄浆果的成熟随果粒平均粒重的增加,其可溶性固形物含量增加、可滴定酸含量下降,这个过程被认为是由内源脱落酸(ABA)引发[18]。Katayama-Ikegami等[19]通过ABA处理“赤霞珠”浆果对着色和黄酮类物质合成基因的影响中表明,葡萄果实发育期间ABA参与黄酮化合物合成的碳流。在葡萄果实转色后,可溶性固形物中的糖与糖苷配基-花色素形成花色苷,基本骨架结构为C6-C3-C3,属于黄酮类化合物[20];且曹雄军等[21]对红宝石无核和红地球葡萄果实着色与糖、酸含量关系的研究中发现:在果实成熟过程中,果皮中的花色苷含量与果实中的糖积累的相关性达极显著水平,与果实中的酸含量呈极显著负相关。这与本研究中酿酒葡萄“赤霞珠”营养系随着果实的成熟,可溶性固形物含量上升、可滴定酸含量下降及果皮中黄酮类物质发生了积累的结论相符,但“赤霞珠”葡萄5个营养系可溶性固形物和可滴定酸含量差异均不显著,这应该是由于黄酮化合物在果实中的含量在很大程度上取决于葡萄品种的基因型[22,23],可通过基因组测序分析5个营养系间黄酮类物质合成相关基因的差异。
黄酮物质中总类黄酮是葡萄酒中一类重要的保健成分,在葡萄果皮和种子含量较高。Zhao等[24]研究发现,总类黄酮等次生代谢产物合成受信号分子的调节。代红军等[25]研究表明,“赤霞珠”葡萄在花后35 d果皮中总类黄酮含量保持上升,这与本研究中各营养系果皮中总类黄酮含量在转色后上升的结论相符;在各时期用水杨酸处理后果皮中总类黄酮含量都比同时期对照高,说明在发育过程中果皮中总类黄酮含量受水杨酸等信号分子的调控。周兰[26]通过对不同基因型、不同部位以及不同发育时期的苹果果实进行研究表明:随着果实的发育,PAL、CHS、CHI、FHT、FLS、DFR、LAR、ANS、ANR和F3H这10对与总类黄酮合成相关的基因在表达量上存在差异,其中CHI基因与总类黄酮含量变化趋势呈最显著正相关。在本试验结果证明不同时期不同营养系间果皮和种子中总类黄酮含量存在差异,可通过研究这10对基因在不同营养系表达量的差异,分析确定各营养系的部分变异基因来源。
黄烷醇具有保护葡萄果实免受紫外线(UV)辐射的作用[27],在葡萄果实中,LAR酶(无色花色素还原酶)对果实中黄烷醇含量的积累起决定作用[28]。冀铮春[29]通过对葡萄果实发育过程干旱处理,发现LAR酶活性和LAR1表达量与黄烷醇物质含量呈显著性相关;Gagné等[30]研究表明,LAR酶在幼果期处于最高值,之后迅速下降,在转色期LAR酶活性有所回升。该结论验证了研究中各营养系果皮中黄烷醇含量在转色后呈先下降后上升的规律,且与李小龙[31]对酿酒葡萄果实生长发育过程中黄烷醇物质变化规律相似。“赤霞珠”葡萄5个营养系转色后不同时期黄烷醇含量不同,可反映LAR酶活性和LAR1表达量等存在差异,为进一步分析不同营养系合成黄烷醇相关基因的差异提供理论依据。
原花色素又称为缩合单宁,具有很强的生理活性,对葡萄和葡萄酒的苦涩有一定的贡献,并很大程度上影响葡萄和葡萄酒色泽[32]。何非等[33]克隆得到“赤霞珠”葡萄原花色素合成的相关结构基因VvLAR1、VvLAR2及VvANR基因启动子的序列,并表明这些基因表达受环境和植物激素等信号分子的影响。温鹏飞[34]在对酿酒葡萄果实中原花色素合成相关酶基因(PAL、CHS、F3H、DFR、LDOX)在不同时期表达量的研究中发现:“赤霞珠”果皮中,原花色素相关基因在幼果期和果实成熟期大量表达。本试验中材料均来自黄土高原栽培下的“赤霞珠”营养系,在相同的栽培模式下,CS191在转色后80 d后,果皮中原花色素含量均较同时期其他营养系含量高,这可能与不同营养系原花色素相关酶基因及相关基因表达量不同有关。
葡萄果实中的花色苷主要分布于果皮,只有在少数几个染色品种“紫北塞”、“烟73”和“烟74”中,其果肉中也有花色苷的存在[35]。葡萄果皮中的花色苷是重要的色泽性状,对红葡萄酒的颜色、品质和保健功能有重要作用[36]。花色苷的合成过程中,苯丙氨酸解氨酶(PLA)是代谢途径中首先起催化作用的酶[37],类黄酮3-O-葡萄糖基转移酶(UFGT)则是花色苷生物合成过程中的关键酶[38],所以PAL和UFGT在葡萄果皮花色苷合成过程中发挥着重要的催化作用。Kennedy等[39]的研究表明花色苷物质在葡萄果实转色后迅速积累,在花后120 d后变化不明显。张彦芳[40]研究证实河西走廊不同产地“美乐”葡萄果实成熟过程中,花色苷物质含量随成熟逐步积累,在不同产区同一品种相同转色期花色苷含量存在差异,表现出地域特征。本试验研究表明,在黄土高原栽培下的“赤霞珠”营养系在转色后各时期花色苷含量不同,这可能与不同时期花色苷相关基因表达量不同所致,在完全成熟的情况下以CS170果皮中的花色甘含量最高,体现了CS170的品系特征。
在黄土高原栽培下的“赤霞珠”葡萄5个营养系在转色后不同时期黄酮类物质存在明显的差异,这与不同时期相关基因表达量不同所致,其中CS191在完全成熟时果实中总类黄酮和原花色素含量均为最高,CS170在完全成熟时果皮中黄烷醇和花色苷含量较其他营养系含量高,可做为黄土高原地区栽培的高黄酮类物质含量的“赤霞珠”品系。不同的营养系黄酮类物质含量特性不同,这与相关基因的表达有关,故可利用不同品系黄酮类物质含量特性,结合合成黄酮类物质的基因差异,为营养系选种和酿酒葡萄育种提供理论依据,为酿酒葡萄杂交育种选择亲本提供材料依据,以选育适宜的酿酒品系品种。
[1] 李红娟,周新明,刘勇强,等.‘蛇龙珠’亲缘关系鉴定在营养系选种中的应用[J].中国农学通报,2012,28(28):153-157.
[2] 何 磊,潘秋红.激素调控葡萄果实类黄酮代谢的研究进展[J].热带生物学报,2016,7(4):522-529.
[3] 于 贞,赵光鳌,李记明.葡萄皮中的酚类物质对葡萄酒中酚含量的影响[J].酿酒科技,2010(4):46-47.
[4] 程国利,于庆泉,张大鹏,等.浸渍酶对蛇龙珠葡萄酒酿造过程中类黄酮化合物变化的影响[J].中国酿造,2007,26(10):32-35.
[5] 王秀芹,张庆华,战吉成,等.产地与品种对葡萄酒中酚类物质含量的影响[J].食品科学,2009(21):113-118.
[6] Resta P, Fanizza G, Ricciardi L,etal.. Analysis of a spontaneous mutant and selected clones of cv. Italia (Vitisvinifera) by AFLP markers [J]. Vitis J. Grapevine Res., 2015,42(1): 27-30.
[7] van Leeuwen C, Roby J P, Alonso-Villaverde V,etal.. Impact of clonal variability inVitisviniferacabernet franc on grape composition, wine quality, leaf blade stilbene content, and downy mildew resistance [J]. J. Agric. Food Chem., 2012, 61(1): 19-24.
[8] 谭 伟,唐晓萍,董志刚,等.‘赤霞珠’和‘梅露辄’不同营养系果实不同部位酚类物质含量的比较分析[J].中国农学通报,2015,31(8):229-234.
[9] Boubals D. Clonal selection of grape [J]. Progrès Agricole Et Viticole, 1990,107(15-16): 333-335.
[10] 张宗勤.欧洲葡萄‘无核白’10个营养系的性状研究[D].陕西咸阳:西北农林科技大学,博士学位论文,2011.
[11] 唐美玲,宋来庆,张超杰,等.烟台地区不同蛇龙珠营养系果实品质分析[J].中外葡萄与葡萄酒,2011(4): 9-13.
[12] 李红娟.法引酿酒葡萄品丽珠、赤霞珠营养系研究[D].陕西咸阳:西北农林科技大学,硕士学位论文,2004.
[13] 穆 宁.赤霞珠营养系品种葡萄与葡萄酒品质的研究[D].陕西咸阳:西北农林科技大学,硕士学位论文,2007.
[14] 孟江飞.山西乡宁地区葡萄采收时间对葡萄及葡萄酒酚类物质与抗氧化活性影响[D]. 陕西咸阳:西北农林科技大学,硕士学位论文,2011.
[15] Poudel P R, Tamura H, Kataoka I,etal.. Phenolic compounds and antioxidant activities of skins and seeds of five wild grapes and two hybrids native to Japan [J]. J. Food Composition Analysis, 2008,21:622-625.
[16] 蒋 宝,罗美娟,张小转,等.不同地区酿酒葡萄果实中酚类物质含量及抗氧化能力的分析[J].食品与发酵工业,2014,10(2):146-150.
[17] Waterhouse A L, Ignelzi S, Shirley J R. A comparison of methods for quantifying oligomeric proanthocyanidins from grape seed extracts [J]. Am. J. Enol. Vitic., 2000,51(4): 383-389.
[18] Sun L, Zhang M, Ren J,etal.. Reciprocity between abscisic acid and ethylene at the onset of berry ripening and after harvest [J]. BMC Plant Biol., 2010,10(1): 257.
[19] Katayama-Ikegami A, Sakamoto T, Shibuya K,etal.. Effects of abscisic acid treatment on berry coloration and expression of flavonoid biosynthesis genes in grape [J]. Am. J. Plant Sci., 2016, 7(9): 1325-1336.
[20] Wu X, Prior R L. Systematic identification and characterization of anthocyanins by HPLC-ESI-MS/MS in common foods in the United States: Fruits and berries [J]. J. Agric. Food Chem., 2005, 53(7): 2589-2599.
[21] 曹雄军,石雪晖,金 燕,等.红宝石无核和红地球葡萄果实着色与糖、酸含量的关系[J].中外葡萄与葡萄酒,2009(5):12-15.
[22] Boss P K, Davies C, Robinson S P. Analysis of the expression of anthocyanin pathway genes in developingVitisviniferaL. cv Shiraz grape berries and the implications for pathway regulation [J]. Plant Physiol., 1996, 111(4): 1059-1066.
[23] Tian L, Pang Y Z, Dixon R. Biosynthesis and genetic engineering of proanthocyanidins and (iso) flavonoids [J]. Phytochem. Rev., 2008, 7(3): 445-465.
[24] Zhao J, Davis L C, Verpoorte R. Elicitor signal transduction leading to production of piant secondary metabolites [J].Biotechnol. Adv.,2005,23(4):283-333.
[25] 代红军,秦晨亮,丁 玲.水杨酸对‘赤霞珠’葡萄总类黄酮、白藜芦醇含量及相关酶活性的影响[J].中国农业大学学报,2016(7):37-42.
[26] 周 兰.苹果果实发育中类黄酮含量变化及相关基因的研究[D].北京:中国农业科学院,博士学位论文,2013.
[27] Shiozaki S, Murakami K. Flavonoid profiles of wild grapes native to Japan:VitiscoignetiaePulliat andVitisficifoliaBunge var.ganebuHatusima [J]. Agric. Sci., 2017, 8(3): 239-252.
[28] Maugé C, Granier T, d'Estaintot B L,etal.. Crystal structure and catalytic mechanism of leucoanthocyanidin reductase fromVitisvinifera[J]. J. Mol. Biol., 2010,397(4): 1079-1091.
[29] 冀铮春.交替滴灌对赤霞珠果实品质及黄烷醇类多酚积累的影响[D].山西晋中:山西农业大学,硕士学位论文,2014.
[30] Gagné S, Lacampagne S, Claisse O,etal.. Leucoanthocyanidin reductase and anthocyanidin reductase gene expression and activity in flowers, young berries and skins ofVitisviniferaL. cv. Cabernet-Sauvignon during development [J]. Plant Physiol. Biochem., 2009,47(4): 282-290.
[31] 李小龙.酿酒葡萄果实生长发育过程中酚类物质变化规律的研究[D].陕西咸阳:西北农林科技大学,硕士学位论文,2015.
[32] Kyraleou M, Kotseridis Y, Koundouras S,etal.. Effect of irrigation regime on perceived astringency and proanthocyanidin composition of skins and seeds ofVitisviniferaL. cv. Syrah grapes under semiarid conditions [J]. Food Chem., 2016,203: 292-300.
[33] 何 非,李 强,朱保庆,等.酿酒葡萄原花色素生物合成关键结构基因 VvLAR 和 VvANR启动子的克隆与功能预测[EB/OL]. http://www.paper.edu.cn/releasepaper/content, 2013-03-12.
[34] 温鹏飞.葡萄与葡萄酒中黄烷醇类多酚和果实原花色素合成相关酶表达规律的研究[D].北京:中国农业大学,博士学位论文,2005.
[35] 赵 权.葡萄酚类物质及其生物合成相关结构基因表达[D].哈尔滨:东北林业大学,博士学位论文,2010.
[36] He J J, Liu Y X, Pan Q H,etal.. Different anthocyanin profiles of the skin and the pulp of Yan73 (Muscat Hamburg×Alicante Bouschet) grape berries [J]. Molecules, 2010,15(3): 1141-1153.
[37] 张 敏.紫外线对霞多丽葡萄品质及相关生化物质的影响[D].山西晋中:山西农业大学,硕士学位论文,2016.
[38] Jeong S T,Goto-Yamamoto N,Kobayashi S,etal.. Effects of plant hormones and shading on the accumulation of antho-cyanins and the expression of anthocyanin biosynthetic genes ingrape berry skins [J]. Plant Sci., 2004,167(2):247-252.
[39] Kennedy J A, Matthews M A, Waterhouse A L. Effect of maturity and vine water status on grape skin and wine flavonoids [J]. Am. J. Enol. Vitic., 2002, 53(4): 268-274.
[40] 张彦芳.河西走廊不同产地美乐(Merlot)果实成熟期间及原酒中花色苷成分比较[D].兰州:甘肃农业大学,硕士学位论文,2015.
ResearchontheChangesofFlavonoidsinBerriesofCabernetSauvignonClones
LIU Zhenghai1, DONG Zhigang2, LI Xiaomei2, TAN Wei2, TAN Min2, TANG Xiaoping2*, LI Liulin1*
1.CollegeofHorticulture,ShanxiAgriculturalUniversity,ShanxiTaigu030801,China; 2.PomologyInstitute,ShanxiAcademyofAgriculturalSciences,ShanxiTaigu030800,China
Flavonoids are important physiologically active substances in grapes and wines, and play a decisive role in the sensory quality of wines. This paper analyzed the differences of flavonoids content in five nutrition clones of wine-grape Cabernet Sauvignon (CS), in order to provide the material for improving the quality of wine in the Loess plateau. The results showed that: After berries conversion, the content of soluble solids and titratable acids in Cabernet Sauvignon clones were not significantly different, while the average grain weight of CS191 was significantly higher than that of other 4 clones. The content of total flavonoids and proanthocyanidins in skins and seeds were significantly higher than that of other clones at 80 days after transformation. After the 80 days transformation, compared with the other clons of flavanols content in the skins, the CS170 were significantly higher than other clons. During berries completely mature, The content of flavonoids and proanthocyanidins in CS191 was higher than other clones and the content of flavanols and anthocyanins in CS170 skins were higher than that of other clones, which could be used as high flavonoids content of “Cabernet Sauvignon” varieties in the Loess Plateau.
Cabernet Sauvignon; clones; skins; seed; flavonoids
2017-06-06;接受日期2017-08-21
农业部现代农业产业技术体系专项(CARS-29-yc-5)资助。
刘政海,硕士研究生,研究方向为果树栽培与生理。E-mail:sxtglzh@163.com。*通信作者:唐晓萍,研究员,博士,研究方向为葡萄栽培育种。E-mail:txp-19590401@163.com。李六林,教授,博士,研究方向为果树栽培生理。E-mail:tgliulin@163.com
10.19586/j.2095-2341.2017.0055
