水稻矮杆突变体D814基因图位克隆与功能分析
2018-01-03陈新兵黄荣峰
陈新兵, 黄荣峰, 王 娟
中国农业科学院生物技术研究所, 北京 100081
水稻矮杆突变体D814基因图位克隆与功能分析
陈新兵, 黄荣峰*, 王 娟*
中国农业科学院生物技术研究所, 北京 100081
水稻株高对作物产量有着重要的影响,在水稻整个生长发育过程中,株高受到多因素的调控,而植物激素乙烯就是重要的影响因素之一。用10 mg/m3乙烯处理水稻幼苗,对水稻突变体库进行筛选,获得了3个根伸长生长对乙烯敏感性降低的突变体,其中1个突变体D814表现出植株矮化、分蘖数减少、千粒重下降等特征。图位克隆将其定位在1号染色体上1 cM的区间内,该区间有6个已报道的矮杆突变基因,通过对这6个基因测序,发现其中1个基因OsBRI1(LOC_Os01g52050)发生了点突变(编码区第1 837位G突变为T)。并在D814中分别对OsBRI1的2个同源基因(OsBRL1和OsBRL3)进行测序,发现这2个基因均无突变。利用已报道的OsBRI1等位突变体gsor300084进行乙烯处理,发现gsor300084与D814一样,表现出根对乙烯敏感性降低。OsBRI1是植物激素油菜素内酯(brassinosteroid,BR)的信号受体,经检测,BR信号途径响应基因在D814突变体中的表达也有变化,说明D814是OsBRI1的1个等位突变体。功能分析发现,D814参与乙烯信号转导调控途径和植物盐胁迫应答途径。研究结果为探究乙烯调控水稻生长发育及耐逆性的分子机理提供了研究材料,也为进一步探讨油菜素内酯与乙烯协同调控水稻生长发育机制奠定了理论基础。
水稻;乙烯;矮杆;图位克隆;盐胁迫应答
水稻矮化是植物生长发育过程中的一个重要考察指标,对于作物产量、光合速率等具有重要的影响。矮化变异可作为一种稳定性状标记,用于新品种培育、作物遗传改良等生产实践[1]。根据矮化程度不同,可将水稻分为:半矮杆、矮杆、极矮杆3种表型,其中矮杆是指水稻株高表型比正常株高矮一半的矮杆突变体[2]。按照惯例,矮杆和极矮杆基因统一用符号d来命名,而半矮杆基因用符号sd来命名。目前在国家水稻数据库网站上(www.ricedate.cn)已鉴定出的矮杆基因有几十个,其中分布在1号染色体上的矮杆基因有6个,分别为sd1、d2、d10、d18、d61、gid1。在这6个基因当中,d61是较早被发现的一个矮杆基因,是编码植物激素油菜素内酯(brassinosteroid,BR)的一个受体激酶BRI1。在水稻中,OsBRI1有2个同源基因,OsBRL1与OsBRL3,OsBRI1主要通过控制细胞分裂以及细胞伸长来调控器官发育,但对器官的起始不是必需的,而OsBRL1和OsBRL3主要是在根部响应BR信号的应答[3]。除此之外,OsBRI1在水稻的生长发育过程中起多种作用,包括节间伸长、叶倾角、暗形态建成等[4]。近年来通过正向遗传学等手段也发现了许多OsBRI1的等位突变基因,例如半矮杆突变体Fn189(d54)的点突变导致OsBRIl激酶活性降低[5]。另外一个点突变体gsor300084,其点突变导致第444位的色氨酸突变为精氨酸,从而导致对BR信号的钝感表型[6]。OsBRI1除了参与植物生长发育以外,在逆境胁迫应答中也发挥着重要的作用。例如:盐胁迫下,OsBRI1的表达量会显著上升,从而导致植物体内BR信号增强;随着氧化胁迫强度的上升,BR能够通过促进植物体内H2O2的积累来使植物抵御这一伤害[7]。
对于BR信号转导机制,在拟南芥中已经研究的十分清楚[8,9]。在水稻中,目前为止只鉴定出了一些与拟南芥相似的BR信号成分。OsBAK1与拟南芥中BAK1同源[10],OsBZR1与拟南芥中BZR1的功能类似[11]。而拟南芥BIN2的同源基因OsGSK2,在水稻中同样是BR信号的负调控因子[12]。除此之外,近年来BR信号转导中一些新的转录因子也陆续被鉴定出来:OsOFP8作为OsGSK2的作用底物参与BR信号途径[13];OsBUL1作为一个正调控转录因子参与BR信号转导途径[14]。随着生物学的发展,水稻中越来越多的BR信号途径新组分被鉴定出来,丰富和发展着BR信号调控网络。在水稻生长发育的过程中,乙烯对植物的株高以及地下部生长发育具有十分重要的影响。挖掘乙烯信号转导途径中的新组分是研究乙烯在植物体内作用的分子基础,也是目前常规的流行方法。作为重要的植物激素之一,乙烯在双子叶植物体内的作用主要表现为典型的三重反应:抑制根的伸长生长、抑制下胚轴的伸长生长以及促进顶端弯曲;而在单子叶植物中乙烯只表现出二重反应:抑制根的伸长生长和促进胚芽鞘的伸长生长[15]。研究表明,乙烯在植物体内的这种作用主要是通过乙烯信号转导途径实现的[16~21]。除了调控植物生长发育作用外,乙烯还参与植物盐胁迫、病原菌侵染等逆境胁迫条件下的应答过程[22]。其中在盐胁迫应答中,乙烯可以通过调节水稻根系Na+/K+的转运或者通过下游转录因子调控耐盐相关基因的表达[23]。
本研究用10 mg/m3乙烯处理水稻幼苗,对水稻突变体库进行筛选,获得了3个根对乙烯敏感性降低突变体,其中1个突变体D814表现出植株矮化、分蘖数减少、千粒重下降等显著特征。图位克隆将其定位在1号染色体上1 cM的区间内,该区间有6个已报道的矮杆突变基因,通过对这6个基因测序发现其中1个基因OsBRI1(LOC_Os01g52050)发生点突变(第1 837位G突变为T)。同时检测到D814中OsBRI1的2个同源基因(OsBRL1和OsBRL3)均无突变,且已报道的d61等位突变体gsor300084也表现出根对乙烯敏感性降低,而D814中BR响应基因的表达也有所变化,上述结果说明该突变体很可能是OsBRI1基因点突变所致。进一步的功能分析发现,D814参与了乙烯信号转导调控途径和植物盐胁迫应答途径。本研究为探究乙烯调控水稻生长发育及耐逆性的分子机理提供了研究材料,也为进一步探讨BR与乙烯协同调控水稻生长发育奠定了理论基础。
1 材料与方法
1.1 试验材料与生长条件
1.1.1试验材料 野生型02428和培矮64(PA64)水稻种子由本实验室保存,3 000份以02428为背景的甲基磺酸乙酯(ethyl methane sulfonate,EMS)诱变水稻突变体材料库由本实验室创建,乙烯敏感性降低矮杆突变体D814由本次实验筛选并保存。用于D814突变体基因图位克隆的F2群体由本实验室创建。
1.1.2生长条件 2015年和2016年,连续2年在试验基地(39.6°N,116.2°E)进行种植。土培幼苗:种植在土培盒中,在水稻培养温室中(30℃,16 h白天/8 h黑夜)生长2周左右;水培幼苗:种植在铁丝网架上,放入温室培养4~5 d左右。
1.1.3试验试剂 Trizol试剂盒购自天根生化有限公司;反转录试剂盒购自诺唯赞有限公司;用于荧光定量PCR的SYBR Green Mix购自翌圣生物科技有限公司。
1.2 乙烯筛选
选取萌发一致的水稻幼苗,种植在铁丝网架上,每个铁网格种植30粒水稻种子,每个株系种植3格,将网架放入10 L的塑料密闭培养箱中,加入5 L的水,使水面距离种子约1 cm处,封盖,注入终浓度为10 mg/m3的乙烯气体,长日照条件下培养4 d,进行表型观察并统计初生根长,实验设3次重复。
1.3 表型分析及农艺性状统计
在水稻幼苗期,选取土培2周左右的幼苗进行拍照;在水稻成熟期,分别对野生型02428和突变体D814植株进行观察统计:随机选取10株成苗,测量统计其株高、分蘖数、各节间长度等主要农艺性状;等种子成熟后,分别称取野生型02428和突变体D814千粒重,并进行3次重复。
1.4 基因初步定位
将D814与PA64进行杂交获得F1代后加繁一代得到F2代群体。选取饱满度大致相同的F2群体以及亲本野生型02428和PA64水稻种子,萌发后土培种植,在水稻温室中培养2周左右,选取矮化表型幼苗单株,根据CTAB法提取基因组DNA后,首先随机选取10个单株F2基因组DNA,按等浓度混匀构成DNA混池,同时分别以野生型亲本02428以及PA64的基因组DNA为模板进行PCR鉴定,PCR反应程序为:95℃ 10 min;95℃ 15 s,55℃ 15 s,72℃ 15 s,共45个循环;72℃ 5 min。PCR反应体系为:模板1 μL,正反向引物各0.5 μL,2×PCR Mix 10 μL, 用H2O补齐到20 μL。PCR引物根据水稻基因组数据库中水稻品种02428和PA64的Indel分子标记进行设计,PCR产物用4%(w/V)琼脂糖凝胶电泳。通过交换率分析确定D814突变基因所在染色体区域。再根据国家水稻数据库网站(http:rapdb.dna.affrc.go.jp/)对该区域基因的注释与分析,选取候选基因。最后设计引物,将PCR产物测序后确定突变基因。
1.5 耐盐性表型试验
选取萌发一致的水稻种子,种植在装有草炭土的种植盒中,每盒种植20粒水稻种子,每个株系种植8盒,分为对照组和处理组,封土,盖好保鲜膜保湿,放在温室中培养,待种子出苗后揭开保鲜膜,继续培养2周左右,选取长势一致的水稻幼苗放入150 mmol/L NaCl溶液中生长,每天观察,待叶片萎蔫后进行复水处理,每天观察并统计复水存活率,实验设3次重复。
1.6 实时荧光定量PCR(Q-PCR)
分别剪取生长2周左右的野生型02428和突变体D814植株幼苗叶片,按Trizol试剂盒说明书步骤操作提取水稻总RNA,再用反转录试剂盒反转录成cDNA。通过荧光定量PCR(IQ5 multicolor Real Time PCR Detection System)检测乙烯信号途径关键基因的表达。PCR反应程序为:95℃ 10 min;95℃ 10 s,58℃ 30 s,72℃ 20 s,共45个循环;以每30 s上升0.5℃的速率从55℃升至95℃来做为溶解曲线程序。PCR反应体系为:模板1 μL,正反向引物各0.5 μL,SYBR Green Mix 10 μL, 用H2O补齐到20 μL。所用引物序列见表1。
2 结果与分析
2.1 乙烯不敏感突变体筛选
通过对野生型02428进行EMS诱变,获得了3 000份水稻突变体材料,用10 mg/m3乙烯对其进行筛选,得到3个根伸长生长对乙烯敏感性降低的突变体,分别是D848、D814以及D841(图1,彩图见图版一)。用已报道的水稻乙烯不敏感突变体ein2(日本晴背景)作为对照,在黑暗条件下水培4 d。统计数据发现,在10 mg/m3乙烯处理下,野生型日本晴(Nip)和ein2初生根长分别缩短为原来的35.45%和76.72%。野生型02428的初生根长在10 mg/m3乙烯处理下缩短为正常条件下的31.69%,而D848、D814和D841突变体经同样处理后,初生根长度分别缩短为原来的43.35%、65.50%、41.88%,该结果表明这3个突变体的根伸长生长对乙烯敏感性均有所降低,其中D814根的伸长生长对乙烯的不敏感性最明显。
表1 实验所用引物序列Table 1 Sequences of the primers used in the experiment.
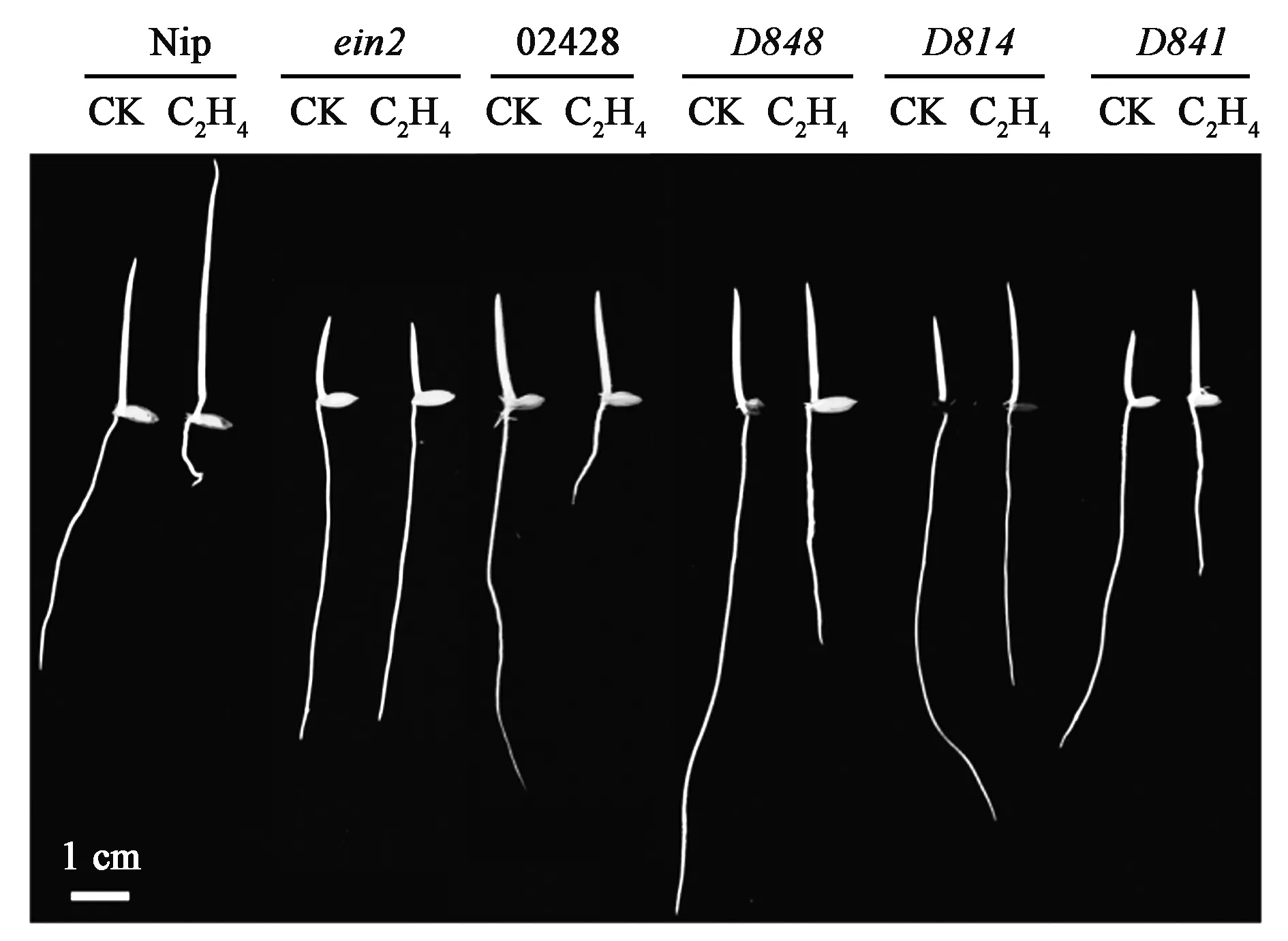
图1 根对乙烯敏感性降低的水稻突变体筛选Fig.1 The screening of rice mutants with root decreased sensitivity to ethylenein.注:图中为黑暗下生长4 d的幼苗在乙烯处理下的表型。其中,CK为对照组,未进行乙烯处理;C2H4为处理组,进行乙烯处理。(彩图见图版一)
2.2 D814参与调控乙烯信号途径
为了进一步研究D814突变体根对乙烯敏感性降低的分子机制,在水稻幼苗期进行乙烯处理后,通过Q-PCR分别检测了乙烯合成途径和信号转导途径的下游调控基因的表达情况。对于乙烯合成家族基因,当外源施加乙烯处理水稻幼苗时,无论是野生型还是突变体,基因表达量都显著升高(图2A),而对于乙烯信号转导途径中的下游调控基因,当外源施加乙烯处理水稻幼苗时,OsSHR5和OsERF063的基因表达量只在野生型中有所上升,而在突变体中并未有明显变化(图2B)。该结果表明D814突变体阻断了乙烯信号转导途径,而对乙烯合成途径无影响,从而说明D814是通过乙烯信号转导途径来调控植物根对乙烯的敏感性降低。
2.3 D814突变体表型分析
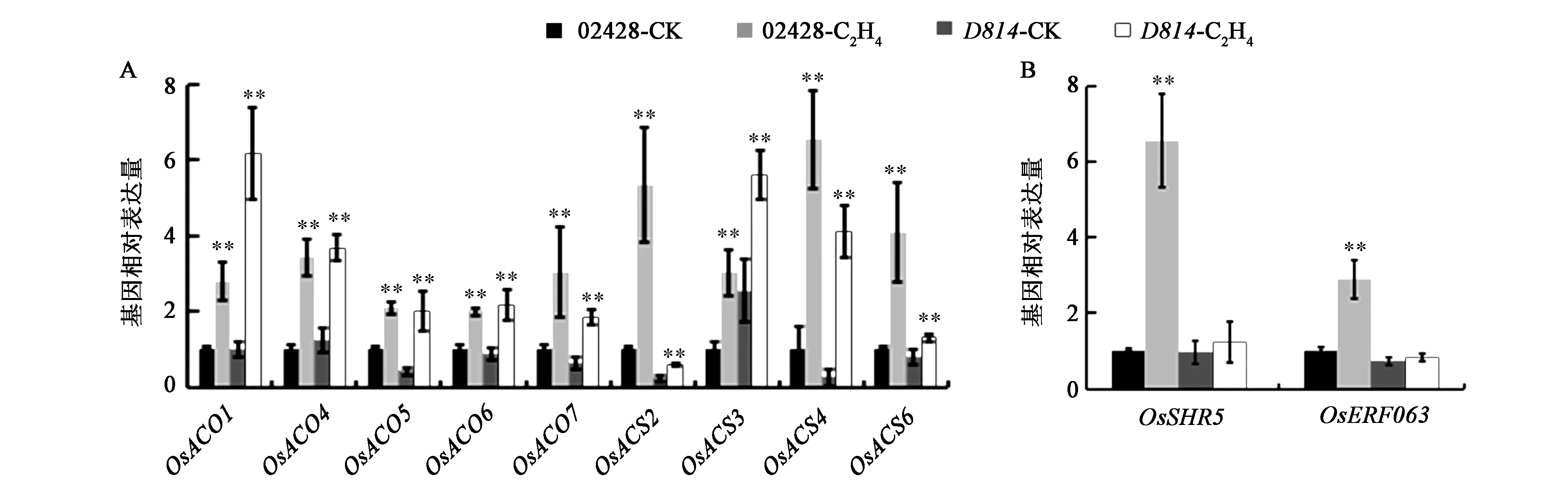
图2 D814调控乙烯信号途径基因的表达Fig.2 D814 regulates the expression of ethylene signaling-related genes.注:A:乙烯合成途径中的关键酶编码基因表达;B:乙烯信号下游基因OsSHR5和乙烯信号下游转录因子OsERF063的基因表达。CK为对照组,未进行乙烯处理; C2H4为处理组,进行乙烯处理。相对定量以ACTIN2为内参基因。**表示与对照组相比差异极显著(P<0.01)。
d61突变体典型的表型就是株高变矮,其成熟期突变体高度相对野生型高度只有60%~70%左右,除此之外,d61突变体还会表现出直立叶、叶色深、突变体种子变黑等系列特征,其他的表型特征还包括叶夹角、叶鞘长度、分蘖数等[3~5]。分别对D814突变体在不同时期的表型进行了观察。在幼苗期,D814突变体与02428相比表现出株高显著变矮(图3A、3B,彩图见图版一);在成熟期,D814突变体与02428相比,在株高、花期、叶型、叶夹角、粒长、粒宽等主要农艺性状方面都存在显著差异(图3C~图3I),尤其是突变体平均株高为野生型的50.44%,OsBRI1的等位突变体d61-2以及gsor300084等都表现出相似的表型。除此之外,D814也像其他OsBRI1等位突变体一样,表现出典型的直立叶、叶色深黑以及褐粒等。对D814突变体成熟期的各个节间进行统计,发现D814突变体株高变矮的原因主要是第一、第三和第四节间变短造成的。同时由于D814突变体粒长显著小于野生型、粒宽略小于野生型,其千粒重也明显低于野生型(表2)。这些结果表明D814能够调控水稻的生长发育,而且D814在株高及种子的发育过程中具有十分重要的作用。

图3 D814突变体与野生型表型比较Fig.3 Comparison of the phenotypes between D814 mutant and wild type.A:幼苗期植株;B:幼苗期根部;C:成熟期植株;D:成熟期节间长度;E:成熟期旗叶; F:成熟期穗部;G:成熟期穗颈及第一节间;H:成熟期籽长;I:成熟期粒宽(彩图见图版一)
2.4 D814突变基因定位
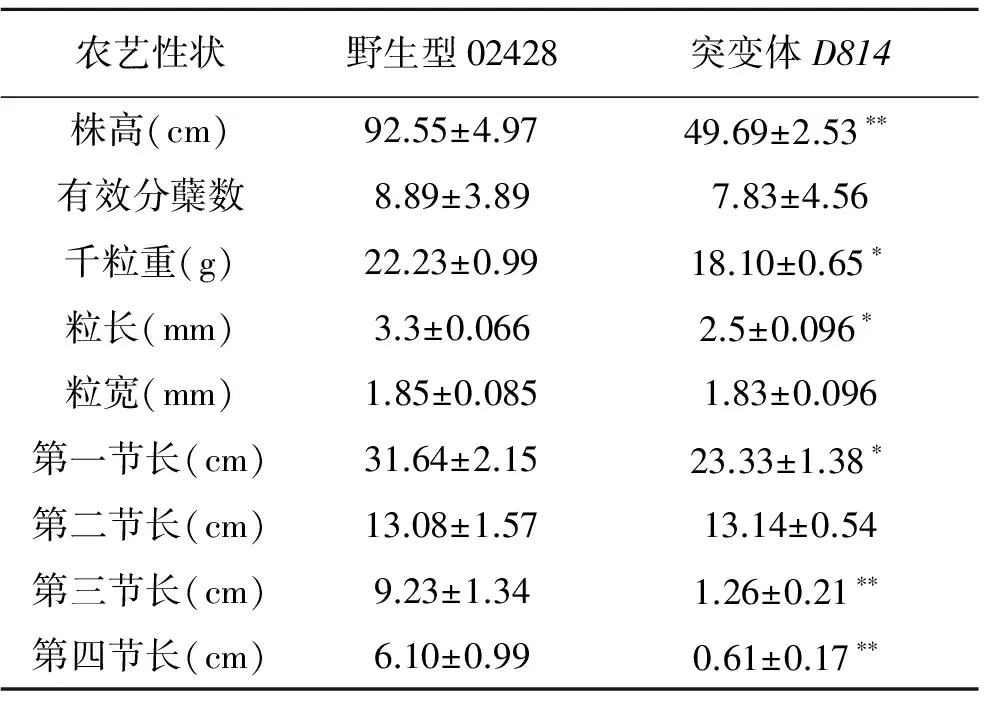
表2 D814突变体与野生型农艺性状比较Table 2 Comparison of agronomic traits between wild type and D814 mutant.
注:*和**分别表示同组数据中突变体与野生型相比差异显著(P<0.05)和极显著(P<0.01)。
利用D814的矮杆表型对其突变基因进行定位,在D814与培矮64(PA64)杂交的F2群体中筛选出了204株具有矮杆性状的突变体单株。提取这些单株基因组DNA后,利用图位克隆基因定位技术,首先将突变区间锁定在1号染色体上,初步定位在2个标记(rm1-33和rm1-34)之间,该区间的遗传距离为1 cM(图4A)。通过水稻数据库(http://rice.plant)查阅发现该区间已报道的矮杆基因有6个,分别为:调控赤霉素信号途径中的GA20氧化酶基因sd1,参与独角金内酯合成途径的细胞色素P450蛋白CYP90D2基因d2,类胡萝卜素裂解双加氧酶编码基因d10,编码赤霉素3β-羟化酶的基因d18,编码油菜素内酯信号转导途径中的BR受体激酶的基因d61,以及编码赤霉素信号途径的GA受体的基因gid1。为了确定D814突变体矮化表型是否是由于这些基因引起的,分别提取野生型02428、突变体D814以及F2群体中随机2个矮杆单株基因组DNA进行测序,结果表明只有d61(OsBRI1,LOC_Os01g52050)在其编码区第1 837位碱基发生了点突变(由G突变为T)(图4B),导致其蛋白第613位氨基酸由甘氨酸变成了缬氨酸(G613V)(图4C)。以上结果表明,D814突变体矮化表型可能是由于1号染色体上的d61等位突变引起。

图4 突变基因D814在1号染色体上的定位图Fig.4 Mapping of mutated gene D814 on chromosome 1.A、B:D814突变基因初步定位图与测序结果;C:d61等位突变
为了进一步验证该突变体是否由OsBRI1基因突变引起的,首先利用野生型以及突变体基因组DNA对其同源基因OsBRL1与OsBRL3启动子及基因组全长进行测序,发现只有OsBRI1基因在其CDS区第1 837位发生了碱基突变(由G突变为A),而其同源基因并没有发生突变。另一方面,由于突变体D814是在水稻突变体库中用乙烯处理筛选出来的,于是利用已经报道的以野生型松前为背景的d61水稻突变体gsor300084,与突变体D814一起进行乙烯处理,并观察统计水稻根长,结果发现,突变体gsor300084与D814一样,初生根都表现出对乙烯的敏感性降低(图5,彩图见图版一)。野生型02428和松前的初生根长在乙烯处理下分别缩短为正常条件下的26.47%和22.03%,而突变体D814和gsor300084分别缩短为57.14%和64.40%。从而进一步表明D814突变体可能是d61的等位突变体。
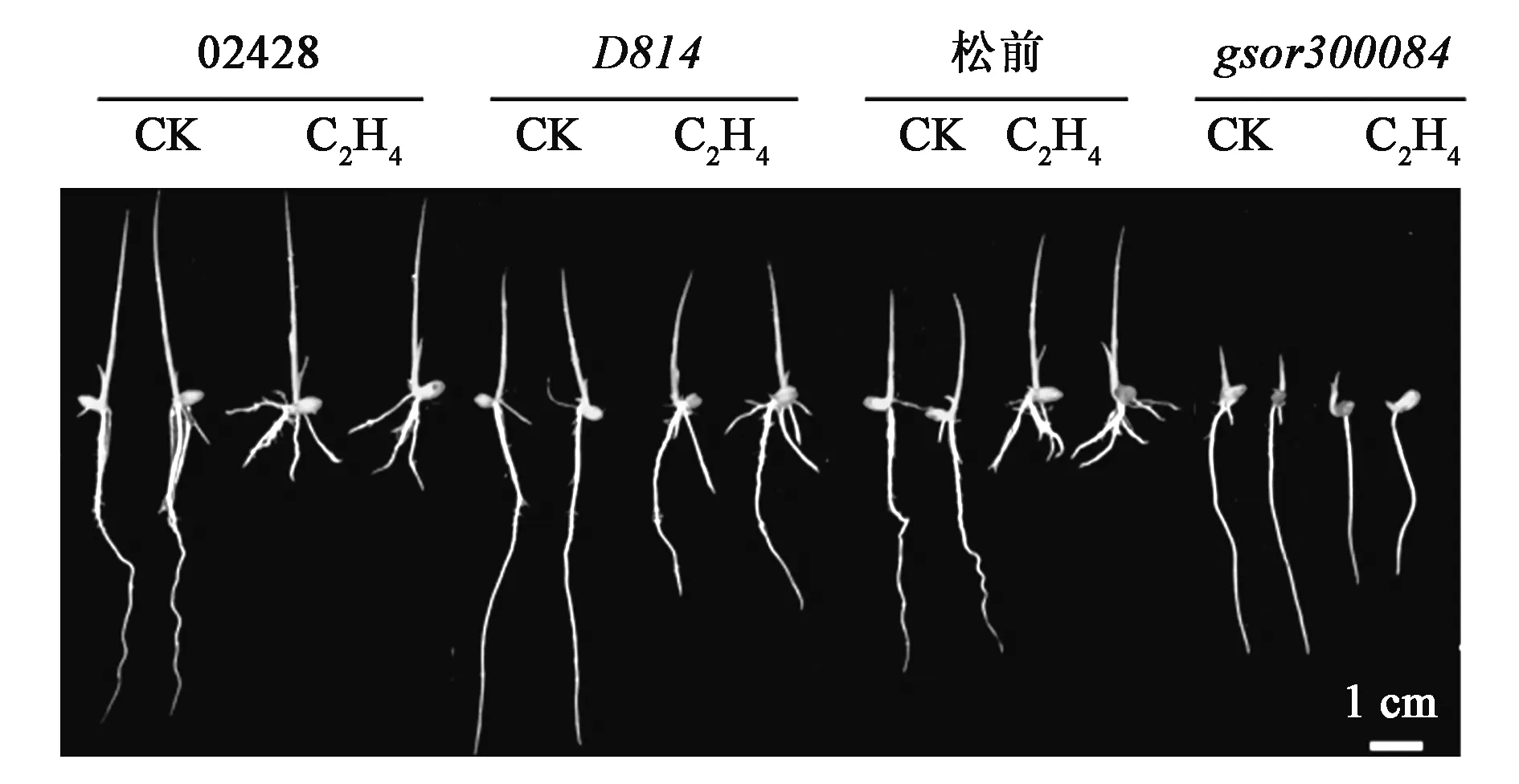
图5 d61等位突变体gsor300084乙烯表型Fig.5 Comparison of the ethylene insensitive phenotypes between D814 and d61 mutant.注:图中为光下生长4 d的幼苗在乙烯处理下的表型。CK为对照组,未进行乙烯处理; C2H4为处理组,进行乙烯处理。(彩图见图版一)
2.5 D814参与BR信号转导途径
为了验证D814参与BR信号途径,提取水培3 d的水稻幼苗总RNA,反转录成cDNA后检测BR信号响应基因的表达情况。结果发现,OsBRI1及其同源基因OsBRL1与OsBRL3基因表达量相对于野生型并没有明显变化,BR信号传导途径基因OsBAK1,其表达量相对于野生型也没有明显变化。而对于BR信号下游响应基因OsOFP8、OsBLE1和OsBUL1,在突变体D814中其基因表达水平相对于野生型02428显著降低,而BR信号途径负调控因子OsGSK2的基因表达略有升高(图6)。该结果表明D814参与BR信号转导途径,也进一步证明了D814突变体很可能就是d61等位突变体。
2.6 D814参与植物盐胁迫应答
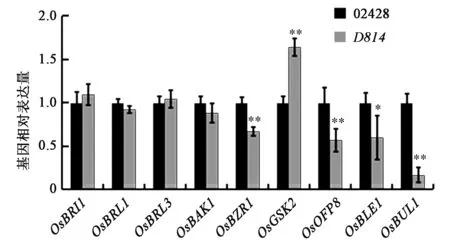
图6 D814调控BR信号途径基因的表达Fig.6 D814 regulates the expression of BR signaling-related genes.注:相对定量以ACTIN2为内参基因。*表示与野生型02428相比差异显著(P<0.05);**表示与野生型02428相比差异极显著(P<0.01)。
盐胁迫是植物非生物胁迫的一个重要方面,植物在抵御盐胁迫过程中,一方面通过Na+/K+转移等离子通道,另一方面通过调控体内一些植物激素水平来减轻盐胁迫对植物造成的伤害。之前的研究[24]表明,乙烯作为一种重要的植物激素,能够负调控水稻耐盐性,因此比较了突变体D814和野生型02428的耐盐性。观察发现,使用150 mmol/L NaCl处理7 d后,水稻幼苗开始出现叶片卷曲,其中突变体发生卷曲的叶片数少于野生型(图7A,彩图见图版二)。拍照统计后对处理组幼苗进行复水,复水5 d后拍照并统计成活率。结果显示,野生型水稻幼苗复水后成活率为9.14%,而突变体复水后成活率为56.08%(图7B)。说明D814突变体对高盐胁迫的耐受力明显高于野生型,并进一步表明D814能参与调控水稻盐胁迫应答。
3 讨论
随着对植物激素乙烯的深入研究,越来越多的乙烯信号转导途径中的新组分被挖掘出来。例如在水稻中筛选到的乙烯信号转导途径突变体mhz6等[25],这些新组分的筛选不但阐明和完善了乙烯在植物体内的信号调控网络,而且为育种学家培育新品种提供了理论基础。
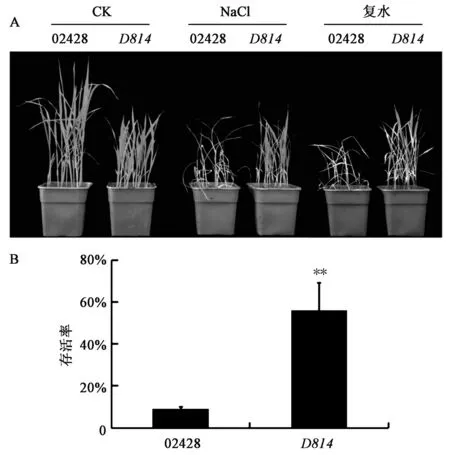
图7 D814突变体与野生型盐胁迫表型比较Fig.7 Comparison of mutants D814 and wild type in response to salt stress.注:A:野生型和突变体幼苗盐处理表型。B:野生型和突变体幼苗盐处理后复水成活率。**表示同组数据与野生型相比极显著(P<0.01)。(彩图见图版二)
本研究首先用10 mg/m3浓度乙烯处理2周左右的水稻幼苗,对实验室突变体库进行筛选,获得了3个根对乙烯敏感性降低的突变体:D841、D814和D848,从而为后续探究乙烯在植物体内的作用及分子机理提供了宝贵的材料。由于突变体D814初生根的伸长生长对乙烯的敏感性最低,因此选择D814突变体作为进一步的研究材料。表型观察发现D814在整个植株生长发育的过程中,都表现出植株矮化、分蘖数减少、千粒重下降等显著特征,与大多数OsBRI1基因的等位突变体相似,具有直立叶、叶色深等表型,说明D814可能是BR信号途径有关的突变体,能够参与水稻生长发育的调控,也说明D814在调控水稻生长发育过程中具有十分重要的作用,特别是在调控水稻株高方面。通过图位克隆,将D814突变基因初步定位在1号染色体上遗传距离为1 cM的区间内,并通过基因测序表明其中的d61基因在编码区1 837位碱基发生了点突变(由G变成T),导致氨基酸的改变。从而说明D814突变基因很可能是d61的等位突变。之前的研究报道了d61的2个等位突变体d61-1和d61-2也都是点突变体(图4)。d61编码一个BR受体蛋白激酶,突变后会导致体内BR信号转导受阻,从而表现出节间伸长被抑制、叶片直立等典型特征[26]。在水稻中,BR不仅能够单独调控植物的生长发育,BR也能参与植物激素乙烯的合成与调控。例如BR与乙烯相互拮抗来共同调节下胚轴的生长[27],也可以通过增强乙烯合成限速酶ACS5蛋白的稳定性来调控乙烯的生物合成[28]。BR处理后,可以提高乙烯不敏感突变体ein2在盐胁迫下种子的发芽率[29]。而D814作为BR信号转导受阻的突变体,幼苗期根部表现出对乙烯敏感性降低的特征,表明D814可作为一个良好的材料,对其深入研究将会为阐明油菜素内酯与乙烯协同调控水稻生长发育机制奠定理论基础。
由于初定位的遗传距离1 cM的区间范围太大,在该区间内是否还有其他基因发生突变尚不清楚,同时为了进一步的验证D814突变基因确实是OsBRI1,首先通过对同源基因OsBRL1和OsBRL3启动子和基因组序列全长进行测序发现,其同源基因并没有发生任何突变,只有OsBRI1基因在其CDs区发生了点突变(图4),进一步推测,如果突变基因确实是OsBRI1,那么D814突变体就应该和已报道的d61等其他突变体一样具有相似的表型,于是对已报道的d61等位点突变体gsor300084进行乙烯处理,观察D814与gsor300084突变体根部表型,通过统计发现D814和gsor300084一样,根部都表现出对乙烯敏感性降低(图5),从而进一步说明D814很可能是OsBRI1的一个新的等位突变体。最后,进一步检测了D814突变体中BR信号响应基因的表达情况,发现突变体中这些基因的表达量与02428野生型有显著差异(图6),进一步说明D814参与BR信号转导途径,但还需要进一步的精细定位以及遗传数据等来证明。
乙烯功能的发挥最终都是将乙烯信号转导给下游一些转录因子,从而启动乙烯相关基因的表达。在水稻中,乙烯处理能显著诱导乙烯信号下游基因OsSHR5(LOC_Os08g10310)与OsERF063(LOC_Os09g11480)超高量表达[30]。而在D814突变体中,基因OsSHR5与OsERF063的表达量在乙烯处理前后并没有显著的差异,表明D814参与乙烯信号转导,从而使突变体D814表现出根对乙烯的敏感性下降。之前研究表明,在水稻中乙烯能够负调控水稻的耐盐性[31],并且发现D814表现出耐盐性增加,进一步表明D814通过阻断乙烯信号途径提高了植物的耐盐性。以上研究对阐明乙烯在调节植物生长发育和盐胁迫应答中发挥功能的分子机制具有十分重要的意义。
综上所述,本研究鉴定了3个乙烯敏感性降低的水稻突变体,这些突变体的根都呈现了对乙烯的钝感表型。通过图位克隆方法初步鉴定D814可能为BR途径的受体激酶OsBRI1点突变。进一步研究发现,D814突变体呈现耐盐性增加,揭示了乙烯可能通过BR途径调控根生长和盐胁迫反应的机制。这些研究对于揭示水稻乙烯信号转导机制具有重要意义,为探究乙烯调控水稻生长发育及耐逆性的机理提供了研究材料,也为进一步探讨油菜素内酯与乙烯协同调控水稻生长发育机制奠定了理论基础。
[1] 闵绍楷, 申宗坦, 熊振民. 水稻育种学[M]. 北京: 中国农业科技出版杜, 1997, 12(6): 1-6.
[2] 马汉云, 王青林, 吴淑平, 等. 水稻株型遗传的研究进展[J]. 安徽农学通报, 2007, 13(23): 105-107.
[3] Nakamura A, Fujioka S, Sunohara H,etal.. The role ofOsBRI1 and its homologous genes,OsBRL1 andOsBRL3, in rice[J]. Plant Physiol., 2006, 140(2): 580-590.
[4] Yamamuro C, Ihara Y, Wu X,etal.. Loss of function of a ricebrassinosteroidinsensitive1 homolog prevents internode elongation and bending of the lamina joint[J]. Plant Cell, 2000, 12(9): 1591-1605.
[5] Zhao J, Wu C, Yuan S,etal.. Kinase activity of OsBRI1 is essential for brassinosteroids to regulate rice growth and development[J]. Plant Sci., 2013, 199: 113-120.
[6] Gao Y, Wang G, Yuan S,etal.. Phenotypic analysis and molecular characterization of an allelic mutant of thed61 gene in rice [J]. Crop J., 2014, 2(4): 175-182.
[7] Xia X J, Wang Y J, Zhou Y H,etal.. Reactive oxygen species are involved in brassinosteroid-induced stress tolerance in cucumber[J]. Plant Physiol., 2009, 150(2): 801-814.
[8] Wang X, Chory J. Brassinosteroids regulate dissociation of BKI1, a negative regulator of BRI1 signaling, from the plasma membrane[J]. Science, 2006, 313(5790): 1118-1122.
[9] He J X, Gendron J M, Yang Y,etal.. The GSK3-like kinase BIN2 phosphorylates and destabilizes BZR1, a positive regulator of the brassinosteroid signaling pathway inArabidopsis[J]. Proc. Natl. Acad. Sci. USA, 2002, 99(15): 10185-10190.
[10] Li D, Wang L, Wang M,etal.. EngineeringOsBAK1 gene as a molecular tool to improve rice architecture for high yield[J]. Plant Biotechnol. J., 2009, 7(8): 791-806.
[11] Bai M Y, Zhang L Y, Gampala S S,etal.. Functions of OsBZR1 and 14-3-3 proteins in brassinosteroid signaling in rice[J]. Proc. Natl. Acad. Sci. USA, 2007, 104(34): 13839-13844.
[12] Tong H, Liu L, Jin Y,etal.. Dwaftandlow-tilleringacts as a direct downstream target of a GSK3/SHAGGY-like kinase to mediate brassinosteroid responses in rice[J]. Plant Cell, 2012, 24(6): 2562-2577.
[13] Yang C, Shen W, He Y,etal.. OVATE family protein 8 positively mediates brassinosteroidsignaling through interacting with the GSK3-like kinase in rice[J]. PLoS Genet., 2016, 12(6): e1006118.
[14] Tanaka A, Nakagawa H, Tomita C,etal..Brassinosteroidupregulated1, encoding a helix-loop-helix protein, is a novel gene involved in brassinosteroid signaling and controls bending of the lamina joint in rice[J]. Plant Physiol., 2009, 151(2): 669-680.
[15] Yang C, Lu X, Ma B,etal.. Ethylene signaling in rice andArabidopsis: Conserved and diverged aspects [J]. Mol. Plant, 2015, 8(4): 495-505.
[16] Ecker J R. The ethylene signal transduction pathway in plants[J]. Science, 1995, 268(5211): 667-675.
[17] Kieber J J, Rothenberg M, Roman G,etal..CTR1, a negative regulator of the ethylene response pathway inArabidopsis, encodes a member of the raf family of protein kinases [J]. Cell, 1993, 72(3):427-441.
[18] Ju C, Yoon G M, Shemansky J M,etal.. CTR1 phosphorylates the central regulator EIN2 to control ethylene hormone signaling from the ER membrane to the nucleus inArabidopsis[J]. Proc. Natl. Acad. Sci. USA, 2012, 109(47): 19486-19491.
[19] Alonso J M, Hirayama T, Roman G,etal.. EIN2, a bifunctional transducer of ethylene and stress responses inArabidopsis[J]. Science, 1999, 284(5423): 2148-2152.
[20] Wen X, Zhang C, Ji Y,etal.. Activation of ethylene signaling is mediated by nuclear translocation of the cleaved EIN2 carboxyl terminus[J]. Cell Res., 2012, 22(11): 1613-1616.
[21] Qiao H, Chang K, Yazaki J,etal.. Interplay between ethylene, ETP1/ETP2 F-box proteins, and degradation of EIN2 triggers ethylene responses inArabidopsis[J]. Gene. Dev., 2009, 23(4): 512-521.
[22] Solano R, Stepanova A, Chao Q,etal.. Nuclear events in ethylene signaling: A transcriptional cascade mediated by ethylene-insensitive3 and ethylene-response-factor1[J]. Gene. Dev., 1998, 12(23): 3703-3714.
[23] Cao W, Liu J, He X J,etal.. Modulation of ethylene responses affects plant salt-stress responses [J]. Plant Physiol., 2007, 143(2): 707-719.
[24] Yang C, Ma B, He S,etal.. Maohuzi6/ethylene insensitive3-like1 and ethylene insensitive3-like2 regulate ethylene response of roots and coleoptiles and negatively affect salt tolerance in rice[J]. Plant Physiol., 2015, 169(1): 148-165.
[25] Wu D, Ji J, Wang G,etal..LchERF, a novel ethylene-responsive transcription factor fromLyciumchinense, confers salt tolerance in transgenic tobacco[J]. Plant Cell Rep., 2014, 33(12): 2033-2045.
[26] Bishop G, Yokota T. Plants steroid hormones, brassinosteroids: Current highlights of molecular aspects on their synthesis/metabolism, transport, perception and response[J]. Plant Cell Physiol., 2001, 42(2): 114-120.
[27] Mori M, Nomura T, Ooka H,etal.. Isolation and characterization of a rice dwarf mutant with a defect in brassinosteroid biosynthesis[J]. Plant Physiol., 2002, 130(3): 1152-1161.
[28] Deslauriers S, Larsen P. FERONIA is a key modulator of brassinosteroid and ethylene responsiveness inArabidopsishypocotyls[J]. Mol. Plant, 2010, 3(3): 626-640.
[29] Hansen M, Chae H, Kieber J. Regulation of ACS protein stability by cytokinin and brassinosteroid[J]. Plant J., 2009, 57(4): 606-614.
[30] Divi U, Krishna P. Overexpression of the brassinosteroid biosynthetic geneAtDWF4 inArabidopsisseeds overcomes abscisic acid-induced inhibition of germination and increases cold tolerance in transgenic seedlings[J]. J. Plant Growth Regul., 2010, 29(4): 385-393.
[31] Ma B, He S, Duan K,etal.. Identification of rice ethylene-response mutants and characterization of MHZ7/OsEIN2 in distinct ethylene response and yield trait regulation[J]. Mol. Plant, 2013, 6(6): 1830-1848.
Map-basedCloningandFunctionAnalysisofRiceDwarfMutantD814
CHEN Xinbing, HUANG Rongfeng*, WANG Juan*
BiotechnologyResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China
Plant height confers important effects on crop yield in rice, which is regulated by many aspects in the growth and development process. Ethylene is one of important factors for regulating plant growth and stress response. In this research, we identified a mutantD814 from the mutants insensitive to ethylene in roots growth.D814 mutants showed the dwarf phenotype, decreased effective tilling numbers and reduced 1000-grain weight. Map-based cloning indicated thatD814 located in 1 cM range on chromosome 1, in which there contained six genes contributed to dwarf phenotype in the previous researches. Sequencing analyses demonstrated thatOsBRI1(LOC_Os01g52050) has a point mutation at 1 837 bp downstream of ATG, in which the G is changed to T. There were two homologous genes ofOsBRI1 in rice,OsBRL1 andOsBRL3, of which the sequences have no mutation inD814 mutants. A reported mutant ofOsBRI1,gsor300084, also showed decreased sensitivity to ethylene in root. Due to the function of OsBRI1 was a receptor in brassinosteroid (BR) signal pathway, we found the expressions of BR-response genes were affected inD814, which indicated thatD814 was an allele mutant ofOsBRI1. Moreover, our analyses showed thatD814 affected the expression levels of ethylene signaling-related genes and displayed increased salt tolerance. Thus our research provided a novel research material for exploring the molecular mechanism of ethylene regulating rice growth and stress tolerance, and laid a foundation for investigating the interplay of ethylene and brassinosteroid in growth and development.
rice; ethylene; dwarf; map-based cloning; salt stress response
2017-05-10;接受日期2017-07-10
国家自然科学基金项目(31470366)资助。
陈新兵,硕士研究生,研究方向为水稻新基因发掘与功能研究。E-mail:chenxinbing_caas@163.com。*通信作者:黄荣峰,研究员,主要从事植物激素与逆境胁迫应答研究。E-mail:rfhuang@caas.cn;王 娟,助理研究员,主要从事作物蛋白质功能研究。E-mail:wangjuan@caas.cn
10.19586/j.2095-2341.2017.0040
