啤酒中源自酒花α-酸的苦味物质研究进展
2018-01-03郝俊光周月南尹花余俊红董建军
郝俊光,周月南,尹花,余俊红,董建军
1(青岛啤酒股份有限公司,啤酒生物发酵工程国家重点实验室,山东 青岛, 266100) 2 (钦州学院 食品工程学院,广西 钦州,535011)
啤酒中源自酒花α-酸的苦味物质研究进展
郝俊光1,2,周月南1,尹花1,余俊红1,董建军1
1(青岛啤酒股份有限公司,啤酒生物发酵工程国家重点实验室,山东 青岛, 266100) 2 (钦州学院 食品工程学院,广西 钦州,535011)
提升啤酒风味稳定性是当前啤酒界公认的技术难点与研究热点。贮存过程中啤酒苦味强度的下降、苦感由舒服的苦感向粗糙和后苦的苦感转化,是啤酒风味老化的重要表现。随着分离纯化以及鉴定检测水平的提升,国外同行对可能引起啤酒苦味粗糙与后苦的物质和反应机理进行了系统的研究,取得了突破性的进展。文中对啤酒酿造中源自酒花α酸的苦味物质,尤其是引起啤酒后苦与粗糙的三环和四环异α-酸降解产物的特性及产生机理进行了系统的介绍,旨在提升国内同行对啤酒苦味质量的认知。
啤酒;酒花;苦味物质;后苦;粗糙;三环;四环;综述
啤酒作为一种传承久远的饮料,其宜人的香味、舒服的苦味是吸引消费者的主要因素。提升啤酒风味稳定性、延缓啤酒的老化是当前啤酒行业的研究热点和难点[1-4]。啤酒老化可分为气味劣化和味觉劣化两方面[4-7]。啤酒气味劣化表现为啤酒的典型风味如醇酯等浓度的下降和老化醛(如反-2-壬烯醛)等高风味活性挥发性老化物质的增加[1-4];味觉的劣化则表现为甜味的增加、苦味强度的降低以及苦感由舒服向粗糙、后苦的劣变[4-7]。
延缓啤酒味觉与气味的劣化对提升啤酒风味稳定性有着同等重要的作用。人们对于引起啤酒老化气味的原因研究较多,长久以来,由于检测鉴定技术的落后限制了人们对引起苦感劣变的微量成分的认知,只能通过跟踪α-酸、异α-酸等主成分的衰减推测可能是源自它们的氧化或降解反应新产物改变了啤酒的苦味强度和苦味质量[8-10]。近十余年来,国外研究者借助高精度核磁共振及高分辨质谱HPLC MSMS等技术,开始对啤酒酿造和贮存过程源自α-酸的微量苦味衍生物质的结构进行鉴定,并对其变化规律和反应机理和特性进行了探讨[11-21]。
1 啤酒苦味的复杂性
啤酒的苦味来源非常复杂,除源自酒花苦味酸的成分外,还有来自酿造过程的苦味肽、氨基酸、多酚等成分[8]。生产实践过程中,人们认识到啤酒苦味质量与酒花品种、酒花添加方式和工艺、啤酒生产实践、贮存条件等有关[22-28]。
源自酒花的啤酒苦味物质很多,包括聚酮类物质(如α、β酸)、 聚查尔酮类物质(如黄腐酚)以及麦汁煮沸过程中相关转化物(如异α-酸、葎草灵酮、希鲁酮、异黄腐酚等)、异α-酸的还原制品等[11-21]。不同酒花苦味物质的苦味强度和质量不同,而异α-酸对啤酒苦味贡献最大。RIGBY等[29]认为异合葎草酮比例高会引起粗糙且强烈的苦感[22-28],而WACKERBAUER等[30]、 KUSCHE等[31]则提出相反的观点。不过,在当前的酿造实践中很多酿酒师仍坚持将降低啤酒的异合葎草酮比例作为提升啤酒苦味质量的一个有效途径。
苦感不仅与苦味物质组成有关,还受到啤酒基体物质的影响。OLADOKUN等[32-33]报道啤酒中过量多酚的存在会促使酒花苦味酸含量高的啤酒产生粗糙和后苦味,酒花香气的组成和强度明显影响人们对啤酒的苦味强度和质量的评价。
长久以来,人们一直试图对啤酒在酿造和贮存过程中苦味强度和质量的变化实质进行探讨,但由于检测鉴定技术的落后,制约了啤酒贮存过程中苦味质量由舒服的苦感向粗糙和后苦苦感转变的内在认知。很明显,酒花中的苦味物质(软树脂如α、β酸、硬树脂如黄腐酚)及其衍生物是啤酒苦味的主要来源物质。最近10年,高分辨质谱HPLC MSMS等技术的应用,人们对α-酸、β酸的衍生物及硬脂酸的组成取得了突破性的进展[11-21]。为系统介绍国外在酒花苦味物质及其衍生物在啤酒酿造和贮存过程的组成变化和特性等方面的认知,本团队将分别对源自酒花α-酸的苦味物质和源自β酸及硬脂酸的苦味物质进行综述。
2 源自酒花α-酸的苦味物质的特性和生成机理
2.1 α-酸
酒花中α-酸是啤酒苦味的主要来源,最高可占酒花干物质的17%以上,由6种含不同酰基侧链的同系物构成[34]。其中合葎草酮、葎草酮和加葎草酮占α-酸的98%,而后葎草酮、前葎草酮、加前葎草酮只占不到2%,6者的侧链分别是甲基乙基、2-甲基丙基、1-甲基丙基、乙基、甲基丁基、戊基。由于后3者含量甚微,下文不做讨论。尽管α-酸具有一定的苦味,但由于其相对疏水性高、酿造损失大等原因,决定了α-酸自身对Lager啤酒苦味贡献较少[35]。
α-酸对酿酒的重要意义是在加热条件下异构化生成啤酒苦味的主要贡献物质-异α-酸。随着科技的进步,人们认识到由α-酸衍生出的苦味物质远不止异α-酸。图1列出了目前已确认的源自α-酸的所有苦味物质,分别α-酸(1)、异α-酸(2、3)、葎草灵酮(4)、三环和四环异α-酸降解产物(5-9)、葎草酸(10、11)、同异α-酸(12、13)及其过氧化物(14、15)和羟基化物(16、17)、三环葎草乳醇(18)、天蝎葎草酮(19)、同葎草灵酮的过氧化物(20)和羟基化物(21)。

注:1a-c、葎草酮;2a-c、反式异葎草酮;3a-c、顺式异葎草酮;4a-c、葎草灵酮;5a-c、三环葎草醇;6a-c、三环葎草烯;7a-c、异三环葎草烯;8a-c、四环葎草醇;9a-c、差向异构四环葎草醇;10a-c、反式葎草酸;11a-c、顺式葎草酸;12a-c、反式同异葎草酮;13a-c、顺式同异葎草酮;14a-c、氢过氧化-反式同异葎草酮;15a-c、氢过氧化-顺式同异葎草酮;16a-c、羟基-反式同异葎草酮;17a-c、羟基-顺式同异葎草酮;18a-c、三环葎草乳醇;19a-c、天蝎葎草酮;20a-c、4′-氢过氧化-同葎草灵酮;21a-c、4′-羟基-同葎草灵酮。注侧链 R是 -CH(CH3)2的为a,合;侧链 R是-CH2CH(CH3)2的为b,/;侧链 R是-CH(CH3)CH2CH3的为c、加。如1a、合葎草酮;1b、葎草酮;1c、加葎草酮;依次类推。图1 源自酒花α-酸的苦味衍生物质[14,16-17]Fig.1 Bitter compounds in beer originated from hop α-acids
2.2 异α-酸
在麦汁煮沸过程中,α-酸会发生重排、环化、氧化等多种反应[36],而异构化成异α-酸是酒花在啤酒酿造过程中最主要的反应。异α-酸的形成机理是α-酸通过经质子化和酮醇重排,形成了五环上有两个手性碳原子的顺反异α-酸混合物[36-37]。每种异α-酸有顺式和反式两种异构体,顺式是指4位碳原子上羟基和5位碳原子的异戊烯基在-五环结构同一侧,反式则相反。-α-酸异构化成顺式和反式异α-酸的反应活化性能不同,顺式较反式高9 kJ/mol,因而顺式异α-酸的热稳定更强[38]。
传统的酒花添加方式下麦汁煮沸过程α-酸异构化率约为50%~60%,而最终啤酒的α-酸利用率仅约35%~40%[9-10,38]。煮沸的工艺、酒花添加的形式、煮沸强度、麦汁浓度以及酒花品种等均可影响啤酒的异构化率[9,38]。而发酵过程中酵母的吸附、二氧化碳溢出、过滤介质的阻挡等均会造成异α-酸的损失,从而降低酒花α-酸的最终利用率[10,37]。ONO等[39]和IRWIN等[40]证实煮沸过程中合葎草酮的异构化率明显高于葎草酮和加葎草酮。HUGHES等[41]证实异合葎草酮亲水性较强、在发酵中的损失相对少,导致其在成品啤酒异α-酸中的占比提高[41]。Lager啤酒22 ℃贮存9个月,啤酒的顺反异α-酸比(T/C)可由原来的0.4降至0.15左右,降幅明显,T/C可用于指示啤酒老化程度[10]。
异α-酸的阈值为5 mg/L,但不同的异α-酸同系物的苦味强度不同。KAPPLER等[42]发现顺反异构异葎草酮混合物比单纯的反式异葎草酮更苦。HUGHES等[43]发现顺式异α-酸比对应的反式异α-酸苦、异葎草酮比异合葎草酮更苦。
2.3 葎草灵酮
酒花贮存和麦汁煮沸过程中均会生成葎草灵酮。葎草灵酮较对应的异α-酸在五环上多了一个羟基,且只存在反式结构,反应机理尚不完全清楚[15-16,36]。ALGAZZALI等[44]将纯化的葎草灵酮与异α-酸进行苦味强度对比,得出葎草灵酮的苦味是异α-酸的66%,且苦感柔和。麦汁煮沸过程中有不到10%的α-酸转化成葎草灵酮,葎草灵酮对Lager啤酒的酒花苦味影响较少,但该物质对大量干加酒花的IPA啤酒的作用不能被忽略[22,36]。MAYE等[22]发现在干加啤酒中葎草灵酮的含量可高达24 ppm,且过高含量的葎草灵酮会加剧酿造过程异α-酸的损失。
2.4 三环和四环异α-酸降解产物
麦汁煮沸、啤酒发酵和贮存过程中异α-酸会发生降解反应。INTELMANN等[11-12]利用NMR和LC MS证实了反式异α降解成三环葎草醇、三环葎草烯、异三环葎草烯、四环葎草醇及异四环葎草醇的存在,且证实它们是引起啤酒的后苦和苦味劣化的主要原因。三四环异α-酸降解产物生成的机理[11](见图2)是反式异α-酸异己烯酰侧链的碳离子质子化后形成中间态正碳离子A,被另一异戊二烯侧链上的次甲基碳原子的π-电子云攻击从而环化形成过渡态正碳离子B。B受异戊二烯侧链上烯碳离子的攻击形成过渡态正碳离子C,C可经水分子亲核加合生成三环葎草醇(5)或失掉不同位置的一个氢离子生成两种不饱和的三环葎草烯(6、7)。而正碳离子B与水分子结合后生成过渡态醇D,其酰基侧链上羰基质子化后诱发了异戊烯侧链和羰基侧链的分子间环化,从而形成构像不同的四环物质(8,9)[11]。

图2 异α-酸的三环(5-7)和四环(8、9)降解反应途径 Fig.2 Proposed degradation pathway for tri- and tetra-cyclic compounds originated from iso α-acids
2.5 葎草酸
葎草酸由异α-酸在有氧条件下的自氧化产生[16,45],反应途径见图3。由于空间阻隔的原因,反式-异葎草酮不能直接转化成葎草酸。反式-异葎草酮须先转化成葎草酮,再转变成顺式-异葎草酮,然后由顺式-异葎草酮转化成葎草酸;而顺式-异葎草酮可直接转换成反式葎草酸,也或先生成顺式葎草酸,并进一步转化成反式葎草酸[16,45]。
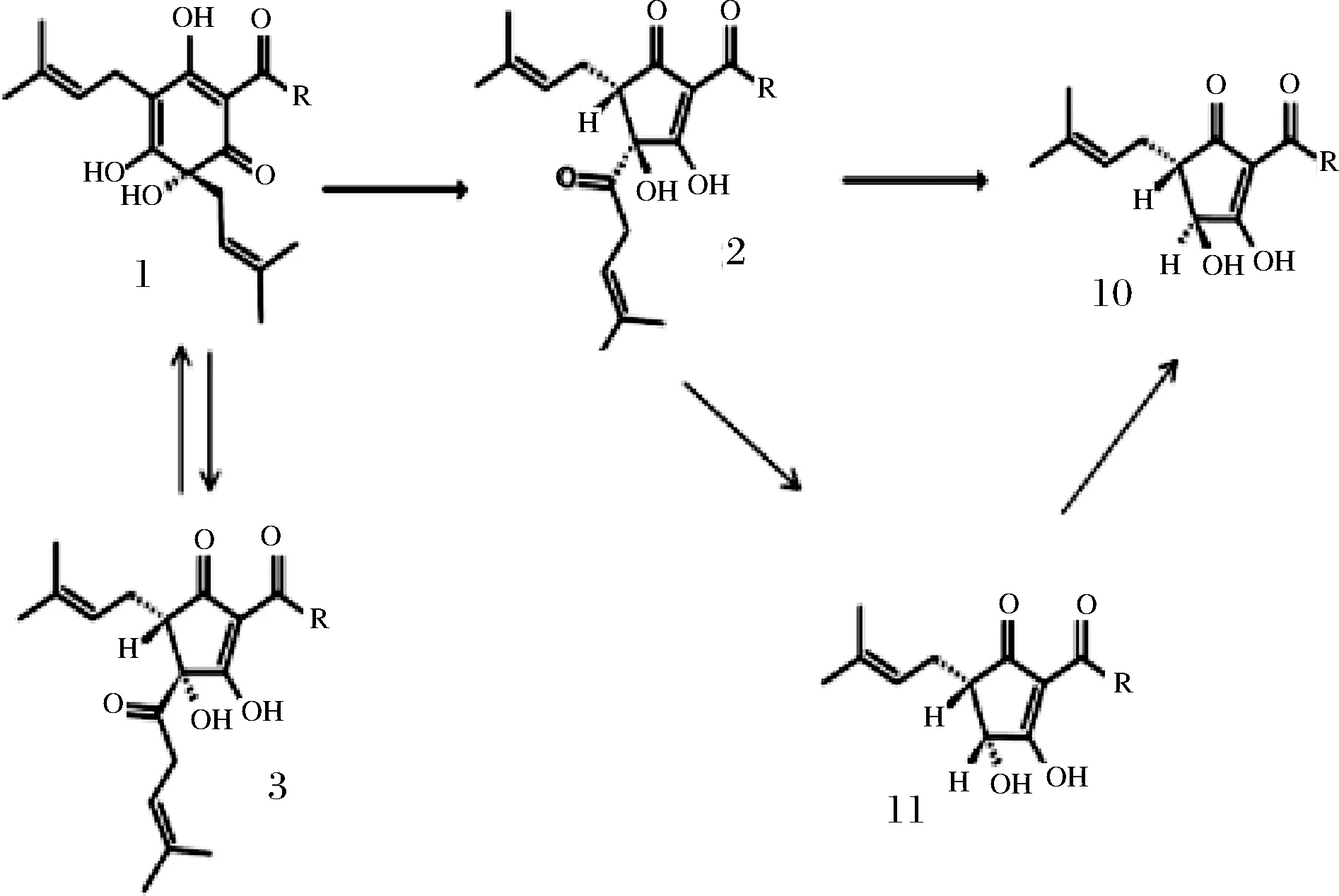
图3 形成顺式-异葎草酸(10)、反式-异葎草酸(11)的反应途径[16,45]Fig.3 Proposed reaction pathway for the formation of trans- and cis-humulinic acids
2.6 葎草灵酮的过氧化物和羟基化物
氢过氧化异α-酸和羟基异α-酸会由顺反异α-酸产生[14],能在贮存的啤酒中检测出来。反应机理(见图4)跟脂肪酸自氧化相似[14]。首先异α-酸上的一个氢原子被起始自由基夺走从而在异己烯酰基的侧链上形成共振稳定的自由基。该自由基跟活性氧结合形成过氧化自由基,而该自由基又可以作为起始自由基作用于其他异α-酸上引起链式反应,从而形成氢过氧化物异α-酸。氢过氧化物异α-酸在过渡粒子如Fe2+或光的作用下,裂解成烷氧基自由基,并从氢供体得到一个氢便生成了羟基异α-酸[14]。

图4 形成同异葎草酮的过氧化物(14、15)和羟基化物(16、17)的反应途径Fig.4 Proposed reaction pathway for the formation of cis- and tran-hydroperoxy-alloisohumulones & hydroxyl-alloisohumulones
2.7 三环合葎草乳醇与天蝎葎草酮
INTELMANN等[16]首次在用NMR和LC MS技术证实了三环合葎草乳醇与天蝎葎草酮的存在,推测反应机理(见图5)是:反式异α-酸(2)自氧化生成氢过氧化-反式同异葎草酮(14),再经FENTON降解生成烷氧自由基a,进而生成羟基-反-同异葎草酮(16)。 烷氧-自由基a生成环氧中间物b,发生与脂肪酸自氧化一样的重排、过氧化反应,生成半缩酮c。c释放出一个丙酮酸,然后烯醇化,生成含氧醛d,再经类似由异α-酸变成三环苦味物质生成的质子催化的环化反应,生成正态碳原子e。e经结合一个分子的水后环化闭合,生成了半缩醛三环葎草乳醇(18)。羟基-反-同异葎草酮(16)生成天蝎葎草酮的过程,类似由异α-酸变成三环苦味物质生成的质子催化的环化反应。起始的环化是将己烯基链上的酮转化成羟基,进而生成正碳离子f,而后结合一个水分子,形成叔丁醇g。烯丙基经质子催化脱水后与叔丁醇发生亲核反应,从而环化成天蝎合葎草酮(19)[16]。
2.8 同α-酸及其过氧化物和羟基化物
TANIGUCHI等[17]首次报道了4′-羟基同葎草灵酮在酒花贮存过程中的存在。4′-羟基同葎草灵酮是葎草灵酮的氧化产物[17],生成路径与INTELMANN等[17]建议的异α-酸生成羟基同合葎草酮的路径相同[16-17](见图6)。
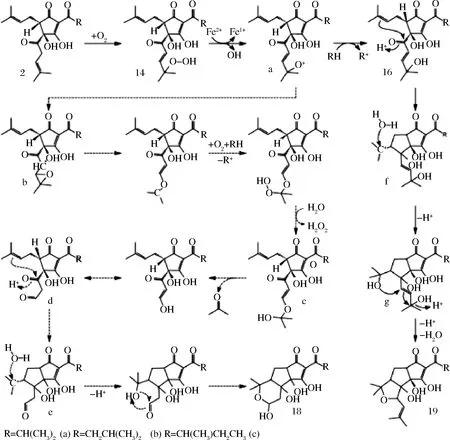
图5 形成三环葎草乳醇(18)和天蝎葎草酮(19)的反应途径Fig.5 Proposed reaction pathway for the formation of tricyclochumulactols(18),scorpiohumols(19)
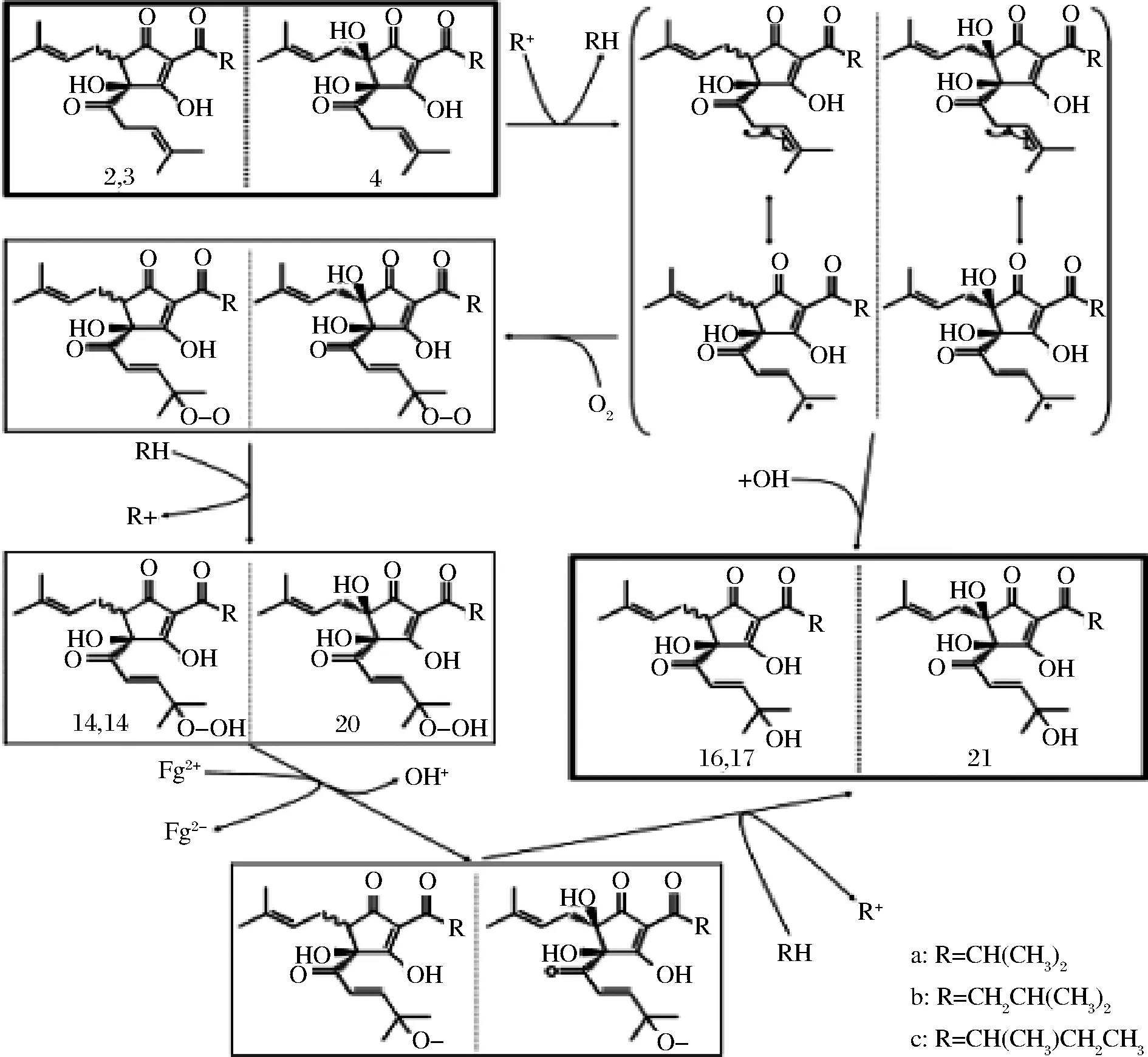
图6 形成4′-氢过氧化-同葎草灵酮(20)、4′-羟基-同葎草灵酮(21)的反应途径Fig.6 Proposed reaction pathway for the formation of 4′-hydroperoxy-allohumulinones(20),4′-hydroxy-allohumulinones(21)
3 α-酸、异α-酸及衍生物在酿造、贮存过程的变化
INTELMANN等[12]首次发现啤酒贮存过程中反式异α-酸(2)在贮存条件下降解生成三和四环降解产物[12],并通过纯化和反添加试验证实这些降解产物是啤酒贮存过程中引起后苦和苦味粗糙的直接原因。他们通过三杯法确定出5%pH4.4水溶液中这些物质的阈值(见表1)[12],发现三环合葎草烯和异三环合葎草烯的阈值较低,分别是5和10 μmol/L,比前驱体反式异合葎草酮的阈值还低。三环葎草醇和四环葎草醇、差向异构四环葎草醇的阈值则相对较高[12]。由于苦味质是基于275 nm波长下吸光值的参数,α-酸、异α-酸的衍生物在此波长下多有吸收[5,9]。根据笔者的经验,苦味质在啤酒贮存过程中波动极小,故用传统的苦味质检测方法很难表征出苦味物质的变化。由于检测三元和四元环等降解产物需要高精度HPLC-MS-MS等成本昂贵的设备,所以目前此类物质在酿造和贮存过程的变化的研究仍局限在INTELMANN等人的实验室。目前α-酸相关衍生产物在贮存和酿造过程中的变化情况跟踪是片面和碎片化的,尚未形成系统的认识,本文按啤酒酿造、啤酒贮存和酒花贮存过程的变化情况进行总结。

表1 反式异葎草酮及其降解产物的阈值Table 1 Threshold concentrations of trans-isocohumulone and its tri- and tetra-cyclic degradation compounds
3.1 酿造过程的变化
HASELEU等[15]跟踪了麦汁煮沸和发酵过程中α-酸(1)、异α-酸(2、3)、葎草灵酮(4)、三环葎草酮(5)、葎草酸(10、11)、羟基同异葎草酮(14、15)、羟基同异葎草酮(16、17)苦味物质的变化,比较了麦汁和成品啤酒苦味物质的差异。麦汁、不同时期的发酵液1-6、啤酒为同一酿造过程的样品。α-酸(1)在麦汁中含量很高,但在啤酒中含量非常少,麦汁中1a、1b、1c含量分别是啤酒中8、17、25 倍。同时,麦汁中的异α-酸浓度高于对应的啤酒,且无论顺式还是反式,异合葎草酮(2a、3a)的利用率和异构化率均高于对应的异葎草酮(2b、3b)。煮沸过程中,α-酸(1)除了异构化外,还有约10%转化成对应的葎草灵酮(4),在啤酒酿造过程略有下降, 4a、4b、4c在啤酒中的含量分别占初始α-酸的6%、6.6%、7.4%。葎草酸(10、11)、羟基同异葎草酮(14、15)、羟基同异葎草酮(16、17)等异α-酸氧化产物在麦汁中就已存在,三者总和约占初始α-酸的4.1%,其中7b、15b、16b的含量相对较高。三环葎草酮(5)在麦汁中无检出,但在发酵液和成品啤酒中有检出,或许与啤酒发酵过程中pH降低相关[15]。
3.2 啤酒贮存过程的变化
INTELMANN等[12]通过对不同贮存条件下啤酒的苦味物质进行跟踪比对,发现贮存温度越高、贮存时间越长、啤酒pH越低,越能加速生成反式异α-酸的降解成三环葎草酮(5)、三环合葎草烯(6)、异三环合葎草烯(7)、四环葎草醇(8)、差向异构四环葎草醇(9)。INTELMANN等[14]对新鲜啤酒(啤酒1)、28 ℃贮存8个月(啤酒2)、玻璃瓶装室温放置4年的啤酒(啤酒3)、室温放置10年的啤酒(啤酒4)、室温放置4年的PET瓶装啤酒(啤酒5)、新鲜啤酒22 ℃条件下与氧接触24 h后的酒样(啤酒6)的异α-酸(2、3)、三环葎草酮(5)、氢过氧化同异葎草酮(14、15)、羟基同异葎草酮(16、17)进行了跟踪检测。发现新鲜啤酒中就已经存在异α-酸降解产物三环葎草酮(5),在玻璃瓶装4年、PET瓶装的4年啤酒中含量更高。反式异α-酸在贮存4年的两种瓶装形式啤酒中的含量都极低,但不同的是,顺式异α-酸(3)在PET瓶中含量甚微,在玻璃瓶装的啤酒中却大量存在。可能的解释是,PET瓶能够渗入较多的空气,而顺式异α-酸被渗入的氧气氧化掉了,但有意思的是在PET瓶装4年啤酒的氢过氧化同异葎草酮(14、15)、羟基同异葎草酮(16、17)含量却甚微。为了解释这一现象,INTELMANN等[14]做了验证实验。将啤酒在有氧条件下室温反应24 h进行检测,发现啤酒中顺式异α-酸(3)含量下降,而羟基同异葎草酮(14、15)、羟基同异葎草酮(16、17)明显呈现上升趋势,而氢过氧化同异葎草酮(14b、15a、15b)、羟基同异葎草酮(16b、17a)增加显著。据此,INTELMANN等[14]认为羟基同异葎草酮(16、17)虽在有氧条件下可以迅速产生,但这类物质也不稳定,会逐渐转化成其他物质,不能作为啤酒氧化的指示剂[14]。
INTELMANN等[16]虽然在溶液模型中鉴定出三环葎草乳醇(18)、天蝎合葎草酮(19),并对其形成机理进行了推测,但并未在啤酒实际样品中检出这些物质。为确认贮存时间对玻璃瓶装啤酒的α-酸衍生产物含量的影响,INTELMANN等[16]对市售啤酒在28 ℃暗处贮存582 d的啤酒每隔两周取样检测α-酸(1)、异α-酸(2、3)、葎草灵酮(4)、三环葎草酮(5)、三环合葎草烯(6)、异三环合葎草烯(7)、四环葎草醇(8)、差向异构四环葎草醇(9)、葎草酸(10、11)、氢过氧化同异葎草酮(14、15)、羟基同异葎草酮(16、17)的含量,结果见图7。很明显,α-酸(1)、反式异α-酸(2)和葎草灵酮(4)在贮存过程中降幅明显,而顺式异α-酸(3)在长期贮存过程中略有下降。据此,INTELMANN等[16]推断合葎草酮的半衰期是100 d、葎草灵酮(4b)和反式异合葎草酮(2a)半衰期均为140天左右。贮存过程中,葎草酸(10、11)增加明显,甚至在反式异α-酸完全消耗殆尽后仍有增加,可能与顺反葎草酮可由顺式异α-酸反应而来有关。三环葎草酮(5)、三环合葎草烯(6)、异三环合葎草烯(7)、四环葎草醇(8)、差向异构四环葎草醇(9),作为反式异α-酸(2)的质子催化的降解产物,在贮存过程中一直增加,达到峰值后并无降低趋势,可以推测这些物质是降解反应的稳定终产物[16]。反式氢过氧化同异葎草酮(14)在贮存过程中呈下降趋势,而顺式氢过氧化同异葎草酮(15)呈上升趋势。反式羟基同异葎草酮(16)呈先升后降的趋势,而顺式羟基同异葎草酮(17)呈上升趋势。
INTELMANN等[16]进一步对市售啤酒的pH、贮存温度进行研究,提出降低pH、降低贮存温度和缩短贮存时间对抑制反式异α-酸降解成三环葎草酮(5)、三环合葎草烯(6)、异三环合葎草烯(7)、四环葎草醇(8)、差向异构四环葎草醇(9)等粗糙和后苦物质的生成是提高苦味稳定性的有效方式。
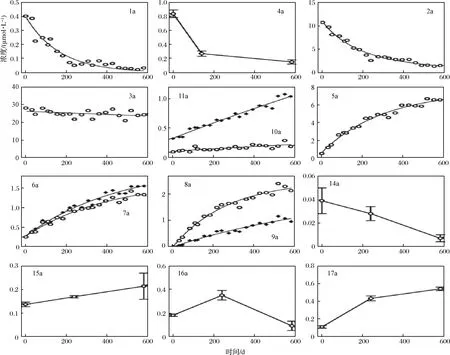
图7 贮存时间对啤酒中源自酒花α-酸的苦味物质的影响Fig.7 Influence of time on the concentrations of bitter compounds in beer originated from hop α-acids during storage of beer at 28 ℃
3.3 酒花贮存过程的变化
TANIGUCHI等证实4′-氢过氧化-同葎草灵酮(20)、4′-羟基-同葎草灵酮(21)由酒花α-酸的氧化产物进一步转化而来,并发现葎草灵酮不稳定,很容易转变成4′-羟基-同葎草灵酮(21)。酒花20 ℃条件下贮存4周后,α-酸浓度由初始的86.9 μmol/g降至37.0 μmol/g,而葎草灵酮和4′-羟基-同葎草灵酮升为32.3和27.0 μmol/g,分别是初始值的17% 和 14%。酒花40 ℃贮存8个周后,α-酸仅为初始值的5%。葎草灵酮在前3周达到峰值33.2 μmol/g,随后急剧下降;而4′-羟基-同葎草灵酮在前2-5周增幅明显,而6周后增幅变缓直至11周时达到峰值51.3 μmol/g,占α-酸初始值的27%。据此,可以肯定4′-羟基-同葎草灵酮是由葎草灵酮降解而来的。酒花60 ℃贮存时相关物质的变化曲线与40 ℃的相似,只不过反应速度高了10倍。α-酸只用72 h降为初始值的5%,而葎草灵酮在48 h达到峰值后迅速降解,而4′-羟基-同葎草灵酮在144 h达到峰值后缓慢下降。目前尚未在啤酒中鉴定出4′-羟基-同葎草灵酮[17]。
4 展望
α-酸相关衍生产物的形成机理和检测技术的有益探讨为人们认知啤酒的苦味质量、提高啤酒苦味稳定性提供了技术支撑。如何降低三环和四环降解产物的含量,无疑是啤酒酿造行业降低后苦粗糙的努力方向之一。降低贮存温度和适当提高酒液pH是目前简单可行的提升苦味稳定性的策略。而随着科技的进步,或许有更多的含量甚微却对苦感影响大的苦味物质被鉴定出来,进一步完善人们对啤酒苦味控制的认知。长远而言,如能实现在啤酒酿造中使用纯品顺式异α-酸,或许是从根本上解决啤酒苦味稳定性问题的理想手段。国内相关研究机构,如能积极开发酒花(异)α-酸相关衍生产物的检测能力,结合国产主流淡爽性啤酒的特点探讨其变化规律,必将为国内啤酒行业提高苦味质量的整体控制提供技术支持。
[1] VANDERHAEGEN B,NEVEN H,COGHE S,et al.Evolution of chemical and sensory properties during aging of top-fermented beer[J].Journal of Agricultural and Food Chemistry,2003,51:6 782-6 790.
[2] VANDERHAEGEN B,DELVAUX F,DAENEN L,et al.Aging characteristics of different beer types [J].Food Chemistry,2007,103:404-412.
[3] SCHIEBERLE P.Primary odorants of pale lager beer.Differences to other beers and changes during storage [J].Zeitschrift für Lebensmittel-Untersuchung und Forschung,1991,193:558-565.
[4] VANDERHAEGEN B,NEVEN H,VERACHTERT H,et al.The chemistry of beer aging - a critical review [J].Food Chemistry,2006,95:357-381.
[5] CABALLERO I,BLANCO A,PORRASISO M.Iso-α-acids,bitterness and loss of beer quality during storage [J].Trends in Food Science and Technology,2012,26:21-30.
[6] SCHONBERGER C,KOSTELECKY T.125th Anniversary review:the role of hops in brewing [J].Journal of the Institute of Brewing,2011,117(3):259-267.
[7] STEENACHERS B,COOMAN L D,VOS D D.Chemical transformations of characteristic hop secondary metabolites,in relation to beer properties and the brewing process:A review [J].Food Chemistry,2015,172:742-756.
[8] MEILGAARD M.Hop analysis,cohumulone factor and the bitterness of beer:review and critical evaluation [J].Journal of the Institute of Brewing,1960,66(1):35-50.
[9] KAPPLER S,KRAHL M,GEISSINGER G.Degradation ofiso-α-acids during wort boiling[J] .Journal of the Institute of Brewing,2010,116(4):332-338.
[10] ARKI S,TAKASHIO M,SHINOTSUKA K.A new parameter for determination of the extent of staling in beer [J].Journal of the American Society of Brewing Chemists,2002,60(1):26-30.
[11] INTELMANN D,DEMMER O,DESMER N.18O stable isotope labeling,quantitative model experiments,and molecular dynamics simulation studies on thetrans-specific degradation of the bitter tastingiso-α-acids of beer [J].Journal of Agricultural and Food Chemistry,2009,57(22):11 014-11 023.
[12] INTELMANN D,KUMMERLOWE G,HASELEU G,et al.Structures of storage induced transformation products of the beer’s bitter principles,revealed by sophisticated NMR spectroscopic and LC/MS techniques [J].Chemistry:A European Journal,2009,15:13 047-13 058.
[13] INTELMANN D,HASELEU G,HOFMAN T.LC-MS/MS quantitation of hop-derived bitter compounds in beer using the ECHO technique [J].Journal of Agricultural and Food Chemistry,2009,57(4):1 172-1 182.
[14] INTELMANN D,HOFMAN T.On the autoxidation of bitter tastingiso-α-acids in beer [J].Journal of Agricultural and Food Chemistry,2010,58:5 059-5 067.
[15] HASELEU G,LAGEMANN A,STEPHAN A,et al,Quantitative sensomics profiling of hop-derived bitter compounds throughout a full-scale beer manufacturing process[J].Journal of Agricultural and Food Chemistry,2010,58:7 930-7 939.
[16] INTELMANN D,HASELEU G,DUNKEL A,et al,Comprehensive sensomics analysis of hop-derived bitter compounds during storage of beer[J].Journal of Agricultural and Food Chemistry,2011,59:1 939-1 953.
[17] TANIGUCHI Y,MATSUKURA Y,OZAKI H,et al,Identification and quantification of the oxidation products derived from α-acids and β-acids during storage of hops (HumuluslupulusL.) [J].Journal of Agricultural and Food Chemistry,2013,61:3 121-3 130.
[18] Martin DUSEK M,OLSOVSKA J,KROFTA K,et al.Qualitative determination of β-acids and their transformation products in beer and hop using HR/AM-LC-MS/MS [J].Journal of Agricultural and Food Chemistry 2014,62:7 690-7 697.
[19] DRSEL M,DUNKEL A,HOFMANN T,Sensomics analysis of key bitter compounds in the hard resin of hops (HumuluslupulusL.) and their contribution to the bitter profile of pilsner-type beer [J].Journal of Agricultural and Food Chemistry,2015,63:3 402-3 418.
[20] TANIGUCHI Y ,YAMADA M,TANINGUCHI H,et al.Chemical characterization of beer aging products derived from hard resin components in hops (HumuluslupulusL.) [J].Journal of Agricultural and Food Chemistry,2015,63:10 181-10 191.
[21] DRSEL M,VOGT C,DUNKEL A,et al,The bitter chemodiversity of hops (HumuluslupulusL.) [J].Journal of Agricultural and Food Chemistry,2016,64:7 789-7 799.
[22] MAYE J P,SMITH R,LEKER R,Humulinone formation in hops and hop pellets and its implications for dry hopped beers[J].Technical Quarterly-Master Brewers Association of the Americas,2016,53(1):23-27.
[23] GOIRIS B J,AERTS G,COOMAN L D.Hop α-acids isomerisation and utilisation:an experimental review [J].Cerevisia,2010,35:57-70.
[24] FRITSCH A,SHELLHAMMER T H.Relative bitterness of reduced and nonreducediso-α-acids in lager beer [J].Journal of the American Society of Brewing Chemists,2008,66(2):88-93.
[25] CESLOVA L,HOLCAPEK M,FIDLER M,et al.Characterization of prenylflavonoids and hop bitter acids in various classes of Czech beers and hop extracts using high-performance liquid chromatography-mass spectrometry [J].Journal of Chromatography A,2009,1216(43):7 249-7 257.
[26] MAYTE J P,SMITH R.Dry hopping and its effects on international bitterness unit test and beer bitterness [J].Technical Quarterly-Master Brewers Association of the Americas,2 016,53,(1):134-136.
[27] IGLESIAS C A,BLANCO C A,BLANCO J,et al.Mass spectrometry-based metabolomics approach to determine differential metabolites between regular and non-alcohol beers [J].Food Chemistry,2014,157:205-212.
[28] MALFLIET S,OPSTAELE F,CLIPPELEER J D,et al.Flavor instability of pale lager beers:determination of analytical markers in relation to sensory ageing [J].Journal of the Institute of Brewing,2008,114(2):180-192.
[29] RIGBY F L.A theory on the hop flavor of beer[C].Proceedings of the American Society of Brewing Chemists,1972:46-50.
[30] WACKERBAUER K,BALZER U.Hop bitter compounds in beer.Part II:The influence of cohumulone on beer quality [J].Brewing International,1993,11:116-118.
[31] KUSCHE M,STETTNER G,STEPHAN A,et al.Influence of the new high alpha hop variety Herkules on beer quality [C].Proceedings of the European Brewery Convention Congress Venice,2007,Fachverlag Hans Carl:Nürnberg,Germany,CD ROM 2007,Contribution 24.
[32] OLADOKUN O,TARREGA A,JAMES S,et al.The impact of hop bitter acid and polyphenol profiles on the perceived bitterness of beer [J].Food Chemistry,2016,205:212-220.
[33] OLADOKUN O,TARREGA A,JAMES S,et al.Modification of perceived beer bitterness intensity,character and temporal profile by hop aroma extract [J].Food Research International,2016,86:104-111.
[34] HELMJA K,VAHER M,PUSSA T,et al.Bioactive components of the hop strobilus:comparison of different extraction methods by capillary electrophoretic and chromatographic methods [J].Journal of Chromatography A,2007,222-229.
[35] FRITSCH A,SHELLHAMMER H.Alphα-acids do not contribute bitterness to lager beer [J].Journal of the American Society of Brewing Chemists,2007,65(1):26-28.
[36] KEUKELEIRE S D.Oxidation products of hop α-acids and iso-αacids [J].Cerevisia,1981,2:73-80.
[37] VERZELE M,DEWAELE C,KEUKELEIRE M.Analysis of beeriso-α-acids by high-performance liquid chromatography without sample pre-treatment [J].Journal of Chromatography A,1982,244:321-326.
[38] JASKULA B, KAFARSKI P, AERTS G,et al.A kinetic study on the isomerization of hop α-acids [J].Journal of Agricultural and Food Chemistry,2008,56 (15) :6 408-6 415.
[39] ONO M,KAKUDO Y,YAMAMOTO Y,et al.Quantitative analysis of hop bittering components and its application to hop evaluation [J].Journal of the American Society of Brewing Chemists,1984,42(4):167-172.
[40] IRWIN A J,Murray C,THOMPSON D.An investigation of the relationship between hopping rating,time of boil and individual alpha acid utilization [J].Journal of the American Society of Brewing Chemists,1985,43(3):145-152.
[41] HUGHES P S,MARINOVA G.Variations in iso-alpha-acids distribution and behavior of different products [J].Brewer’s Guardian,1997,126(83):26-29.
[42] KAPPLER S,SCHONERGER C,KROTTENTHALER M,et al.Isohumulone- a review [J].Brewing Science,2010,63:105-111.
[43] HUGHES P S.The significance of iso-alpha acid for beer quality-cambridge prize paper [J].Journal of the Institute of Brewing,2000,106(5):271-276.
[44] ALGAZZALI V,SHELLHAMMER T.Bitterness intensity of oxidized hop acids:bitterness intensity of oxidized hop acids:humulinones and hulupones [J].Journal of the American Society of Brewing Chemists,2016,74(1):36-43.
[45] SCHULZE W G,TING P L,HENCKEL L A,et al.Separation of humulinic acids by reverse-phase high performance liquid chromatography [J].Journal of the American Society of Brewing Chemists,1980,38(1):12-15.
Studyonbittercompoundsinbeeroriginatedfromhopαacid
HAO Jun-guang1,2,ZHOU Yue-nan1,YIN Hua1,YU Jun-hong1,DONG Jian-jun1
1 (Qingdao Brewing Company,State Key Laboratory of Biological Fermentation Engineering of Beer,Qingdao 266100,China) 2 (School of Food Science and technology,Qinzhou University,Qinzhou 535011,China)
It is a common limiting technological problem and research focus for brewing industry worldwide to improve the flavor stability to keep refreshing character of beer in the shelf life of beer as long as possible to attract consumers.A decrease of the bitterness intensity accompanied by a shift of the taste profile toward harsh and long lingering bitter is well known phenomena observed during aging of beer.Using modern purification technologies,such as nuclear magnetic resonance spectroscopy and high resolution HPLC MS,the overseas researchers had took some breakthroughs in study on identification of the compounds responsible for harsh and lingering bitterness during brewing and storage process of beer as well as their possible transformation routes.In this paper,the bitter compounds newly identified from hop a-acid were reviewed in detail.Especially the formation mechanism,thresholds and elution of newly found tri-and tetra-cyclic molecules,namely main iso-α acids degraded compounds,during brewing and storage were introduced.
beer; hop; bitter compounds; harsh; lingering; review
10.13995/j.cnki.11-1802/ts.015341
博士,教授。
青岛创业创新领军人才计划项目:低碳酿造技术及装备的开发与应用(项目编号:13-CX-15)
2017-07-31,改回日期:2017-09-27
