复杂性肝癌的手术切除治疗效果及影响因素分析
2018-01-03冯浩龚伟夏晓华孙涛刘瑞文范仁根
冯浩,龚伟,夏晓华,孙涛,刘瑞文,范仁根
(昆山市第一人民医院肝胆外科1、普外科2,江苏 昆山 215300)
复杂性肝癌的手术切除治疗效果及影响因素分析
冯浩1,龚伟1,夏晓华1,孙涛1,刘瑞文1,范仁根2
(昆山市第一人民医院肝胆外科1、普外科2,江苏 昆山 215300)
目的观察复杂性肝癌的手术切除效果,并探讨其影响因素。方法收集2006年3月至2014年2月昆山市第一人民医院收治的复杂性肝癌患者60例,对患者的肿瘤部位及大小、人肝血流阻断、切除方式、出血量、引流等方面进行回顾性分析。用Kaplan-Meier法计算患者生存率,应用COX模型进行多因素分析。结果术后患者中出现胸腔积液18例,胆瘘6例,腹腔感染2例,膈下积液2例。患者的HbsAg与术后2年或3年生存率无关(P>0.05)。单因素分析发现,患者的肝硬化程度、门静脉癌栓、肿瘤合并包膜及术中出血量等因素均与预后有关(P<0.05);多因素分析结果显示,胆管癌栓、AFP、肿瘤大小、术中输血量(血浆)、术前Child-Pugh分级、第一肝门阻断时间、术时(麻醉时间)等对患者术后生存率无影响(P>0.05),肿瘤子灶或卫星灶、肝硬化程度、门静脉癌栓(一级分支)、术中出血、肿瘤包膜、肝静脉癌栓量等对患者术后生存率均有影响(P<0.05)。结论复杂性肝癌的手术切除明显提高患者的生存率,肿瘤子灶或卫星灶、肝硬化程度、门静脉癌栓(一级分支)、术中出血、肿瘤包膜、肝静脉癌栓量是影响患者术后生存率的因素。
复杂性肝癌;手术切除;单因素分析
原发性肝癌(primary liver cancer,PLC)是指起源于肝细胞或肝内胆管上皮细胞发生的一种恶性肿瘤,是全球最常见的十种恶性肿瘤之一,也是发病率仍在上升的少数几种恶性肿瘤之一,全球每年有45~100万人死于肝癌[1-2],而其中43.7%的肝癌发生在中国,我国的肝癌死亡率在恶性肿瘤死亡率中占第3位,年死亡率为20.40/10万。原发性肝癌起病隐匿,发展迅速,一旦发现多为中晚期,丧失手术机会,而且对放化疗不佳且耐受性差。如果不积极治疗,自然生存时间一般少于3个月[3-4]。目前国内外在肝癌的外科治疗有了很大的进展,情况比较严重的肝癌也可以得到治疗,但是巨大肝癌的治疗和复杂性肝癌手术切除仍有一定的风险[5-7]。但大量研究发现,行肝癌切除术患者的术后5年生存率可以达到40%,这一结果突出了手术切除在复杂性肝癌治疗中发挥的作用[8]。本文旨在观察复杂性肝癌的手术切除效果,并探讨其影响因素。
1 资料与方法
1.1 一般资料 收集昆山市第一人民医院2006年3月至2014年2月进行手术切除的60例复杂性肝癌患者的临床病例资料,其中男性50例,女性10例,年龄27~65岁,中位年龄50岁。HbsAg阴性者占46.6%(28/60),HbsAg 阳性者占 53.4%(32/60)。本研究经我院伦理委员会批准,患者或近亲属对研究方案签署知情同意书。
1.2 入选标准 (1)符合《原发性肝癌的临床诊断与分期标准》[9],经临床诊断或病理确诊为原发性肝癌患者;(2)手术切除肝癌患者术前肝功能为Child-pughA级或B级;(3)无广泛的肝外转移;(4)未见肿瘤残留。
1.3 排除标准 (1)患者因身体情况差不能进行手术切除治疗;(2)肿块<10 cm的大肝癌和小肝癌患者;(3)肿瘤未完全切除,可见肿瘤残留。
1.4方法(1)手术方法:患者采用肝部分切除或半肝切除进行治疗,先进行肝癌瘤灶切除,根据患者的恢复情况特别是肝功能指标,再决定是否进行辅助治疗。在未发现明确的复发灶时,在肝固有动脉灌注化疗药物。(2)术中控制出血的方法:采用选择性入肝血流阻断36例,选择性半肝血流阻断24例。(3)肝切缘和断面的处理方法:电刀烧灼肝断面23例,肝断面对缝闭合35例,肝断面喷生物胶2例。
1.5 研究方法术后随访3年,了解患者术后并发症和生存状况,并分析影响患者生存的因素。
1.6 统计学方法应用SPSS20.0统计学软件进行数据分析,计数资料比较采用χ2检验,P<0.05为差异具有统计学意义。将差异有统计学意义的预后影响因素引入COX逐步回归分析。
2 结 果
2.1 患者的性别、年龄和HbsAg对生存率的影响 研究结果表明,患者的年龄、性别及HbsAg与术后2年或3年生存率无关(P>0.05),见表1。

表1 患者的性别、年龄和HbsAg对术后生存率的影响
2.2 患者术后并发症发生情况 术后患者出现并发症共28例,其中胸腔积液18例(64.2%),胆瘘6例(21.4%),腹腔感染2例(7.10%),膈下积液2例(7.10%),可见并发症中胸腔积液的发生率最高,要对并发症的发生进行预防和及时的治疗。
2.3 病理指标对术后生存率的影响 结果显示,胆管癌栓、AFP、肿瘤大小、术中输血量(血浆)、术前Child-Pugh分级、第一肝门阻断时间、术时(麻醉时间)等对患者术后生存率均无影响(P>0.05);COX模型多因素分析结果显示,肿瘤子灶或卫星灶、肝硬化程度、门静脉癌栓(一级分支)、术中出血、肿瘤包膜、肝静脉癌栓量等对患者术后生存率均有影响(P<0.05),见表2、表3 。
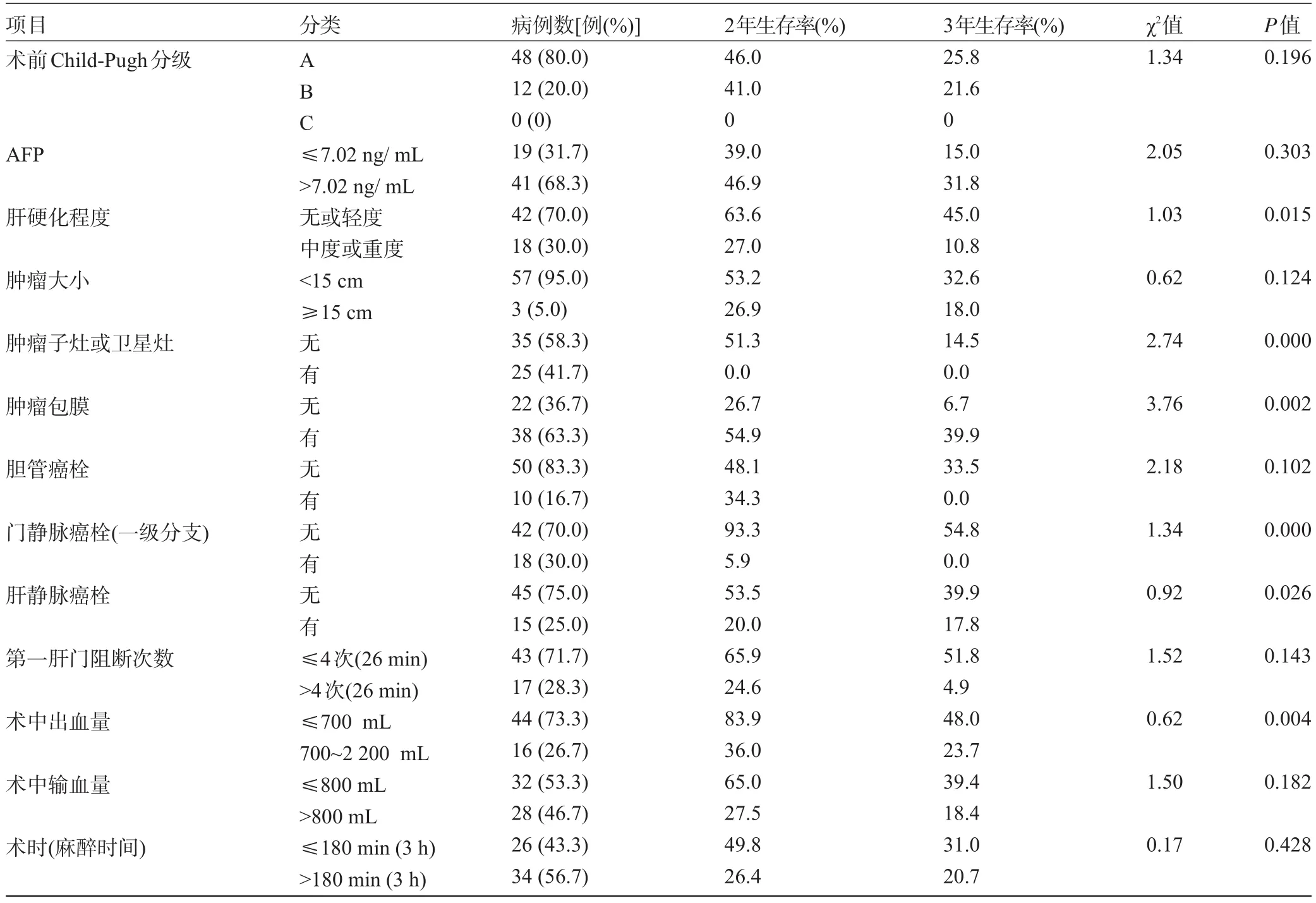
表2 病理指标对术后生存率的影响

表3 影响复杂性肝癌手术切除术后长期生存的COX模型多因素分析
3 讨 论
肝癌是全球最常见的十种恶性肿瘤之一,也是目前发病率仍在上升的少数恶性肿瘤之一[10-12]。手术切除是目前最好的治疗方法,但由于复杂性肝癌的位置特殊,手术切除仍然具有很大的风险,并且术后并发症的发生率较高,复杂性肝癌手术切除术后的预后结果较差。近年来,随着普通外科各种技术的发展,肝切除手术的死亡率和术后并发症发生率大大降低,如何彻底地切除肝脏病灶,充分保留的余肝功能,使患者快速康复,成为外科医师面临的新挑战。目前,肝癌手术切除的难点包括巨大肝癌的切除、特殊部位肝癌切除及腹腔镜下肝癌切除等几方面[13-15]。
本研究通过对60例行复杂性肝癌切除术患者的临床资料及术后身体各项指标进行比较发现:术后患者中出现胸腔积液18例,胆瘘6例,腹腔感染2例,膈下积液2例。患者的HbsAg与术后2年或3年生存率无关。单因素分析发现患者的肝硬化程度、门静脉癌栓、肿瘤合并包膜及术中出血量等因素均与预后有关,实验结果显示胆管癌栓、AFP、肿瘤大小、术中输血量(血浆)、术前Child-Pugh分级、第一肝门阻断时间、术时(麻醉时间)等对患者术后生存率无明显影响,肿瘤子灶或卫星灶、肝硬化程度、门静脉癌栓(一级分支)、术中出血、肿瘤包膜、肝静脉癌栓量等对患者术后生存率影响较大。术前对肿瘤充分评估,选择合适的手术方式,熟悉肝脏解剖,控制术中出血,对复杂性肝癌的切除意义重大。在治疗过程中要时刻观察以上危险因素对患者造成的影响,以便制定有效的治疗方案。针对本次研究中出现的问题提出以下建议:(1)重视肝周韧带的解剖,充分游离肝脏,便于切除肿瘤、控制出血以及肝癌切除后肝断面的处理;(2)应根据肝肿瘤的位置选择合适的切口和体位可获得良好的手术显露,有利于手术的顺利进行;(3)避免及控制术中发生大出血。术后对并发症积极防治,平稳度过围手术期,是安全切除复杂性肝癌的重要砝码。本组有6例右半肝和9例左半肝切除,采用了半肝血流阻断法,仅阻断被切除半肝的造血细胞凋亡的易感性可能还与造血细胞质和量的缺陷、骨髓微环境的缺陷、其他免疫活性细胞如NK细胞、单核细胞异常活化及T淋巴细胞存在不同的激活状态有关,其中造血细胞质和骨髓微环境的缺陷使凋亡信号增强、抗凋亡信号减弱。
综上所述,复杂性肝癌的手术切除明显提高患者的生存率,肿瘤子灶或卫星灶、肝硬化程度、门静脉癌栓(一级分支)、术中出血、肿瘤包膜、肝静脉癌栓量是影响患者术后生存率的因素。
[1]王俊岭,李萍,江智龙,等.联合检测甲胎蛋白和高尔基体蛋白73(ELISA法)对原发性肝癌诊断价值的Meta分析[J].世界华人消化杂志,2015,45(22):3604-3613.
[2]Shen Q,Fan J,Yang XR.Serum DKK1 as a protein biomarker for the diagnosis of hepatocellular carcinoma:a largescale,multicenter study[J].Lancet Oncology,2015,16(1):1225-1229.
[3]Qin W,Shen Q,Gu J.Use of DKK1 as diagnosis marker,WO/2013/181951[P].2014,12(3):125-128.
[4]Pu L,Jing S,Bianqin G,et al.Development of a chemiluminescence immunoassay for serum YB-1 and its clinical application as a potential diagnostic marker for hepatocellular carcinoma[J].Hepatitis Monthly,2015,13(7):544-548.
[5]Li J,Cheng Z J,Liu Y,et al.Serum thioredoxin is a diagnostic marker for hepatocellular carcinoma[J].Oncotarget,2015,6(11):9551-9563.
[6]依马木买买提江·阿布拉,易超,苏雅婷,等.54例复杂性肝癌手术治疗的临床分析[J].中国现代普通外科进展,2015,18(9):695-700.
[7]Tang J,Jiang R,Deng L,et al.Circulation long non-coding RNAs act as biomarkers for predicting tumorigenesis and metastasis in hepatocellular carcinoma[J].Oncotarget,2015,6(6):4505-4515.
[8]Murray MJ,Nicholson JC,Coleman N.Biology of childhood germ cell tumors,focussing on the significance of microRNAs[J].Andrology,2015,3(1):129-139.
[9]中国抗癌协会肝癌专业委员会.原发性肝癌的临床诊断与分期标准[J].中华肝脏病杂志,2002,14(4):324-324.
[10]Morena M,Assent I,Duruy AM,et al.Osteoprotegerin and sclerosis in chronic kidney disease prior to dialysis:potential partners in vascular calcifications[J].Nephrology Dialysis Transplantation,2015,30(8):1345-1356.
[11]Tung EK,Ng IO.Significance of serum DKK1 as a diagnostic biomarker in hepatocellular carcinoma[J].Future Oncology,2014,8(12):1525-1528.
[12]Shen Q,Yang XR,Tan Y,et al.High level of serum protein DKK1 predicts poor prognosis for patients with hepatocellular carcinoma after hepatectomy[J].Hepatic Oncology,2015,2(3):1-14.
[13]Huang Y,Yang X,Zhao F,et al.Overexpression of Dickkopf-1 predicts poor prognosis for patients with hepatocellular carcinoma after orthotopic liver transplantation by promoting cancer metastasis and recurrence[J].Medical Oncology,2014,31(7):1-10.
[14]Shen Q,Yang XR,Tan Y,et al.High level of serum protein DKK1 predicts poor prognosis for patients with hepatocellular carcinoma after hepatectomy[J].Hepatic Oncology,2015,2(3):1-14.
[15]Huang Y,Yang X,Zhao F,et al.Overexpression of Dickkopf-1 predicts poor prognosis for patients with hepatocellular carcinoma after orthotopic liver transplantation by promoting cancer metastasis and recurrence[J].Medical Oncology,2014,31(7):1-10.
R735.7
B
1003—6350(2017)23—3936—03
10.3969/j.issn.1003-6350.2017.23.052
江苏省盐城市医学科技发展项目(编号:YK2015004)
龚伟。E-mail:3550682828@qq.com
2017-04-07)
