辉钼矿冶炼工艺综述及展望
2018-01-03卜春阳曹维成张国华常贺强周国治
卜春阳,曹维成,王 璐,张国华,常贺强,周国治,何 凯
(1.金堆城钼业股份有限公司技术中心,陕西 西安 710077)(2.北京科技大学钢铁冶金新技术国家重点实验室,北京 100083)
辉钼矿冶炼工艺综述及展望
卜春阳1,曹维成1,王 璐2,张国华2,常贺强2,周国治2,何 凯1
(1.金堆城钼业股份有限公司技术中心,陕西 西安 710077)(2.北京科技大学钢铁冶金新技术国家重点实验室,北京 100083)
本文简要介绍了钼资源的状况,对目前处理辉钼矿采用的各种工艺进行了评述。对火法和湿法冶炼工艺分别进行了比较,系统分析了辉钼矿传统冶炼的工艺特点。通过对目前辉钼精矿冶炼工艺的比较,认为当今对于辉钼精矿的冶炼一是要不断改进现有生产工艺,并开发新的工艺;二是要以目标产物为导向,跳过单质钼的生产环节,简化生产工序,开发新的辉钼精矿冶炼工艺。
辉钼矿;火法冶炼;湿法冶炼
0 引 言
钼被誉为战争金属。钼位于元素周期表的第五周期第Ⅵ族,由于其特殊的原子结构,不仅有着优良的高温强度和高温硬度、刚度大、抗磨损性能等良好的力学性能,而且具有导热、导电性能好,热膨胀系数小,抗腐蚀性能强等优异的物理化学性能,因此被广泛应用于社会工业的各方面。在化学和石油工业中用作催化剂[1-3];用作钢铁工业的添加剂[4];在航空航天方面用于发动机零部件制造[5];冶金工业中用于高温炉体的发热体[6];用于生产化肥[7]等。钼已经成为发展现代高科技必不可少的原材料之一,也是重要的战略储备金属。
我国的钼资源非常丰富,基础储量位居世界首位,也是世界上钼产品出口量最大的国家之一。目前已知的钼矿约有20余种,其中包括辉钼矿(MoS2)、硒钼矿(MoSe2)、钼华(MoO3)、钼酸铅矿(PbMoO4)、钼酸钙矿(CaMoO4)、钼酸铁矿(Fe2O3·3MoO3·7H2O)和硫钼铜矿(CuMo2S5或CuS·2MoS2)等。这些钼矿中具有工业价值的矿石只有4种,即辉钼矿、钼酸钙矿、钼酸铁矿和钼酸铅矿。其中又以辉钼矿的工业价值最高,分布最广,约有99%的钼以辉钼矿的状态存在,它占世界开采量的90%以上。
1 辉钼矿冶炼工艺
目前处理辉钼矿的方法有火法和湿法两大类。焙烧-氨浸工艺是钼工业上的经典冶金工艺。目前世界上大部分的纯钼化合物生产是采用此工艺。按照焙烧所用的化学试剂和在冶金过程中的作用的不同,焙烧方法可分为氧化焙烧、氯化焙烧、还原焙烧和真空热分解等。由于焙烧-氨浸工艺较为成熟,同时又具有设备简单、易于操作、投资少等优点,至今在工业上仍有较大应用。钼精矿湿法工艺是在矿浆状态下将MoS2氧化浸出,过程中不会产生烟气,能够回收钼精矿中各种有价元素,对当前愈来愈迫切的低品位复杂矿石的冶炼具有较大的优势。按照氧化条件的不同,浸出方法可分为酸性碱性条件下氧化浸出、次氯酸钠法浸出、电氧化法浸出等方法。
1.1 火法冶炼
1.1.1 氧化焙烧
目前国内外大多数企业采用直接用空气作为氧化剂,对辉钼矿进行焙烧[8-11]。根据焙烧设备的不同,可将辉钼矿的氧化焙烧工艺分为多膛炉焙烧、流态床焙烧、回转窑焙烧、反射炉焙烧和闪射炉焙烧等。我国金堆城钼业股份有限公司采用12层的多膛炉对辉钼矿的焙烧进行投入生产,取得了重大突破。焙烧出来的钼焙砂的主要成分是MoO3,之后进行升华提纯或者采用湿法提纯。辉钼矿氧化焙烧为强烈的放热反应,主要反应为:
MoS2+ 3.5O2= MoO3+ 2SO2
(1)
除了上述主反应之外,辉钼矿还发生其他副反应:MoO3和MoS2的相互反应;一些金属硫化物氧化生成氧化物和硫酸盐;MoO3和杂质氧化物、硫化物、硫酸盐相互反应生成钼酸盐等。
目前,很多研究者[12-19]对辉钼矿氧化焙烧的研究取得了大量重要成果,普遍得出:在空气的环境下,MoS2优先氧化生成MoO2,之后MoO2继续氧化,生成MoO3。王连勇等[19]通过热重分析实验,得出了辉钼矿焙烧的动力学曲线,如图1所示。根据图1,大致可以把辉钼矿氧化焙烧过程分为4个阶段:

图1 辉钼矿氧化焙烧的热重曲线
第一阶段:辉钼矿的预热干燥,钼矿中水分和浮选油的挥发;第二阶段:空气中的氧分子向钼矿颗粒的表面扩散,供给钼矿氧化时所需要的氧,同时,辉钼矿在表面原子力的作用下, 对空气中的氧产生吸附;第三阶段:吸附的氧与MoS2发生反应, 主要生成物为MoO2;第四阶段:生成的MoO2进一步氧化,生成MoO3。
辉钼矿氧化焙烧所用的空气方便而又充足,产出的钼焙砂产量较大,质量较高,经济又实惠,可以为企业节约能源,是一种应用较多的焙烧辉钼矿的方法。但是,由于MoO3在较低温度下,如700 ℃时就开始显著升华,挥发出去的MoO3被炉气带走,这会造成钼的大量损失。又因为MoO3的熔点很低,为795 ℃,放热的情况下,温度一旦高于熔点,MoO3很容易融化,并且和一些金属氧化物生成低熔点共熔物而发生烧结现象,这对焙烧工艺是很不利的。另外,焙烧产物SO2的释放,也会对大气环境造成污染。因此,对辉钼矿的研究要综合考虑各个方面的利益关系。
1.1.2 氯化焙烧
Medvedev et al[20-24]提出了用辉钼矿和氯化钠的混合物在空气条件下处理辉钼矿的焙烧方法。所用的化学流程见图2。它用氧化氯化焙烧代替了单一的氧化焙烧,这不但可以实质性的降低SO2的释放,减少空气污染,还可以降低焙烧温度(大约为450 ℃),节约能源。并且可以从一定的辉钼矿中提取不少于98%的钼于最终产物中。并且认为最优焙烧条件为焙烧温度为450 ℃,焙烧时间为90 min和150%过量的氯化钠;并有浸出温度为室温(20~25 ℃),浸出时间为60 min,碱溶度为50 g/L。但是采用了大量的化学试剂,并且对辉钼矿的精度有一定的要求,对于低品位和中等品位的辉钼矿有一定的限制,进一步的研究工作仍在继续。

图2 氧化氯化焙烧处理辉钼矿的流程图
1.1.3 还原焙烧
Mankhand和Prasad等研究者[25-26]采用MoS2在添加石灰的条件下,用H2把反应物辉钼矿直接还原成了金属Mo粉。Mehdi Afsahi等[27-28]把MoS2制成圆柱形,在石灰的条件下,用H2直接还原,所得产物中既有金属Mo粉,又有钼酸盐。目前H2直接还原辉钼矿已取得了重大突破,并且提出了“过滤—还原—熔炼”的处理辉钼矿的方法,见图3。王多刚等[29]研究人员对辉钼矿直接氢气还原工艺的热力学进行了研究,得出在不添加固硫剂时,辉钼矿直接氢还原很难进行,当加入固硫剂,辉钼矿的氢气还原反应速率明显加大。

图3 加石灰H2还原辉钼矿提取金属Mo的流程图
采用该方法提取金属Mo,其主要的化学反应有:
MoS2(s)+2CaO(s) + 2H2= Mo(s)+2CaS(s) +2H2O(g)
(2)
它是由以下两个方程耦合而组成的:
MoS2+ 2H2=Mo + 2H2S
(3a)
2H2S + 2CaO=2CaS +2H2O
(3b)
但是实际上反应(3a)在热力学上是不可行的,在927 ℃下的平衡常数只有K3a=2.76×10-3, 加入石灰时,石灰具有很高的固硫能力,K3b=5.08×102, 使得反应[2]向右移动,K2=1.4,这就使得反应[2]在热力学上可行[19]。该方法可处理较低品位的辉钼矿,收得的金属Mo的纯度较高,是一种很有潜力提取Mo的方法。
1.1.4 真空热分解
Donald[30-31]将辉钼精矿通过圆盘造粒机造粒后,在室温条件下送入炉膛中,然后对炉膛进行抽真空,直接升温热解炉料,热解完成后,通入H2一段时间,使产物在还原气氛中冷却,最终可得到金属Mo。
4MoS2→2Mo2S3+ S2
(4)
2Mo2S3→ 4Mo + 3S2
(5)
热解得到的金属Mo比较纯,Mo含量大于99.6%,Fe、Cu和SiO2的含量分别小于0.2%、0.03%和0.07%。但是真空直接热分解法对空气的气压要求较高,热解温度也比较高,对设备要求严格。辉钼精矿真空热分解脱硫后的残留物中还含有大量的杂质元素,如何得到纯度较高的金属钼还需要进一步的研究。
1.1.5 MoS2和MnO2共同焙烧
吴江丽等[32-33]研究了辉钼矿和二氧化锰共同焙烧的新工艺。具体的实验步骤如下:将称量好的二氧化锰和辉钼矿在坩埚中磨碎并充分混合均匀,当马弗炉的温度升到设定值时,将装样的坩埚置入马弗炉中焙烧,中间每隔一段时间将焙烧样搅拌一次。反应一定时间后,将所得的焙砂进行酸浸、过滤、滤渣氨浸,最后对氨浸渣进行Mo含量的分析,以此计算浸出率。该反应的流程图见图4。此外,吴江丽等人还对各种参数对MoS2分解的影响进行了详细的研究,得出了在二氧化锰和辉钼矿共同焙烧时,MoS2的分解率随温度的提高缓慢增大,与辉钼矿单独焙烧相比,分解温度降低;并且认为450 ℃焙烧2 h效果较好;物料的配比对MoS2的分解率没有温度对其的影响大;无论是压制成型,还是CMC造粒,对MoS2分解率没有太大的影响,认为MnO2对辉钼矿的相混性能较好,不会阻碍气体的扩散,可以强化MoS2的氧化分解。
由于二氧化锰具有强氧化性、辉钼矿的还原性和硫酸盐的稳定性,采用辉钼矿与二氧化锰共同焙烧新工艺可以克服传统的焙烧-氨浸提钼工艺中含硫烟气严重污染环境、金属综合回收率低等弊端。但是其焙烧反应更复杂,产物多样,并且主要产物为MnMoO4。

图4 辉钼矿和二氧化锰共同焙烧流程图
1.1.6 苏打烧结法
吴建中等[34-36]在辉钼矿中加入碳酸钠进行了烧结熔合方面的研究。将辉钼矿和苏打按一定的比例混合加入到炉中,在700 ℃熔融状态下进行反应。混合物料中加入一定的硝酸钠作为氧化剂,使矿物中的硫化物氧化为氧化物,之后氧化物与苏打反应生成钼酸钠。主要的反应如下,具体工艺流程见图5。
2NaNO3= Na2O + 2NO +1.5O2
(6)
MoS2+ 3.5O2= MoO3+ 2SO2
(7)
MoO3+ Na2CO3= Na2MoO4+ CO2
(8)
该反应在达到反应温度时,过程可以自动进行。反应产物以熔融态放出,冷却结块,破碎。钼的浸出率高达99%。但是浸出液过滤后加入氨水进行氨沉时对溶液的pH值要求较高,需控制在2左右。对熔融态的处理不够彻底时,会影响钼的浸出率。而且反应会放出有毒气体,污染环境。

图5 辉钼矿-苏打-硝酸钠烧结法流程示意图
1.2 湿法冶炼
20世纪70年代以来,国内外竟相开展了钼精矿全湿法新工艺的研究,其核心是在矿浆状态下将钼精矿氧化转化成为钼的氧化物或其盐,其优势在于能处理各种品位的钼矿物,适应性广,避免了焙烧工序从而有效解决了SO2气体的环境污染问题。钼矿物经湿法分解后可通过溶剂萃取或离子交换等新型分离技术回收,缩短了工艺流程,同时也能高效综合回收多种伴生有价金属,如铼等[37]。全湿法分解工艺将成为一种环境友好的钼精矿主要冶金方法[38-40],根据氧化剂种类和氧化条件的不同,目前己研制出的钼精矿湿法冶炼工艺有硝酸氧化工艺[41-42]、强酸性(或强碱性)介质中氧压煮工艺[43]、电氧化工艺[44]及其他强氧化剂氧化工艺。
1.2.1 硝酸氧化分解法
采用硝酸(浓度25% ~50%)在加热(温度为80 ℃以上)的条件下,能有效地将钼精矿氧化生成钼酸沉淀,钼精矿与硝酸相互反应的方程式如式(9):
MoS2+6HNO3=MoO4+2H2SO4+6NO
(9)
随着硝酸浓度和溶液温度的增加,钼精矿的氧化速度加快。如果分解过程在封闭的系统中进行,从析出的氮的氧化物中回收硝酸,而可显著地降低硝酸用量:
NO+1/2O2=NO2
(10)
3NO2+H2O= 2HNO3+NO
(11)
反应完成后,80%的钼进入固相形成钼酸沉淀,约20%的钼留在母液中,钼精矿中含的全部铼都能转移到溶液中。精矿分解生成的钼酸沉淀,经洗涤和过滤后用氨液浸出,然后再按通常的工艺流程处理成纯钼酸按溶液,经结晶析出仲钼酸铵产品。在硝酸氧化分解过程中,重金属硫化物均被氧化成硝酸盐进入溶液,铼几乎全部进入溶液,因而固相中的钼纯度明显提高,分解液经除铁净化后,可用阳离子交换萃取剂(2-乙基己基磷酸)从弱酸性溶液中萃取Mo,然后用三烷基胺萃取Re。
该方法的优点是取消了氧化焙烧工序,避免了长生废气对空气的污染;可以回收几乎全部的铼,铼在母液中富集,用萃取法能将铼全部提取;母液可结晶出硫酸铵和硝酸铵混合物作为肥料,避免了污染;硝酸溶液可重复使用,降低了成本;返回液中由于硫酸的存在,可减少硝酸的耗量。
该方法的主要缺点是消耗大量的硝酸,精矿要求粒度要细;腐蚀性严重,所用设备必须选用优质昂贵的材料制造。
1.2.2 酸性碱性条件下氧化浸出
无论是酸性还是碱性条件下的氧压法都是在高压釜内使MoS2氧化为可溶性钼酸盐。表1为塞浦路斯钼提取工艺高压氧化浸出过程经济技术指标。碱性条件下高压氧化浸出主要工艺条件为:温度130~200 ℃,总压力2.0~2.5 MPa,反应时间3~7 h,NaOH用量为理论量的1.0~1.03倍。
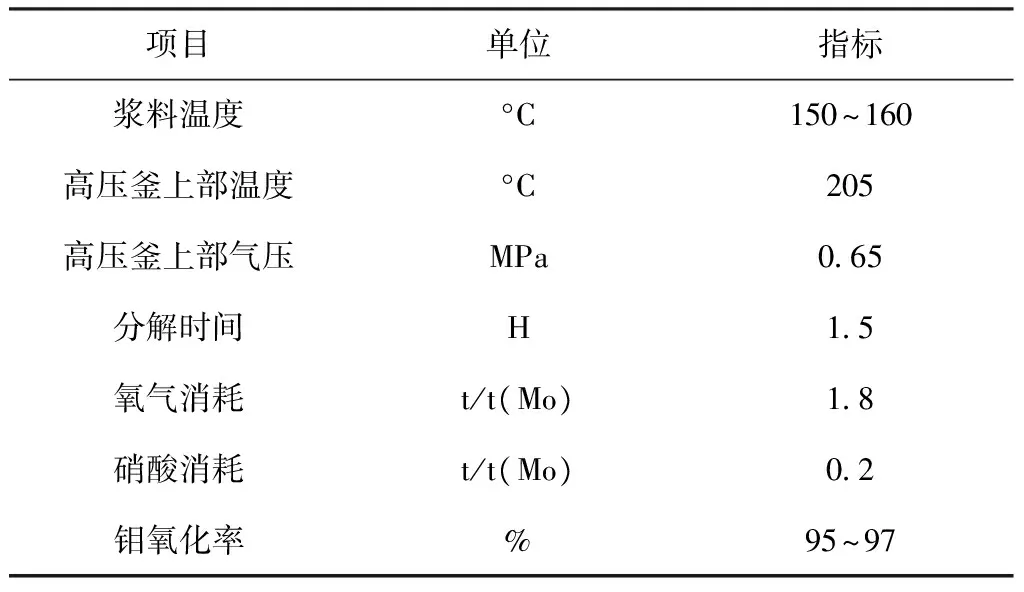
表1 高压氧分解过程技术指标
氧压浸出法和硝酸氧化法主要消耗廉价的氧化剂-空气或纯氧,但过程需要高温高压,对反应设备要求很高,反应条件苛刻,生产技术难度较大,浸出过程中的工艺条件也较难控制,且生产中存在一定的安全隐患,一般较难应用于中小型生产厂家,目前国内己有厂家停用该法。
考虑到软锰矿(MnO2)为强氧化剂,而工业生产中为从软锰矿制取硫酸锰需还原焙烧后再浸出,若将它作为氧化剂处理MoS2,则在MoS2本身被氧化的同时,MnO2将直接转化成MnSO4,取得很好的效果。顾珩[45]在常压下,研究了二氧化锰对辉钼矿的湿法氧化浸出,用软锰矿对辉钼矿的浸出在最佳工艺条件下钼浸出率大于95%。
1.2.3 次氯酸钠法浸出
次氯酸钠在碱性条件下能氧化分解几乎所有硫化矿物(MeS)[46],常温条件下,次氯酸钠对辉钼矿的氧化速率大于Fe、Cu硫化物。在处理低品位钼矿物原料时,次氯酸钠是一个很有效的氧化浸出剂。在氧化浸出过程中,次氯酸钠本身也会缓慢分解析出氧,其他的一些金属硫化物也会被次氯酸钠氧化,这些金属的离子或氢氧化物又会与钼酸根生成钼酸盐沉淀,使进入溶液的钼又返回到渣中。控制适当的进出条件,可以减少其他金属硫化物的氧化浸出。反应式如下:
(12)
次氯酸钠法尽管反应条件温和,生产易控制,对设备要求不高,设备投资成本低,但原料次氯酸钠消耗量大而造成生产成本过高,该法常用于低品位中矿、尾矿的浸出,其改进工艺-氯碱法虽可适当降低药剂成本,但存在氯源供给限制及氯污染问题[47]。
1.2.4 电氧化法浸出
电氧化法处理辉钼矿是由次氯酸钠法改进而来,即在电解槽中集NaClO的生成和辉钼矿的氧化为一体。将已经浆化的辉钼矿物料加入到装有氯化钠溶液的电解槽中,在电氧化过程中,电解槽两极电化学过程如下:
阳极电化学反应:2Cl-→Cl2+2e
阴极电化学反应:2H2O+2e→2OH-+H2
阳极产物C12又与水反应,生成次氯酸根ClO-。ClO-再氧化矿物中的硫化钼,使钼以钼酸根形态进入溶液中[48]。
电化学方法可提供极强的氧化、还原能力,并能通过改变电化学因素,如电流密度、电极电位、电催化活性及选择性等,较为方便地控制、调节反应的方向、限度、速率。它继承了次氯酸钠法浸出率高、反应条件温和、无污染的特点[49]。为提高电氧化法的电流效率降低能耗,过程中引入超声波强化浸出,超声场可显著减少电极表面的覆盖物,提高电解电流,促进MoS2氧化分解。同时在强酸介质中Mn3+/Mn2+氧化能力很强,能将MoS2氧化分解为MoO3和硫酸,且锰离子可以循环利用。符剑刚采用Mn3+/ Mn2+间接电氧化法湿法分解辉钼矿,钼的浸出率为88.5%。以上方法提高了经济效益、降低了能耗,同时反应设备易解决、投资小,条件易控制,操作简单。但目前仍处于试验阶段,没有能够实现工业化[50]。
2 辉钼矿冶炼工艺前景与展望
目前国内钼冶炼大都采用传统的氧化焙烧-氨浸工艺生产钼酸铵,该工艺要求600 ℃以上的高温条件,能耗大,最主要的是生成的二氧化硫污染环境严重;虽然钼精矿中加入石灰,可以解决二氧化硫烟尘问题,但是石灰与辉钼矿反应生成钼酸钙,又增加了钼浸出的难度。氧化焙烧方法对设备如回转窑、多膛炉等温度控制要求高,炉内温度超过750 ℃时,将造成三氧化钼的升华而使钼损失;同时温度高致使炉料烧结,会造成下料口堵塞而必须清炉,增加了劳动强度。现有的全湿法分解工艺中,高压氧酸浸和高压氧碱浸工艺对设备耐蚀性能及操作条件(高温、高压)要求苛刻。高压氧酸浸工艺所利用的硝酸在运输、储存和加入高压容器中时都容易挥发,不仅在使用中容易发生安全事故,而且还造成环境污染。高压氧碱浸工艺中,反应时间长,消耗苛性钠量太大,且辉钼矿氧化不彻底,因此工业上难以推广应用。其他强氧化剂分解工艺也存在氧化剂耗量大,成本高且运输、贮存不方便等问题。电氧化湿法分解钼精矿虽然具有反应条件温和、氧化彻底、反应过程无污染物等优点,但此工艺尚在研发阶段,未有成熟方案运用于工业生产。
目前,减少对环境的污染,提高金属的综合回收率和产品质量,降低生产成本,开展从低品位钼矿及各种钼废料中回收钼的新工艺研究成了钼工业发展的重点。就生产钼金属而言,辉钼矿的冶炼工艺将不断地朝着降低能耗、减小污染、缩短流程的方向发展;就钼精矿的冶炼而言,可以转换一种思维,以目标产物为导向,而不仅仅局限于钼金属的生产,比如直接以钼精矿为原料去生产二硅化钼和碳化钼以及其他钼的化合物,直接以结果为导向在一定程度上可以跳出原有的处理思路,缩短处理流程,使原料得到更加有效的利用。目前已经有学者对以钼精矿为原料制取二硅化钼做了深入的研究[51]。
3 结束语
我国钼资源储量丰富,随着各行业对特殊钢需求的激增,钼资源的开发得到进一步推动。钼资源的不断消耗导致富矿、易选矿床逐渐减少,而低品位、复杂矿将成为今后的重点开发对象。矿石的贫、杂化对钼的冶炼工艺和设备都提出了更高的要求和挑战,传统工艺已经无法实现环境保护与经济效益的统一,钼矿冶炼工艺得到进一步的改进和发展已变的势在必行。本文从辉钼精矿的火法和湿法冶炼工艺方面做了详细评述,认为当今对于辉钼精矿的冶炼一是要不断改进现有生产工艺,并开发新的工艺;二是要以目标产物为导向,跳过单质钼的生产环节,简化生产工序,开发新的辉钼精矿冶炼工艺。相信在广大科研工作者的努力下,一定能做到辉钼精矿的最大化利用。
[1] 张 乐, 石亚华.含钼和/或钨及镍和/或钴的加氢精制催化剂及其制备[J].中国钼业, 2007,31(2):13.
[2] Kirillova N V, Kuznetsova N I, Kuznetsova L I, et al.Reductive activation of dioxygen in catalytic systems including platinum and heteropoly compounds: oxidation of Cyclohexane [J].Catalysis Letters, 2002, 84(3-4):163-168.
[3] Mcgarvey G B, Moffat J B.The oxidative dehydrogenation of isobutyric acid to methacrylic acid on ion exchange modified 12-heteropoly oxometalates [J].Cheminform, 2010, 23(4).
[4] 李 兵.钼在钢铁工业中的应用[J].金属世界,2005,24(1):48.
[5] 张春基, 吕宏军, 贾中华,等.铌钨合金材料在液体火箭发动机上的应用[J].宇航材料工艺, 2007, 37(6):57-60.
[6] 殷 磊, 易丹青, 肖来荣, 等.铌表面MoSi2高温涂层的形貌和结构研究[J].稀有金属材料与工程, 2005, 34(1):91-94.
[7] 应小芳, 刘 鹏, 徐根娣.土壤中的铝及其植物效应的研究进展[J].生态环境学报, 2003,12(2):237-239.
[8] L Coudurier, I Wilkomirsky, G Morizot.Molybdenite roasting and rhenium volatilization in a multiple-hearth furnace [J].Transactions of the Institution of Mining and Metallurgy Section C, 1970,79:34-40.
[9] G Grimes, G Witkamp.Climax conversion practice II [J].JOM.1971(23):17-24.
[10] D Lindsay.Endako roasting practice [J].Canadian Metallurgical Quarterly, 1977, 16:32-36.
[11] L McHugh, J Godshalk, M Kuzior.Climax conversion practice III [J].Canadian Metallurgical Quarterly, 1977, 16: 21-24.
[12] A Abdel-Rehim.Thermal analysis and X-ray diffraction of roasting of Egyptian molybdenite [J].Journal of Thermal Analysis Andcalorimetry, 1999, 57: 415-431.
[13] P R Ammann, T A Loose.The oxidation kinetics of molybdenite at 525 ℃ to 635 ℃ [J].Metallurgical Transactions, 1971, 2(3):889-893.
[14] E L Coltrinari, W W Hazen, V.J.Ketcham.Pressure oxidation process for the production of molybdenum trioxide from molybdenite.US 081327980[P]. 2000-11-21.
[15] R Ebrahimi-Kahrizsangi, M H Abbasi, A Saidi. Mechanochemical effects on the molybdenite roasting kinetics[J]. Chemical Engineering Journal, 2006,121(2-3):65-71.
[16] T Marin, T Utigard, C Hernandez.Roasting kinetics of molybdenite concentrates [J].Canadian Metallurgical Quarterly, 2013,48(1):73-80.
[17] I Yusufoglu, G Pilevne.The kinetics of molybdenum sulfide oxidation under isothermal conditions [J].Chimica Acta Turcica-Istanbul, 1992, 20: 229.
[18] 汪金发, 丁芝虎, 张文洁, 等.辉钼矿氧化焙烧制取低硫工业氧化钼 [J].中国钼业, 1992,16(5): 15-18.
[19] 王连勇, 张井凡, 蔡九菊, 等.钼精矿氧化焙烧机理研究 [J].中国钼业, 2011, 35(2):17-19.
[20] P Aleksandrov, A Medvedev, A Kadirov, et al. Processing molybdenum concentrates using low-temperature oxidizing-chlorinating roasting [J].Russian Journal of Non-Ferrous Metals, 2014, 55(2): 114-119.
[21] K Nair, D Sathiyamoorthy, D Bose, et al.Studies on oxychlorination of MoS2in a fluid bed reactor [J].Metallurgical Transactions B, 1988, 19(4): 669-675.
[22] K Nair, D Sathiyamoorthy, D Bose, M Sundaresan, et al.Chlorination of commercial molybdenite concentrate in a fluidized bed reactor [J].Metallurgical Transactions B, 1987,18(2): 445-449.

[25] Mankhand T R, Prasad P M.Lime-enhanced hydrogen reduction of molybdenite[J].Metallurgical Transactions B, 1982, 13(2):275-282.
[26] Prasad P M, Mankhand T R, Rao P S.Lime-scavenged reduction of molybdenite[J].Minerals Engineering, 1993, 6(8-10):857-871.
[27] M Mehdi Afsahi, M.Sohrabi, H.Ale Ebrahim.A model for the intrinsic kinetic parameters of the direct reduction of MoS2with hydrogen [J]. International Journal of Materials Research, 2008, 99: 1032-1038.
[28] M Mehdi Afsahi, M Sohrabi, R Vasant Kumar, et al. A study on the kinetics of hydrogen reduction of molybdenum disulphide powders [J].Thermochimica Acta, 2008, 473: 61-67.
[29] 王多刚, 郭培民, 赵 沛.辉钼矿直接氢还原工艺的热力学研究 [J].有色金属 (冶炼部分), 2010(3): 2-4.
[30] 陈 洁.辉钼矿真空热分解脱硫的研究 [D].昆明理工大学, 2009.
[31] Buker D O.Process for thermal dissociation of molybdenum disulfide: US3966459[P].1976.
[32] 符剑刚, 钟 宏, 吴江丽, 等.软锰矿在辉钼矿焙烧过程中的固硫作用[J].中南大学学报: 自然科学版, 2005, 36: 995-999.
[33] 吴江丽.辉钼矿和二氧化锰共同焙烧新工艺的研究 [D].中南大学, 2005.
[34] 吴建中.苏打压煮分解钨精矿过程的强化[J].江西冶金, 1982(4):47.
[35] 宁振茹.钼冶金 [M].北京: 北京化学工业出版社, 1999.
[36] 张启修, 赵秦生.钨钼冶金 [M].北京:冶金工业出版社, 2005.
[37] 刘英汉.从含铼铝精矿中提取铝和铼的研究[J].江西大学报,1989,13(1):88-95.
[38] Gregory J Olson,Thomas R Clark.Bioleaching of molybdenite[J].Hydrometallurgy,2008,93(l):10-15.
[39] Lan X, Liang S, Song Y.Reeovery of rhenium from molydenite calcine by aresin-in-PulP Proeess[J].Hydrometallurgy,2006,82(3):133-136.
[40] 魏绪钧译.用硝酸分解铝精矿[J].国外稀有金属,1983(6):26-30.
[41] 张文钲.硝酸硫酸浸出钼精矿现状和进展[J].钼业经济技术,1989(3):20-28.
[42] 王玉芳,刘三平,王海北.钼精矿酸性介质加压氧化生产钼酸铵[J].有色金属,2008,60(4):91-94.
[43] 彭建蓉,杨大锦,陈加希,等.原生铝矿加压碱浸试验研究[J].稀有金属,2007,31(6):110-11.
[44] 闻振乾.辉钼矿电氧化分解过程的研究[D].中南大学,2009.
[45] 顾 珩,李洪桂,刘茂盛,等.辉钼矿湿法浸出新工艺研究[J].中国钼业,1997,21(5):29-32.
[46] 张文钲,康泰成,黄宪法.铝冶炼[M].西安:西安交通大学出版社,1991:111-138.
[47] 符剑刚,钟 宏,吴江丽,等.常温常压条件下辉钥矿的湿法浸出[J].金属矿山,2004(12):35-38.
[48] Derek G E.Hydrometallurgieal Production oftechnical grade molyndic oxide from molybdenite concentrates.US 3988418[P]. 1976-10-26.
[49] 赵中伟.辉钼矿湿法浸出过程某些理论问题之浅见[J].稀有金属与硬质合金,1995,122(6):l-3.
[50] William A Y, Tucson A.Processfor converting molybdenite to molybdenurn oxide.US 4551312[P]. 1985-11-5.
[51] Zhang G H, Sun G D, Chou K C.A novel process to prepare MoSi2, by reaction between MoS2and Si[J].Journal of Alloys & Compounds, 2017, 694:480-488.
OVERVIEWANDPROSPECTFORTHESMELTINGPROCESSOFMOLYBDENITE
BU Chun-yang1, CAO Wei-cheng1, WANG Lu2, ZHANG Guo-hua2, CHANG He-qiang2, ZHOU Guo-zhi2, HE Kai1
(1.Technical Centre, Jinduicheng Molybdenum Co., Ltd., Xi’an 710077, Shaanxi, China)(2.State Key Laboratory of Advanced Metallurgy, University of Science and Technology Beijing, Beijing 100083, China)
The status of molybdenum resources was briefly introduced, and the various treatment methods of molybdenite used in the present were summarized and shown.The process characteristics of traditional smelting of molybdenite were systematically analyzed by comparing the thermometallurgy with the hydrometallurgy process.Through the comparison of the molybdenite concentrate smelting processes, it is considered that one thing is to continuously improve the existing production process, and develop new technology; the other thing is to target product oriented production over molybdenum, simplify production process,and develop new smelting process of molybdenite concentrate.
molybdenite; thermometallurgy; hydrometallurgy
2017-09-17;
2017-10-20
卜春阳(1978—),男,高级工程师,现从事钼金属材料研究开发开作。E-mail:bp208@163.com
10.13384/j.cnki.cmi.1006-2602.2017.06.002
TF841.2
A
1006-2602(2017)06-0005-07
