蛋白酪氨酸磷酸酶抑制剂的研究进展
2018-01-02付建平熊伟吴磊韩晓丹王慧宾胡居吾
付建平,熊伟,吴磊,韩晓丹,王慧宾,胡居吾
(江西省科学院应用化学研究所,江西南昌330096)
蛋白酪氨酸磷酸酶抑制剂的研究进展
付建平,熊伟,吴磊,韩晓丹,王慧宾,胡居吾
(江西省科学院应用化学研究所,江西南昌330096)
蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphataese,PTPs)在生物体内广泛存在,起信号传导作用。蛋白酪氨酸磷酸酶在许多人类疾病中都扮演着重要角色,因此,设计高效且专一的PTPs抑制剂就越来越受到关注。本文主要介绍了蛋白酪氨酸磷酸酶的作用机制,对近年来报道的几类重要PTPs抑制剂进行分析阐述,并对其发展趋势进行了展望。
蛋白酪氨酸磷酸酶;抑制剂;作用机制;疾病
蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphataese,PTPs)在生物体中广泛存在,主要起信号传递和调节作用,近年来引起科学家们的极大关注。在真核细胞内,几乎所有的信号传导过程都是通过由蛋白激酶和蛋白磷酸酶催化的磷酸化和去磷酸化作用来调节的。蛋白磷酸酶和激酶(Kinase)在细胞内通过分别催化蛋白质的去磷酸酯化或磷酸酯化,来启动(增强)或关闭(减弱)细胞的某些功能,起信号传导作用。这期间如果任何传递发生问题都会导致某些疾病。例如,蛋白磷酸酶PTP1B可通过催化蛋白质酪氨酸残基上的磷酸酯水解来向细胞传递减少分泌胰岛素的指令,结果造成身体内胰岛素水平不足而引发糖尿病。另外,已证实与蛋白磷酸酶相关的疾病还有癌症、肥胖症和老年痴呆症等[1-2]。因此,研究细胞生长过程中蛋白磷酸酶的功能及其与环境的相互关系意义非同寻常,特别是在医学应用上具有重要意义。
1 蛋白磷酸酶的催化机制
蛋白磷酸酶和激酶(Kinase)在细胞内通过分别催化蛋白质的去磷酸酯化或磷酸酯化,来启动(增强)或关闭(减弱)细胞的某些功能,其反应过程如图1所示。
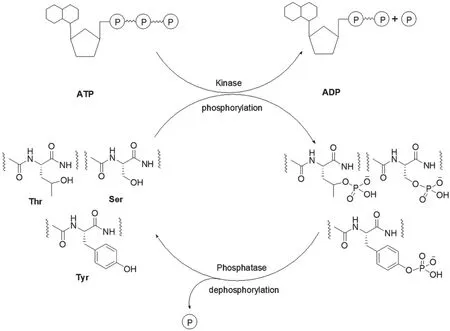
图1 蛋白质磷酸化循环
蛋白酪氨酸磷酸酶PTPs由一个信号酶的大家族构成,其中人体内有100多种。这些酶对细胞增殖、分裂、迁移和生存有重要作用[3]。PTPs的机能障碍会导致酪氨酸磷酸化紊乱。这就会引起几种常见的疾病,如癌症和糖尿病[4-5]。不像蛋白激酶,它们的酪氨酸激酶和丝氨酸激酶拥有序列统一性,PTPs没有序列相似性。定义PTPs大家族的标志是催化区活性中心的氨基酸序列C(X)5R,也叫做PTP特征基序。根据活性中心底物专一性,可以把PTPs广义地分成两类:酪氨酸特异性蛋白磷酸酶和“双重特异的”蛋白磷酸酶dual-specificity phosphatases (DSP),即对磷酸化苏/酪氨酸均有特异性。
半胱氨酸依赖的磷酸酶通过形成磷酸-半胱氨酸中间体来催化磷酸酯键的断裂,具体过程如图2所示[6]。
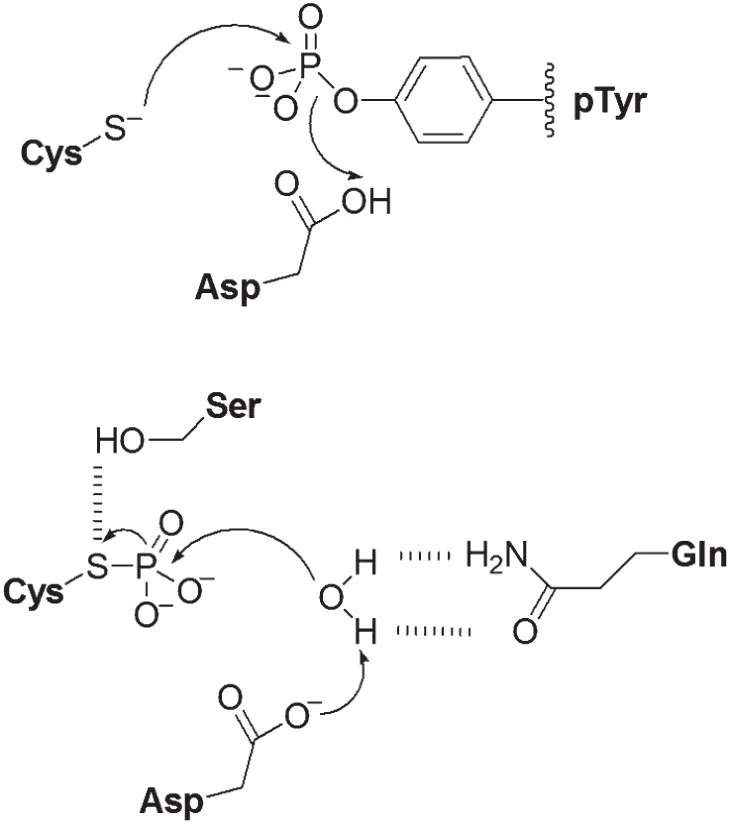
图2 半胱氨酸依赖的磷酸酶催化酪氨酸去磷酸化的机制
2 PTPs与疾病
磷酸化和去磷酸化是生物体内一种普通的调节方式,分别由蛋白激酶和蛋白磷酸酶调控,在细胞信号转导的过程中起重要作用。PTP1B是胰岛素信号通路中主要的负性调控因子[7-8],对2型糖尿病的发生、发展有重要作用,在治疗2型糖尿病的潜在靶点中,PTP1B是一个极为重要的药物靶点。CD45分子参与多种免疫功能,其高度保守的胞质区具有磷酸酪氨酸酯酶活性,使得其在信号传导及淋巴细胞效应功能中具有重要意义[9]。CD45分子可能通过控制细胞表面分子的相互作用和其胞质区的PTPase活性使底物活性改变来发挥其在信号转导中的调节作用。研究表明,Cdc25在多种癌症中过表达[10],如肺癌、卵巢癌、乳腺癌、结肠癌、食道癌、肝细胞癌、胃癌、肺癌、非霍奇金淋巴瘤、胰导管癌、甲状腺和头颈癌。多数Cdc25A和/或Cdc25B的过表达与癌症的预后不良有关。WEHI231是一种带有未成熟B细胞表型的B淋巴细胞系,在遭遇BCR偶联时会发生凋亡,田茂鑫[11]等筛选了能够阻断BCR诱导的WEHI231细胞凋亡基因。研究揭示了HePTP具有抑制BCR诱导的未成熟B淋巴细胞凋亡的作用,因而推测HePTP的过量表达会打破淋巴细胞形成生理性耐受的过程,进而影响了自身免疫性疾病及肿瘤的易发性。研究结果在骨髓增生异常综合症及急性骨髓性白血病等疾病的治疗中有重要意义。
3 PTPs抑制剂
PTPs在许多人类疾病中都扮演者重要角色,设计高效且专一的PTPs抑制剂就越来越受到关注。根据其作用机制和来源,近年来报道的PTPs抑制剂可以分为以下几类。

表1 蛋白酪氨酸磷酸酶与疾病的对应关系
3.1 非专一性的无机类PTPs抑制剂
钒酸根在结构上类似于酶的天然底物磷酸根,因此钒酸盐化合物作为一类PTPs非特异性抑制剂很早就被报道过[12]。其他的无机类PTP抑制剂还有一氧化氮和氧化苯砷,这些无机化合物不仅可以抑制PTPs,还可以抑制其他的酶活性。正是这种非专一性使得这类抑制剂选择性差,膜穿透能力差,生物利用度低,且钒易在生物体内累积产生毒性,这类抑制剂在临床上的应用十分有限。
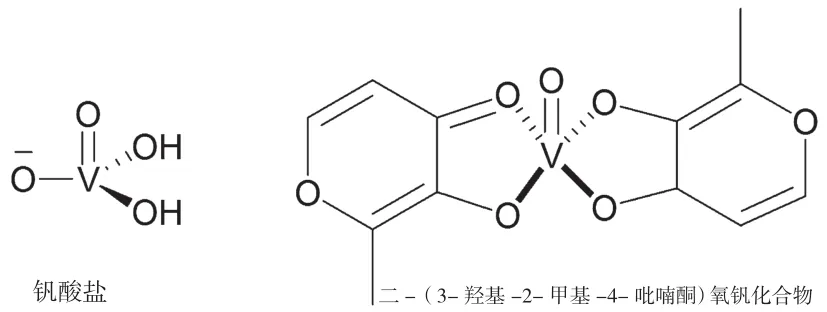
图3 非专一性的无机类PTPs抑制剂
3.2 天然产物及其衍生物类PTPs抑制剂
在天然化合物中寻找具有生理活性的物质是新药先导化合物确立的重要方法和途径。虽然大多数此类抑制剂的作用位点不是很明确,但是它们却具有高选择性和活性。1997年,Regina等人从一种海绵中分离得到Sulfircin,它是一种对PTP1B具有中等抑制活性的化合物(IC50=29.8μM),对其他PTPs(Cdc25A)也具有较好的抑制活性。2000年,Watanabe等人报道Dephostain及其同系物对PTPs表现出良好的抑制活性,PTP1B的IC50为0.52μg/mL。从真菌菌株中分离得到的4-Isoavenaciolide,它可以不可逆地抑制VHR,但对Cdc25B、Laforin和PTP1B的抑制活性表现不明显[13]。作用机理可能是4-Isoavenaciolide与VHR中的Cys124和Cys171形成了共价键。生物碱nornuciferine对CD45的IC50值是5.3μmol/L,且其全合成已有报道[14]。从青霉菌中分离得到的stevastelins,取代基R为磺酸基时活性最好[15]。一些常见的天然PTPs抑制剂如图4所示。
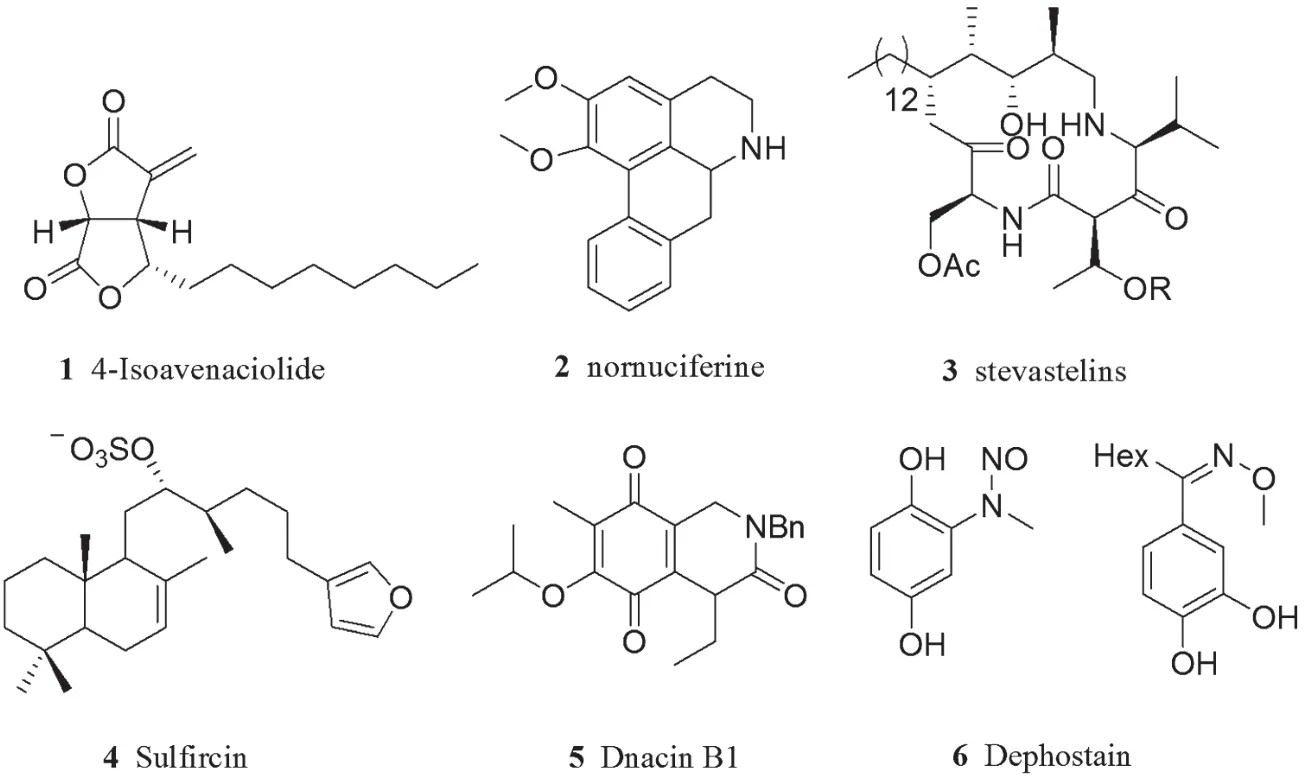
图4 天然产物及其衍生物类PTPs抑制剂
3.3 非水解的酪氨酸磷酸酯类似物
酶的底物类似物一般具有竞争性抑制活性,一直作为PTPs抑制剂设计的重点。作用位点在催化域的Cys252残基。其中最具代表性的是二氟甲基磷酸酯类化合物(DFMP)。在磷酸的α位引入负电性的卤原子后,降低了磷酸根的pKa值,增强了磷酸与PTPs催化区域的静电作用及氢键相互作用。且双DFMP的化合物的活性是单DFMP活性的450倍,是非氟化同类化合物的1000倍。1994年,Burke等人首次报道二氟甲基磷酸基苯丙氨酸7对PTP有抑制性[16]。1998年,Taylor等人报道了二氟甲基磷酸基苯及其衍生物8、9、10具有PTP抑制活性[17]。2001年,Zhang等通过组合化学的方法得到化合物11,它对PTP1B具有很好的抑制活性,并且对TCPTP有近10倍活性。Zhang等人还对此化合物进行了优化,提高了膜通透性[18]。这类抑制剂弥补了肽类抑制剂在体内易受到体内蛋白酶的降解作用且不易通过生物膜等缺点。
3.4 肽类抑制剂
含有磷酸化酪氨酸残基pTyr的肽类底物与PTPs有较高的亲和性,所以肽类似物应该与酶有较高亲和性,但事实上由于某些原因,并没有取得理想的效果。这也直接导致人们开发出二氟甲基磷酸酯等类小分子抑制剂。较经典的一些肽类抑制剂如图6 所示[19-20]。
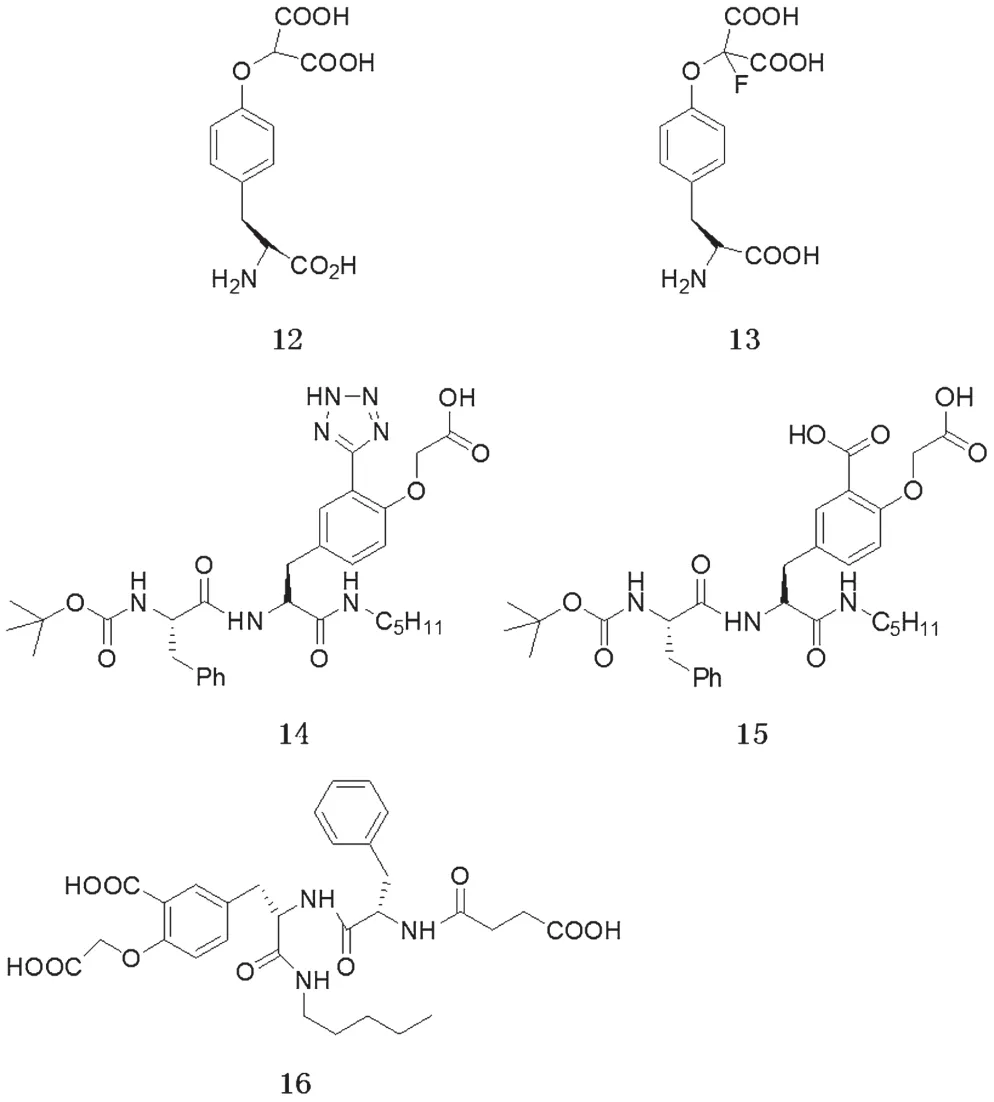
图6 肽类抑制剂
3.5 醌类PTPs抑制剂
有相当一部分的PTPs抑制剂具有醌的结构,科研人员推测其机理可能是PTPs活性位点的半胱氨酸被醌氧化,形成了共价结合物,从而起到抑制酶活性的目的。常见的一些醌类PTPs抑制剂如图7所示[21]。
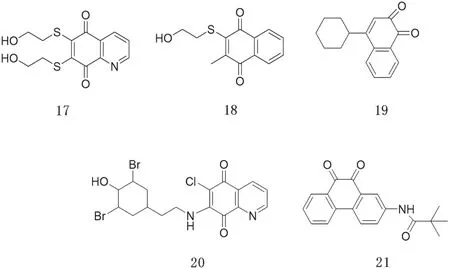
图7 醌类PTPs抑制剂
还有一些其他的PTPs抑制剂,如唑类抑制剂、变构抑制剂等,这里不再详细论述。
4 结语
从以上的论述可以看出,PTPs抑制剂对治疗许多疾病方面有重要用途,因此寻找更多专一性高、膜透性好的抑制剂一直是一项前景广阔的工作。α-单卤代和α,α-双卤代磷酸酯类化合物由于它们在结构和电子上类似于天然磷酸酯类似物,已经被设计为天然磷酸酯类似物,用来作为抗癌药和酶抑制剂,这类化合物将是酶抑制剂的主要研究方向和发展趋势。
[1]韩颖,罗建民,贾晓辉,等.白血病患者造血细胞磷酸酶与半胱氨酸蛋白酶基因表达及其临床意义[J].中华内科杂志,2006,45(5):363-365.
[2]Hunter T.Signaling-2000 and beyond[J].Cell,2000,100(1):113-127.
[3]Tonks NK,Neel BG.Combinatorial control of the specificity of protein tyrosine phosphatases[J].Current Opinion inCell Biology,2001,13(2):182-195.
[4]Li L,Dixon J E.Form,function and regulation of protein tyrosine phosphatases and their involvement in human diseases[J].Seminarsin Immunology,2000,12(1):75-84.
[5]Zhang ZY.Protein tyrosine phosphatases:prospects for therapeutics[J].Current Opinion in Chemical Biology,2001,5(4):416-423.
[6]Barford D.Molecular mechanisms of the protein serine/threonine phosphatases[J].Trendsin BiochemicalSciences,1996,21(11):407-412.
[7]Zhang Z Y.Protein Tyrosine Phosphatases:Structure and Function,Substrate Specificity,and Inhibitor Development[J].AnnualReviewof Pharmacology and Toxicology,2002,42(1):209-234.
[8]Ramachandran C,Kennedy BP.Protein Tyrosine Phosphatase 1B:A Novel Target for Type 2 Diabetes and Obesity[J].Current Topics in Medicinal Chemistry,2003,3(7):749-757.
[9]Penninger JM,Irie SJ,Sasaki T.CD45:new jobs for and old acquaintance[J].Natureimmunology,2001,2(5):389-396.
[10]Kristjánsdóttir K.,Rudolph J.Cdc25 Phosphatases and Cancer[J].Chemistry &Biology,2004,11(8):1043-1051.
[11]Tian m.x.,Gonzalez G.,Scheer B.Bcl10 can promote survival of antigen-stimulated B lymphocytes[J].Blood,2005,106(6):2105-2112.
[12]Shisheva A.,Ikonomov O.,Shechte Y.The protein tyrosinephosphatase inhibitor,pervanadate,is a powerful antidiabetic agent in streptozotocin-treated diabetic rats[J].Endocrinology,1994,134(1):507-510.
[13]Cebula R.E.,Blanchard J.L.,Boisclair M.D.,et al.Synthesis and phosphatase inhibitory activity of analogs of sulfircin[J].Bioorganic &Medicinal Chemistry Letters.1997,7(15):2015-2020.
[14]Ueda K.,Usui T.,Nakayama H.4-Isoavenaciolide covalently binds and inhibits VHR,a dual-specificity phosphatase[J].FEBS Letters,2002,525(1):48-52.
[15]Hamaguchi T.,Sudo T.,Osada H.RK-682,a potent inhibitor of tyrosine phosphatase,arrested the mammalian cell cycle progression at G1phase[J].FEBS Letters,1995,372(1):54-58.
[16]Gunasekera S.P.,McCarthy P.J.,Kelly M.Dysidiolide:A Novel Protein Phosphatase Inhibitor from the Caribbean SpongeDysidea etheriade Laubenfels[J].Journal of the AmericanChemical Society,1996,118(36):8759-8760.
[17]Scott D,Taylor,Kotoris C.C.,et al.Potent non-peptidyl inhibitors of protein tyrosine phosphatase 1B[J].Bioorganic &MedicinalChemist ry,1998,6(9):1457-1468.
[18]Boutselis IP,Yue EW,Zhang ZY.Synthesis and Cell-Based Activity of a Potent andSelective Protein Tyrosine Phosphatase 1B Inhibitor Prodrug[J].Journal of Medicinal Chemistry,2007,50(4):856-864.
[19]Larsen SD,Barf T,Liljebris C.Synthesis and Biological Activity of a Novel Class of Small Molecular Weight Peptidomimetic Competitive Inhibitors of Protein Tyrosine Phosphatase 1B[J].Journal of Medicinal Chemistry,2002,45(3):598-622.
[20]Liljebris C,Larsen SD,Ogg D.Investigation of Potential Bioisosteric Replacements for the Carboxyl Groups of Peptidomimetic Inhibitors of Protein Tyrosine Phosphatase 1B:Identification of a Tetrazole-Containing Inhibitor with Cellular Activity[J].Journal of Medicinal Chemistry,2002,45(9):1785-1798.
[21]Lazo J S,Nemoto K,Pestell KE.Identification of a Potent and Selective Pharmacophore for Cdc25 Dual Specificity Phosphatase Inhibitors[J].Molecular Pharmacology,2002,61(4):720-728.
Research Progress in Inhibitors of Protein Tyrosine Phosphatases
Fu Jian-ping,Xiong Wei,Wu Lei,Han Xiao-dan,Wang Hui-bin,Hu Ju-wu
(Institute of Applied Chemistry,Jiangxi Academy of Sciences,Jiangxi Nanchang 330096)
Protein tyrosine phosphatases (PTPs) are widely exists in the living organisms and play a role as a signal tr ansducer.PTPs are known to as sociated with human diseases.Therefore,it is necessary to explore efficient and specific PTPs inhibitors.This paper focuses on several important inhibitors of PTPs and analyze the research progress in inhibitors of PTPs.
PTPs;Inhibitors;Mechanism;Diseases
R98 文献标志码:A
2096-0387(2017)06-0082-05
江西省科学院重大科技项目(2017-YZDZ-18)
付建平(1987—),男,江西新余人,硕士,助理研究员,研究方向:天然产物化学。
