糖芯片制备的关键技术:基于氨基改性表面的糖分子固定方法及其表面表征
2018-01-02王汉奇孙世猷
程 昉,王汉奇,孙世猷,何 炜
(1.大连理工大学精细化工国家重点实验室,辽宁大连116024)
(2.大连理工大学制药科学与技术学院,辽宁大连116024)
(3.武汉科技大学城市学院医学部制药系,湖北武汉430070)
0 引言
随着糖生物学研究的不断深入,糖芯片(糖微阵列)成为一类高通量研究糖生物学的工具和手段,已被广泛应用于研究糖参与生命活动,挖掘定量信息和规律,阐明和揭示糖在发育、分化、再生和癌变过程的作用,研制肿瘤靶向治疗和病原体阻断的新药物[1-5]。糖芯片制备的关键技术在于如何将寡糖、多糖或者单糖分子固定在芯片基质表面。由于糖化学结构的复杂性和功能的多样性,糖芯片通常需要使用天然来源的寡糖或者多糖分子。由于来源的稀有加之分离、纯化的繁琐,通常仅能毫克级制备各种糖分子。对于这类珍贵样品,需要合理设计和发展表面固定策略以及必要的糖衍生化。
近年来,国内外有多篇综述性论文系统地介绍通过共价键或者物理吸附方式将糖分子固定在芯片基质表面[6-9]。一般而言,针对芯片基质选取合理的修饰方法,溶液相的糖分子或者衍生物通过一步反应或者吸附,即可实现糖分子在芯片基质表面的固定[10-12]。当芯片基质表面修饰了叠氮、巯基、共轭双烯或者琥珀酰亚胺酯,相应的糖分子需要化学衍生化,引入炔烃、马来酰亚胺、烯烃或者氨基基团。当芯片基质表面修饰了硼酸或者乙烯基砜基团,未经修饰的天然糖分子可以与表面直接发生键合。
糖芯片实验室规模制备时期出现了多种芯片基质,例如硝酸纤维素膜和含氟高分子材料。随着商业芯片的规模化制备、高通量打印和高灵敏检测技术的出现,硅基质芯片成为了主流。3-氨基丙基三乙氧基硅烷(APTES)是一种典型的硅烷偶联剂,广泛用于硅基质表面的氨基改性[13-15]。通过APTES与基质表面硅羟基之间反应,在基质表面展示氨基。这一方法可以改变表面的亲/憎水程度,提高正电荷密度,也为后续的表面反应提供了高密度的反应活性位点。基于氨基改性表面发展了一系列的固定方法,已经用于蛋白质、核酸和小分子等多种生物芯片的制造[16-20]。然而,直接利用氨基改性表面实现糖分子固定的方法鲜有报道。
该文直接利用氨基改性表面,设计新颖的糖分子固定路线并丰富含糖样品的表面分析手段。以乳糖为例,发展了采用二乙烯基砜为偶联试剂共价键固定糖分子的方法。采用天然糖以及糖衍生化物,提出了三种在氨基改性表面固定乳糖的方法,构筑了基于氨基改性表面的样品。利用酶联凝集素分析技术 (enzyme-linked lectin assay,ELLA)初步评价了上述样品;采用生物膜干涉实验定量研究了固定的乳糖与血凝素蛋白质之间的结合/解离动力学和热力学;通过X-射线光电子能谱(XPS)表征了氨基改性前后和乳糖固定前后样品表面上元素的变化以及碳化学物种的变化。
1 实验部分
1.1 仪器与试剂
乳糖 (98%,)和3-氨基丙基三乙氧基硅烷(98%)购于阿拉丁试剂有限公司;氨水(25%)购于天津市富宇精细化工有限公司;二乙烯基砜(98%)购于山东西亚化学工业有限公司;Quanta BluTM Flurogenic Peroxidase试剂盒购于Pierce (美国);4-羟乙基哌嗪乙磺酸(HEPES,98%)和牛血清蛋白(BSA,98%)购于大连美仑生物有限公司;花生凝集素(Peanutagglutinin,PNA,SDS-PAGE 级)购于 Vector Laboratories(美国);牛血清蛋白辣根过氧化酶复合物 (BSA-HRP,>95%)和花生凝集素辣根过氧化物酶复合物(PNA-HRP,>95%)购于北京博胜经纬科技有限公司;玻璃圆形盖玻片 (FIS12-545-80 12CIR,φ12mm)购于 Fisher Scientific(美国);氨基修饰生物膜干涉探头(APSdips)购于 ForteBio(美国)。
Bruker Avance II 400M核磁共振波谱仪(Bruker公司, 德国);ESCALAB 250Xi型 X 射线光电子能谱仪 (Thermo Fisher Scientific公司,美国),X 射线源采用 Al Kα (hv=1486.6 eV),光电子出射角为90°,采用污染碳C 1s(BE=285.0 eV)作为能量校正;生物膜干涉BLItz型传感器(ForteBio 公司,美国)。
1.2 脱氧氨基乳糖乙烯基砜衍生物 (化合物1)的制备
称取3.42 g乳糖(10mmol)和0.96 g碳酸铵(10mmol)溶于70mL甲醇中,加热至回流,缓慢滴加氨水至溶液澄清,回流反应12 h。反应体系4℃冷却结晶,抽滤,冰甲醇洗涤三次制备脱氧氨基乳糖(化合物2)[21-23]。将获得的脱氧氨基乳糖溶于50mLHEPES缓冲液 (pH=9.5),加入10 mL 二乙烯基砜(DVS,100mmol),并加入 10mL丙酮助溶,反应体系25℃搅拌12 h,柱色谱纯化获得脱氧氨基乳糖乙烯基砜衍生物 (化合物1)2.85 g (收率 62.0%)。1H NMR(500MHz D2O):δ 6.87(dd,1H,CH=CH2),6.42&6.21(dd,2H,CH=CH2),5.16(d,2H,-CHOHCHO-),3.08(t,2H,-SO2CH2CH2NH),3.51-3.70(m,others)。
1.3 氨基六聚乙二醇的制备
称取2.82 g六聚乙二醇 (10mmol)溶于40 mL二氯甲烷制备六聚乙二醇溶液,称取1.14 g对甲基苯磺酰氯(6mmol)溶于20mL二氯甲烷并在冰浴条件下缓慢滴加至六聚乙二醇溶液中,室温反应12 h后柱色谱纯化制备六聚乙二醇单对甲基苯磺酸酯。得到的产物溶于50mL乙醇并加入6.50 g叠氮化钠(100mmol)回流4 h。反应液冷却至室温,抽滤除去过量叠氮化钠,旋蒸除去溶剂后溶于50mL四氢呋喃(含25%水),加入2.62 g三苯基膦(10mmol)回流过夜,产物经柱色谱纯化获得氨基六聚乙二醇1.21 g(收率43.1%)。1H NMR(500 MHz CDCl3):δ 3.72(t,2H,NH2CH2CH2O),3.60(t,2H,HOCH2CH2O),3.55(t,2H,HOCH2CH2O),2.89(t,2H,NH2CH2CH2O),3.67(m,16H,others)。
1.4 样品的氨基改性和DVS处理
1.4.1 样品的氨基改性
(1)将圆形盖玻片分别用水和乙醇超声清洗3次,然后置于食人鱼洗液中90℃反应40min(食人鱼洗液的制备:冰浴条件下将10mL过氧化氢缓慢滴加至30mL浓硫酸中。注意:食人鱼洗液对有机物有强烈腐蚀性。),分别用水和乙醇超声清洗3次;
(2)将食人鱼洗液处理的样品置于APTES的乙醇溶液(2%,V/V,含有数滴乙酸),室温反应24 h,乙醇超声清洗3次;
(3)上述处理的样品置于120℃真空干燥箱中交联4 h,氮气氛围下避光保存。
1.4.2 样品的DVS处理
将氨基改性的样品置于DVS溶液 (10%,V/V,pH=12),室温反应2 h后取出,分别用丙酮和水清洗3次,氮气吹干并避光保存。
1.5 样品的三种乳糖固定方法
1.5.1 乳糖固定方法1(method 1)
(1)将化合物1溶于新鲜的HEPES缓冲溶液(10mmol/L,pH=9.5),充分溶解后备用。
(2)将氨基改性的样品置于24孔板中,每孔加入2 mL上述化合物1溶液,室温下震荡(1000~1200 r/min)反应12 h后分别用水和乙醇清洗三次,氮气吹干并避光保存。
1.5.2 乳糖固定方法2(method 2)
(1)化合物2溶于50mLHEPES缓冲溶液(10mmol/L,pH=9.5),充分溶解后备用。
1.5.3 乳糖固定方法3(method 3)
将DVS处理的样品浸泡在乳糖溶液(0.1 g/mL,pH=10),室温反应 12 h 后取出,用超纯水清洗、氮气吹干后浸入新鲜的氨基聚乙二醇溶液室温反应12 h后取出,用超纯水清洗3次,氮气吹干并避光保存。按照图1所示,在BLI传感器的氨基探头制备抗垢涂层,将含有抗垢涂层的探头置于NHS/EDC(0.5mol/L,0.55mol/L)溶液中4℃活化30min,然后置于0.2mg/mL的森林脑膜炎重组抗原溶液(pH7.4)中室温反应40min。最后使用氨基乙醇(50mmol/L,pH9.5)封闭 30min,PBS洗涤2次,氮气吹干备用。
1.6 样品的蛋白质非特异性和特异性吸附
1.6.1 蛋白质非特异性吸附
将制备的三种乳糖固定样品和氨基化样品置于24孔板内并加入400μLBSA-HRP。样品37℃孵育2 h后,吸出蛋白溶液并用磷酸缓冲液清洗3次。
1.6.2 蛋白质特异性吸附
将制备的三种乳糖固定化样品和氨基化样品置于24孔板内并加入400μLBSA(1mg/mL)。样品37℃孵育2 h后,吸出BSA溶液并用磷酸缓冲液清洗3次。向孔板内加入400μL PNAHRP。样品37℃孵育2 h后,吸出蛋白溶液并用磷酸缓冲液清洗3次。
在含有样品的孔板中加入1mLQuantaBluTMFlurogenic Peroxidase Substrate,37℃孵育 10 min后加入1mL终止液。分别取200μL反应后溶液置于96孔板中,酶标仪(激发波长230 nm,发射波长450 nm)读取各孔的荧光强度。每个样品重复 3~5次。
1.7 基于生物膜干涉技术测定蛋白质结合的热力学常数
BLI传感器的氨基探头按照method 1进行乳糖固定并采用1mg/mLBSA溶液封闭30min,缓冲液清洗并氮气吹干。将经过上述处理的探头依次插入下列溶液中并监测信号变化:缓冲溶液30 s,PNA蛋白质溶液(浓度为0.001,0.005,0.01,0.1,0.5 和 1mg/mL)180 s,缓冲溶液 30 s,再生溶液(10mmol/L 甘氨酸,pH=3)30 s,缓冲溶液 30 s。检测过程中盛放溶液的离心管在25℃恒温条件下1000 r/min椭圆振荡。使用Langmuir吸附平衡公式对其响应值进行拟合:
重力位场成像是将勘测区域下半空间剖分成均匀网格,然后根据归一化相关函数(扫面函数)计算每一网格节点的相关系数,实现重力异常成像,成像结果表征了地下异常地质体的分布形态和质量剩余(盈余或缺失)情况[27-33]。
Q=(Qm.c)/((Kd+c))
式中Q为吸附量响应值,Qm为最大吸附量响应值,Kd为解离平衡常数,c为溶液PNA浓度(mg/mL)。
2 结果与讨论
2.1 脱氧氨基乳糖乙烯基砜衍生物(化合物1)的合成
如图1所示,采用Kochetkov反应在碳酸铵和氨水的混合溶液对乳糖进行修饰,获得脱氧氨基乳糖(化合物2)。该反应将还原性糖分子的异头碳羟基转化成为氨基,这一种氨基常被用于糖分子的进一步衍生化,从而制备多种化学糖基化分子和材料。例如,该文课题组前期报道了脱氧氨基糖(包括单糖和寡糖)与二硫化碳在碱性条件下室温反应,制备用于金衬底上自组装的糖基二硫代氨基甲酸盐[23]。在二乙烯基砜底物过量的条件下,化合物2的氨基与二乙烯基砜进一步反应制备端基为乙烯基砜基团的糖衍生物(化合物1)。乙烯基砜基团具有高反应活性,能够与多种亲核试剂在水溶液室温发生加成反应,例如,中性和偏酸性条件与巯基反应;碱性条件与氨基反应;当溶液的pH高于10与羟基发生反应[24],从而实现材料的糖基化。
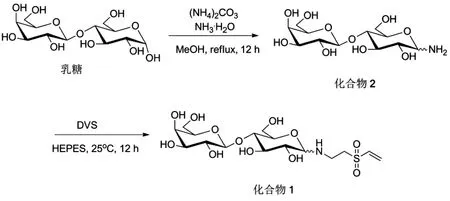
图1 化合物1和2的制备流程Fig.1 Synthesis of Compound 1 and 2
2.2 乳糖固定和初步筛选
将氨基改性的样品浸泡在化合物1的碱性水溶液(HEPES,pH=9.5),室温反应即可获得乳糖固定的样品,流程如图2method 1所示。此外,该文还探索了两种基于氨基改性样品的乳糖固定方法。如图2method 2和3所示,首先氨基改性样品与DVS反应,然后分别浸泡在化合物2和乳糖的碱性水溶液中。由于乙烯基砜基团高的反应活性和不易水解的特性,method 2和3也可以制备乳糖固定的样品。
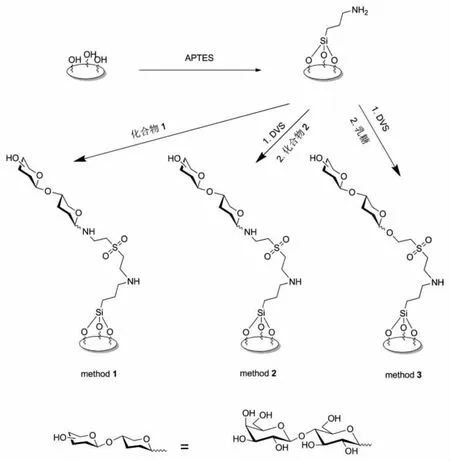
图2 在氨基改性表面的三种利用二乙烯基砜为偶联试剂的乳糖固定方法Fig.2 Three methods of lactose immobilization on APTES-modified sample surfaces using DVSasa cross linker
牛血清白蛋白(Bovine Serum Albumin,BSA)常被用于评价研究对象的抗蛋白质非特异性吸附能力。花生凝集素蛋白(Peanut agglutinin,PNA)是一种植物来源的凝集素蛋白,能特异性结合乳糖、半乳糖分子,常被用于评价糖基化材料的蛋白质特异性吸附能力。该文采用上述两种蛋白与偶联辣根过氧化酶的偶联物,即BSA-HRP和PNA-HRP,配合酶催化的荧光定量,比较三种乳糖固定样品的蛋白质非特异性吸附和特异性结合。如图3a所示,样品均有一定程度的非特异性蛋白质吸附。其中method 1、2和3样品的BSA吸附的量低于氨基改性的对照样品,主要原因是对照样品表面氨基所带正电荷促进了蛋白质的吸附,而后续的表面反应降低了表面正电荷数量。对比method 2和3,method 1样品具有更好的抗蛋白质非特异性吸附能力,推测其样品表面固定的乳糖密度更高,多羟基与水分子形成水化层更致密,有效提高样品的抗蛋白质非特异性吸附能力。
根据以上非特异性吸附的情况,样品浸泡在BSA溶液(1mg/mL)封闭处理2 h,然后进行PNA蛋白质特异性结合评价。如图3b所示,氨基改性的对照样品的荧光强度显著下降,而method 1样品能够特异性结合PNA并高于method 2和3。综上,相比method 2和3而言,method 1所制备样品表面乳糖密度较高。

图3 BSA-HRP(a)和PNA-HRP(b)在三种样品表面的吸附情况Fig.3 Adsorption of BSA-HRP(a)and PNA-HRP(b)on samples prepared by three methods determined by fluorescence intensity
对比method 1和2,发现不同的反应途径影响了蛋白质非特异性和特异性结合的程度。推测,部分化合物2在水溶液中发生分解,游离出氨分子。游离的氨进而与表面的乙烯基砜基团发生反应,消耗了一部分的乙烯基砜基团。因此,method 2制备的样品表面的乳糖密度偏低。在前期,采用method 3类似的方法构筑了含糖高分子膜。虽然还原性糖异头碳的羟基较醇羟基活泼,但是其反应活性低于氨基[25]。目前,如何提高羟基的反应活性,从而提高与乙烯基砜基团反应的产率在持续研究中。综上,该工作针对method 1进行了深入的研究。
2.3 蛋白质水平糖生物活性
生物膜干涉技术 (Biolayer interferometry,BLI)是一种基于光干涉现象的光学无标记传感。两束光在传感器探头涂层表面两端发生,并且相互干涉,所形成的干涉光谱被光学检测器监测。当传感器探头涂层表面有生物大分子吸附时,两束反射光的光程差变大,相应的干涉光谱发生漂移。通过实时监测这一漂移过程,可以获取表面配基/生物大分子的结合/解离定量信息。此项技术具有以下特点:待测溶液样品用量小,最小为4 μL;无需复杂的进样和微纳流控系统;光学探头插入待测溶液即可读取结果。
采用method 1对传感器探头进行处理,定量研究表面乳糖/PNA蛋白质结合/解离过程。如图4 a所示,当传感器探头插入PNA溶液,蛋白质在表面发生吸附和解离,随着时间延长吸附和解离趋向于平衡;当传感器探头切换到缓冲溶液,已吸附的蛋白质发生解离。对于吸附/解离过程进行动力学拟合,获得了表面乳糖/PNA蛋白质的动力学结合速率(ka)1.84×10-4mol/L/s、解离速率(kd)3.0×10-3/s。之后采用不同浓度PNA蛋白质进行了等温吸附实验并采用Langmuir吸附方程进行曲线拟合,计算蛋白吸附解离平衡常数(Kd)1.65×10-7mol/L。Sleiman等[26]采用等温滴定量热法定量研究PNA与溶液中自由的半乳糖和乳糖的结合/解离,经测定热力学解离常数分别达到1.88×10-3mol/L 和 8.77×10-4mol/L。对比上述实验结果,表面乳糖/PNA的热力学解离常数远远小于文献报道的溶液中自由糖分子。究其原因,method 1样品表面展示的高密度的乳糖簇引起了PNA的四个亚基与多个糖分子之间作用,所造成的多价态结合大大提高了相互作用的强度[27-29]。
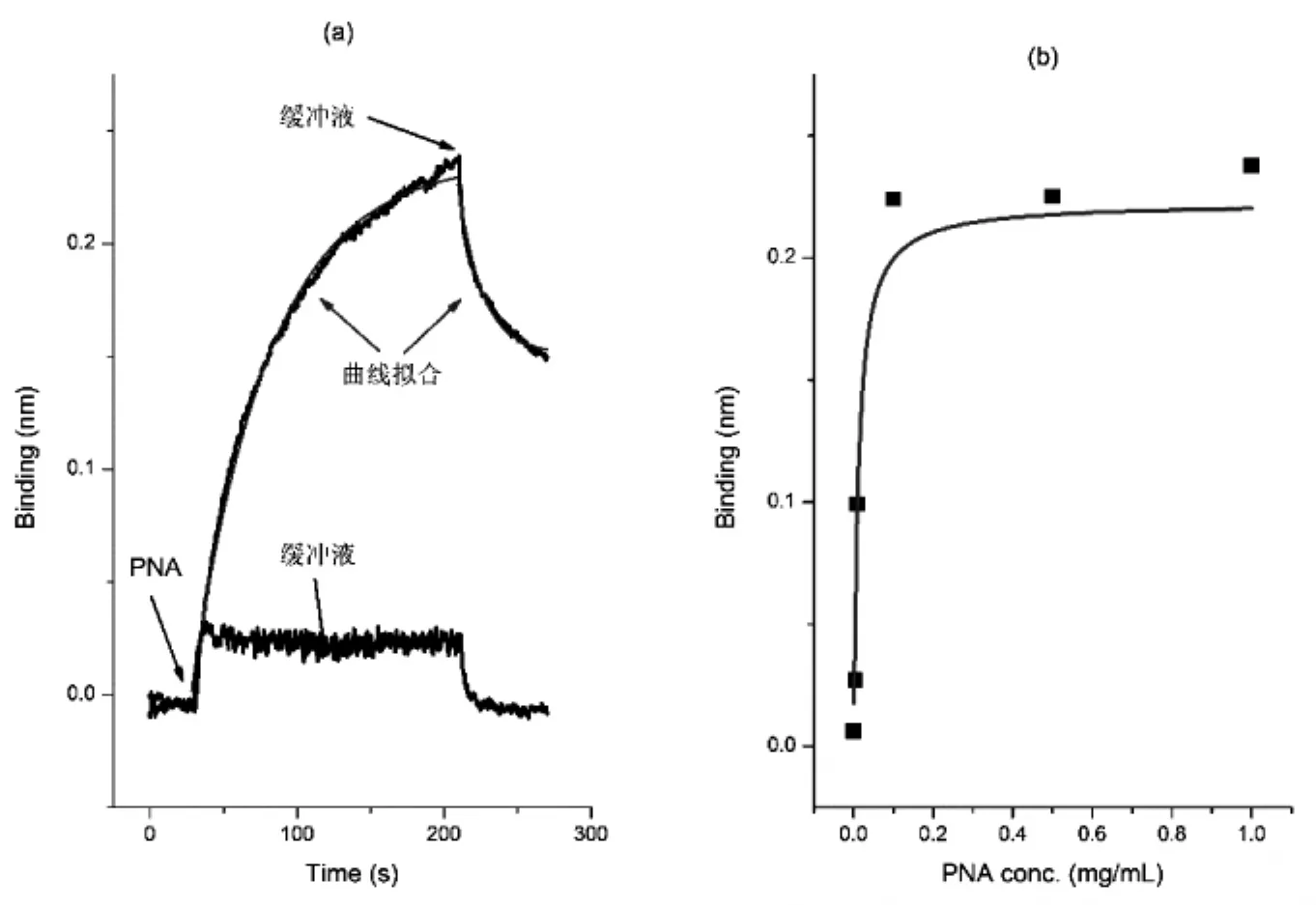
图4 PNA蛋白质在method 1样品表面上吸附/解离的典型动力学曲线(a)和热力学等温吸附曲线(b)红色曲线分别是数值拟合动力学和热力学结果Fig.4 Typical kinetics(a)and isothermo(b)of PNA adsorption on method 1 samples.Red lines are fitted with kinetics and isothermo models,respectively
2.4 样品表面元素分析
采用X-射线光电子能谱(XPS)定量分析了采用method 1固定乳糖的样品表面元素。表1是氨基改性前后和乳糖固定前后样品表面各种元素的百分比组成。对比未修饰的样品表面,氨基改性样品出现氮元素(图5a),而进一步的化合物1反应引入了硫元素(图5b)。
XPS高分辨C 1s谱图可以明确显示乳糖固定前后碳化学物种的变化。结果如图5c所示,未修饰的样品表面在285.0 eV处有微弱的峰,归属为表面残存的痕量碳污染物(C*-C)。经过氨基改性的样品在286.4 eV附近出现一个肩峰,归属为与氨基相连的亚甲基物种(C*-N)。进一步与化合物1反应,样品在286.4 eV附近的肩峰明显增强,这是由于乳糖分子引入的C*-O物种。此外,288.0 eV出现一个新峰,归因于强吸电子的砜基基团的相邻碳物种(C*-SO2)。综上,XPS结果表明,method 1可以在氨基改性的样品表面引入含糖化合物。
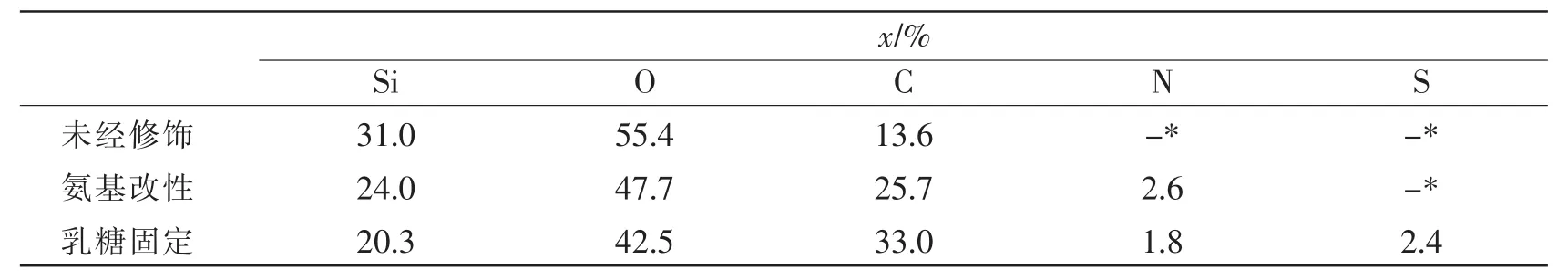
表1 XPS测定的method 1样品表面的元素摩尔分数(x)Tab.1 Elemental molar fraction(x)of samples prepared by method 1 determined by XPS
XPS在超高真空条件下分析样品表面,适用于研究糖芯片的表面污染物、表面化学和处理过程。随着XPS成像技术的普及,芯片二维表面上各种物种的可视化也成为了可能,能够为糖芯片制造工艺提供定量、定位的重要信息。例如。芯片表面处理和清洗、接触式打印的机械损伤、打印液滴的“咖啡环式”蒸发和芯片表面化学质量控制。如何借助XPS谱学和成像信息,配合二次离子质谱、拉曼成像等表面分析结果,指导和优化糖芯片的制造工艺和保存条件,将有助于提升糖芯片等多种生物芯片规模制造的质量。
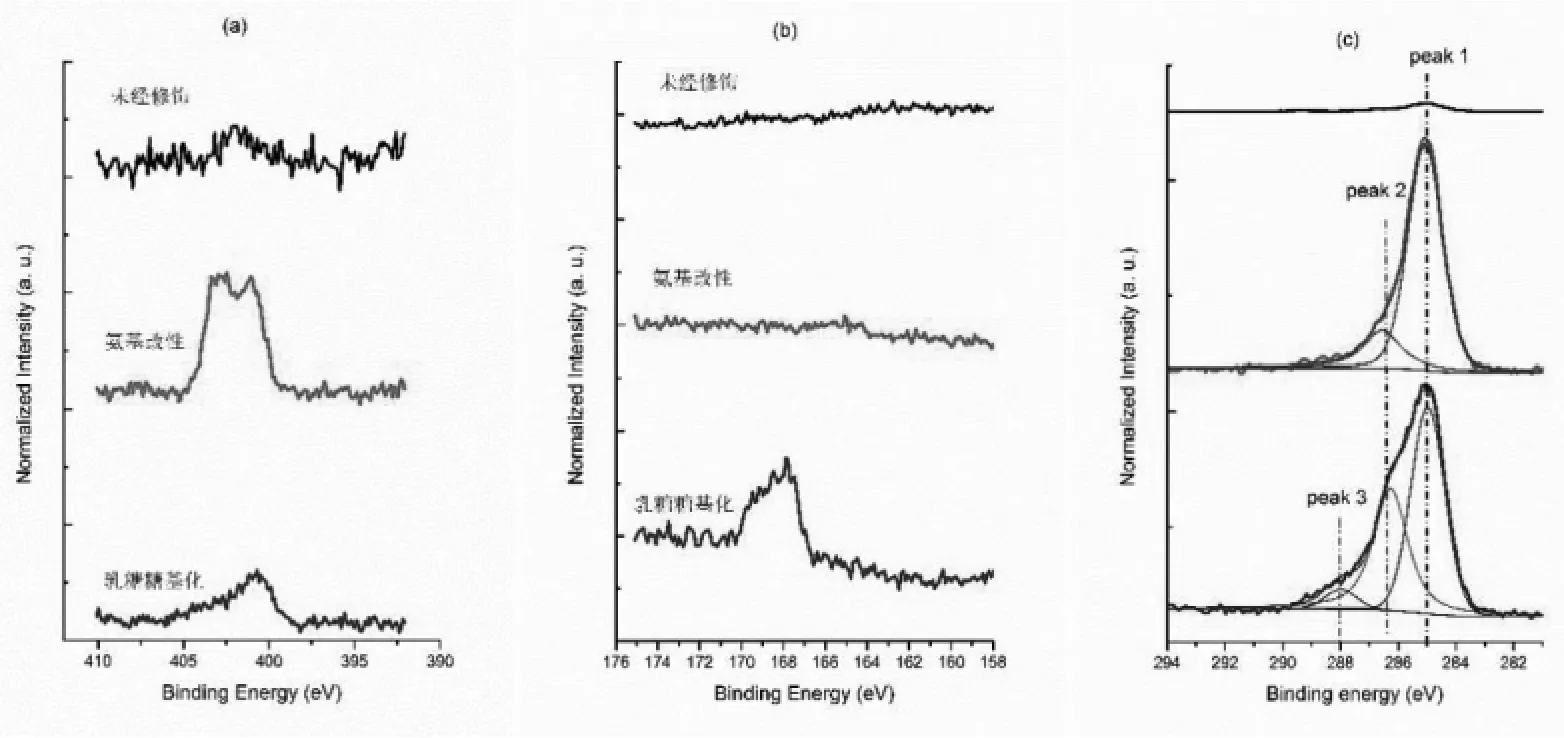
图5 method 1样品XPSN 1s扫描谱图(a)S2p扫描谱图(b)和高分辨C1s谱图(c)表征。Peak 1,2 and 3分别归属为C*-C,C*-NH2和C*-O,以及C*-SO2物种Fig.5 Detailed spectra for N 1s(a)and S 2p(b)and high resolution spectra for C 1s(c)on samples determined by XPS.Peak 1,2 and 3were assigned to C*-C,C*-NH2 and C*-O,and C*-SO2 species,respectively
3 结论
该文提出了在氨基改性表面利用二乙烯基砜为偶联试剂共价键固定糖分子的策略。以乳糖为例,通过ELLA评价了三种固定乳糖的方法。其中,乙烯基砜衍生化的脱氧氨基乳糖(化合物1)与氨基改性表面反应,所制备的样品展示了较高的蛋白质特异性吸附,并且具有良好的抗蛋白质非特异性吸附能力。在此基础上,定量研究了固定乳糖与血凝素蛋白质之间的多价态相互作用;定量分析了乳糖固定前后表面元素和化学物种的变化。该文所发展的利用二乙烯基砜为偶联试剂的糖分子固定策略以及采用的表面分析技术,为氨基改性表面在糖芯片制备方面的应用提供了有效的方法和评价手段。上述固定策略以及表面分析技术也适用于纳米靶向药物输送材料、组织工程支架、传感器和抗生物垢涂层等多种含糖生物表界面的制备和评价。
[1]Blixt O,Head S,Mondala T,et al.Printed covalent glycan array for ligand profiling of diverse glycan binding proteins[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(49):17033-17038.
[2]Fukui S,Feizi T,Galustian C,et al.Oligosaccharide microarrays for high-throughput detection and specificity assignments of carbohydrate-protein interactions[J].Nature Biotechnology,2002,20(10):1011-1017.
[3]Liang P,Wang S,Wong C,etal.Quantitative analysis of carbohydrate-protein interactions using glycanmicroarrays:Determination of surface and solution dissociation constants[J].Journal of the American Chemical Society,2007,129(36):11177-11184.
[4]Liang P,Wu C,Greenberg W,et al.Glycan arrays:biological and medical applications[J].Current Opinion in Chemical Biology,2008,12(1):86-92.
[5]Stevens J,Blixt O,Paulson J,et al.Glycanmicroarray technologies:Tools to survey hostspecificity of influenza viruses[J].Nature Reviews Microbiology,2006,4(11):857-864.
[6]Donczo B,Kerekgyarto J,Szurmai Z,etal.Glycanmicroarrays:New angles and new strategies[J].Analyst,2014,139(11):2650-2657.
[7]Narla S,Nie H,Li Y,et al.Multi-dimensional glycan microarrays with glyco-macroligands[J].Glycoconjugate Journal,2015,32(7):483-495.
[8]Park S,Gildersleeve J,Blixt O,et al.Carbohydrate microarrays[J].Chemical Society Reviews,2013,42(10):4310-4326.
[9]Reuel N,Mu B,Zhang J,et al.Nanoengineered glycan sensors enabling native glycoprofiling for medicinal applications:Towards profiling glycoproteins without labeling or liberation steps[J].Chemical Society Reviews,2012,41(17):5744-5779.
[10]Cheng F,Ratner D.Glycosylated self-assembled mono-layers for arrays and surface analysis[J].Methods in Molecular Biology,2012,808:87-101.
[11]Shang J,Cheng F,Dubey M,et al.An organophosphonate strategy for functionalizing silicon photonic biosensors[J].Langmuir, 2012,28(6):3338-3344.
[12]Yu A,Shang J,Cheng F,etal.Biofunctional papervia the covalentmodification of cellulose[J].Langmuir,2012,28(30):11265-11273.
[13]Howarter J,Youngblood J.Optimization of silica silanization by 3-aminopropyltriethoxysilane[J].Langmuir,2006,22(26):11142-11147.
[14]Vandenberg E,Bertilsson L,Liedberg B,et al.Structure of 3-aminopropyl triethoxy silane on silicon oxide[J].Journal of Colloid&Interface Science,1991,147(1):103-118.
[15]YamauraM,Camilo R,Sampaio L,etal.Preparation and characterization of(3-aminopropyl)triethoxysilane-coated magnetite nanoparticles[J].Journal of Magnetism&Magnetic Materials,2004,279(2-3):210-217.
[16]Festag G,Steinbrück A,Wolff A,et al.Optimization of gold nanoparticle-based DNA detection for microarrays[J].Journal of Fluorescence,2005,15(2):161-170.
[17]Nijdam A,Ming-Cheng M,Geho D,et al.Physicochemically modified silicon as a substrate for proteinmicroarrays[J]. Biomaterials, 2007,28(3):550-558.
[18]Oh S,Cho S,Kim C,et al.Characteristics of DNA microarrays fabricated on various aminosilane layers[J].Langmuir,2002,18(5):1764-1769.
[19]Qin M,Hou S,Wang L,etal.Two methods for glass surface modification and their application in protein immobilization[J].Colloids and Surfaces B:Biointerfaces,2007,60(2):243-249.
[20]WangW,Wang Y,Tu L,et al.Surface modification for protein and DNA immobilization onto GMR biosens or[J].IEEE Transactions on Magnetics,2013,49(1):296-299.
[21]Vetter D,Gallop M.Strategies for the synthesis and screening of glycoconjugates.1.A library of glycosylamines[J].Bioconjugate Chemistry,1995,6 (3):316-318.
[22]Vetter D,Tate E,Gallop M.Strategies for the synthesis and screening of glycoconjugates.2.Covalent immobilization for flow cytometry[J].Bioconjugate Chemistry,1995,6(3):319-322.
[23]程昉,王汉奇,许旷,等.基于二硫代氨基甲酸盐自组装的糖芯片制备与表征[J].物理化学学报,2017,33(2):426-434.
[24]Cheng F,Shang J,Ratner D.A versatile method for functionalizing surfaces with bioactive glycans[J].Bioconjugate Chemistry,2011,22(1):50-57.
[25]孙世猷,李明洋,王汉奇,等.基于乙烯基砜化学的高分子膜表面化学糖基化及其活性研究[J].功能材料,2016,10(47):10019-10023.
[26]Sleiman M,Csonka R,Arbez-Gindre C,et al.Binding and stabilisation effects of glycodendritic compounds with peanutagglutinin[J]. International Journal of Biological Macromolecules,2015,80:692-701.
[27]Chabre Y,Roy R.Multivalent glycoconjugate syntheses and applications using aromatic scaffolds[J].Chemical Society Reviews,2013,42(11):4657-4708.
[28]Chandrasekaran E,Xue J,Xia J,etal.Novel interactions of complex carbohydrates with peanut(PNA),Ricinus communis(RCA-I),Sambucus nigra(SNA-I)and wheat germ (WGA)agglutinins as revealed by the binding specificities of these lectins towardsmucin core-2 O-linked and N-linked glycans and related structures[J].Glycoconjugate Journal,2016,33(5):819-836.
[29]Kwon S,Na D,Kwak J,et al.Nanostructured glycan architecture is important in the inhibition of influenza A virus infection[J].Nature Nanotechnology,2017,12(1):48-54.
