生物燃料电池及其研究进展介绍
2018-01-02许凯歌晋晓勇彭亚鸽
许凯歌,张 笛,晋晓勇,彭亚鸽
(宁夏大学化学化工学院,宁夏银川750021)
0 引言
面对全球环境和能源的挑战,人们对新能源技术的发展充满期待。燃料电池被认为是新能源技术中最有前途的技术之一。目前一些发达国家,都对燃料电池的发展产生了极大地关注。其中,生物燃料电池是利用天然酶或微生物组织,以及纳米材料为催化剂,将燃料的化学能转化为电能的一类特殊的燃料电池装置。与其他形式的燃料电池相比,BFC具有反应条件温和、生物相容性好等优点,是一种新型绿色能源技术[1],因此在过去的十几年里受到学者们的广泛关注。
BFC在便携式、可植入式医疗设备供电和生物传感器系统中具有很大的应用潜力。根据电子传递转移方式的不同可分为直接BFC和间接BFC;依据电化学催化剂类型的不同,BFC又可以分为三大类:微生物燃料电池 (Microbial Biofuel Cell,MBFC)、 酶生物燃料电池 (Enzyme Biofuel Cell,EBFC)、 模拟酶生物燃料电池 (Mimicenzyme BiofuelCell)。BFC经历了几十年的发展,取得了丰硕的成功。
1 燃料电池
目前已经研究和开发了一些绿色能源技术,如太阳能、风能、水力发电、生物能源、地热能源等。这些替代能源技术都处在不同的发展阶段,因此它们具有不同的优点和缺点,而燃料电池被认为是最有前途的技术之一。美国、日本等发达国家都对燃料电池的发展广泛关注。美国能源部的调查报告显示,燃料电池的市场份额将从2013年的630万美元增长到2018年的25.4亿美元[2],这表明燃料电池在能源领域具有广阔的发展前景。
通常,燃料电池是将存储在燃料中的化学能利用电化学反应直接转换成电能的装置。它是由阳极、阴极和电解质溶液三个部分组成[4]。这一电化学反应过程是:燃料在阳极氧化释放质子和电子;质子通过电解质溶液到达阴极,电子通过外电路流向阴极,形成一个闭合的回路。燃料电池可根据其电解质类型、工作温度、和燃料种类进行分类[5]。根据电解质类型可将燃料电池定义为如下类型[6]:氢氧质子交换膜燃料电池(PEMFC)、直接甲醇燃料电池(DMFC)、固体氧化物燃料电池(SOFC)、碱性燃料电池(AFC)、熔融碳酸盐燃料电池(MCFC)、和磷酸盐燃料电池(PAFC)。
相比传统的电池和内燃机,燃料电池具有更显著的优势[7]。首先,燃料电池的能量转换效率可以达到50%以上。能源效率可以通过引入多个的单个电池获得设定功率输出;其次,燃料来源丰富,氢气、甲醇、乙醇、葡萄糖、天然气都可作为燃料;此外,从环保的角度讲,燃料电池可以减少有害气体的排放并且不会产生噪音污染。然而,燃料电池的商业化成功仍需要解决一些关键问题,如操作要求相对高、成本较高、以及循环性和耐用性差、生产运输困难等问题。
2 生物燃料电池
BFC的发展经历了漫长而曲折的过程。1911年,Potter在做酵母和大肠杆菌的厌氧实验时,通过一个金属箔电极获得微弱的电流[3],提出利用微生物可以产生电流的观点,由此BFC作为一个新的研究课题被学者们广泛关注。1964年,Yahiro[8]提出可将燃料电池作为植入式医疗设备的电源。当时,大部分的燃料电池的研究焦点是将葡萄糖(Glucose)和氧气作为反应物,生物酶作为催化剂[9]。随着研究的深入,上世纪80年代,人们将氧化还原反应中间体 (Mediator)广泛用于BFC体系中,使得生物燃料电池可以作为一个小型的应用电源系统[10]。
根据电子传递转移方式的不同BFC可分为直接BFC和间接BFC,直接BFC是反应底物和电极间直接进行电子转移,而间接BFC需要电子中介体将电子传递到电极。按照电池构造的不同,BFC又可分为双室BFC和单室BFC,双室BFC是利用质子交换膜将电池阴阳极隔开[1]。
生物燃料电池依据电化学催化剂类型的不同,可以分为MBFC、EBFC和模拟酶生物燃料电池。MBFC[11]是利用完整的微生物为催化剂来催化燃料的氧化。EBFC[12]是直接利用天然酶作为催化剂来催化燃料的氧化,即先将酶从生物体系中提取出来,然后在燃料电池阳极利用酶的活性催化氧化燃料分子,与此同时加速阴极氧的还原。模拟酶生物燃料电池是利用无机纳米材料为催化剂的特殊的生物燃料电池[13]。如图1所示,依据电子的传递方式和催化剂类型将BFC分类。

图1 生物燃料电池的分类Fig.1 The classification ofbiofuelcell
以葡萄糖为生物燃料电池原料的研究最为广泛。一分子的葡萄糖完全氧化成CO2和H2O可以提供24个电子,因此葡萄糖可作为化学能转化为电能的理想燃料。然而在实际反应过程中,这个反应很难发生,当燃料电池提供高电位时,葡萄糖仅发生第一步氧化提供了两个电子。葡萄糖/O2生物燃料电池的电化学催化原理[14]如图2所示:在BFC阳极区,葡萄糖被氧化为葡萄糖酸,释放电子和H+;电子通过外电路传递至电池阴极区,H+在阴极与O2结合生成水。为了防止O2干涉阳极葡萄糖的电催化氧化,大多数BFC需要一个离子选择性膜将电池阴阳极隔开并促进在阳极生成的H+单向流动。
2.1 微生物燃料电池
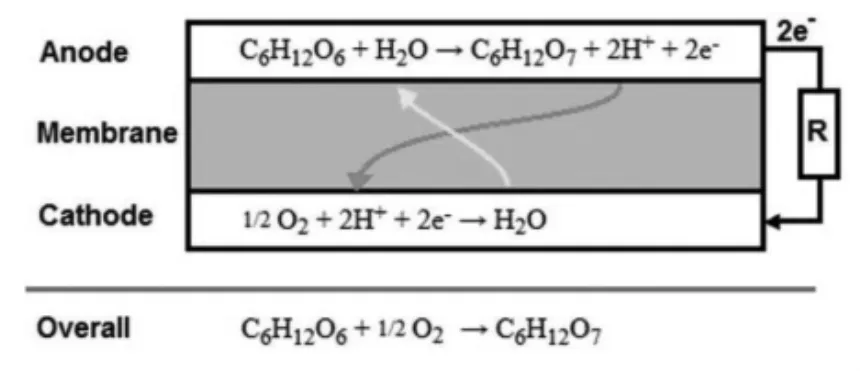
图2 葡萄糖/O2生物燃料电池电化学催化原理[13]Fig.2 The most common reaction studied for glucose biofuel cells is the oxidation of glucose to gluconolactone and the reduction of oxygen to water.According to Reference[13]
MBFC是一种直接利用活体微生物为催化剂,在厌氧阳极室产电的装置[15]。其发电所需燃料不仅包括锯末、秸秆、落叶等有机物的水解物,还包括一些有机类染料。因此MBFC还可利用废水发电,被称为是“绿色”细菌发电站,因此引起研究者的广泛关注。一般的MBFC体系的装置[16-17]如图3所示,质子交换膜(PEM)将阳极室和阴极室隔开,在厌氧条件下,微生物通过代谢作用降解有机染料,同时释放H+和电子。H+通过PEM到达阴极室,电子通过外部电路传递到阴极,质子在阴极与O2得到电子发生平行反应生成水。以醋酸作为底物的微生物燃料电池为例,其阳阴极化学反应式如(1)、(2)所示。
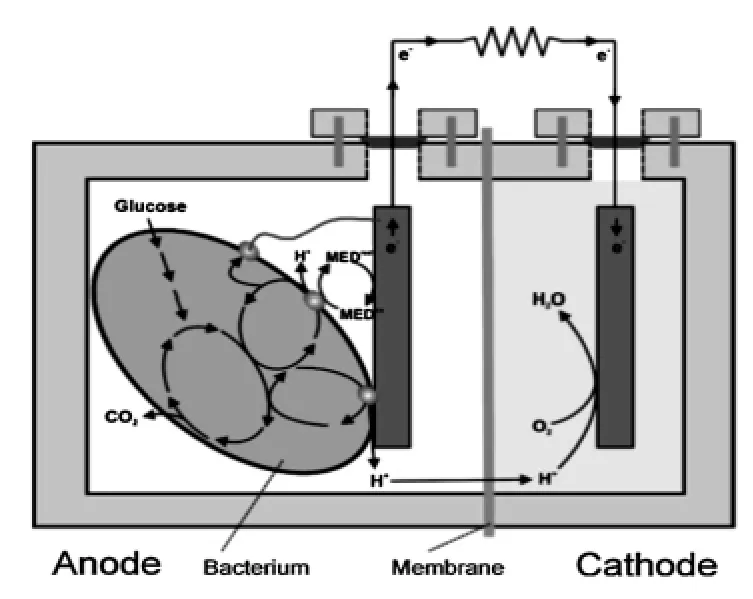
图3 MBFC体系的装置[17]Fig.3 The MBFC system is consisted of anode and cathode compartments[17]
MBFC的电子传递方式有两种,可分为有界体电子传递和直接电子传递。有界体电子传递(间接电子传递)MBFC是通过人工添加的辅助电子传递中介体,或者微生物自身产生的可溶性电子传递中介体将电子传递到电极上。因为微生物细胞膜或酶蛋白质的非活性部分会阻碍电子传递,所以选择合适的电子中介体可以有效地促进电子传递[1]。近年来,MBFC主要应用于发电、生物制氢、废水处理、以及生物传感器等方面。2006年,Bettin指出,如果一个MBFC可以产出25mW的电能,就可以刺激心脏的跳动。但是需要很大的电极面积才能实现这一目标[18]。因此,MBFC主要应用于为小型电子设备输入合适的电能。Rahimnejad[15]等将MBFC叠加作为输出电源设备,成功为十盏LED灯和一个数字时钟供电2 d。MBFC也可以作为可再生产氢装置,对于一个典型的氢源MBFC,阳极电位的外加电压必须大于0.23 V,并且阴极室需将O2隔绝[19]。在废水处理方面,MBFC具有高的运行稳定性和材料成本低等特点。2006年,Rabaey等使用特定微生物构建的MBFC能有效地将废水中的硫化物去除[20];利用MBFC的发电装置也可以有效去除难闻气体,Kim等利用废水构建的MBFC在发电量达到228 mW/m2的同时,能加速去除污水中的气味[21]。另外,利用MBFC技术构建传感器可对污染物进行分析检测,如将MBFC作为生物需氧量(BOD)传感器[22],该类BOD传感器[23]具有良好的运行稳定性和重现性,有报道表明该类MBFC可以连续运行5年。
由于微生物细胞的活性组分包裹在细胞内部,而电子的传递介体通常吸附在细胞膜的表面,因此MBFC存在电子的传递效率低且使用寿命短等缺陷,一般利用微生物构建的BFC的性能比理想情况低很多。近来研究者们陆续构建了无需电子介体的MBFC和自介体MBFC,这将有利于降低MBFC的成本以及提高其产电功率。另外由于MBFC的供电系统是微生物,因此微生物种群、温度、酸碱度以及其它环境因素都会对MBFC的运行产生影响,这也限制了微生物燃料电池的发展。要解决这些科研难题和技术瓶颈,需要海内外的科研工作者的合作交流。
2.2 酶生物燃料电池

图4 天然酶生物燃料电池原理图[12]Fig.4 Schematic of an enzymatic glucose biofuel cell[12]
EBFC是在MBFC的基础上应用发展的,是以生物体内提取的酶(葡萄糖氧化酶、胆红素氧化酶、漆酶等)为催化剂的一种生物燃料电池,如图4是EBFC的原理图。其中葡萄糖和氧气普遍存在于机体器官并通过新陈代谢在生物体液中不断补充,因此葡萄糖和氧气可作为EBFC理想的燃料和氧化剂。此外,与传统贵金属电极燃料电池相比,纯化氧化还原酶具有价格相对低廉和可再生的优点[24]。另外,EBFC具有体积小和良好的生物相容性的优点,因此在可植入式或微设备方面,EBFC有着诱人的前景。2000年初,Barton等利用生物体液中的葡萄糖产电[24],这推动了自产电的可植入式生物医学设备的发展。
在过去的十年间,采用酶促反应的各类酶生物燃料电池已有广泛的研究和报道[25-27],这说明EBFC领域具有大的发展空间。为了使电池能够成功连续地产电,酶修饰电极中天然酶的生物电催化性能是重要的考察因素。众所周知,生物酶是具有高分子量的天然蛋白质,其活性中心为烟酰胺腺嘌呤二核苷酸[NAD(H)]或烟酰胺腺嘌呤二核苷酸磷酸[NADP(H)]。许多酶的活性中心位于酶的内部被蛋白质外壳包裹,因此实现酶和电极表面间的电子快速转移非常困难[28]。目前,酶与电极之间的电子传递方式主要有两种:直接电子转移(Direct Electron Transfer,DET)[29]和中介电子转移(Mediator Electron Transfer,MET)[30]。如图5所示,DET(a)是酶的活性位点可以从酶中运动扩散到电极表面进行电子传递,而MET(b)则采用氧化还原电对(电子介体)作为中介质使酶和电极表面之间的进行电子传递。因此实现酶与电极直接电子转移是提高EBFC性能的关键。
依据电子介体的有无,可将EBFC分为无介体EBFC和有介体EBFC;另外也可按照EBFC结构的不同可分为单室和双室EBFC。双室EBFC是为了避免EBFC阴阳极间反应物和产物的相互干扰,与MBFC相似通常采用质子交换膜将EBFC的阴、阳电极分隔为阴极区和阳极区。以葡萄糖氧化酶电极为电池阳极,漆酶为电池阴极构建的电池为例,电池运行时,葡萄糖氧化酶的辅因子黄素腺嘌呤二核苷酸将葡萄糖转化为葡萄糖酸内酯并最终转化为葡萄糖酸,产生的电子和H+到达阴极区后,在漆酶的作用下,O2被还原成H2O。近来,基于葡萄糖/O2微型化的无膜EBFC由于其性能更加优良因而受到更广泛关注[31-33]。

图5 EBFC中酶与电极之间的电子传递方式[25]Fig.5 Alternative electron-transfer mechanisms in EBFC.(a)Direct electron transfer from electrode surface to the active site of an enzyme.(b)Electron transfer via redox mediator[25]
将EBFC集成到植入式生物电子学中是最具发展前途和挑战性的研究。EBFC为低功率生物医学装置提供电力[33-34],使得植入式生物电子产品如心脏起搏器、药物输送装置、以及葡萄糖生物传感器应运而生。如图6所示[34-35],利用脑脊液中的葡萄糖,在蛛网膜下腔内构建EBFC可以适当的恢复功能性损害器官,而不需要外部电源。目前,高性能EBFC[36-37]大多采用碳纳米管(CNTs)作为电极材料,这些纳米电极材料具有大的电活性面积,能大大提高固定化酶的负载量从而提高EBFC的性能。Zebda等[36-37]将碳纳米管构建的葡萄糖生物燃料电池植入老鼠腹腔内,这个体内BFC可提供38.7μW的稳定电量。

图6 脑脊液提供能量的植入式葡萄糖BFC原理图插图为一个原型的显微照片,显示阳极的金属层(中央电极)和阴极接触(外环)的硅晶片[34-35]Fig.6 Conceptual schematic of energy harvesting from cerebrospinal fluid by an implantable glucose fuel cell.The inset illustrates a micrograph of one prototype,showing the metal layers of the anode(central electrode)and cathode contact(outer ring)patterned on a silicon wafer[34-35]
2.3 模拟酶生物燃料电池
以微生物种群和天然酶为电化学催化剂的传统BFC虽然具有绿色环保、选择性和生物相容性好等特点,但也面临环境可操作性苛刻、稳定性差、以及电子传递不稳定等许多技术瓶颈,这都限制了BFC的发展和应用。近来,随着功能化纳米材料在纳米生物技术中的应用,基于无机纳米材料为催化剂的模拟酶生物燃料电池得到发展。与天然生物催化剂相比,非生物催化剂具有对温度和pH的要求相对较低、热稳定性高、耐化学性强以及组成结构可控的特点。
模拟酶生物燃料电池是涉及材料科学和生物电催化作用的跨学科研究。因此需要研究者不断探索和开发具有高效电催化活性的纳米材料。经过几十年的科研探索,研究者们已经对Pt、Au、Pd纳米材料构建的BFC的电化学催化氧化葡萄糖的反应机制深入了解。Kerzenmacher等[38]在其综述中将以Pt或其它贵金属构建的BFC称之为“state of the art”,即“最先进的水平”,这表明贵金属纳米材料模拟酶对葡萄糖氧化具有优异的催化活性。但是贵金属纳米材料存在稀有且价格昂贵的缺点,因此开发低成本,生物相容性好,具有高催化活性的非贵金属纳米材料具有重要意义。
最近,研究者们将目光投注在如Fe、Ni、Mn、C、以及O等大量元素构成的无机纳米材料模拟酶的研究领域[13]。目前已经发现的具有模拟酶活性的非贵金属纳米材料主要有金属氧化物、金属硫化物、以及碳基纳米材料等。Ci等[39]利用热处理法一步合成氮掺杂的石墨烯负载Co纳米粒子(Co/NG)的纳米复合物,该方法突破了传统制备杂原子掺杂石墨烯方法的局限性,将石墨烯掺杂杂原子的过程和功能纳米材料的加载同时进行。所制备的Co/NG的纳米复合物同时具有模拟葡萄糖氧化反应(Glucose Oxidation Reaction,GOR)活性和氧气还原反应 (Oxygen Reduction Reaction,ORR)活性,因此可将Co/NG同时作为阳极催化剂和阴极催化剂。所构建的模拟酶BFC具有的开路电位(Voc)为0.79 V,最大功率密度(Pmax)为 0.15mW·cm-2。 Oncescu 等[40]用多孔碳纸作为导电阳极催化剂的支持层,制备了体积小、低欧姆电阻、膜堆叠少的模拟酶葡萄糖生物燃料电池。与无网设计的模拟酶阳极相比,电极成本降低,电极表面积增加,因而Pt纳米粒子的负载量大大增加,这种燃料电池的Pmax大约是2 μW·cm-2。Yan等[41]设计了一个基于光诱导的模拟酶葡萄糖燃料电池,并将其作为生物传感器灵敏的检测葡萄糖的浓度。在可见光照射下,葡萄糖在阳极室被复合模拟酶催化剂Ni(OH)2/CdS/TiO2氧化,产生的过氧化氢在阴极室被血红素-石墨烯(hemin-graphene,HG)还原,通过产生的电量从而间接的测定葡萄糖。
近来,可植入式微型模拟酶葡萄糖BFC得到发展。Noh等利用AuZn电极制备的微型模拟酶BFC[42],在葡萄糖溶液和人体血清中产生的功率密度分别为 2.07和 0.29mW·cm-2(图 7),将该微膜燃料电池植入老鼠的大脑内可以产生0.52 V的电位,并且稳定性良好,能连续运行超过18 d。
3 结语
虽然各类BFC的发展由于自身因素存在着各种问题,但是总体来讲生物燃料电池具有广阔的发展空间,亟需我们的研究和探索。随着生物学科和化学学科交叉研究的深入,纳米材料具有独特的尺寸效应和表面效应将为BFC的发展注入新的活力。与MBFC和EBFC相比,纳米材料为模拟酶构建的BFC虽然具有相对长期稳定性的特点,但也存在诸多科研挑战,如当葡萄糖和O2同时出现时存在选择性差的问题;在中性pH值条件下纳米材料模拟酶的电催化活性低,导致电池电位和功率输出不稳定。因此研究开发具有选择性好、催化活性高、成本低的模拟酶催化剂是提高非生物燃料电池性能的必要条件。
以纳米材料为模拟酶构建的BFC,由于其特殊的生物化学特性受到学者们的广泛关注。由于非酶生物燃料电池中纳米微粒模拟酶催化活性受其组成、形貌、粒径大小、表面修饰、价态变化、电荷及电荷密度等因素影响,因此如何更好地调控纳米微粒模拟酶催化活性,提高它们的稳定性、特异性、选择性和灵敏度是目前研究非酶BFC的新研究方向。

图 7 (A)微型膜(聚合物/AuZn SPMEs)FCs植入颈部皮下层(a)和(b)老鼠的大脑;(B)植入式 FCs分别在脖子和大脑I–V和I–P曲线;(C)18天的长期稳定性测试[42]Fig.7 (A)Micro film FCs implanted in the(a)subcutaneous layer of the neck and(b)brain of rat(polymer/AuZn with SPMEs);(B)I–V and I–P curves for FCs in the neck and brain.(C)The long-term stability test for18 days in the brain[42]
[1]Winter M,Brodd R J.What Are Batteries,Fuel Cells,and Super capacitors[J].Chem.Rev.,2004,104:4245-4269.
[2]Xu Q, Zhang F,Xu L,et al.The applications and prospect of fuel cells in medical field:A review[J].Renewable and Sustainable Energy Reviews,2016,67(2017):574-580.
[3]Potter M C.Electrical effects accompanying the decomposition of organic compounds[J].Proceedings of the Royal Society of London.Series B,Containing Papers of a Biological Character,1911,84(571):260-276.
[4]程旋.燃料电池电催化[M].北京:化学工业出版社,2016.567-658.
[5]SMekhilef R S,Safari A.Comparative study of different fuel cell technologies[J].Renewable and Sustainable Energy Reviews,2012,16:981-989.
[6]Omar ZSharaf,Orhan M.An overview of fuel cell technology:Fundamentals and applications[J].Renewable and Sustainable Energy Reviews,2014,32:810-853.
[7]陆天虹,曹殿学,王贵领,等.燃料电池[M].北京:化学工业出版社,2014.108-191.
[8]Yahiro A T,Lee SM,Kimble DO.Bioelectrochemistry:I.Enzyme utilizing bio-fuel cell studies[J].Biochimica et Biophysica Acta(BBA)-Specialized Section on Biophysical Subjects,1964,88(2):375-383.
[9]Liu Q,Xu X,Ren G,et al.Enzymatic biofuel cell[J].Progress in Chemistry,2006,18(11):1530-1537.
[10]Jia H F.Biofuel cells[J].Battery,2000,2(30):86-89.
[11]Logan BE,Hamelers B,Rozendal R,etal.Microbial fuel cells:methodology and technology[J].Environ.Sci.Technol.,2006,40(17):5181-5192.
[12]Slaughter G,Kulkarni T.Enzymatic glucose biofuel cell and its application[J].Journal of Biochips&Tissue Chips,2015,5(1):1.
[13]Holade Y,Tingry S,Servat K,et al.Nanostructured Inorganic Materials at Work in Electrochemical Sensing and Biofuel Cells[J].Catalysts,2017,7(1):31.
[14]Milazzo,Giulio,Martin F.Bach,eds.Bioelectrochemistry I:Biological Redox Reactions[M].Springer Science&Business Media,2013.
[15]Rahimnejad M,Adhami A,Darvari S,et al.Microbial fuel cell as new technology for bioelectricity generation:A review[J].Alexandria Engineering Journal,2015,54(3):745-756.
[16]Ghasemi M,Daud W RW,Ismail M,et al.Effect of pretreatment and biofouling of proton exchange membrane on microbial fuel cell performance[J].Int.J.Hydrogen Energy,2013,38(13):5480-5484.
[17]Rahimnejad M,Ghoreyshi A A,Najafpour G.Effect of mass transfer on performance of microbial fuel cell[M].INTECH Open Access Publisher,2011.
[18]Bettin C.Applicability and feasibility of incorporating microbial fuel cell technology into implantable biomedical devices[D].The Ohio State University,2006.
[19]Logan BE.Microbial fuel cells[M].John Wiley&Sons,2008.
[20]Rabaey K,Van de Sompel K,Maignien L,et al.Microbial fuel cells for sulfide removal[J].Environ.Sci.Technol.,2006,40(17):5218-5224.
[21]Kim JR,Dec J,BrunsM A,et al.Removal of Odors from Swine Wastewater by Using Microbial Fuel Cells[J].Appl.Environ.Microbiol.,2008,74(8):2540-2543.
[22]GilGC,Chang IS,Kim BH,etal.Operational parameters affecting the performannce of a mediator-less microbial fuel cell[J].Biosens.Bioelectron,2003,18:327-334.
[23]Du ZW,LiH R,Gu TY.A state of the art review on microbial fuel cells:a promising technology for wastewater treatment and bioenergy[J].Biotechnol.Adv.,2007,25:464-482.
[24]Barton SC,Gallaway J,Atanassov P.Enzymatic biofuel cells for implantable and microscale devices[J].Chem.Rev.,2004,104(10):4867-4886.
[25]Karaskiewicz M,Nazaruk E,Z elechowska K,et al.Fully enzymatic mediatorless fuel cell with efficient naphthylated carbon nanotube–laccase composite cathodes[J].Electrochem.Commun.,2012,20:124-127.
[26]Castoren-Gonzalez JA,Foote C,MacVittie K,et al.Biofuel cell operating in vivo in rat[J].Electroanalysis,2013,25(7):1579-1584.
[27]MacVittie K,Halámek J,Halámková L,etal.From “cyborg”lobsters to a pacemaker powered by implantable biofuel cells[J].Energy Environ.Sci.,2013,6 (1):81-86.
[28]Armstrong FA,Hill H A O,Walton N J.Direct electrochemistry of redox proteins[J].Acc.Chem.Res.,1988,21(11):407-413.
[29]Bartlett PN,TebbuttP,Whitaker RG.Kinetic aspects of the use of modified electrodes and mediators in bioelectrochemistry[J].Prog. React.Kinet.1991,16(2):55-155.
[30]Katz E,Willner I.A biofuel cell with electrochemically switchable and tunable poweroutput[J].J.Amer.Chem.Soc.,2003,125(22):6803-6813.
[31]Miyake T,Yoshino S,Yamada T,et al.Self-regulating enzyme-nanotube ensemble films and their application as flexible electrodes for biofuel cells[J].J.Amer.Chem.Soc.,2011,133(13):5129-5134.
[32]Miyake T,Haneda K,Yoshino S,etal.Flexible,layered biofuelcells[J].Biosens.Bioelectron.,2013,40(1):45-49.
[33]Mano N,Heller A.A miniature membraneless biofuel cell operating at0.36V under physiological conditions[J].J.Amer.Chem.Soc.,2003,150(8):A1136-A1138.
[34]Szczupak A,Halámek J,Halámková L,etal.Living battery-biofuel cells operating in vivo in clams[J].Energy Environ.Sci.,2012,5(10):8891-8895.
[35]Hayes D L,Asirvatham SJ,Friedman PA.Cardiac Pacing,Defibrillation and Resynchronization [M].Wiley-Blackwell,2012.
[36]Reuillard B,Le Goff A,Agnès C,etal.High power enzymatic biofuel cell based on naphthoquinone-mediated oxidation of glucose by glucose oxidase in a carbon nanotube 3Dmatrix[J].Phys.Chem.Chem.Phys.,2013,15(14):4892-4896.
[37]Cinquin P,Gondran C,Giroud F,etal.A glucose biofuel cell implanted in rats[J].PloSone,2010,5(5):e10476.[38]Kerzenmacher S,Ducrée J,Zengerle R,etal.Energy harvesting by implantable abiotically catalyzed glucose fuel cells[J].J.Power Sources,2008,182(1):1-17.
[39]Ci S,Wen Z,Mao S,et al.One-pot synthesis of high performance Co/graphene electro catalysts for glucose fuel cells free of enzymes and precious metals[J].Chem.Commun.,2015,51(45):9354-9357.
[40]Oncescu V,Erickson D.High volumetric power density,non-enzymatic,glucose fuel cells[J].Scientific reports,2013,3:1226.
[41]Yan K,Yang Y,Okoth O K,etal.Visible-Light Induced Self-Powered Sensing Platform Based on a PhotofuelCell[J].Anal.Chem.,2016,88(12):6140-6144.
[42]Noh H B,Naveen M H,Choi Y J,et al.Implantable nonenzymatic glucose/O2micro film fuel cells assembled with hierarchical AuZn electrodes[J].Chem.Commun.,2015,51(30):6659-6662.
