中国热带珊瑚岛橙花破布木(Cordia subcordata)的生物学特性
2017-12-29吴淑华陈昊雯简曙光刘慧张炜任海
吴淑华, 陈昊雯, 简曙光, 刘慧, 张炜, 任海,*
中国热带珊瑚岛橙花破布木()的生物学特性
吴淑华1,2, 陈昊雯3, 简曙光1, 刘慧1, 张炜1, 任海1,*
1.广东省应用植物学重点实验室, 中国科学院华南植物园, 广州 510650 2. 中国科学院大学, 北京 100049 3. 湖南大学土木工程学院, 长沙 410082
橙花破布木()为紫草科常绿小乔木, 生长在沿海荒地以及红树林边缘, 是我国西沙群岛和南沙太平岛的优势乡土树种。对其叶片生理生态学特征、叶片营养元素含量、土壤营养元素含量进行了测定, 结果表明, 橙花破布木叶片栅栏组织排列较为紧密有序, 而海绵组织则排列较疏松无序, 具备明显的阳生性特征; 叶片面积大, 可竞争到更多的光照; 叶片下表皮气孔数多, 利于同化二氧化碳并积累干物质; 上表皮厚, 比叶面积小、导管直径和导管密度大, 叶导水率低, 木质部密度大, 这些生理生态特征有利于其充分利用水分, 并适应干旱环境。橙花破布木叶片超氧化物歧化酶(SOD)活性较高, 脯氨酸(PRO)和脱落酸(ABA)含量较高, 但丙二醛(MDA)的含量较低, 说明其对逆境的耐受性较强。橙花破布木体内养分含量较高, 而其生长的土壤养分含量低, 说明其养分吸收和利用能力较高。因此, 橙花破布木对高温、强光、干旱、贫瘠具有较强的适应能力, 因而在热带滨海地区的绿化和防风林建设方面具有良好的应用前景。
橙花破布木; 叶片结构; 生理生态特性; 土壤营养元素; 防风林建设
1 前言
橙花破布木(), 又名仙枝花, 为紫草科 (Boraginaceae)破布木属()常绿小乔木, 高可达6 m, 主要分布于中国海南(永兴岛、琛航岛、甘泉岛)和台湾(太平岛)以及非洲东海岸、印度、越南、太平洋南部诸岛屿[1]。橙花破布木多生长在沿海地区以及红树林边缘等低海拔地区, 通常生长在沙质、粘土或岩石的石灰岩土壤上和熔岩岬角上, 为常见的小乔木丛或次生小乔木丛。
橙花破布木常被种植于家园附近, 用来庇荫, 亦可作行道树。在太平洋群岛, 橙花破布木次生林有非常好的防风效果, 其根系较浅且发达, 适应沙土和干旱, 可有效地保护受侵蚀的沿海地区[2]。橙花破布木有较大的开发利用价值, 但目前国内外对橙花破布木的相关研究报道极少, 在世界自然保护联盟(IUCN)红色名录中被列为最不受关注的植物之一[3]。近年来, 国内外有关橙花破布木的研究大多集中在花粉形态、繁殖特征、引种栽培、农业开发等方面[4], 太平洋群岛地区报道较多[5], 破布木属6种植物研究较少, 目前缺乏对橙花破布木生物学特性的综合研究, 尤为缺乏对热带珊瑚岛原生条件下生长的橙花破布木的生物学特性研究。
本研究以中国热带的西沙群岛永兴岛的橙花破布木为研究对象。永兴岛位于西沙群岛东部宣德群岛的宣德群礁中(北纬16°50′, 东经112°20′)。永兴岛地处北回归线以南, 属热带季风气候, 由于周围被海包围且陆地面积小, 有海洋性气候的特点, 雨量充沛, 终年高温, 高湿, 高盐[6]。该岛年均降雨量约1505 mm, 但降水季节分布不均, 故在干季出现季节性干旱。年均气温为26.5 ℃。永兴岛是热带珊瑚岛, 其土壤为磷质石灰土, 堆积物以砂为主, 也含少量小砾。永兴岛土层薄, 土壤水分易丧失, 在干旱季仍然会受到明显的干旱胁迫。永兴岛植被为热带珊瑚岛常绿林, 组成种类以热带性为主, 有植物种数300多种, 其中野生植物种类为100多种[1]。
本研究对原产于永兴岛的野生橙花破布木进行了形态解剖学特征、生理学特性、植物营养元素及根际土壤理化性质的综合研究, 以期全面了解橙花破布木的生物学特性, 为其保护、栽培及开发利用提供参考。
2 材料与方法
2.1 实验材料
本研究所需的植物样品及土壤样品于2016年6月在西沙群岛永兴岛采集。采集时, 选取健康的5株橙花破布木(1株植物为一个重复), 采集树冠中长势较好的成熟叶片和枝条, 将枝条放入封口袋, 加入适量的湿滤纸并迅速放入船载冰箱, 上岸后用冰盒带回实验室进行各项测定。同时, 采集选取的5株植物0—20 cm深的根际土壤, 混合后装袋密封低温保存, 测定主要的土壤理化性质。
2.2 测定方法
2.2.1 生理生态学特征的测定
叶片厚、栅栏组织厚、海绵组织厚、栅栏宽、上表皮厚、气孔保卫细胞长、气孔密度、木质部密度、导管密度、导管密度、导管直径按Duncan[17]和任海[8]的方法, 通过制片在显微镜下进行观测。叶面积采用LI-3000 C叶面积仪(LI-COR, 美国)进行测定并称鲜重, 后将叶片置于65 ℃烘箱烘干48h后称干重, 并根据叶干重计算比叶面积、叶片干物质含量和叶片密度。叶片密度计算公式:=d/, 式中,为叶片密度(g·cm–3);d为比叶面积(mg·cm–2);为叶片厚度(μm)。
枝条最大导水率的测定: 采用冲洗法, 取20 cm枝条放入装满水的烧杯, 并套上黑色塑料袋, 待枝条水分充分饱和后, 既用50 cm高的龙头冲洗后测定最大导水率, 其稳定的最大导水率能够在一定程度上反映枝条木质部潜在导水率[9]。枝条最大导水率公式:max=/Δ。其中max为反复冲洗后枝条最大导水率(g cm–2s–1MPa–1);为枝条在一定时段内的导水量(g),为导水历时(s), A为枝条横截面积(cm2)。木材密度:ρ=0/,0为木材干重,为木材体积。枝条空腔比:=/,为导管面积(cm),为木质部面积(cm)[10]。
δ13C的测定: 在MAT-252质谱仪上进行测定, 以 PDB(Pee Dee Belemnite)为标准, 计算公式为: δ13CPDB={[13C/12C]样品-[13C/12C]标准}/[13C/12C]标准×1000[11]。
叶绿素含量的测定: 称取0.5g取橙花破布木叶片, 以80%的丙酮浸提叶片, 用紫外分光光度计(UV- 3802, Unico)分别于663 nm和645 nm处测定吸光度, 重复测量6次, 计算叶片的叶绿素a、叶绿素b、总叶绿素含量及叶绿素a/b的比值[12]。
可溶性蛋白含量的测定: 采用BCA法, 检样0.1 mL加工作试剂2.5 mL混合后置37℃水浴120分钟, 用紫外分光光度计(UV-3802, Unico)比色, 波长595 nm, 以试剂空白调零, 读取吸光度[13]。
脱落酸(ABA)含量的测定: 采用高效液相色谱法测定, ABA在254 nm 下有吸收峰[14]; 脯氨酸(PRO)含量的测定: 采用磺基水杨酸法提取PRO, 0.5 g橙花破布木叶片剪碎后放入试管中, 加5 mL 3%磺基水杨酸溶液, 沸水浴中10分钟。PRO与酸性茚三酮溶液染色, 加入甲苯, 静置后, 吸取甲苯层于紫外分光光度计(UV-3802, Unico)520 nm处比色[15]。
抗氧化酶活性的测定: 抗氧化酶包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)。SOD活性测定: 采用氮蓝四唑法, 在 560 nm波长下测量透光率。以每g组织每分钟催化1 nmol H2O2降解定义为一个酶活力单位; POD活性测定: 采用愈创木酚法, 在470 nm波长下测定吸光值。以每g组织在每mL反应体系中每分钟A470变化0.5为一个酶活力单位; CAT活性测定: 配置反应液, 在525 nm 波长下测量光密度。以每分钟每克鲜重OD值变化 0.01所需的酶量为一个酶活单位[16]。
丙二醛(MDA)含量测定: 采用硫代巴比妥酸法, 取0.6%硫代巴比妥酸(先用NaOH溶解)和酶粗提液各3 mL, 于沸水浴上反应15min, 离心取上清液, 测定 532 nm和600 nm处吸光度[17]。
总抗氧能力(T-AOC)的测定: 采用FRAP法, 在酸性条件下, Fe3+-TPTZ(三吡啶三吖嗪)可被样品中还原物质还原为蓝色的Fe2+-TPTZ, 于593 nm处具有最大光吸收, 在Fe3+-TPTZ过量的情况下, 检测蓝色物质的生成量可反映待测样品的还原能力, 即样品的总抗氧化能力[18]。
2.2.2 植物营养元素及土壤理化性质的测定
叶片烘干后, 干样品磨碎、过筛后用酸消化, 其中全N(TN)用靛酚蓝比色法测定, 全C(TOC)用丘林法测定; 总酚(TP)采用Foli-ci0caheu(FC)比色法法测定[19]。
根际土土壤样品风干、研细, 通过 0.83 mm筛, 用pH 211酸度离子测定仪进行pH值测定(土: 水= 1: 5), 通过0.075 mm筛, 用靛酚蓝比色法进行全N测定, 全C(TOC)用丘林法测定, 全P用酸溶-钼锑抗比色法测定, K、Na、Ca、Mg、Fe、Mn、Zn和Cu用原子吸收光谱仪测定[20]。
2.2.3 数据处理
数据分析和作图均采用 Excel 2013软件进行, 图片用Photoshop 5进行处理。
3 结果与分析
3.1 形态解剖学特征
野外观测发现, 橙花破布木的冠型较均匀, 叶片叶片在冠层分布密度适中。其叶片形态解剖特征如表1。其叶片的解剖结构显示其叶片大而厚(图3)。气孔大而密度较高(图2), 细胞呈无规则型, 导管直径较大且导管密度较大(图4), 其比叶面积为(205.06± 19.54) cm2·g–1, 单位叶片干物质含量为(0.24±0.02) %。枝条空腔比为(10.69±1.92) %。δ13C为(–28.03±0.57)‰。
3.2 叶片生理学特征
橙花破布木叶绿素的叶绿素a/b比值为2.11±0.18。其可溶性蛋白含量为(35.32±0.24) mg·g–1, 脱落酸含量为(3.4±0.1) µg·g–1、脯氨酸含量为(200.78±3.73) μg·g–1, 丙二醛含量为(16.94±0.06) nmol·g–1。植物对膜脂过氧化的酶促防御系统的保护酶类, 如, 超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性分别为(255.25±7.85)、(42.08±0.34)、(30.99±2.49) U·g–1(表2)。
3.3 营养元素含量
橙花破布木叶片全氮含量为(27.32±2.44) g·kg–1, 总有机碳含量(385.17±4.86) g· kg–1。
调查样地的土壤养分含量如表3所示。土壤pH值为8.6, 呈碱性, 含水量很低, 只有0.06%。土壤中加权平均养分含量依次为: 有机质(3.06%)、有机碳(1.78%)、全氮(0.03%)。全磷含量为2.39 mg·kg–1。土壤中金属元素中, 含量较高的为Ca(81.89 mg·kg–1)、Fe(1527.95 mg·kg–1)、Mg(7.17 mg·kg–1), Cu元素的含量较低, 只有2.66 mg·kg–1。

表1 橙花破布木的形态解剖特征
4 讨论
4.1 橙花破布木是阳生植物
植物的光合作用与叶面积、叶片的分布及单叶的光合能力有关[21]。本研究结果显示, 橙花破布木叶片面积大, 可截获更多的光照。气孔是植物进行光合作用和蒸腾的主要通道, 橙花破布木下表皮气孔数多, 这有利于其同化二氧化碳并积累干物质。橙花破布木叶片叶肉内栅栏组织发达, 排列较为紧密有序, 胞间隙小, 而海绵组织则排列较疏松无序, 具备明显的阳生性特征。

图1 橙花破布木的气孔

图2 橙花破布木的叶片横切面

图3 橙花破布木的木质部横切面
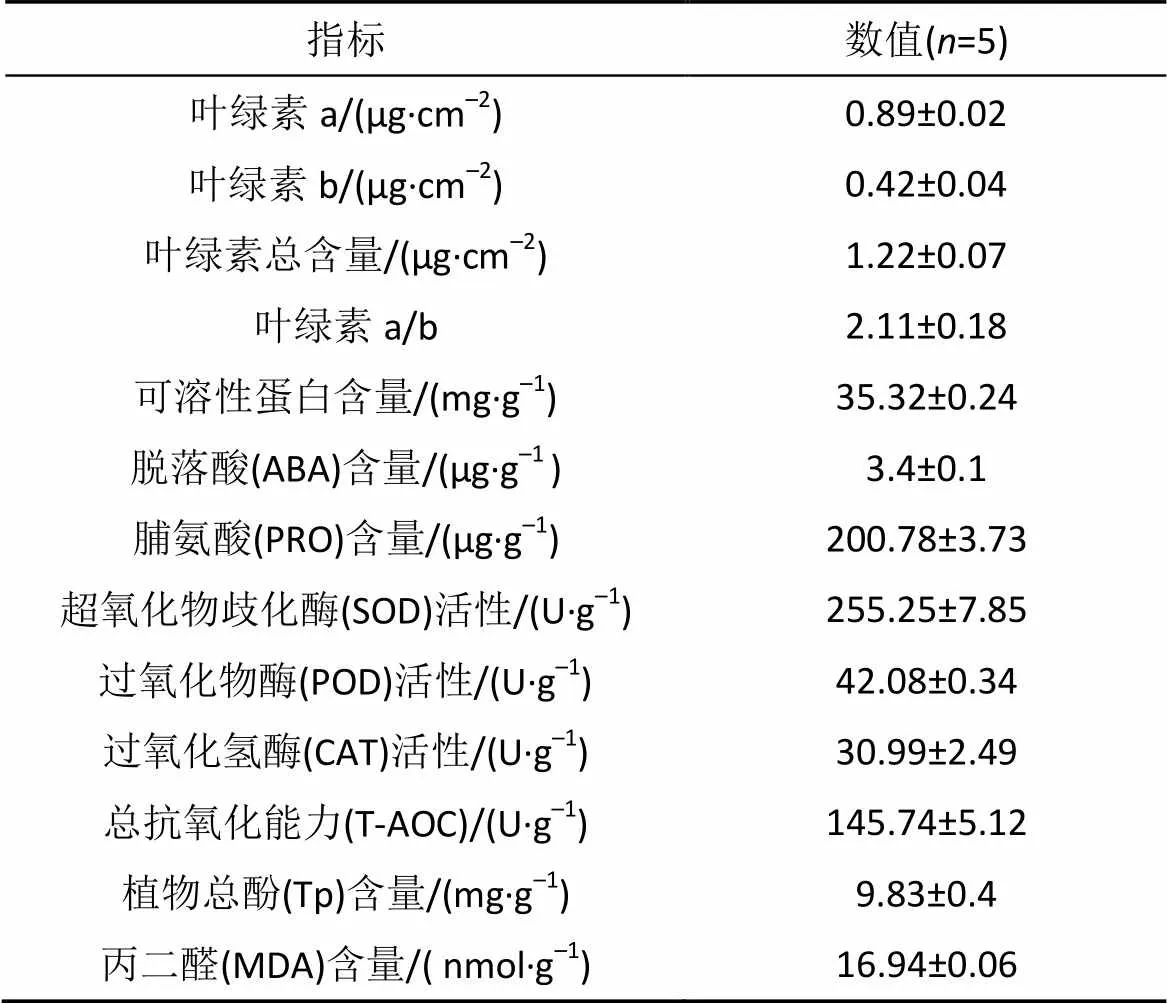
表2 橙花破布木的生理生态学特性

表3 橙花破布木的土壤理化性质特征
4.2 橙花破布木是旱生植物
橙花破布木上表皮厚, 角质层发达, 可有效防止水分散失, 适应干旱环境。比叶面积是植物叶片面积与叶片干重的比值, 可表征植物与环境互作的功能性状指标, 在贫瘠或恶劣的环境, 比叶面积一般较小, 而在资源和营养状况良好的环境比叶面积较大[22]。沙丘生境植物抗旱能力较强, 其比叶面积一般为86—295 cm2·g–1 [23], 橙花破布木比叶面积为205 cm2·g–1, 该值在沙丘生境植物比叶面积的范围中, 说明橙花破布木具有较强的抗旱能力。
植物木质部的导水能力和栓塞化程度与抗旱性之间有着密切关系[24]。木质部水分运输效率主要依靠导管直径和导管密度, 木质部导管是影响水分运输的重要参数。导管直径越大、密度越高, 导管的水分输导率越高[25]。荒漠植物沙棘的导管直径和导管密度分别为9—14 μm、42—55 g·mm–2[26], 橙花破布木导管直径和导管密度与其相比都较大, 故更有利于水分的运输, 提高水分利用效率, 使其能够在强光照及干旱条件下保持植物体内水分平衡。高木质部抗栓塞能力与高木材密度相关[27], 根据木材密度数据库统计的木质部密度一般为0.1—1.2 g·cm–3 [28], 橙花破布木最高木质部密度可达1.4 g·cm–3, 说明其栓塞阻力也较高, 以适应干旱环境。
植物水分利用效率(WUE)指植物消耗单位水分所生产的同化物质的量, 是反映植物耐旱性的一个有效指标。在相同条件下水分利用效率高的植物的抗旱能力越强。目前普遍将植物叶片δ13C值用来间接表征植物的水分利用效率, 植物叶片的δ13C值与其水分利用效率呈一定程度的正相关, δ13C值越大, 植物水分利用效率越高。据研究, 阜康荒漠植物乔木的δ13C为(–26.83±0.02)‰[29], 而橙花破布木的δ13C为(–28.03±0.57)‰, 略低于荒漠植物乔木的δ13C值, 说明水分利用效率较高, 抗旱能力较强。
ABA的含量常作为植物抗旱性的指标之一。橙花破布木叶片中ABA含量很高, 可明显减少叶片水分散失, 最终植物的保水能力和对干旱的耐受性提高[30]。
4.3 橙花破布木具有抵抗多种逆境的能力
Pro是植物体内适应逆境胁迫的渗透调节物质, 在受到高温高湿等胁迫条件时, Pro大量合成和积累增加了植物对渗透胁迫的耐性, 具有渗透保护剂的功能, 从而保护细胞的结构, 因此干旱胁迫和盐胁迫会导致植物体内Pro的含量积累增加[31]。抗旱能力较强的松科植物, Pro含量范围为16.0—26.46 μg·g–1, 与其相比, 橙花破布木叶片中Pro含量较高, 说明其抗胁迫能力较强, 能很好的适应海岸或海岛的极端环境。
植物有抗氧化系统, 可在逆境条件下保护植物的膜系统, 清除植物体内产生的多余的自由基[32]。POD、CAT、SOD则是植物对膜脂过氧化的酶促防御系统。橙花破布木中SOD、POD 和CAT的活性都较高, 其中, SOD植物抗氧化系统的第一道防线, 其活性尤为较高, 说明其膜系统的稳定性较高, 能够耐受多种逆境胁迫。
MDA是细胞膜脂过氧化的产物, 其含量可反映细氧化胁迫对植物膜脂的伤害程度, 也可反映植物遭受逆境伤害的程度[33]。橙花破布木中MDA含量较低, 说明该物种的抗逆性较强。
4.4 橙花破布木具有高水平的养分利用效率
植物营养元素含量体现植物在一定生境条件下吸收和利用营养元素的能力, 能在一定的程度上揭示植物的生长状况[34]。通常, 植物体内N元素含量为10—50 g·kg–1 [35]。本研究中, 橙花破布木的N元素含量在植物养分常规含量范围内, 说明其生长状况良好。
土壤含水量与降水量、蒸发量、气温有关[36], 橙花破布木所生长的土壤含水量较低, 而西沙群岛降雨量大, 气温高, 故主要是其蒸发量过大且礁砂孔隙大引起保水能力差造成的土壤含水量低。土壤养分含量直接影响植物的生长。本研究中, 土壤养分含量较低, 但橙花破布木植物体内营养元素含量处于正常水平, 说明橙花破布木的营养元素吸收利用能力较高, 耐受贫瘠, 适应海岛环境的能力强。
5 结论
通过对橙花破布木生理生态特征及营养元素含量及利用的研究表明, 该种植物属典型阳生性植物, 对高温和强光照具有较强的适应能力, 适合在热带地区引种栽培。其耐干旱和耐贫瘠的能力, 使得橙花破布木在热带和亚热带滨海地区海滩防风林建设、绿化环境等方面具有良好的应用前景。
[1] 童毅, 简曙光, 陈权, 等. 中国西沙群岛植物多样性. 生物多样性, 2013, 21(3): 364–374.
[2] FRIDAY J B, OKNO D.(kou)[J]. Species Profiles for Pacific Island Agroforestry, 2006, 3:1.
[3] IUCN红色名录(2011年2月)。
[4] ABBOTT I A, SHIMAZU C. The geographic origin of the plants most commonly used for medicine by Hawaiians[J]. Journal of Ethnopharmacology, 1985, 14(2/3): 213–222.
[5] THAMAN R R. Ethnobotany of Pacific Island coastal plants[J]. Science of Pacific Island peoples, 1994, 3: 147– 184.
[6] 赵焕庭, 宋朝景, 余克服, 等. 西沙群岛永兴岛和石岛的自然与开发[J]. 海洋通报, 1994, 13(5): 44–56.
[7] DUNCAN W G. Leaf angles, leaf area, and canopy photosynthesis[J]. Crop Science, 1971, 11(4): 482–485.
[8] 任海, 彭少麟, 孙谷畴, 等. 广东中部两种常见灌木的生态学比较[J]. 植物生态学报, 1997, 21(4): 386–392.
[9] REN Hai, PENG Shaolin, SUN Guchou, et al. The ecological comparison ofandin South China[J]. Chinese Journal of Plant Ecology, 1997, 21: 386–392.
[10] SPERRY J S, TYREE M T. Mechanism of water stress- induced xylem embolism[J]. Plant Physiology, 1988, 88(3): 581–587.
[11] 陈拓, 陈雄. 甘肃马衔山平车前叶片 δ^13C 的海拔和时间差异[J]. 西北植物学报, 2000, 20(4): 672–675.
[12] ZHU S D, CHEN Y J, CAO K F, et al. Interspecific variation in branch and leaf traits among three Syzygium tree species from different successional tropical forests[J]. Functional Plant Biology, 2015, 42(4): 423–432.
[13] 关岚岚, 刘楠, 韦强, 等. 华南地区 8 种藤本植物叶绿素荧光特性对模拟二氧化硫污染的响应[J]. 热带亚热带植物学报, 2008, 16(2): 95–103.
[14] BROWN R E, JARVIS K L, HYLAND K J. Protein measurement using bicinchoninic acid: elimination of interfering substances[J]. Analytical Biochemistry, 1989, 180(1): 136–139.
[15] 张能刚, 徐义俊, 周燮. 脱落酸间接酶联免疫检测法的建立[J]. 南京农业大学学报, 1991, 14(3): 21–24.
[16] 张殿忠, 汪沛洪, 赵会贤. 测定小麦叶片游离脯氨酸含量的方法[J]. 植物生理学通讯, 1990, 4: 62–65.
[17] 袁庆华, 桂枝, 张文淑. 苜蓿抗感褐斑病品种内超氧化物歧化酶, 过氧化物酶和多酚氧化酶活性的比较[J]. 草业学报, 2002, 11(2): 100–104.
[18] I W, WU Y, REN C, et al. The activity of recombinant human neuroglobin as an antioxidant and free radical scavenger[J]. Proteins: Structure, Function, and Bioinformatics, 2011, 79(1): 115–125.
[19] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical biochemistry, 1996, 239(1): 70–76.
[20] CORNELISSEN J H C, LAVOREL S, GARNIER E, et al. A handbook of protocols for standardised and easy measurement of plant functional traits worldwide[J]. Australian Journal of Botany, 2003, 51: 335–380.
[21] 任海, 彭少麟, 戴志明, 等. 了哥王 () 的生态生物学特征[J]. 应用生态学报, 2002, 13(12): 1529–1532.
[22] SHIPLEY B, VU T T. Dry matter content as a measure of dry matter concentration in plants and their parts[J]. New Phytologist, 2002, 153(2): 359–364.
[23] 李玉霖, 崔建垣, 苏永中. 不同沙丘生境主要植物比叶面积和叶干物质含量的比较[J]. 生态学报, 2005, 25(2): 305–310.
[24] COCHARD H, HERBETTE S, Hernández E, et al. The effects of sap ionic composition on xylem vulnerability to cavitation[J]. Journal of Experimental Botany, 2010, 61(1): 275–285.
[25] BASS P. New perspectives in wood anatomy[M]. M. NIJHOFF/W Junk Publishers, 1982.
[26] 李晓燕, 王林和, 李连国, 等. 沙棘茎的形态解剖特征与其生态适应性研究[J]. 干旱区资源与环境, 2008, 22(3): 188–191.
[27] NARDINI A, BATTISTUZZO M, SAVI T. Shoot desiccation and hydraulic failure in temperate woody angiosperms during an extreme summer drought[J]. New Phytologist, 2013, 200(2): 322–329.
[28] CHAVE J, COOMES D, JANSEN S, et al. Towards a worldwide wood economics spectrum[J]. Ecology Letters, 2009, 12(4): 351–366.
[29] 陈拓, 冯虎元, 徐世建, 等. 荒漠植物叶片碳同位素组成及其水分利用效率[J]. 中国沙漠, 2002, 22(3): 288–291.
[30] 刘红娟, 刘洋, 刘琳. 脱落酸对植物抗逆性影响的研究进展[J]. 生物技术通报, 2008, 6: 7–9.
[31] 赵福庚, 刘友良, 章文华. 大麦幼苗叶片脯氨酸代谢及其与耐盐性的关系[J]. 南京农业大学学报, 2002, 25(2): 7–10.
[32] FRIDOVICH I. Free radicals in biology[J]. New York: Academic Press, 1976, 1: 239.
[33] 王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990, 26(6): 55–57.
[34] 刘鹏, 郝朝运, 陈子林, 等. 不同群落类型中七子花器官营养元素分布及其与土壤养分的关系[J]. 土壤学报, 2008, 45(2): 304–312.
[35] 廖红, 严小龙. 高级植物营养学[M]. 北京: 科学出版社, 2003.
[36] HAWLEY M E, JACKSON T J, MCCUEN R H. Surface soil moisture variation on small agricultural watersheds[J]. Journal of Hydrology, 1983, 62(1): 179–200.
吴淑华, 陈昊雯, 简曙光, 等. 中国热带珊瑚岛橙花破布木()的生物学特性[J]. 生态科学, 2017, 36(6): 57-63.
WU Shuhua, CHEN Haowen, JIAN Shuguang, et al. The biological characteristics ofon tropical coral island in China[J]. Ecological Science, 2017, 36(6): 57-63.
The biological characteristics ofon tropical coral island in China
WU Shuhua1,2, CHEN Haowen3, JIAN Shuguang1, LIU Hui1, ZHANG Wei1, REN Hai1,*
1. Guangdong Provincial Key Laboratory of Applied Botany, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China 2. University of Chinese Academy of Sciences, Beijing 100049, China 3. College of Civil Engineering, Hunan University, Changsha 410082, China
is an evergreen small tree species of Boraginaceaefamily. It generally grows in the coastal wasteland and the edge of mangroves. It is the dominant tree species in Xisha Islands and Taiping Island in south China. We examined the ecophysiological characteristics, and nutrients contents of its leaves and its growing soil. We found that the leaf palisade tissue ofarranged in an orderly manner, but its spongy tissue arranged loosely and disorderly, which showed that this specieswas a typical heliophyte. The large leaf area ofcould help in intercepting sunlight. The leaf epidermal stomata density ofwas high, which was beneficial to assimilate carbon dioxide and accumulate dry matter. For, the upper epidermis was thick, the specific leaf area value was low, the vessel diameter and density were high, the leaf water conductivity was low and the xylem density was high. These physiological ecology characteristics could favorin fully utilizing water and adapting to the arid environment. The leaf superoxide dismutase (SOD) activity ofwas high, and the leaf proline (PRO) and abscisic acid (ABA) contents were high, but leaf malondialdehyde (MDA) content was low, which meant that it could well tolerate stress conditions. Therefore,individuals tolerate high temperature, thigh radiation, drought, as well as barren. We conclude thathas a good application potential in greening and windbreak construction in the tropical coastal area.
; leaf structure; ecophysiological characteristics; soil nutrition elements; windbreak construction
10.14108/j.cnki.1008-8873.2017.06.008
S157.2
A
1008-8873(2017)06-057-07
2017-08-09;
2017-09-04
国家重点研发计划项目(2016YFC1403002); 中国科学院A类战略性先导科技专项(XDA13020500); “十二五”农村领域国家科技计划项目(2015BAL04B04)和广东省科技计划项目(2016A030303044)
吴淑华(1991—),女,重庆秀山人,硕士研究生,研究方向为植物生理生态,E-mail:wushuhua77@sina.com
任海, 男, 博士,研究员,研究方向为恢复生态学和森林生态学,E-mail: renhai@scib.ac.cn
