两株珍珠龙趸病原性哈维弧菌(Vibrio harveyi)的分离与鉴定
2017-12-29蒋魁徐力文苏友禄马红玲刘广锋郭志勋高芳冯娟
蒋魁, 徐力文, 苏友禄, 马红玲, 刘广锋, 郭志勋, 高芳, 冯娟
两株珍珠龙趸病原性哈维弧菌()的分离与鉴定
蒋魁, 徐力文, 苏友禄, 马红玲, 刘广锋, 郭志勋, 高芳, 冯娟*
中国水产科学研究院南海水产研究所, 农业部南海渔业资源开发利用重点实验室, 广东 广州 510300
自海南陵水和广东深圳养殖场患病珍珠龙趸(pearl gentian)分离到2株优势菌(X12XC30和X13SZ03), 经回归感染实验证实2株菌是珍珠龙趸的病原菌, 对珍珠龙趸的半致死浓度(LD50)分别是6.58×106CFU·g-1和9.83×105CFU·g-1。对菌株进行形态、颜色和生长条件等常规生理生化实验, 并进行,和等管家基因的序列分析综合鉴定。结果显示: 2株病原菌均为短杆状革兰氏阴性菌, TCBS生长为黄色, 对O/129(150 ug·片-1)敏感, 生理生化指标与哈维弧菌标准株一致;和序列在Genbank上检索与哈维弧菌的同源性最高, 根据管家基因的序列构建系统进化树, 自然地与哈维弧菌分支聚类为一支, 确定这2株菌均为哈维弧菌。药敏实验发现2株哈维弧菌均耐呋喃唑酮, 而对诺氟沙星、恩诺沙星、环丙沙星和氯霉素等药物敏感。哈维弧菌具有较高的致死率, 在珍珠龙趸养殖业中存在潜在的威胁。
哈维弧菌; 珍珠龙趸; 鉴定
1 前言
海水养殖业中, 细菌病是影响广泛的重要因素[1], 哈维弧菌()作为海水养殖业重要的致病菌[2–3], 可感染多种鱼、虾、蟹等并造成大量的死亡[4–7], 例如, 哈维弧菌感染牙鲆()[8–9]、斑节对虾()[10–11]、凡纳滨对虾()[12]、尖吻鲈()[13]、刺尾鱼()[14]和红鳍东方鲀()[15]等水产养殖动物, 并导致其死亡的主要原因, 给水产养殖业带来严重的经济损失。病原性哈维弧菌分布的养殖海域, 当细菌数量达到一个阈值, 则会触发群体感应效应, 产生毒性变异, 对海洋生物造成细菌性侵染毒害, 扰乱海域生态环境。
珍珠龙趸(pearl gentian), 又称珍珠斑或龙虎斑, 是由鞍带石斑鱼(♂)和棕点石斑鱼(♀)杂交培育的新种。珍珠龙趸结合了棕点石斑鱼抗病力强和鞍带石斑鱼生长快的优点, 显现出明显的杂种优势[16]。2013年全中国石斑鱼产量约为18.44万吨, 其中广东、福建、海南养殖量就高达8.24万吨, 近两年在天津、青岛等地也都实现了珍珠龙趸的大规模养殖。目前, 珍珠龙趸的研究主要是育种和养殖技术[17–18], 随着养殖规模的不断扩大, 养殖过程中疾病的问题逐渐凸现, 大量的鱼在养殖过程中染病死亡[19–20], 但关于珍珠龙趸细菌性疾病的相关报道很少。
2012年9月中下旬, 海南陵水县新村湾周边池塘养殖的珍珠龙趸, 鱼体出现烂身, 死亡, 体长15—17 cm, 体重125—140 g, 盐度32—34 PPT, 水温29—32 ℃, 每天死亡率0.5%—1.0%, 分离病原菌X12XC30。2013年10月上中旬, 广东深圳大鹏某水泥池养殖的珍珠龙趸, 体长13—15 cm, 体重90—120 g, 盐度28—30, 水温27—29 ℃,每天死亡率0.6%—1.4%, 分离病原菌X13SZ03。患病鱼表现的主要症状相似: 体侧脱鳞, 尾柄溃疡, 以口腔上下颚溃疡明显, 部分鱼眼膜发白, 鳃轻度贫血状, 部分鱼有少量瓣体虫寄生。肾脏肿大软化, 脾脏肿大, 肝脏边缘有坏死状浅色斑块, 胃和肠道无食物, 积有少量浅色脓液状物。从肝、肾和脑分离到优势菌落。
本研究分离来自不同地区珍珠龙趸的疑似病原菌X12XC30和X13SZ03, 并从两株菌的形态、生理生化特征、生物学分类以及致病性进行研究, 以期为防治珍珠龙趸养殖中弧菌病的爆发提供生物学科学依据。
2 材料与方法
2.1 病原菌的分离
本实验室于2012年和2013年分别在海南陵水与广东深圳养殖场的患病珍珠龙趸分离的2株病原菌(表1)。
2.2 回归感染实验
自海南三亚一养殖场购得珍珠龙趸幼鱼, 体长(10±0.5) cm, 体重(11.8±1) g, 在5 m3的水泥池中暂养一周。每株菌设5个实验组和1个对照组, 每组3个平行, 每个平行10尾鱼, 分别饲养于1 m3的水泥池中。将待检菌株接种于2216E斜面培养12—16 h, 用无菌生理盐水(0.9% NaCl)洗脱, 制成菌悬液, 10倍稀释五个浓度梯度(菌悬液涂布法计数), 实验组每尾鱼腹腔注射0.2 ml菌悬液, 对照组注射等量生理盐水。每天正常喂养, 观察记录实验鱼的死亡情况, 直到实验鱼稳定3天以上不出现死亡为止, 取实验组濒死鱼肝脏、肾脏划线分离细菌。
采用寇氏法计算LD50, 公式如下:
lg LD50=-(Σ-0.5)
式中:死亡率为100%组的对数剂量
对数组距
表1 菌株来源及编号

Tab.1 Sources of strains and serial number
Σ各组死亡率之和
2.3 菌株形态及生理生化特征分析
对菌株X12XC30和X13SZ03及感染后分离株进行革兰氏染色, 用油镜观察细菌形态及染色情况。将纯化后的菌株接种到2216E液体培养基培养, 根据常规生理生化鉴定测定方法[21], 同时做API(32E)系统鉴定。
2.4 分子生物学鉴定
将两株病原菌接种于营养肉汤中, 28 ℃过夜培养12—16 h。取2 mL菌悬液, 根据细菌基因组DNA提取试剂盒说明书方法提取DNA为PCR模板, 保存于–20 ℃备用。选取1和三个管家基因进行PCR扩增。设计引物, 送上海生工合成(见表2)。2×Premix Taq购自Takara公司。DL 2000 Maker购自广州东盛生物科技有限公司。
PCR扩增体系如下:
2×Premix Taq 25uL
Primer-F 2uL
Primer-R 2uL
DNA 2uL
ddH2O up to 50uL
PCR扩增条件: 95 ℃ 5 min; 95 ℃ 30 s, 50—60 ℃ 40 s, 72 ℃ 1 min, 35个循环; 72 ℃ 10 min。
取5 uL PCR产物进行1%的琼脂糖凝胶电泳, 阳性产物送英潍捷基公司测序, 得到基因序列, 利用MEGA 6.0 软件构建NJ系统进化树, 分析结果[22]。
2.5 菌株对药物的敏感性实验
据NCCL实验操作标准, 采用纸片扩散K-B法检测菌株X12XC30和X13SZ03对药物的敏感性, 取100 μL菌悬液(浓度约为108CFU·mL-1)涂布于MHA培养基上, 10 min后贴药敏纸片, 药敏纸片为12种常见的抗生素(均于杭州天和微生物试剂有限公司购得): 头孢克肟、庆大霉素、四环素、环丙沙星、诺氟沙星、氯霉素、复方新诺明、利福平、呋喃唑酮、阿莫西林、红霉素和恩诺沙星。于28 ℃下培养24 h后, 观察并测量抑菌圈直径。根据抑菌圈直径大小判断菌株对药物的敏感性[23–25]。
3 结果
3.1 菌株X12XC30和X13SZ03致病性
回归感染显示, X12XC30和X13SZ03对珍珠龙趸具有强致病性, 引起宿主死亡。其表现病征为肾脏肿大软化, 脾脏肿大, 胃和肠道无食物, 肝门有出血等。根据实验鱼死亡结果, 计算得到LD50分别是6.58×106CFU·g-1和9.83×105CFU·g-1(见表3)。对感染后的珍珠龙趸鱼肝脏、肾脏组织重分离细菌、纯化, 菌株分别标记为X12XC30-1和X13SZ03-1。
3.2 生理生化检测
经生理生化以及染色鉴定, 革兰氏染色为红色, 呈短杆状的阴性菌(图1)。TCBS生长为黄色, 对O/129(150 ug·片-1)敏感; 在28 ℃和35 ℃均能生长, 需要NaCl; 利用葡萄糖, 对氧化酶与过氧化氢酶均呈阳性, 实验菌株在利用甘露醇、肌醇及淀粉等项目中与哈维弧菌标准株有差异(见表4)。对照《伯杰氏细菌鉴定手册》(第九版)[26], 参照有关文献[27–28], 确定两株病原菌归属于弧菌属。
表2 引物信息
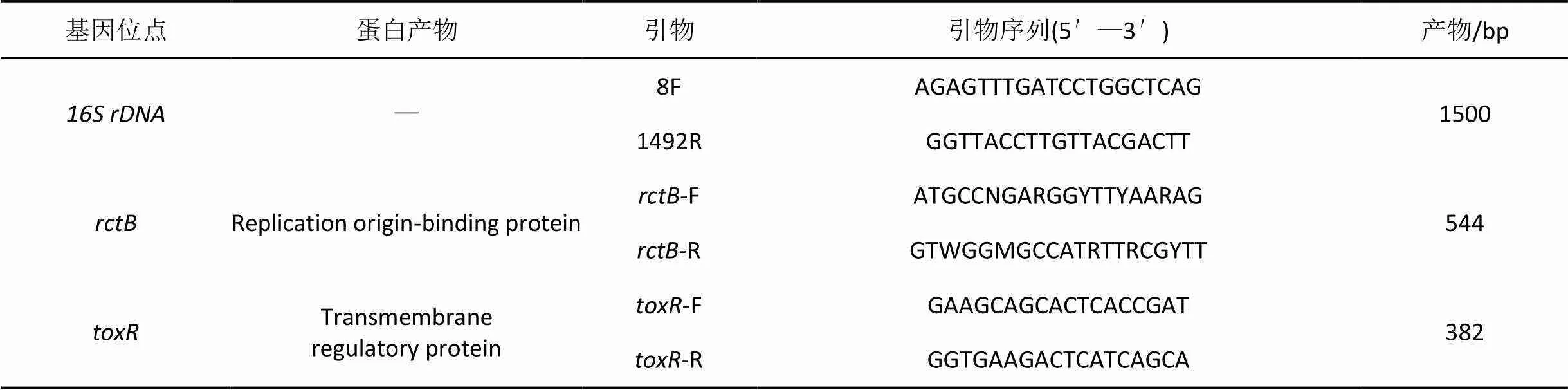
Tab.2 Information of the primers
表3 菌株X12XC30和X13SZ03对珍珠龙趸的回归感染结果
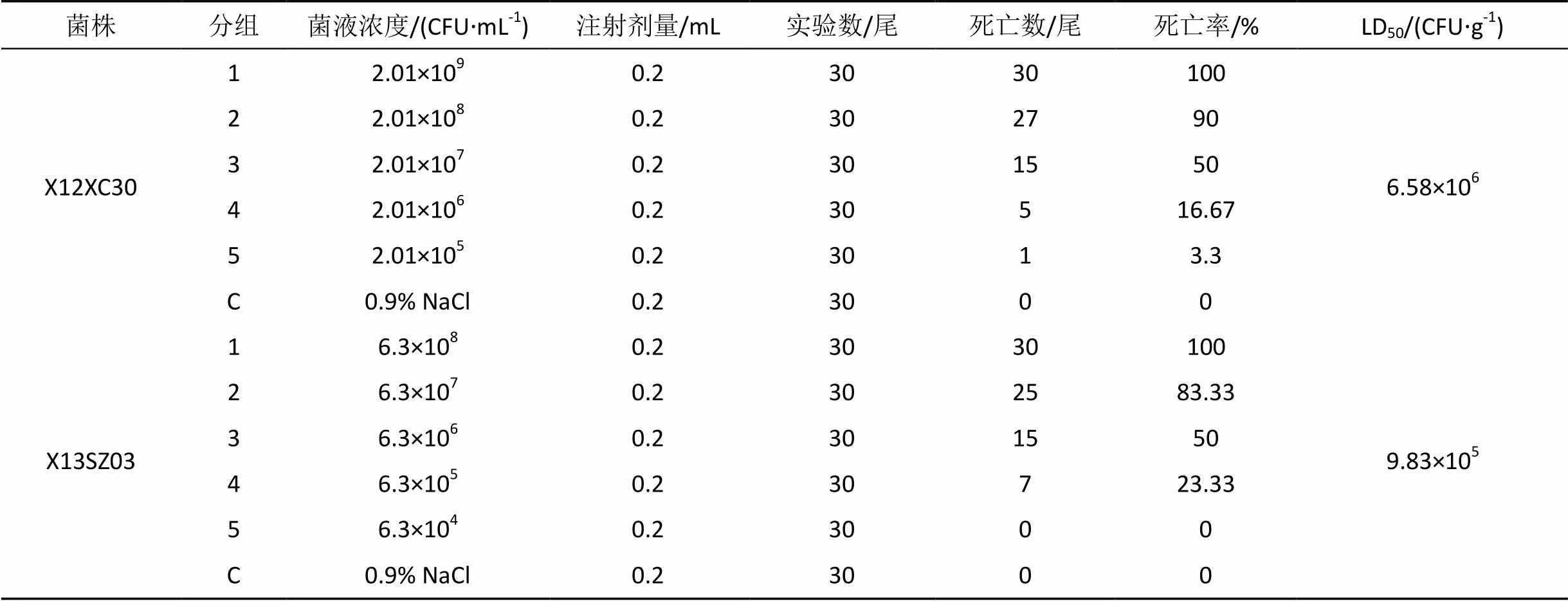
Tab.3 Pathogenicity of Strains X12XC30 and X13SZ03 to pearl gentian
注: “C”为0.9%生理盐水对照组。
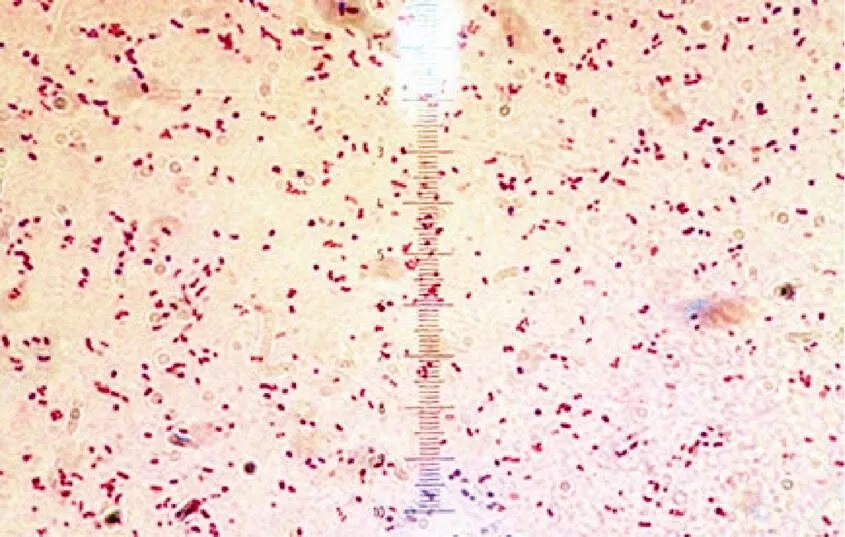
图1 X12XC30革兰氏染色结果
3.3 分子生物学鉴定
分别将和串联基因与弧菌属参考菌株, 利用MEGA 6.0 软件构建NJ系统进化树, 进行同源性分析(图2, 3, 4, 5)。结果显示两株病原菌X12XC30和X13SZ03的基因与哈维弧菌自然聚类;和等管家基因均自然聚类于哈维弧菌分支, 结合形态学和生理生化鉴定结果, 可确定这两株病原菌为哈维弧菌。
表4 菌株X12XC30和X13SZ03的主要生理生化指标检测结果
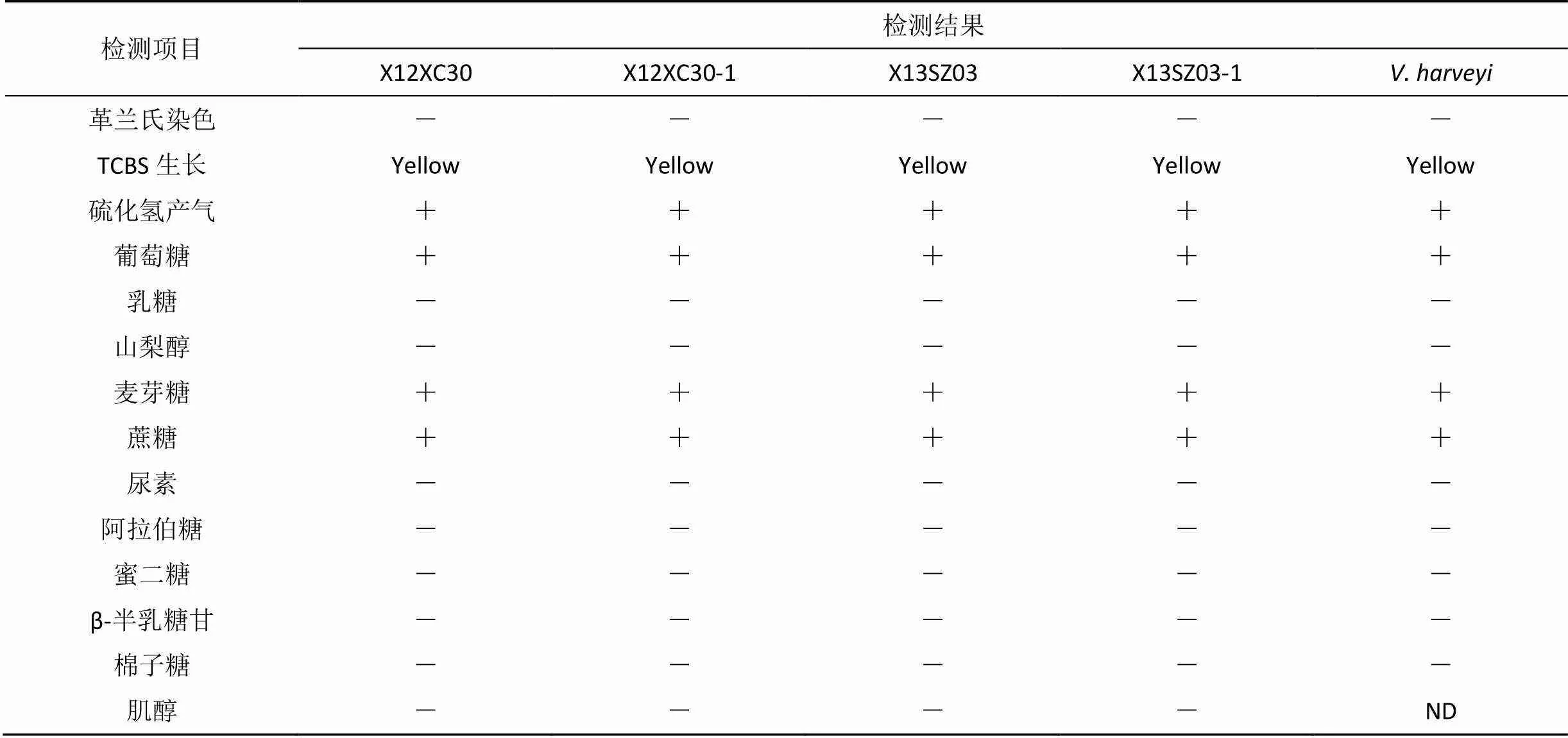
Tab.4 Main phenotypic traits of X12XC30 and X13SZ03 strains
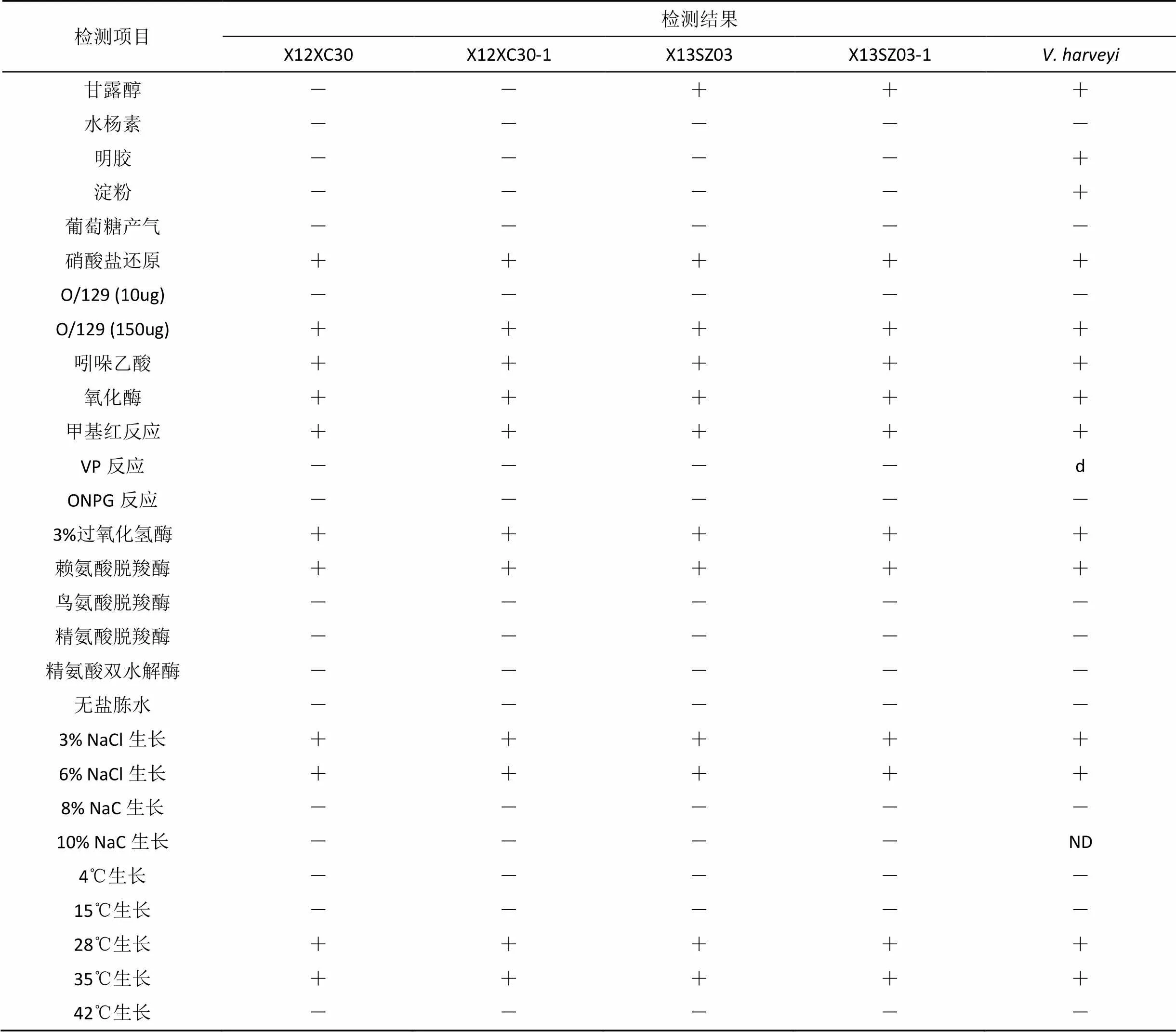
续表
注: “+”表示结果为阳性; “-”表示结果为阴性; “ND”表示没有可提供的数据; “d”表示有差异。
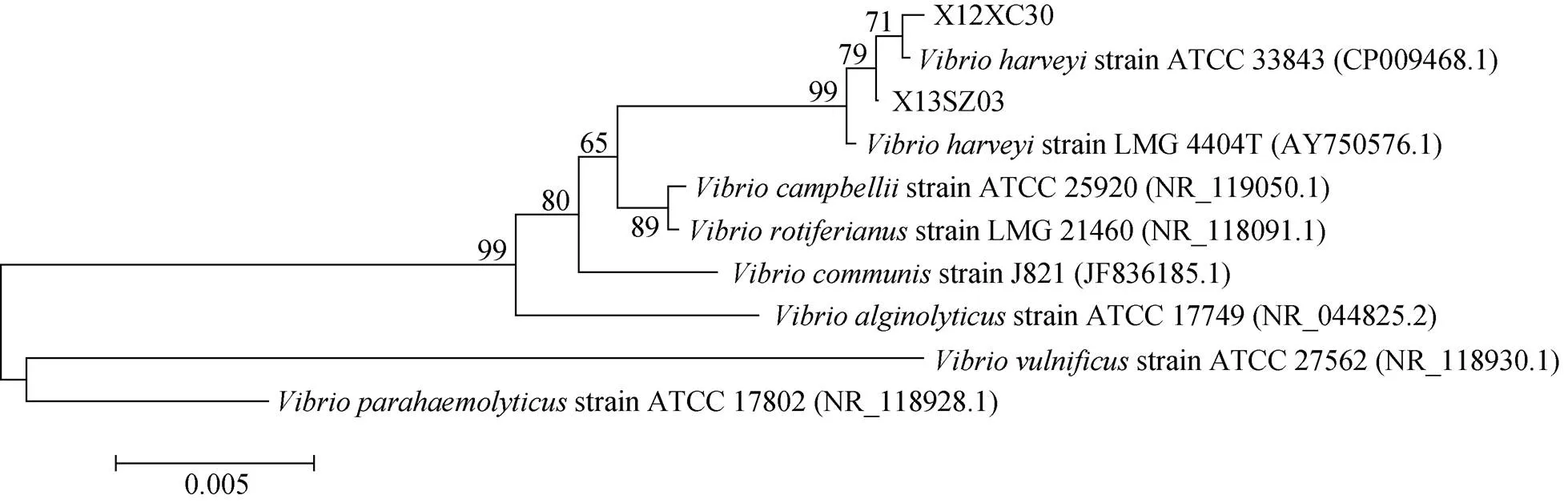
图2 基于16S rDNA基因构建的系统进化树
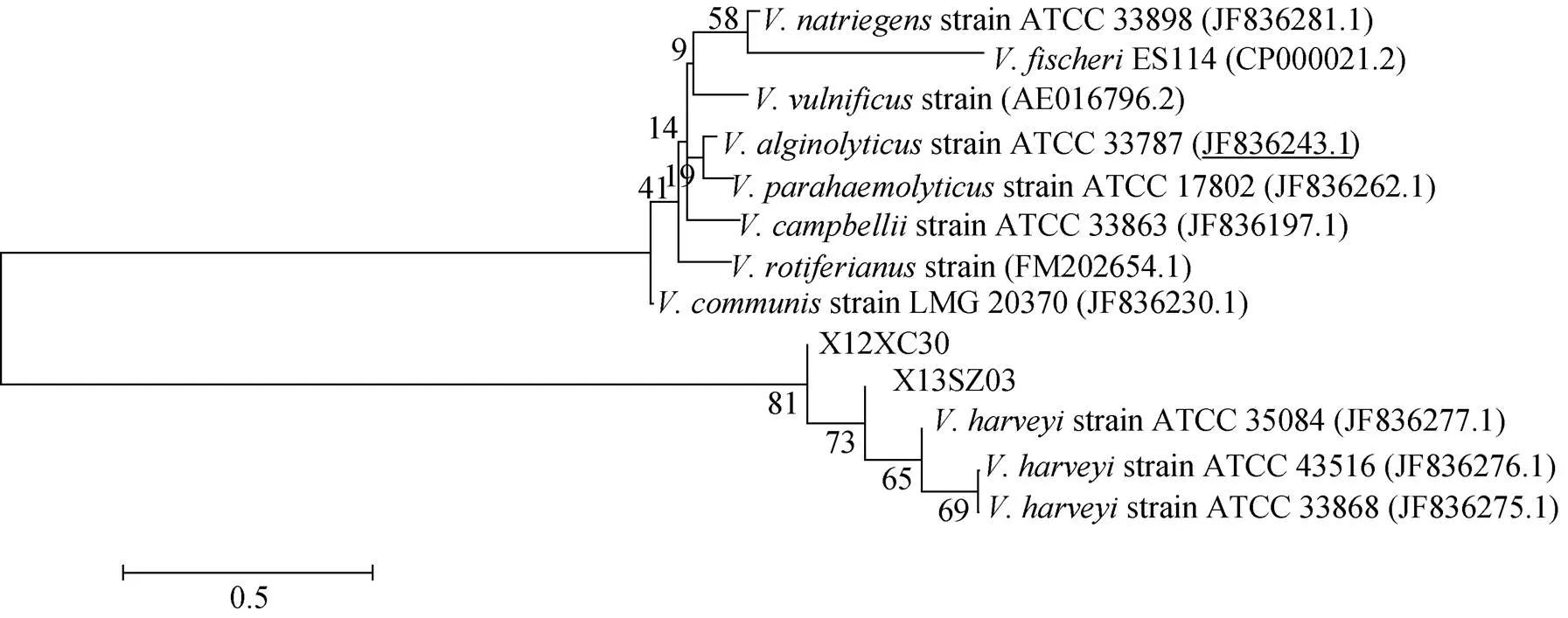
图3 基于rctB基因构建的系统进化树
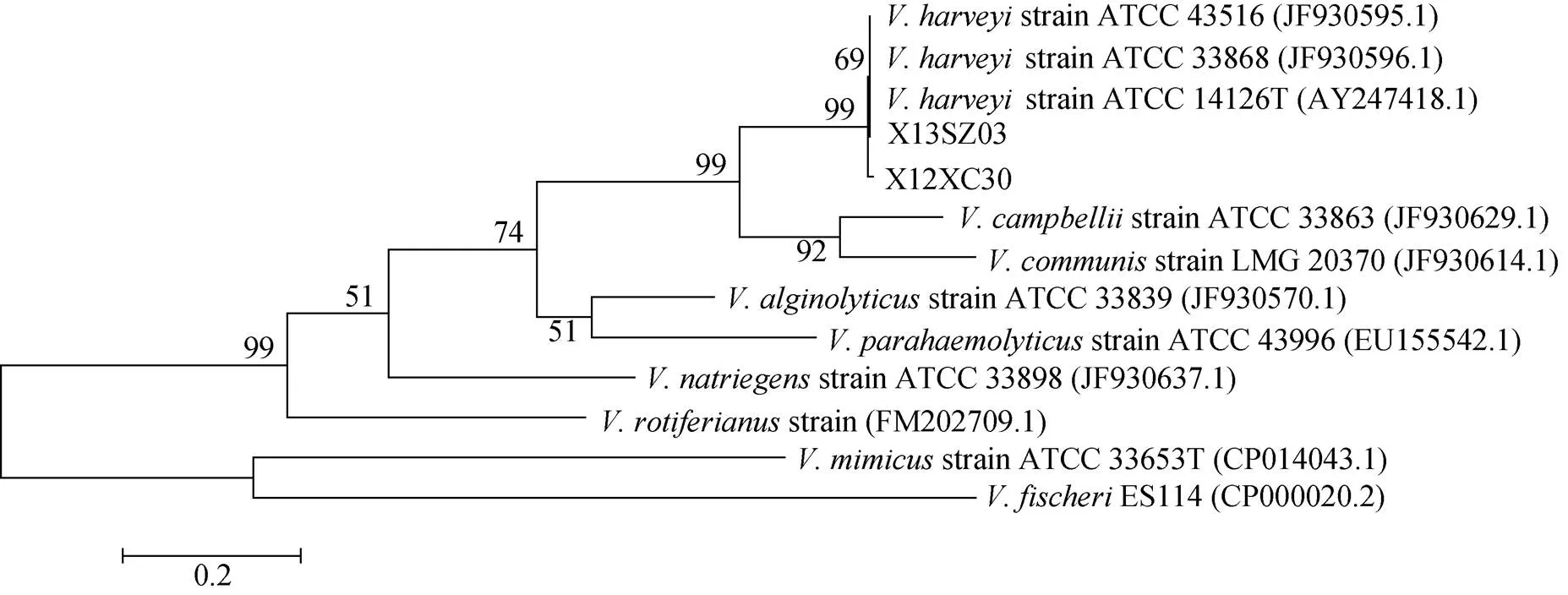
图4 基于toxR基因构建的系统进化树
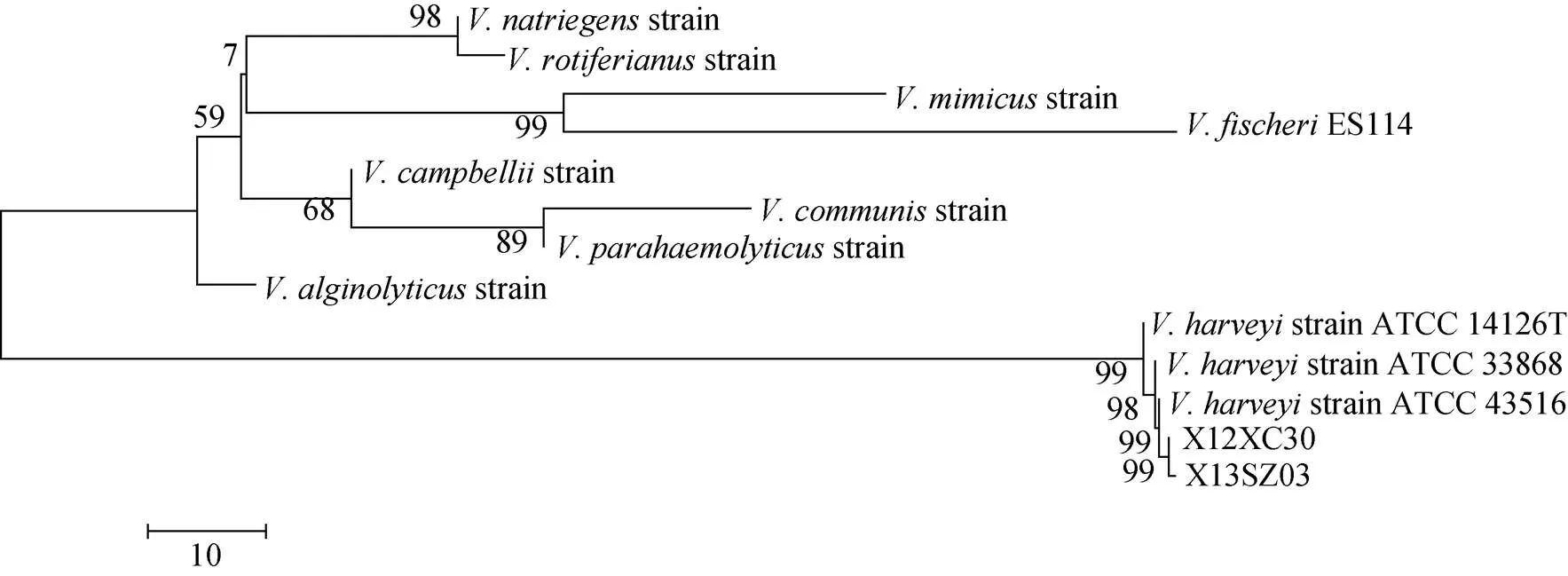
图5 rctB-toxR串联序列构建的系统进化树
3.4 菌株耐药性检测
致病菌X12XC30与X13SZ03对12种抗菌药物敏感性的检测结果, 显示2株哈维弧菌均耐呋喃唑酮; 对诺氟沙星、恩诺沙星、环丙沙星和氯霉素等药物敏感。而对庆大霉素、四环素、阿莫西林、利福平、复方新诺明、红霉素和头孢克肟等药物的敏感性存在明显差异(见表5)。
4 讨论
经人工感染实验, 分离到X12XC30和X13SZ03对应菌株X12XC30-1和X13SZ03-1, 对这四株菌进行形态以及常规生理生化鉴定, 结果显示为革兰氏阴性短杆菌, TCBS上呈黄色, O/129(150 ug·片-1)敏感。生理生化鉴定结果与哈维弧菌特征极为相近, 与其他研究者的鉴定结果, 部分鉴定项存在差异[29–30], 如实验菌株在利用甘露醇、肌醇及淀粉等项目中与哈维弧菌标准株有差异, 不能完全确定这两株菌是否为哈维弧菌。另外, 对X12XC30和X13SZ03进行了分子生物学鉴定, 1[31],和管家基因建立的系统发育树显示两株菌与哈维弧菌聚类到一支。根据曾德乾等[22]研究结果, 将两个基因序列串联构建系统进化树, 能够快速有效的鉴别哈维弧菌, X12XC30和X13SZ03的基因串联构建的系统进化树, 均自然地聚类到哈维弧菌分支。综合生理生化与分子生物学鉴定结果, 可确定这两株菌为哈维弧菌。
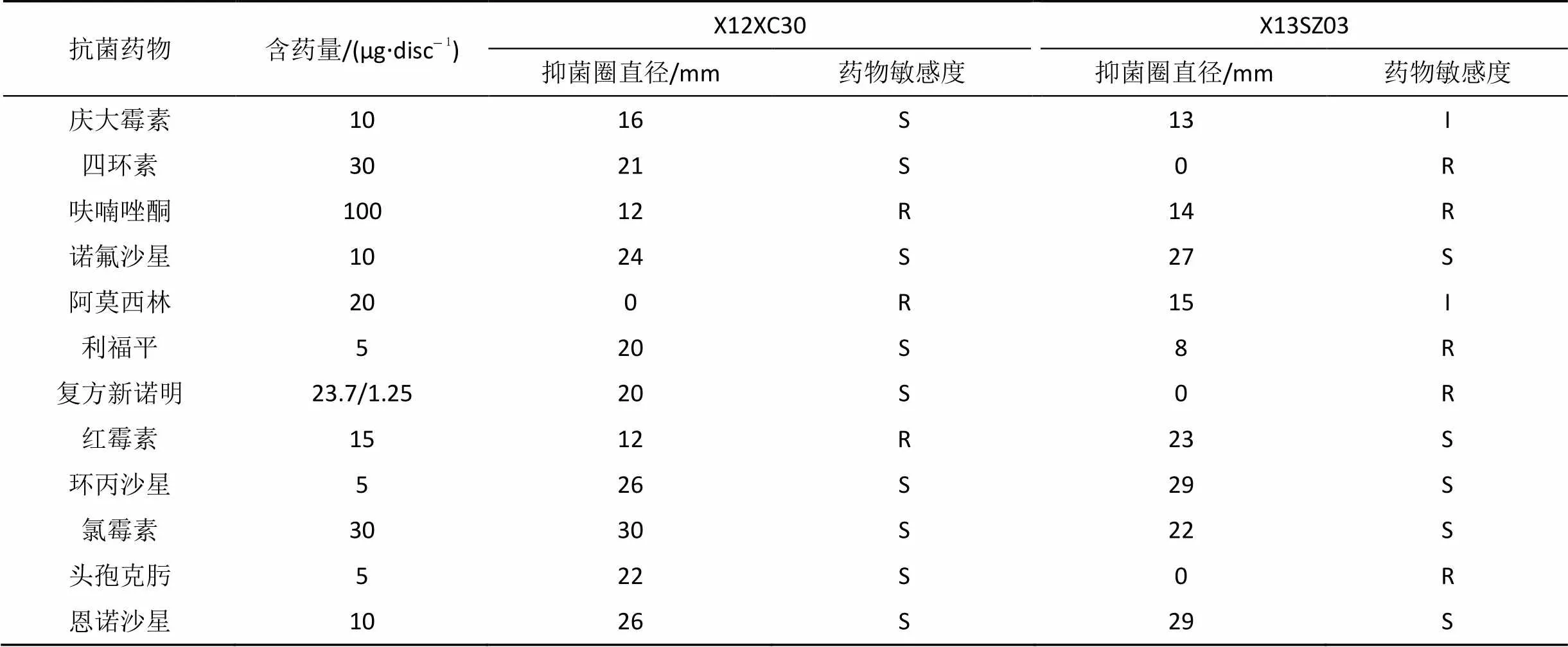
表5 致病菌X12XC30与X13SZ03对不同抗菌药物的敏感性
注: R为耐药; I为中度敏感; S为高度敏感
沈锦玉等[32]从浙江患病大黄鱼分离的哈维弧菌病原株GYC1108-1回归感染大黄鱼实验, 该菌LD50为1.1×108CFU·g-1, 对原宿主致病性较强。梅冰等[33]从海南三亚患病的斜带石斑鱼分离的哈维弧菌, 人工感染后得到的LD50为1.05×104CFU·g-1, 表明哈维弧菌有强致病性。本文中, 从患病珍珠龙趸分离到病原菌X12XC30和X13SZ03, 经过人工感染实验确认, 均具有强致病性, 其LD50分别为6.58×106CFU·g-1和9.83×105CFU·g-1。感染后的珍珠龙趸体表有溃疡, 取濒死实验鱼解剖发现肝脏、脾脏不同程度肿大, 与分离菌株的患病鱼症状表现一致, 证明这两株菌具备重复感染的能力, 且具有强毒性。证实哈维弧菌在海水养殖鱼类中, 是一个重要的细菌性病原, 具有强致病性, 能造成海水鱼的死亡。
本文选取的12种抗菌药物包括国标渔药, 及以前可用或禁用的药物, 可用于借鉴分析养殖中抗菌药物的使用, 抗菌药物风险及耐药性污染的评估工作[34]。2株哈维弧菌均耐呋喃唑酮; 而对诺氟沙星、恩诺沙星、环丙沙星和氯霉素等药物敏感。在养殖生产中, 哈维弧菌泛滥, 毒害水产养殖动物, 可使用原粉诺氟沙星等药物拌饲料投喂, 缓解、去除哈维弧菌病害, 保护养殖动物。哈维弧菌所处环境的差异, 使得其对庆大霉素、四环素、阿莫西林、利福平、复方新诺明、红霉素和头孢克肟等药物的敏感性存在明显的差异。有研究发现, 水产养殖环境分离的哈维弧菌对头孢菌素类的头孢噻吩(KF)等和新型β-内酰胺单酰胺环类的氨曲南(AZT)等多种抗生素耐药[35]; 而自然海域分离的哈维弧菌耐药谱为DOX/AMP/PEN/GEN/CIP/NOR/AK、DOX/AMP/PEN/ GEN/CIP[36]。环境影响细菌的耐药性, 而抗生素的过度使用, 导致细菌对抗菌药物产生更多的耐性, 污染养殖及自然海域, 扰乱海域的生态系统平衡。
X12XC30和X13SZ03分别分离自海南和广东, 其表现出相似的毒性与症状, LD50无明显差异, 可能与珍珠龙趸的幼苗来源有关, 广东珍珠龙趸鱼苗从海南购买的鱼苗携带有哈维弧菌, 通常情况下是正常菌群, 而当外界环境改变导致哈维弧菌大量繁殖, 产生毒性, 致使珍珠龙趸死亡, 说明哈维弧菌具有广泛的毒性作用[37–38]。通过对珍珠龙趸患病鱼分离的哈维弧菌的致病性、生物学鉴定分析及药敏实验, 为我国鱼类弧菌病的防治及流行病学提供生物学基础, 为水产细菌性病害的用药提供理论基础。
[1] 王瑞旋, 徐力文, 冯娟. 海水鱼类细菌性疾病病原及检测、疫苗研究概况[J]. 南方水产科学, 2005, 1(6): 72–79.
[2] 王瑞旋, 耿玉静, 冯娟. 杂色鲍哈维弧菌耐药质粒的鉴定和分析[J]. 南方水产科学, 2012, 8(2): 1–6.
[3] 曾德乾, 冯娟, 徐力文, 等. 海水养殖鱼哈维弧菌分离株的耐药谱型分析[J]. 中国水产科学, 2015, 22(1): 129– 138.
[4] MUSA N, WEI L S, WEE W. Phenotypic and genotypic characteristics ofisolated from black tiger shimp()[J]. World Applied Sciences Journal, 2008, 3(6): 885–902.
[5] TATSUYA N, EMI I, NAKAO N, et al. Comparison ofstrains isolated from shrimp farms and from culture collection in terms of toxicity and antibiotic resistance[J]. FEMS Microbiology Letters, 2006, 258(2): 194–199.
[6] 王瑞旋, 王江勇, 徐力文, 等. 军曹鱼养殖鱼水体及其肠道弧菌的耐药性研究[J]. 南方水产科学, 2007, 5(3): 1–6.
[7] AUSTIN B, ZHANG Xiaohua.: a significant pathogen of marine vertebrates and invertebrates[J]. Letters in Applied Microbiology, 2006, 43(2): 119–124.
[8] 王宝坤, 余俊红, 李筠, 等. 花鲈弧菌病病原菌(哈维弧菌)的分离与鉴定[J]. 中国水产科学, 2002, 9(1): 52–55.
[9] LI Mofei, WANG Chunlin, SUN Li. A pathogeniclineage causes recurrent disease outbreaks in cultured Japanese flounder () and induces apoptosis in host cells [J]. Aquaculture, 2011, 319 (s1/2): 30–36.
[10] SUDHEESH P S, XU Huaishu. Pathogenicity ofin tiger prawnFabricius: possible role of extracellular proteases [J]. Aquaculture, 2001, 196(s1-2): 37–46.
[11] EBONIA B S, SHIRLENY G, MILAGROS R. et al. Evaluation of dietary freeze-driedsupplementation to controlinfection onjuvenile[J]. Aquaculture, 2014, 432 (2): 212–216.
[12] HUANG Haihong, LIU Xiaolin, XIANG Jianhai, et al. Immune response ofafter infection with[J]. Aquaculture, 2013, s406–407(2): 115–120.
[13] ALLAH D T.(Peppermint) as feed additive enhanced growth performance, survival, immune response and disease resistance of Asian seabass,(Bloch) againstinfection[J]. Aquaculture, 2014, s420–421(3): 71–78.
[14] MANMOUD H, MANAL E B.infection in Arabian Surgeon fish () of Red Sea at Hurghada, Egypt[J]. Egyptian Journal of Aquatic Research, 2013, 39(3): 199–203.
[15] MOHIL M M, KURARANIL M, MIYAZAKIL T, et al. Histopathological studies on–infected tiger puffer,(Temminck et Schlegel), cultured in Japan [J]. Journal of Fish Diseases, 2010, 33(10): 833–840.
[16] 于宏, 万刚涛, 程民杰, 等. 龙虎斑鱼肌肉营养成分分析[J]. 广东海洋大学学报, 2015, 34(6): 83–87.
[17] 陈超, 孔祥迪, 李炎璐, 等. 棕点石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代胚胎及仔稚幼鱼发育的跟踪观察[J]. 渔业科学进展, 2014, 35(5): 135–144.
[18] 刘忠优, 张健东, 周晖, 等. 不同饵料强化剂对龙虎斑仔稚鱼生长、存活率、消化酶活力及体成分的影响[J]. 广东海洋大学学报, 2014, 34(4): 27–32.
[19] 杨少丽, 王印庚, 董树刚. 海水养殖鱼类弧菌病的研究进展[J]. 海洋水产研究, 2005, 26(4): 75–83.
[20] 于欢欢, 李炎璐, 陈超, 等. 棕点石斑鱼(♀)×鞍带石斑鱼(♂)杂交F1仔、稚、幼鱼的摄食与生长特性分析[J]. 中国水产科学, 2015, 22(5): 968–977.
[21] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 195–230.
[22] 曾德乾. 海水养殖鱼哈维弧菌分离株多位点序列分析及耐药谱型研究[D]. 上海: 上海海洋大学, 2014: 12–42.
[23] CLSI. Performance standards for antimicrobial disk susceptibility tests; approved standard-eleventh edition. CLSL document M02-A11[S]. Wayne, PA: CLSI, 2012: 8–52.
[24] CLSI. Performance standards for antimicrobial disk susceptibility tests; twenty-second informational supplement. CLSL document M100-S22[S]. Wayne, PA: CLSI, 2012: 20–161.
[25] CLSI. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard ninth-editon. CLSL document M07-A9[S]. Wayne, PA: CLSI, 2012: 16–42.
[26] HOLT J G, KRIEG N R, SNEATH P H, et al. Bergey's manual of determinative bacteriology. 9th Edition [M]. London: Williams & Wilkins Press, 1994: 190–194, 259–271.
[27] 张晓华, 钟英斌, 陈吉祥. 哈维弧菌的生物学特性、流行病学及检测技术[J]. 中国海洋大学学报: 自然科学版, 2007, 37(5): 740–748.
[28] RUAN Jisheng. Bergey's Manual of Systematic Bacteriology (second edition) Volume 5 and the study of Actinomycetes systematic in China [J]. Acta Microbiologica Sinica, 2013, 53(6): 521–530.
[29] 陈献稿, 吴淑勤, 石存斌, 等. 斜带石斑鱼病原菌(哈维弧菌)的分离与鉴定[J]. 中国水产科学, 2004, 11(4): 313– 317.
[30] ZHANG Fengping, PENG Zhilan, ZHANG Jian, et al. Isolation and identification of the pathogenic strain offrom[J]. Acta Microbiologica Sinica , 2010, 50(3): 304–309.
[31] BAKER G C, SMITH J J, COWAN D A. Review and re-analysis of domain-specific 16S primers [J]. Journal of Microbiological Methods, 2003, 55(3): 541–555.
[32] 沈锦玉, 李新华, 潘晓艺, 等. 哈维弧菌的主要致病因子及其特性分析[J]. 浙江大学学报(农业与生命科学版), 2011, 37(2): 142–148.
[33] 梅冰, 周永灿, 徐先栋, 等. 斜带石斑鱼烂尾病病原菌的分离与鉴定[J]. 热带海洋学报, 2010, 29(6): 118–124.
[34] 蒋魁, 徐力文, 苏友禄, 等. 2012年~2014年南海海水养殖鱼类病原菌哈维弧菌分离株的耐药性分析[J]. 南方水产科学, 2016, 12(6): 99–107.
[35] 王春艳, 阎斌伦. 连云港市赣榆县水产养殖环境中哈氏弧菌耐药性研究[J]. 淮海工学院学报, 2013, 22(1): 88–91.
[36] RAISSY M, MOUMENI M, ANASARI M, et al. Antibiotic resistance pattern of somestrains isolated from seafood [J]. Iranian Journal of Fisheries Sciences, 2012, 11(3): 618–626.
[37] HOFFMANN M, FISCHER M, OTTESEN A, et al. Population dynamics of. associated with marine sponge microcosms [J]. The ISME journal, 2010, 4(12): 1608–1612.
[38] ORNDORFF S A, COLWELL R. Distribution and identifycation of luminous bacteria from the Sargasso Sea [J]. Applied and environmental microbiology, 1980, 39(5): 983–987.
蒋魁, 徐力文, 苏友禄, 等. 两株珍珠龙趸病原性哈维弧菌()的分离与鉴定[J]. 生态科学, 2017, 36(6): 16-24.
JIANG kui, XU liwen, SU youlu, et al. Isolation and identification of two pathogeneticstrains from pearl gentian[J]. Ecological Science, 2017, 36(6): 16-24.
Isolation and identification of two pathogeneticstrains from pearl gentian
JIANG kui, XU liwen, SU youlu, MA hongling, LIU guangfeng, GUO zhixun, GAO fang, FENG juan*
South China Sea Fisheries Research Institute, China Academy of Fishery Science; Key Laboratory for Exploitation and Utilization of Marine Fisheries Resource in South China Sea, Ministry of Agriculture, Guangzhou 510300, China
In this study, two bacterial strains (X12XC30 and X13SZ03) were isolated from pearl gentian cultured in Guangdong and Hainan province. The analysis of regression experimental infection test confirmed they were brachychronic pathogenicasthe LD50of X12XC30 and X13SZ03 to pearl gentian was 6.58×106CFU·g-1and 9.83×105CFU·g-1, respectively. The results showed that the two strains wereGram-negative and short rod in shape, exhibited yellow in TCBS and were susceptible toO/129 (150ug·tablet-1) with their phenotypic and molecular characteristics studied, which were similar tomorphologically, physiologically and biochemically. Their,andgenes were highly similar to those ofretrieved from Genbank. In the phylogenetic trees based onandsequences, the two strains all merged within a branch, and they were identified as. The susceptibility test showed that two strains ofwere resistant to furazolidone, while were sensitive to norfloxacin, enrofloxacin, ciprofloxacin and chloramphenicol.is highly pathogenic to pearl gentian and has a potential threat in breeding and culturing
; pearl gentian; identification
10.14108/j.cnki.1008-8873.2017.06.003
S941.42
A
1008-8873(2017)06-016-09
2016-10-18;
2016-12-29
海南省科技兴海项目(2015XH03), 广东省级鱼病防治专项资金项目(2015), 广东省海洋渔业科技与产业发展专项资金(A201501B14)
蒋魁(1990—), 男, 硕士研究生, 主要从事海水鱼类弧菌病害研究, E-mail: jiangkui0514@163.com
冯娟(1973—), 女, 博士, 研究员, 从事鱼类疾病的防治研究, E-mail: jannyfeng@163.com
