湖泛发生过程中水体理化性质及细菌群落的变化
2017-12-29冯胜袁斌王博雯
冯胜, 袁斌, 王博雯
湖泛发生过程中水体理化性质及细菌群落的变化
冯胜1,*, 袁斌1, 王博雯2
1. 常州大学环境与安全工程学院, 江苏 常州 213164 2. 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 江苏 南京 210008
运用分子生物学技术及多元统计分析的方法, 跟踪湖泛爆发过程中细菌群落的动态及环境因子变化。结果表明: 湖泛爆发过程中水质明显恶化, DO(溶解氧)、SD(透明度)、pH(酸碱度)显著降低, 其中DO含量均低于0.51 mg·L-1, 水体中TN(总氮)、TP(总磷)等营养盐的含量远远高于正常水体中的含量。细菌丰度和藻类数量明显升高, 其中, 湖泛中心区的细菌丰度上升到107cells·L-1, 相比未发生湖泛的区域提高了一个数量级。运用高通量测序技术, 分析比较非湖泛区及不同程度湖泛区的细菌群落结构的差异。结果表明: 湖泛最严重的区域, α-、γ-变形菌纲(alpha-, gamma-Proteobacteria)分别由未发生湖泛时的4.10%和13.16%降至0.59%和1.91%; 放线菌门(Actinobacteria)所占比例由未发生湖泛区域的19.04%降至0.92%; 而拟杆菌门(Bacteriodetes)所占的比例则由1.12%增加至36.32%。此外, 还检测到一些特殊生境的细菌类群, 如。通过对湖泛事件中细菌群落与关键环境因子的变化规律研究, 为湖泛问题的深入研究提供一定科学依据。
水环境因子; 细菌丰度; 细菌群落结构; 湖泛
1 前言
太湖是我国五大淡水湖之一, 自20世纪90年代起, 太湖湖西水域、梅梁湖、贡湖曾多次出现湖泛现象[1-2]。湖泛是藻类大量暴发、积聚和死亡后, 在适宜的气象、水文条件下与底泥中的有机物发生生物、化学反应, 在缺氧或厌氧条件下释放硫化物、甲烷和二甲基三硫等硫醚类物质, 从而在富营养化湖泊中形成伴有恶臭的褐黑色水团的现象[3]。继大规模重度蓝藻水华之后, “湖泛”问题已成为我国淡水富营养化浅水湖泊面临的又一严峻生态灾害[4]。目前针对湖泛的研究涉及湖泊水文[5]、气象[6]、物理[7]、化学[8-9]、生物[10]等多个领域, 大量交叉研究的结果显示: 蓝藻和某些快速繁殖水生植物的堆积与污染有机质的输入是湖泛发生的物质基础, 适宜的气象水文条件(强光照、高温、低风速、水体垂直热分层等)是湖泛的触发因素, 而以厌氧条件下快速分解有机质的梭菌、硫酸盐还原菌、产甲烷菌(古菌)以及甲烷氧化菌为标志的微生物是湖泛形成的生物机制。溶解氧作为联系湖泊水文、理化和生物过程的关键因子, 成为诱导湖泛形成和消散的核心因素[11-12]。由此可见: 与湖泛发生时的环境特征(如低溶解氧, 低pH, 高有机质, 高总磷、总氮)相对应的是其简化的食物网结构和特殊的微生物类群, 细菌作为湖泊生态系统中食物链和食物网的重要组成部分, 驱动湖泊生态系统中绝大多数生物活性元素的形态转化和地球化学循环[13], 在湖泛发生期间及后期的生态系统恢复等方面都具有关键作用。细菌是湖泊生态系统中的主要分解者, 在物质循环和能量流动中起着重要作用。其数量和群落结构的改变都会显著影响整个微食物网的结构及系统中物质循环和能量流动, 对于细菌群落结构特征的研究受到了广泛关注[14-15]。李玉华等[16]采用聚合酶链式反应-变性凝胶梯度电泳(PCR-DGGE)对松花湖水体中微生物群落结构的多样性进行了研究; 沈燕等[17]选用针对α、β、γ变形菌门和拟杆菌门的几类探针, 采用原位杂交的方法(FISH)研究了太湖中主要变形菌门细菌的优势类群、空间分布差异及其与营养盐、Chl-a浓度等环境因素的相互影响。吴庆龙等[18]运用原位荧光杂交、变形梯度凝胶电泳(DGGE)和反向线点杂交(RLB)等多种分子生物学方法对青藏高原16个不同盐度湖区进行了盐度和纬度对细菌群落结构影响的研究。目前使用最多的分子生物学方法主要为DGGE和T-RFLP, 有些研究也会再结合Sanger测序得到一些特别的序列图谱的碱基序列, 建立克隆文库与数据库进行对比[19-22]; 而高通量测序技术, 无需构建文库, 避免了克隆的误差, 能在数百万个点上同时阅读测序, 拥有较好的定量功能和性价比[23-24]。本研究应用高通量测序技术研究湖泛发生过程中细菌群落组成的动态变化, 以探寻湖泛事件过程中细菌群落的变化规律, 为湖泛问题的研究提供一定科学依据。
2 材料与方法
2.1 样点布设
湖泛是一种因藻类和水草等大量聚积、死亡所引发的湖泊水体突发性黑臭现象。典型湖泛区会出现硫化氢、甲烷等气体逸出水面, 大面积黑水、底泥上泛, 出现如藻华(algal bloom) 相似开放(bloom)的状态。湖泛的生消过程大致可分为4个阶段, 即(藻类或水草)生物聚积阶段、(水体)耗氧缺氧阶段、(湖泛)爆发成灾阶段, 以及(水体)复氧消退阶段。根据太湖站2000年至2015年近16年的年报报道[25-28], 太湖主要发生湖泛的区域在: 贡湖湾北岸沿岸带。根据常规监测和现场情况, 在此区域设立5个采样点(1#-5#), 见图1。其中1#(N:120.286025; E:31.419991) 为未发生湖泛区域, 设为对照。其余点位坐标分别为: 2#(N:120.285939; E:31.423140)、3#(N:120.246714; E:31.412227)、4#(N:120.282677; E:31.420650)、5#(N: 120.278729; E:31.418672)。
2.2 样品采集
用采水器采集每个点位表层水样(约湖面以下50 cm), 置于预先用酸浸泡过的塑料桶中, 运回实验室, 在12 h内完成理化参数测定。另取15 mL水样装入预先灭过菌的离心管中, 加入经滤膜(0.22 μm)过滤后的甲醛溶液, 使甲醛终浓度为2%(V/V)。随后将样品置于冰盒中, 带回实验室用于测定细菌的丰度群落结构。

图1 采样点位图
2.3 水体理化参数的测定
水温(T)、透明度(SD)、电导率(EC)、DO和pH值在现场用YSI6600多参数水质分析仪测定。总氮(TN)、溶解性总氮(DTN)、总磷(TP)、溶解性总磷(DTP)、Chl-a等参数的测定参考湖泊富营养化调查规范[29]。
2.4 细菌丰度、藻类生物量的测定
由于天然水环境中只有0.001%—3%的微生物可以被分离培养[30], 本研究利用荧光染料DAPI (4¢,6-diamidino-2-phenylindole)与表面荧光显微镜结合, 直接计数环境中细菌的方法(epifluorescence direct counting method, FDC)[31-32]。浮游植物个体体积小, 直接称重较困难, 且其细胞比重多接近于1。藻类生物量一般按体积来换算, 可用形态相近似的几何体积公式计算细胞体积, 细胞体积的毫升数相当于细胞重量的克数, 这样体积值(μm3)可直接换算为重量值(109μm3≈1 mg鲜藻重)。
2.5 DNA的提取、高通量测序
取200 mL原水经0.22 μm孔径的聚碳酸酯膜(Millipore, Cork, Ireland)过滤后收集滤膜, 用事先灭过菌的剪刀剪碎, 放入灭菌后的2 mL离心管中, 置于-80 ℃的超低温冰箱中保存至DNA提取。微生物样品DNA采用试剂盒FastDNA SPIN Kit for Soil(MP Biomedicals)进行提取并于-20 ℃下保存, 高通量测序实验委托上海派森诺生物科技有限公司完成。
3 结果与讨论
3.1 理化参数与细菌丰度、藻类数量的对比
湖泛突发区域, 溶解氧(DO)、透明度(SD)、pH值与湖泛未发生区域1#点相比显著降低。其中2#-5#区域DO浓度均低于0.51 mg·L-1, SD在湖泛最严重点位处仅为0.13 m。随着采样点位向湖泛中心靠近, Chl-a、电导率也都在不断增加, 水温也略微升高。其中, 湖泛最严重点位处(5#), Chl-a含量是未发生湖泛区域(1#)的近5倍(图2)。这是由于湖泛形成过程中, 藻类大量腐败, 水体透明度急剧下降, Chl-a升高[33]。由于水面以下缺乏光照, 水面下大量藻体细胞的呼吸作用、新陈代谢以及有机质的协同作用消耗了大量的氧气, 短时间内溶解氧就降至接近于零, 藻类的大量分解使得湖泛区水温升高、电导率增加并降低水体pH值[34-36]。
图3中可以明显的看到随着湖泛的不断加剧, 由湖泛外围向中心, N、P等营养盐的含量不断增加。在湖泛最为严重的5#点TN含量达到14.09 mg·L-1, 是太湖正常水体TN含量的7倍左右; TP含量达到0.51 mg·L-1, 比对照点的TP含量高出0.40 mg·L-1左右, 且NH4+、溶解性总氮(DTN)、PO43-和DTP均高于正常值。这是由于水华蓝藻在快速生长繁殖过程中, 群体内积聚了大量的营养盐, 当“湖泛”发生时, 一方面, 由于大量蓝藻的腐败使其体内大量聚集的 N、P营养盐被迅速释放到水体中; 而另一方面, “湖泛”中的厌氧环境会促进NH4+-N、PO43−-P从沉积物表层向上覆水扩散[37]。因此, 这些氮、磷营养盐的变化主要是由藻类剧烈分解导致形成水体厌氧环境及大量释放有机物造成的[38-39]。

图2 野外湖泛现场数据

图 3 野外湖泛的理化参数
由图4可以看出: 细菌丰度随着湖泛程度的加剧也由106cells·L-1上升到107cells·L-1, 增加了一个数量级。藻类数量在湖泛区均明显高于对照点, 但湖泛区的藻类数量并没有随着湖泛的加剧呈现不断上升趋势, 而是大致相等。
3.2 Miseq宏基因组测序结果及分析
5个样品共得到40万个序列, 经优化分析后获得了10127个operational taxonomic unit (OTUs), 样品的覆盖度达到了95.7%—98.45%, 根据数据绘制了用来表示样本丰富度与均匀度的几种多样性指数图(图5)。
群落生态学中研究微生物多样性, 通过单样品的多样性分析(Alpha多样性)可以反映微生物群落的丰度和多样性, 包括通过一系列统计学分析指数估计环境群落的物种丰度和多样性[40]。Chao指数和Ace指数是计算菌群丰度的指数, Chao是用chao1算法估计样品中所含OTU数目的指数, 在生态学中常用来估计物种总数, 由Chao[41]最早提出的, Ace也是由Chao提出的生态学中估计物种总数的常用指数之一[42]。Simpson由Edward Hugh Simpson[43]提出, 在生态学中常用来定量描述一个区域的生物多样性。Simpson指数值越大, 说明群落多样性越低。Shannon与Simpson多样性指数都常用于反映alpha多样性指数, 而Shannon值越大, 则说明群落多样性越高[44-45]。在图5的多样性指数中可以看出, 同样是湖泛区的3#物种丰度低于其他点位, 多样性也低于其它点位。同样是湖泛区, 不同区域之间的细菌群落结构也存在着差异。

图4 野外湖泛各个点细菌丰度及藻类生物量对比图

图5 各个样本的多样性指数
高通量数据的分析结果显示: 5个样本中的序列主要为变形菌门(3367个OTUs)的α-、β-和γ-亚纲(α-,β-,and γ-subdivision of Proteobacteria), 拟杆菌门(Bacteriodetes)(996个OUTs), 放线菌门(Actinobacteria)(434个OTUs), 厚壁菌门(Firmicutes)(1379个OTUs)、OD1和一些未分类的门。除细菌外, 还有少量的古菌分别属于泉古菌门、广古菌门和一些未分类的门。进一步分析显示, 属于α-proteobacteria变形菌门的主要有短波单胞菌属()和鞘氨醇单胞菌()等。属于β-Proteobacteria的主要有食酸菌属()、噬氢菌属()等一些未分类的属。属于γ-Proteobacteria变形菌的主要有不动杆菌属()、假单胞菌属()等等。属于放线菌门(Actinobacteria)下的优势种为微杆菌属()、分支杆菌属()、类诺卡氏菌属()、和一些未分类的菌属。属于拟杆菌门(Bacteriodetes)的属主要有拟杆菌()、理研科的未分类的一些属和黄杆菌科下的一些属。属于厚壁菌门(Firmicutes)的主要有库特氏菌属()、球菌科的一些属、微杆菌属()、动性微菌属()、乳杆菌属()、梭菌属()和醋杆菌属()。
3.3 湖泛不同区域的细菌优势种的差异分析
由图6可见: 1#点位处叶绿素最低, 相反湖泛最严重的5#叶绿素最高, 各个饼图表示测序结果在门水平上的百分比。目前, 在湖泊水体中共发现21个典型的淡水细菌门类, 其中变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)是最主要的5个门类[46]。在这次的高通量检测结果主要有变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和OD1。各个样品的群落结果呈现显著差异(表1)。
从表1中可以看出, 变形菌门(Proteobacteria)里的α-变形菌纲(α-proteobacteria), γ-变形菌纲(γ-Proteobacteria)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)在未发生湖泛的区域与发生湖泛的区域相比OTU数量在不断减少, 而β-proteobacteria、拟杆菌门(Bacteroidetes)的OTU数量则在发生湖泛的区域呈现增加的趋势。α-变形菌纲(α-Proteobacteria)所占比例由未发生湖泛时的4.10%降至湖泛最严重区域的0.59%, 进一步分析数据发现α-变形菌纲(α-Proteobacteria)下的短波单胞菌属()和鞘氨醇单胞菌属()明显减少。其中, 鞘氨醇单胞菌()可以降解芳香化合物亦可将戊糖、己糖及二糖转变成酸。但它属于专性需氧型微生物, 所以可能是由于湖泛发生区域的厌氧环境特征使得这种菌种数量减少。
另外一个不同区域变化最为显著的是放线菌门(Actinobacteria), 放线菌可以分解许多有机物, 包括芳香化合物、石蜡、橡胶、纤维素、木质等复杂化合物和一些氰等毒性强的化合物。在自然界物质循环中, 更在污水及有机固体废物的生物处理中有积极的作用, 还能促使土壤形成团粒结构而改善土壤。在湖泛发生的区域放线菌的数量并没有增加而是显著的减少了, 未发生湖泛的对照点1#中放线菌的OTU比例为19.04%, 而在湖泛最为严重的5#点中仅为0.92%, 降低了近20倍, 造成原因可能是大多数放线菌是好氧的且放线菌最适生长pH一般为微碱性。而随着湖泛的加重, 水体中溶氧极低且pH值也在减小。例如, 在这次发现的放线菌门(Actinobacteria)下的微杆菌属()、杆菌属()、节杆菌属 ()和类诺卡氏菌()基本上都是好氧菌且不抗酸, 都随着湖泛的发生加剧呈现减少的变化趋势。

图6 细菌群落组成与叶绿素的关系

表1 各个样品中主要几种淡水菌种的所占比例(%)
图7、8中也列出了一些在湖泛发生的不同区域中变化较为显著的菌种, 在湖泛发生的水体中增加的菌群大都是厌氧菌, 例如能够分解多糖的拟杆菌门(Bacteroidetes)是大多是厌氧菌, 与未发生湖泛的水体中(1.12%)相比, 湖泛区水体中拟杆菌门(Bacteroidetes)的OTU比例都不同程度地大幅增加, 最高的达到36.32%。厚壁菌门(Firmicutes)整体OTU的数量在湖泛发生区域水体中是下降的, 而属于它的厌氧菌种韦荣氏球菌()和球菌消化链球菌属()的OTU数量却是增加的。其中球菌消化链球菌属()在厌氧条件下能够产酸, 但较适合偏碱性环境生长。这也就能解释了该菌种在湖泛发生区域的最外围湖泛不是特别严重的2#点中OTU数量最高, 但在湖泛最为严重的中心5#点OTU数量含量最少。因为随着湖泛越严重其pH值越低, 相比之下, 还是同样厌氧环境但偏碱性的2#点适合其生长。但随着球菌消化链球菌属()不断的繁殖并分解产酸, 也直接改变了其所在的环境。从图2对湖泛监测的现场数据的分析中可以看出, 随着湖泛的加剧, 水体中的电导率等指标都是增大的, 在高通量的数据分析中也发现, 在湖泛较为严重的5#点出现了一些在高盐地带出现的菌种, 例如属于拟杆菌门(Bacteroidetes)的。
在对各个样品中主要细菌种类的分析显示, 5个样品共发现放线菌门(Actinobacteria)的有434种菌属, 在未发生湖泛的1#点占了395种, 而湖泛最为严重区域比例升高的菌种的5#仅发现72个属, 同样OTU数量在减少的α-变形菌纲(α-Proteobacteria), γ-变形菌纲(γ-Proteobacteria)在湖泛最严重的5#种类的多样性也减少, 而拟杆菌门(Bacteroidetes)和β-变形菌纲(β-Proteobacteria)在发生湖泛的区域水体中的种类的多样性升高。但是对于主要的细菌种类的分析, 各个样品即湖泛发生时不同区域都没有达到在5个样品所发现的主要几种细菌种类的总数, 这说明湖泛的发生不仅仅是减少了一些细菌种类, 也出现了一些未发生湖泛区域水体中在不存在的细菌种类。

图 7 湖泛区域比例降低的菌种
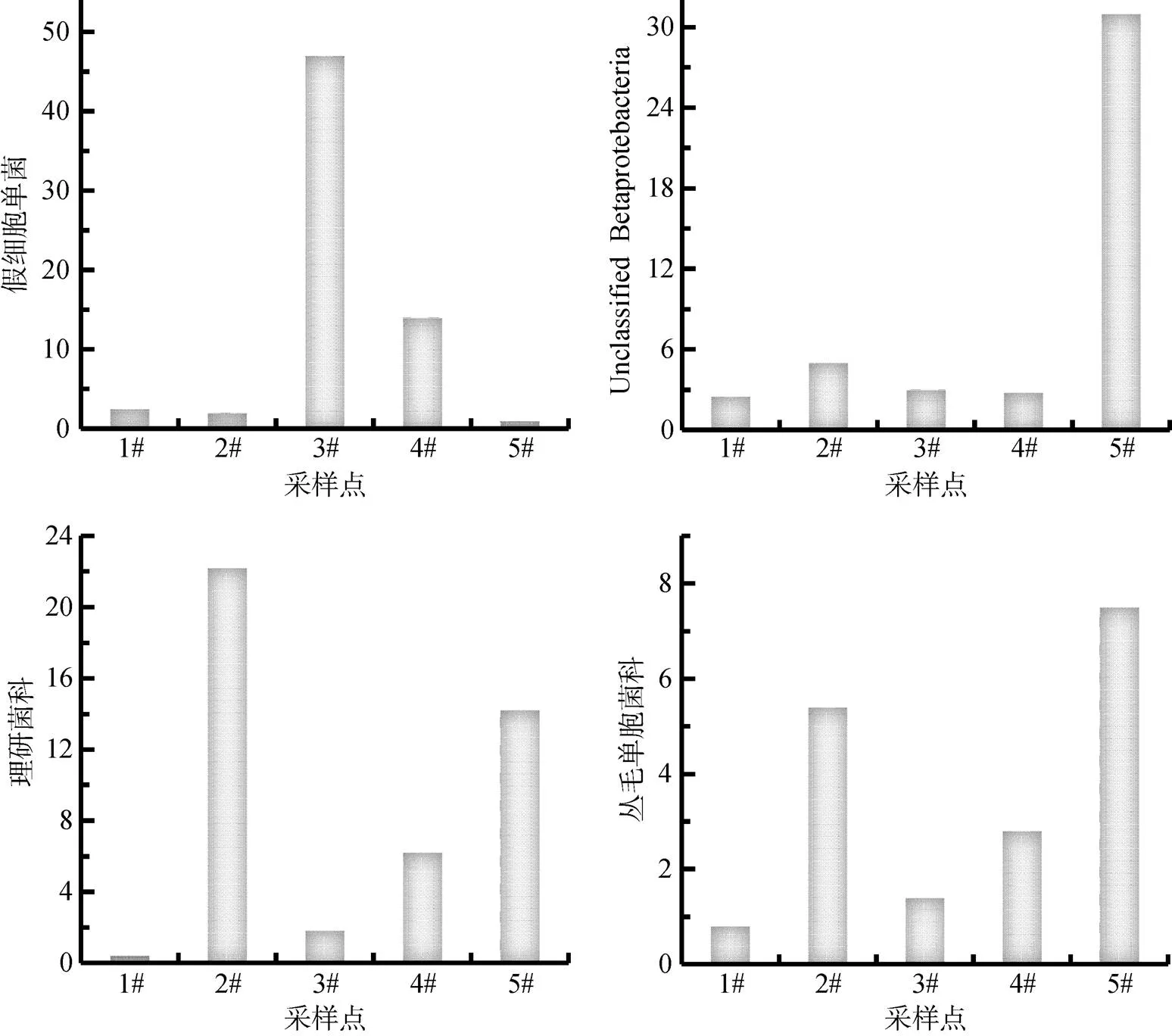
图 8 湖泛区域比例升高的菌种
4 小结
本研究的主要目的是通过比较湖泛发生过程不同区域之间及其与未发生湖泛区域间水体中理化指标的改变、细菌群落结构的差异, 来了解湖泛对水体中原核微生物丰度及群落结构的影响。不同区域可以看作是湖泛发生的不同严重程度, 湖泛中心即是湖泛最为严重的区域。各个不同区域水体中细菌群落的组成可以看做是湖泛各个阶段的群落演替过程。与未发生湖泛区域水体相比, 湖泛区主要有以下特点:
1) 水质明显恶化, DO、透明度(SD)、pH值显著降低, 其中DO含量均低于0.51 mg·L-1, 属于厌氧环境。水体中TN、TP等营养盐的含量分别是正常水体含量的7倍和5倍左右。
2) 细菌丰度和藻类数量都明显升高, 其中, 湖泛中心的细菌丰度上升到107cells·L-1高出对照水体中细菌丰度一个数量级。
3) 变形菌门的α-、β-和γ-纲(α-,β-, and γ- Proteobacteria)、拟杆菌门(Bacteriodetes), 放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)等几种太湖主要的淡水菌种的比例都发生了显著变化。α-、γ-变形菌纲分别由未发生湖泛区的4.10%和13.16%降至0.59%和1.91%; 放线菌门(Actinobacteria)所占比例由未发生湖泛区域的19.04%降至0.92%; 而拟杆菌门(Bacteriodetes)所占的比例则由1.12%增加至36.32%。
4) 在湖泛区域水体中的厌氧环境下, 不再适合一些专性好氧菌, 而是出现了一些新的产生酸性代谢产物的厌氧菌,,在湖泛区的群落组成中发现。
[1] 陆桂华, 张建华, 马倩. 太湖湖泛成因及防控关键技术[C]//水利部水文局、国际水文计划(IHP)中国国家委员会、国际水文科学协会(IAHS)中国国家委员会、中国水利学会水文专业委员会. 中国水文学术讨论会论文集. 北京: 科学出版社, 2012: 867–874.
[2] 张军毅, 朱冰川. 水华、蓝藻水华、湖泛及其与富营养化关系的探讨[C]//中国环境科学学会. 中国环境科学学会学术年会论文集. 北京: 北京航空航天大学出版社, 2013: 3993–3995.
[3] 陆桂华, 马倩. 太湖水域“湖泛”及其成因研究[J]. 水科学进展, 2009, 20(3): 438–442.
[4] 申秋实, 周麒麟, 邵世光, 等. 太湖草源性“湖泛”水域沉积物营养盐释放估算[J]. 湖泊科学, 2014, 26(2): 177–184.
[5] 申秋实, 邵世光, 王兆德, 等. 风浪条件下太湖藻源性湖泛的消退及其水体恢复进程[J]. 科学通报, 2012, 57(12): 1060–1066.
[6] 王成林, 张咏, 张宁红, 等. 太湖藻源性“湖泛”形成机制的气象因素分析[J]. 环境科学, 2011, 32(2): 401–408.
[7] 梅森, 段洪涛, 张玉超, 等. 浮游植物降解过程中的水体光学吸收特性变化研究[J]. 中国环境科学, 2014, 34(5): 1258–1267.
[8] SHEN Qiushi, ZHOU Qilin, SHANG Jingge, et al. Beyond hypoxia: occurrence and characteristics of black blooms due to the decomposition of the submerged plant Potamogeton crispus in a shallow lake[J]. Journal of Environmental Sciences, 2014, 26(2): 281–288.
[9] 刘国锋, 申秋实, 张雷, 等. 藻源性黑水团环境效应: 对水沉积物界面氮磷变化的驱动作用[J]. 中国环境科学, 2010, 31(12): 2917–2924.
[10] LI Huabing, XING Peng, WU Qinglong. Characterization of the bacterial community composition in a hypoxic zone induced byblooms in Lake Taihu, China[J]. FEMS Microbiology Ecology, 2012, 79(3): 773–784.
[11] BODAMER B L, BRIDGEMAN T B. Experimental dead zones: two designs for creating oxygen gradients in aquatic ecological studies[J]. Limnology and Oceanography- Methods, 2014, 12(12): 441–454.
[12] 邢鹏, 胡万婷, 吴瑜凡, 等. 浅水湖泊湖泛(黑水团)中的微生物生态学研究进展[J]. 湖泊科学, 2015, 27(4): 567– 574.
[13] 任丽娟, 何聃, 邢鹏, 等. 湖泊水体细菌多样性及其生态功能研究进展[J]. 生物多样性, 2013, 21(4): 421–432.
[14] 柴丽红, 崔晓龙, 彭谦, 等. 青海两盐湖细菌多样性研究[J]. 微生物学报, 2004, 44 (3): 271-275.
[15] VREDE K. Nutrient and temperature limitation of bacterioplankton growth in temperate lakes[J]. Microbial ecology, 2005, 49 (2): 245–256.
[16] 李玉华, 许其功, 赵越. 松花湖水体中不同空间分布的细菌群落结构分析[J]. 农业环境科学学报, 2013, 32(4): 764–770.
[17] 沈燕. 基于FISH方法检测太湖水体中细菌优势类群的研究[D]. 南京: 南京农业大学, 2009: 16– 21.
[18] WU Qiuliang, ZWART G, SCHAUER M, et al. Bacterioplankton community composition along a salinity gradient of sixteen high-mountain lakes located on the Tibetan Plateau, China[J]. Applied and Environmental Microbiology, 2006, 72 (8): 5478–5485.
[19] 王兴春, 杨致荣, 王敏, 等. 高通量测序技术及其应用[J]. 中国生物工程杂志, 2012, 32 (1): 109-114.
[20] 夏围围, 贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价[J]. 微生物学报, 2014, 54(12): 1489– 1499.
[21] 尹承苗, 王功帅, 李园园, 等. 连作苹果园土壤真菌的T-RFLP分析[J]. 生态学报, 2014, 34(4): 837–846.
[22] 孙宇晶, 刘畅, 龙彦, 等. ADx-ARMS法与PCR-Sanger测序法检测非小细胞肺癌微小标本EGFR基因突变的比较[J]. 临床检验杂志, 2014, 1(7): 485–489.
[23] TANG Xiangming, XIE Guijuan, SHAO Keqiang, et al. Influence of salinity on the bacterial community composition in Lake Bosten, a large oligosaline lake in arid northwestern China[J]. Applied and Environmental Microbiology, 2012, 78 (13): 4748–4751.
[24] 李靖宇, 张琇. 腾格里沙漠不同生物土壤结皮微生物多样性分析[J]. 生态科学, 2017, 36(3): 36–42.
[25] 陆桂华, 马倩. 2009年太湖水域“湖泛”监测与分析[J]. 湖泊科学, 2010, 22(4): 481–487.
[26] 王成林, 张宁红, 张咏, 等. 基于气象条件的太湖湖泛预警研究[J]. 环境监控与预警, 2010, 2(5): 1–4.
[27] 曾诚. 太湖藻源性“湖泛”发生的过程以及环境影响研究[D]. 武汉: 华中农业大学硕士学位论文, 2015: 23–26.
[28] 李旭文, 牛志春, 姜晟, 等. 环境卫星CCD影像在太湖湖泛暗色水团监测中的应用[J]. 环境监控与预警, 2012, 4(3): 1–9.
[29] 金相灿, 刘鸿亮, 屠清瑛, 等. 中国湖泊富营养化[M]. 北京: 中国环境科学出版社, 1990: 64.
[30] AMANN R I. LUDWIG W, SCLEIFER K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews, 1995, 59 (1): 143–169.
[31] PORTER KG, FEIG Y S. The use of DAPI for identifying and counting aquatic microflora[J]. Limnology and Oceanography, 1980, 25 (5): 943–948.
[32] 冯胜, 高光, 朱广伟, 等. 基于16S rDNA-DGGE和FDC技术对富营养化湖泊不同生态修复工程区细菌群落结构的研究[J]. 应用与环境生物学报, 2007, 13 (4): 35–540.
[33] 任丽娟, 何聃, 邢鹏, 等. 湖泊水体细菌多样性及其生态功能研究进展[J]. 生物多样性, 2013, 21 (4): 421–432.
[34] 陈荷生. 太湖宜兴近岸水域“湖泛”现象初析[J]. 水利水电科技进展, 2011, 31(4): 33–37
[35] 齐敏, 孙小雪, 邓绪伟, 等. 太湖不同形态异味物质含量, 相互关系及其与环境因子关系的探讨[J]. 湖泊科学, 2013, 25(1): 31–38.
[36] 尚丽霞, 柯凡, 李文朝, 等. 高密度蓝藻厌氧分解过程与污染物释放实验研究[J]. 湖泊科学, 2013, 25(1): 47–54.
[37] XIE Liqiang, XIE Ping, LI Sixin, et al. The low TN: TP ratio, a cause or a result ofblooms[J]. Water Research, 2003, 37(9): 2073–2080.
[38] 阮晓红, 张瑛, 黄林楠, 等. 微生物在湿地氮循环系统的效应分析[J]. 水资源保护, 2005, 20(6): 1-7.
[39] 郭建华, 彭永臻. 异养硝化, 厌氧氨氧化及古菌氨氧化与新的氮循环[J]. 环境科学学报, 2008, 28(8): 1489– 1498.
[40] 李祎, 郑伟, 郑天凌. 海洋微生物多样性及其分子生态学研究进展[J]. 微生物学通报, 2013, 40(4): 655– 668.
[41] CHAO A. Nonparametric estimation of the number of classes in a population[J]. Scandinavian Journal of statistics, 1984, 11(4): 265–270.
[42] ASMA Z, SYLVIE C, LAURENT C, et al. Microbial ecology of the rumen evaluated by 454 GS FLX pyrosequencing is affected by starch and oil supplementation of diets[J]. FEMS Microbiology Ecology, 2013, 83(2): 504–514.
[43] 赵三军, 肖天, 李洪波, 等. 胶州湾异养细菌及大肠菌群的分布及对陆源污染的指示[J]. 海洋与湖沼, 2005, 36 (6): 541–547.
[44] GUO Wei, LI Ying, WANG Lizhi, et al. Evaluation of composition and individual variability of rumen microbiota in yaks by 16S rRNA high-throughput sequencing technology[J]. Anaerobe, 2015, 34: 74–79.
[45] PITTA D W, PINCHAK W E, DOWD S E, et al. Rumen bacterial diversity dynamics associated w ith changing from Bermudagrass hay to grazed winter wheat diets[J]. Microbial Ecology, 2010, 59(3): 511–522.
[46] 任丽娟, 何聃, 邢鹏, 等. 湖泊水体细菌多样性及其生态功能研究进展[J]. 生物多样性, 2013, 21 (4): 421–432.
冯胜, 袁斌, 王博雯. 湖泛发生过程中水体理化性质及细菌群落的变化[J]. 生态科学, 2017, 36(6): 25-34.
FENGsheng, YUANbin, WANG bowen. Changes in physical and chemical properties of water and bacterial community when black bloom occurs[J]. Ecological Science, 2017, 36(6): 24-34.
Changes in physical and chemical properties of water and bacterial community when black bloom occurs
FENGsheng1,*, YUANbin1, WANG bowen2
1. School of Environmental & safety Engineering, Changzhou University, Changzhou, Jiangsu 213164, China 2. State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing, JiangSu 210008, China
Molecular biology techniques and multivariate statistical analysis method were used to evaluate relationships between bacterial abundance and environmental variables in the areas when black bloom happened regularly. We also investigated the changes of spatial bacterial community during black bloom happened. Results showed that: DO(dissolved oxygen), SD(secchi disk) and pH(potential of hydrogen) decreased significantly in the black bloom field, particularly, DO decreased as low as 0.51 mg·L-1, which indicated an anaerobic environment in the water column. In addition, black bloom increased nutrient concentrations (total nitrogen, total phosphorus), phytoplankton biomass and bacterial abundance. The bacterial abundance in the central of black booms area exceeded 107cells·L-1, which improved an order of magnitude higher than other areas without black bloom; bacterial community structures were significantly different among the areas: alpha-, beta-, and gamma-Proteobacteria, Bacteriodetes, Actinobacteria. Namely, along black bloom, α-, γ-proteobacteriadecreased from 4.10% and 13.16% to 0.59% and 1.91% respectively; anddeceased from 19.04% to 0.92%. In contrast, Bacteriodetes increased from 1.12% to 36.32%. In addition, some special habitats bacteria were also detected in our samples likeand. Through studying the change rules of bacterial community and key environmental factors when black bloom occurs, we can provide some scientific instruction for further research of black bloom.
aquatic environmental factor; bacterial abundance; bacterial community structure; black bloom
10.14108/j.cnki.1008-8873.2017.06.004
X524
A
1008-8873(2017)06-025-10
2016-07-19;
2016-09-15
国家自然科学基金(41371446); 国家自然科学基金(41271498)
冯胜(1974—), 男, 江苏常州人, 博士, 副教授, 主要从事湖泊治理研究, E-mail: shfeng@cczu.edu.cn
E-mail: shfeng@cczu.edu.cn.
