胆道闭锁Kasai术后肝移植患儿不同自体肝生存的临床与病理分析
2017-12-29詹江华王政禄
余 晨 詹江华 高 伟 王政禄
·论著·
胆道闭锁Kasai术后肝移植患儿不同自体肝生存的临床与病理分析
余 晨1詹江华2高 伟3王政禄3
目的分析和比较胆道闭锁(Biliary Atresia,BA)Kasai术后肝移植患儿不同自体肝生存情况,结合手术时病理及肝功能指标,初步探讨自体肝生存时间较长患儿的肝脏病理特点。方法将43例Kasai术后行肝移植的BA患儿按Kasai术与肝移植术间隔时间分为3组:G1组(n=17),间隔时间<6个月;G2组(n=18),间隔时间6个月至2年;G3组(n=8),间隔时间>2年。分析各组患儿临床资料包括Kasai手术时年龄、术后胆管炎发生情况、肝移植术前肝功能生化指标,同时对实施Kasai手术时及肝移植手术时的肝组织进行HE、Masson及免疫组化(CK19)染色,观察肝脏纤维化程度、胆管增生程度、淤胆情况以及炎性细胞浸润情况。结果①三组Kasai手术时平均日龄分别为66.65 d、58.39 d、49.63 d,差异有统计学意义(F=3.757,P=0.032);三组患儿术后出现胆管炎的比例分别为12/17(70.6%)、14/18(77.8%)、4/8(50.0%),经统计学分析差异无意义(χ2=2.035,P>0.05);三组出现频发胆管炎的例数分别为7/10(41.2%)、12/18(66.7%)、1/8(12.5%),经统计学分析差异有意义(χ2=6.679,P=0.032);肝移植手术前三组患儿肝功能指标显示 G3组 AST、ALT、TBI、DBI、GGT、TBA均低于前两组,但差异无统计学意义(P>0.05)。②Kasai手术时肝纤维化分级为3(2~3),胆管增生分级为2(1~2.5),胆栓分级为1(1~2.5),汇管区炎细胞浸润程度分级为3(1.5~3);移植时肝脏病理显示三组肝纤维化程度分级分别为4(4~4)、4(4~4)、4(2~4),经统计学分析差异有意义(χ2=5.978,P=0.047);胆管增生程度分级分别为3(3~3)、2(1~3)、0(0~2),经统计学分析差异有意义(χ2=19.577,P<0.001);胆栓分级分别为3(2.5~3)、1(1~3)、1(1~3),经统计学分析差异有意义(χ2=13.998,P<0.001);炎细胞浸润程度分级分别为2(1~2)、1.5(1~2)、1(1~1),差异具有统计学意义(χ2=6.221,P=0.044)。③Kasai手术日龄越早,术后胆管炎发作次数越少的BA患儿,其肝纤维化进展速度缓慢,胆管增生、淤胆及炎细胞浸润程度轻,自体肝生存时间较长。结论①BA患儿行Kasai手术的日龄及术后胆管炎发作的频次,是影响术后肝脏病理及自体肝生存时间的重要因素。②对于自体肝生存时间长的BA患儿,Kasai手术解除了胆道梗阻,降低了炎细胞浸润程度,有助于延缓肝纤维化进程。
胆道闭锁;自体肝生存;肝移植;病理学
胆道闭锁是一种发生于婴幼儿时期的、严重的、进行性的肝内外胆道梗阻性疾病,未经手术治疗的患儿大多数因肝功能衰竭于2年内死亡[1]。自1959年施行Kasai手术至今,BA患儿的预后逐步改善[2]。然而,尽管施行了Kasai手术,术后仍有超过60%的患儿因反复胆管炎、胆汁淤积性肝硬化、腹水、食管静脉曲张破裂出血等并发症而需肝移植来挽救生命。有作者报道超过75%的BA肝移植发生在 2岁以内[3、4],且 1岁以内行肝移植的患儿手术风险及术后并发症的发生率均较年长儿高,移植肝存活率较年长儿低,预后不佳[5]。如何延长BA患儿自体肝生存时间,推迟肝移植年龄,是临床迫切需要解决的问题。本文通过分析不同自体肝生存时间的BA患儿Kasai手术前后临床资料及病理特点,明确影响自体肝生存的主要因素,为改善BA患儿预后提供理论依据。
材料与方法
一、临床资料
收集2003年1月至2016年1月就诊于本院普外科,经术中胆道造影及肝活检确诊为Ⅲ型胆道闭锁,行Kasai术,并最终因肝功能衰竭于2012年4月至2016年12月在天津市第一中心医院接受肝移植的BA患儿,共计43例,其中男15例,女28例。按Kasai手术与肝移植手术间隔时间将其分为3组:G1组(n=17),间隔时间 <6个月;G2组(n=18),间隔时间6个月至2年;G3组(n=8),间隔时间>2年。回顾性分析各组患儿临床资料,包括Kasai手术时年龄、术后胆管炎发生情况、肝移植手术前肝功能生化指标,同时取Kasai手术时及肝移植手术时肝组织进行 HE、Masson及免疫组化(CK19)染色,观察肝脏纤维化程度、胆管增生程度、淤胆以及炎性浸润情况。
本研究中胆道闭锁的肝移植患儿均为肝功能失代偿期,肝移植标准为:①终末期肝病诊断明确,伴有肝硬化的并发症(腹水、脑病、消化道出血);②生长发育障碍;③反复胆管炎发作,严重影响患儿生活质量。
二、胆管炎诊断标准
胆管炎诊断标准:出现无其他部位感染的发热(体温>38.5℃)、进行性黄疸、无胆汁便,血常规白细胞及CRP明显升高,血清胆红素升高。将术后1个月内发生的的胆管炎称为早期胆管炎;1个月后发生的胆管炎称为晚期胆管炎;术后半年内胆管炎发作3次及3次以上,为频发胆管炎;少于3次,为偶发胆管炎。
三、标本处理
肝组织标本均取自Kasai手术时及肝移植手术中肝右叶前缘组织,予10%甲醛固定,石蜡包埋后,由病理科医生切成4μm切片,经HE、Masson及免疫组化(CK19)染色后在光学显微镜下观察肝组织病理特点。本研究经医院伦理委员会审查通过。
四、病理学观察指标
1.肝纤维化程度分级:采用METAVIR纤维化分级(0-4)标准[6]:F0:无纤维化;F1:肝汇管区轻度纤维化;F2:邻近汇管区轻度桥接纤维化;F3:伸向邻近汇管区重度桥接纤维化;F4:肝硬化、假小叶形成。
2.胆管增生程度分级:经CK19染色在高倍镜视野下随机选取5个不同汇管区的视野,计数胆管数量,取平均值为最终值。0级(无):平均每个视野小于5个胆管结构;1级(轻):平均每个视野为5~9个增生胆管;2级(中):平均每个视野为≥10个增生胆管;3级(重):平均每个视野为在≥10个增生胆管的基础上增生胆管形态扭曲异常、细小等表现[7]。
3.胆栓分级:1级:汇管区无胆栓;2级:只有几个汇管区的少量胆管有胆栓;3级:每个汇管区的少量胆管存在胆栓;4级:几乎所有汇管区的全部小胆管存在胆栓[8]。
4.炎细胞浸润程度分级:在高倍视野下观察汇管区细胞核总数(T)及炎细胞数目(N),计算分级炎症浸润程度I=N/T×100%。炎性浸润程度:1级:Ⅰ<25%;2级:25%≤Ⅰ<50%;3级:50%≤Ⅰ<75%;4级:Ⅰ≥75%。
五、统计学处理
采用SPSS17.0进行统计学分析,正态分布资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;多组之间率的比较采用RxC列联表资料的χ2检验,两组间比较采用Brunden法进行显著性水平校正;等级资料采用中位数及百分位数 M(P25~P75)表示,多组间采用Kruskal-Wallis H检验,多重比较用Brunden法进行显著性水平校正。相关性分析采用Spearman相关检验。P<0.05为差异有统计学意义。
结 果
一、三组患儿临床资料比较
1.Kasai手术时年龄对自体肝生存时间的影响:研究结果显示,三组BA患儿Kasai手术时日龄分别为66.65 d、58.39 d、49.63 d(F=3.757,P=0.032),两两比较发现G3组与G1组之间差异具有统计学意义,表明自体肝生存时间相对较长的患儿行Kasai手术的平均日龄最小,见表1。

表1 三组患儿Kasai手术及肝移植日龄(χ±s)Tab le 1 Ages of Kasai and liver transplantation in three groups(χ±s)
2.三组Kasai术后胆管炎发生情况比较:对比三组Kasai术后胆管炎的发生情况,就早期胆管炎发生率而言,三组之间差异无统计学意义(χ2=0.799,P=0.788);而对比频发胆管炎的发生比例,三组之间比较差异具有统计学意义(χ2=6.679,P=0.032),G3组发生胆管炎的次数明显低于前两组,且与G2组比较差异有统计学意义,见表2。

表2 Kasai术后胆管炎发生情况[n(%)]Table 2 Occurrences of cholangitis after Kasai[n(%)]
3.三组患儿肝移植手术前肝功能指标比较:谷草转氨酶(AST)、谷丙转氨酶(ALT)主要反应肝细胞受损情况,总胆红素(TBI)、结合胆红素(DBI)和胆汁酸(TBA)主要评估胆汁淤积情况,谷氨酰转肽酶(GGT)可用于临床评估胆管损坏情况。对比三组患儿移植手术前生化指标发现,G3组患儿其ALT、AST、TBI、DBI、TBA、GGT水平均低于其他两组患儿,但都高于正常水平,经统计学分析差异无意义(P>0.05),见表 3。
二、三组患儿Kasai手术时和肝移植手术时肝脏病理改变的比较
Kasai手术时肝脏纤维化程度分级为3(2~3),胆管增生分级为2(1~2.5),胆栓分级为1(1~2.5),汇管区炎细胞浸润程度分级为3(1.5~3),且年龄与纤维化程度成正相关(rs=0.828,P=0.042),见表4和图1至图3。

表3 三组肝移植术前生化值比较(χ±s)Table 3 Comparison of biochemical values before liver transplantation in three groups(χ±s)
移植时肝脏病理显示三组肝纤维化程度分级分别为4(4~4)、4(4~4)和 4(2~4),差异具有统计学意义(χ2=5.978,P=0.047),两两比较发现 G1组纤维化程度明显高于G3组(P<0.017);胆管增生程度分级分别为3(3~3)、2(1~3)和0(0~2),差异具有统计学意义(χ2=19.577,P<0.001),两两比较发现,G1组胆管增生程度均高于G2、G3组,其中 G3组最低(P<0.017);胆栓分级分别为3(2.5~3)、1(1~3)和1(1~3),差异有统计学意义(χ2=13.998,P<0.001),其中 G2、G3组均低于 G1组(P<0.017);炎细胞浸润程度分级分别为 2(1~2)、1.5(1~2)、1(1~1),差异有统计学意义(χ2=6.221,P<0.044),两两比较发现 G3组浸润程度明显低于G1组(P<0.017)。对比三组移植肝病理情况显示:G3组患儿其肝脏病变较G1、G2组轻,具体表现为肝纤维化进展缓慢、淤胆缓解、纤维间隔内胆管增生较低、炎性浸润减少。见表4和图4至图6。
对比Kasai手术时的肝脏病理与三组移植时病理发现,其肝纤维化程度分级比较差异具有统计学意义(χ2=21.852,P<0.001),其中 G1组与 G2组肝移植时肝纤维化程度明显高于Kasai手术时(P<0.0083);胆管增生程度分级比较差异具有统计学意义(χ2=21.085,P=0.01),其中 G1组肝移植时较Kasai手术时增高,但G3组增生程度明显低于Kasai手术时(P<0.0083);胆栓分级比较发现差异有统计学意义(χ2=15.243,P<0.001),将三组移植时病理与Kasai手术时病理比较并未发现差异;炎细胞浸润程度分级比较发现差异具有统计学意义(χ2=9.986,P=0.014),且 G3组浸润程度明显低于Kasai手术时(P<0.0083)。对于G1组与G2组肝移植时病理而言,其肝纤维化程度明显高于Kasai手术时,且淤胆并未解除,炎细胞浸润及胆管增生持续存在;而对于G3组而言,其淤胆及炎细胞浸润程度均明显低于Kasai手术时,但肝纤维化及胆管增生仍持续存在,见表4。

表4 Kasai手术时与肝移植手术时肝脏病理的比较 M(P25~P75)Table 4 Comparison of pathology during Kasai versus liver transplantation M(P25~P75)
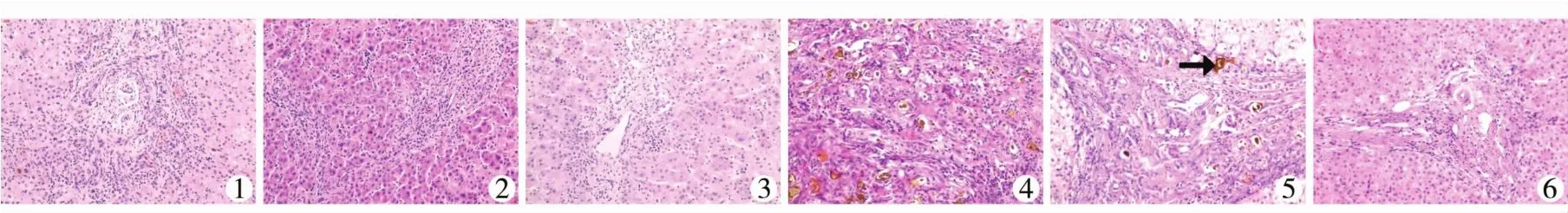
图1 G1组Kasai手术时病理提示汇管区可见轻度胆栓,HE×100(黑色箭头所指为胆栓) 图2 G2组Kasai手术时肝内炎细胞浸润程度较重,HE×100 图3 G3组Kasai手术时病理提示肝纤维化程度较轻,HE×100 图4 G1组移植肝内见重度胆管增生及胆栓,HE×100(黑色箭头所指为胆栓) 图5 G2组移植肝内可见中度胆管增生及胆栓,HE×100(黑色箭头所指为胆栓) 图6 G3组移植肝内胆管增生轻,未见胆栓,HE×100Fig.1 Hepatic tissue showed mild bile plugs in portalarea during Kasai in group 1(HE×100)(black arrows indicated bile plug)Fig.2 Hepatic tissue showed the degree of intrahepatic inflammatory cell infiltration was severe during Kasai in group 2(HE×100)Fig.3 Hepatic tissue showed mild liver fibrosis during Kasai in group 3(HE×100) Fig.4 Hepatic tissue showed severe bile duct hyperplasia and bile plug during liver transplantation in group 1(HE×100)(black arrows indicated bile plug) Fig.5 Hepatic tissue showed moderate bile ducthyperplasia and bile plug during liver transplantation in group 2(HE×100)(black arrows indicated bile plug)Fig.6 Hepatic tissue showedmild bile ducthyperplasia and no bile plugwas found during liver transplantation in group 3(HE×100)
讨 论
胆道闭锁是小儿肝胆外科严重且较常见的疾病之一,亚洲发病率明显高于欧美地区[9]。目前临床上推荐序贯性疗法:即在病程早期行Kasai手术,解除胆道梗阻;若Kasai术后出现反复胆管炎、肝硬化、肝功能衰竭则行肝移植手术延长患儿生命[4]。
本实验通过回顾性分析BA患儿Kasai术前、术后临床资料以及肝脏病理特点,总结影响自体肝生存的因素包括Kasai手术时年龄、术后胆管炎频次等临床指标及其与肝脏病理的关系。
一、Kasai手术时年龄
Kasai手术年龄是影响预后的独立危险因素,这一观点已得到国内外专家的一致认可,普遍认为手术时年龄 <60 d的患儿,其自体肝生存时间较长[10]。近年来,随着BA早期粪卡筛查项目的推广,Kasai手术年龄明显提前[11]。早期施行 Kasai手术的患儿,其肝脏纤维化程度较低,术后有望逆转胆汁对肝脏的持续损害,能够获得较长的自体肝生存[12]。本实验通过回顾移植患儿临床资料发现,自体肝生存时间超过2年的患儿,其平均Kasai手术年龄最小,术后黄疸消退快,解除了胆汁对肝脏的毒性作用,延缓了肝纤维化进程,预后良好。同时相关性检验也表明Kasai手术年龄与肝纤维化程度成正相关(rs=0.828,P=0.042)。而肝移植年龄与肝纤维化程度无明显相关(rs=-0.205,P=0.194),究其原因主要是成功的手术干预延缓了肝脏损伤进程,部分患儿可自体肝生存超过10年,同时也为肝移植赢得了时间[13]。
二、Kasai术后胆管炎发生情况
Kasai术后胆管炎是其主要并发症,同时也是影响自体肝生存的重要因素[14]。研究发现,胆管炎发生的时间越早,发生的次数越多,BA患儿的预后越差[15]。反复发作胆管炎将对肝脏造成持续性损害,加速肝纤维化过程,导致自体肝生存时间缩短[16]。本实验结果也同样表明在术后胆管炎频发的G1、G2组,自体肝生存时间短,患儿预后较差,而G1组发生胆管炎的频次低于G2组,考虑为G1组术后很快发生肝功能衰竭而行肝移植手术,故次数相对较低。自体肝生存时间长的第3组患儿术后胆管炎的发生率低,发生胆管炎的频次也较少,预后相对较好。
三、肝移植前各项生化指标
Kasai手术后各项肝功能指标在一定程度上可反应肝脏受损程度[12]。有学者对Kasai术后长期自体肝纤维化制定了一套非侵袭性的评分标准(BALF),该标准提出通过 TBI、GGT联合年龄、血清白蛋白水平评估纤维化程度是一种较好的方法,纤维化分级越高,评分越高[17]。本实验通过三组之间移植前肝脏生化指标的横向比较发现:AST、ALT、TBI、DBI、TBA、GGT水平在三组之间均呈降低趋势,这与术后三组肝脏病理的变化趋势基本相符,说明自体肝生存时间长的患儿其肝脏受损程度轻。但三组生化指标比较未见明显差异,考虑仅用肝生化指标评估肝脏功能有所欠缺,应适当结合其他临床检查以及肝脏病理对术后肝脏受损程度进行综合且准确的评估。
四、病理改变
胆道闭锁的特征性病理改变包括肝脏纤维化、胆管增生、淤胆及炎细胞浸润等[18,19]。既往研究表明肝纤维化与胆管增生和胆汁淤积呈正相关[12]。目前认为各种原因引起的炎性细胞浸润是肝脏受损的第一步,而胆汁淤积是BA病变的共同通路[20,21]。淤积在胆管中的胆汁,刺激胆管大量增生,分泌大量细胞因子,诱导肝星型细胞(HSC)活化并产生大量基质,包绕和分隔新生的胆小管。因此增生的胆管是对胆汁淤积的反应,与自体肝生存短、进行性纤维化有关[22]。
Kasai手术后小叶内胆汁淤积被认为是预测胆汁是否通畅引流的一项标志,同时也是提示早期行肝移植的一项指标[13]。Kasai术与肝移植间隔时间越短,淤胆、胆管增生及炎细胞浸润越重。在本组实验中,G1、G2组肝纤维化进展迅速,肝脏呈明显肝硬化状态,胆管重度增生,淤胆及炎细胞浸润程度持续存在甚至较Kasai时加重。推测其术后并未建立通畅的胆汁引流,淤积在肝脏内的胆汁持续作用并进一步加重胆管增生和肝纤维化,导致其在较短时间内出现肝硬化及并发症,而需早期行肝移植术。
在G3组中,肝脏纤维化进展缓慢,虽部分呈弥漫性肝硬化,但其汇管区及界板周围可见少量炎细胞浸润,胆汁淤积轻或无淤胆,胆管增生程度轻。其中有1例自体肝生存超过10年者,其术后胆汁引流较好,未出现频发胆管炎,病理结果显示肝脏虽呈弥漫性肝硬化,但纤维间隔内未见胆栓,炎细胞浸润程度低,胆管未见明显增生。
最新研究结果表明在成功施行了Kasai手术后,肝组织的胆汁淤积和门管区的炎症得以解决,表现为炎性细胞Th1、Th2表达相关的基因减少,然而伴随着胆管增生的纤维化以及与纤维化相关的collagen-1、α-SMA的基因过表达仍然存在[23]。将本组实验中Kasai手术时与肝移植时的肝脏病理进行比较也发现,在Kasai手术后肝纤维化程度是不断进展的,但自体肝生存时间长的患儿其肝纤维化进展慢,淤胆及炎细胞浸润情况也较Kasai手术时明显改善,肝脏损伤较自体肝生存时间短的患儿轻,预后较好。
肝纤维化及胆管炎是制约自体肝生存的两个重要因素,但具体Kasai手术后肝脏的纤维化程度是如何进展的?这需要我们对随访的BA患儿进行多次肝活检,现已有学者提出对Kasai手术后随访的患儿进行肝活检,但因其有创性或许让家长难以接受。同时,国内外也有研究者对随访儿童进行Fibroscan(肝脏瞬时弹性扫描)检查,用以监测肝纤维化进展,并结合肝功能对患儿进行综合评估,可靠性较好[21,24]。
综上所述,BA患儿早期诊断、早期行Kasai手术,术后胆管炎发作频次低,有利于延缓肝脏纤维化进程,是延长患儿自体肝生存时间的关键。同时应积极探索Kasai术后肝纤维化进展的分子机制,针对该机制采取适宜的方式延缓甚至阻止肝纤维化进程,从而达到延长自体肝生存时间的目的。
1 Hartley JL,Davenport M,Kelly DA.Biliary atresia[J].Lancet,2009,374(9702):1704—1713.DOI:10.1016/S0140—6736(09)60946—6.
2 Chardot C,Carton M,Spire-bendelac N,et al.Prognosis of biliary atresia in the era of liver transplantation:French national study from 1986 to 1996[J].Hepatology,1999,30(3):606—611.DOI:10.1002/hep.510300330.
3 Alexopoulos SP,Mmerrill M,Kin C,et al.The impact of hepatic portoenterostomy on liver transplantation for the treatment of biliary atresia:early failure adversely affects outcome[J].Pediatr Transplant,2012,16(4):373—378.DOI10.1111/j.1399—3046.2012.01677.
4 詹江华.胆道闭锁诊疗流程(草案)[J].中华小儿外科杂志,2013,34(2):147—149.DOI:10.3760/cma.j.issn.0253—3006.2013.02.018.Zhan JH.The treatment process of biliary atresia(draft)[J].Chin JPediatr Surg,2013,34(2):147—149.DOI:10.3760/cma.j.issn.0253—3006.2013.02.018.
5 Neto JS,Feier FH,Bierrenbach AL,et al.Impact of Kasai portoenterostomy on liver transplantation outcomes:A retrospective cohort study of347 children with biliary atresia[J].Liver Transpl,2015,21(7):922—927.DOI:10.1002/lt.24132.
6 Bedossa P,Poynard T.An algorithm for the grading of activity in chronic hepatitis C.The METAVIR Cooperative Study Group[J].Hepatology,1996,24(2):289—293.DOI:10.1002/hep.510240201.
7 LeeWS,Looi LM.Usefulness of a scoring system in the interpretation of histology in neonatal cholestasis[J].World J Gastroenterol,2009,15(42):5326—5333.
8 刘钧澄,李桂生,钟思陶,等.胆道闭锁葛西手术后肝脏病理变化 [J].中华小儿外科杂志,1994,15(6):332—334.DOI:R726.574.Liu JC,Li GS,Tao SY,et al.Pathological changes of liver after operation for biliary atresia[J].Chin J Pediatr Surg,1994,15(6):332—334.DOI:R726.574.
9 詹江华.胆道闭锁早期筛查现状及对策[J].天津医药,2015,43(1):1—3.DOI:10.3969/j.issn.0253—9896.2015.01.001.Zhan JH.The early screening and counter-measures of biliary atresia[J].Tianjin Med J,2015,43(1):1—3.DOI:10.39 69/j.issn.0253—9896.2015.01.001.
10 Webb NL,Jiwane A,Ooi CY,et al.Clinical significance of liver histology on outcomes in biliary atresia[J].JPaediatr Child Health,2017,53(3):252—256.DOI:10.1111/jpc.13371.
11 Gu YH,Yokoyama K,Mizuta K,et al.Stool color card screening for early detection of biliary atresia and long-term native liver survival:a19-year cohortstudy in Japan[J].JPediatr,2015,166(4):897—902.DOI:10.1016/j.jpeds.2014.12.063.
12 Lampela H,Kosola S,Heikkila P,et al.Native liver histology after successful portoenterostomy in biliary atresia[J].JClin Gastroenterol,2014,48(8):721—728.DOI:10.1097/MCG.0000000000000013.
13 刘丹丹,詹江华,高伟,等.胆道闭锁Kasai术后胆管病理改变的研究[J].中华小儿外科杂志,2014,35(4):248—253.DOI:10.3760/cma.j.issn.0253—3006.2014.04.004.Liu DD,Zhan JH,GaoW,et a1.Changes of bile duct pathology in children with biliary atresia after Kasaiportoenterostomy[J].Chin J Pediatr Surg,2014,35(4):248—253.DOI:10.3760/cma.j.issn.0253—3006.2014.04.004.
14 詹江华,卫圆圆.胆道闭锁患儿Kasai术后胆管炎病因及诊疗状况[J].天津医药,2016,44(7):803—805.DOI:10.1 1958/20160236.Zhan JH,Wei YY.Etiology and treatment of eholangitis after Kasaioperation in biliary atresia patients[J].Tianjin Med J,2016,44(7):803—805.DOI:10.11958/201 60236.
15 郭鑫,孙雪,任红霞.102例胆道闭锁Kasai术后胆管炎分析[J].临床小儿外科杂志,2017,16(2):146—150.DOI:10.3969/j.issn.1671—6353.2017.02.010.Guo X,Sun X,Ren HX.Analysis of cholangitis in patients with biliary atresia after Kasai operation[J].J Clin Ped Sur,2017,16(2):146—150.DOI:10.3969/j.issn.1671—6353.2017.02.010.
16 宋亭亭,詹江华,高伟,等.胆道闭锁Kasai术后肝脏病理改变的研究[J].中华小儿外科杂志,2014,(8):603—607.DOI:10.3760/cma.j.issn.0253—3006.2014.08.011.Song TT,Zhan JH,GaoW,et al.Changes of hepatic pathology in children with biliary atresia after Kasaiportoenterstomy[J].Chin J Pediatr Surg,2014,(8):603—607.DOI:10.3760/cma.j.issn.0253—3006.2014.08.011.
17 Tomita H,Masugi Y,Hoshino K,et al.Long-term native liver fibrosis in biliary atresia:development of a novel scoring system using histology and standard liver tests[J].JHepatol,2014,60(6):1242—1248.DOI:10.1016/j.jhep.2014.01.028.
18 陈扬,詹江华.胆道闭锁Kasai术后自体肝生存情况研究进展 [J].天津医药,2016,44(7):829—833.DOI:10.11958/20160237.Chen Y,Zhan JH.Research progress on the survival of autologous liver in children with biliary atresia after Kasai operation[J].Tianjin Med J,2016,44(7):829—833.DOI:10.11958/20160237.
19 Obayashi J,Tanaka K,Ohyama K,et al.Relation between amount of bile ducts in portal canal and outcomes in biliary atresia[J].Pediatr Surg Int,2016,32(9):833—838.DOI:10.1007/s00383—016—3941—y.
20 Arva NC,Russo PA,Erlichman J,et al.The inflammatory phenotype of the fibrous plate is distinct from the liver and correlateswith clinical outcome in biliary atresia[J].Pathol Res Pract,2015,211(3):252—260.DOI:10.1016/j.prp.2014.12.003.
21 王增萌,陈亚军,沈秋龙,等.胆道闭锁Kasai术后肝脏纤维化及生化指标变化趋势的横断面研究 [J].中华小儿外科杂志,2016,37(2):118—123.DOI:10.3760/cma.j.issn.0253—3006.2016.02.009.Wang ZM,Chen YJ,Shen QL,et al.Cross-sectional study of liver fibrosis and biochemical trends after Kasai operation in patientswith biliary atresia[J].Chin JPediatr Surg,2016,37(2):118—123.DOI:10.3760/cma.j.issn.0253—3006.2016.02.009.
22 Kerola A,Lampela H,Lohi J,et al.Increased MMP-7 expression in biliary epithelium and serum underpins native liver fibrosis after successful portoenterostomy in biliary atresia[J].J Pathol Clin Res,2016,2(3):187—198.DOI:10.1002/cjp2.50.
23 Kerola A,Lampela H,Lohi J,et al.Molecular signature of active fibrogenesis prevails in biliary atresia after successful portoenterostomy[J].Surgery,2017,162(3):548—556.DOI:10.1016/j.surg.2017.04.013.
24 Chongsrisawat V,Vejapipat P,Siripon N,et al.Transient elastography for predicting esophageal/gastric varices in children with biliary atresia[J].BMC Gastroenterol,2011,11(41):DOI:10.1186/1471—230X—11—41.
Clinicopat hologicalanalysis with different native liver survivals for biliary atresia after Kasai.
Yu Chen1,Zhan Jianghua2,Gao Wei3,Wang Zhenglu3.
1.Graduate School,Tianjin Medical University,Tianjin 300070,China;2.Department of Pediatric Surgery,Tianjin Children's,Hospital,Tianjin 300134,China;3.Department of Transplantation Surgery,First Municipal Central Hospital,Tianjin 300192,China.Corresponding author:Zhan Jianghua,Email:zhanjianghuatj@163.com
ObjectiveTo compare the survival conditions of different native livers in biliary atresia(BA)patients after Kasaioperation and explore the pathological characteristics of liver in children with a longer survival time with hepatic pathology and biochemistry.M ethodsA total of43 BA patients undergoing Kasai and liver transplantation(LT)were divided into 3 groups according to interval time between Kasai and LT:group 1(n=17),interval time<6 months;group 2(n=18),from 6 months to 2 years;group 3(n=8),>2 years.A retrospective study was conducted for clinical data of each group including age at Kasai,occurrence of cholangitis and biochemical values pre-LT.Meanwhile,pathological examinations of liver pathology during Kasaiand LT included hematoxylin-eosin(HE),Masson and immunohistochemical(CK19)staining for evaluating grade of liver fibrosis,extension of bile duct,cholestasis and infiltration of inflammatory cells.ResultsIn three groups,the average ages at Kasaiwere 66.65,58.39,49.63 days(P<0.05);number of cases with cholangitis 12/17(70.6%),14/18(77.8%),4/8(50%)(P>0.05)and with frequent cholangitis 7/10(41.2%),12/18(66.7%),1/8(12.5%)(P<0.05)post-Kasai;biochemical values pre-LT showed that the levels of AST,ALT,TBI,DBIand GGT in group 3 were lower than other groups and the differences not statistically significant.The grade of hepatic fibrosis was 3(2-3),bile duct proliferation 2(1-2.5),portal bile plug 1(1-2.5)and infiltration of inflammatory cells 3(1.5-3)during Kasai;Pathology during LT showed that the grades of hepatic fibrosis 4(4-4),4(4-4),4(2-4)(P<0.05),bile duct proliferation 3(3-3),2(1-3),0(0-2)(P<0.001),bile plug 3(2.5-3),1(1-3),1(1-3)(P<0.001)and infiltration of inflammatory cells 2(1-2),1.5(1-2),1(1-1)(P<0.05).The differences were statistically significant.Clinicopathological data showed earlier operations of BA patients and less occurring frequency of cholangitis,slower progress of hepatic fibrosis andmilder proliferation ofbile duct,cholestasis and inflammatory cell infiltration and longer survival time of native liver.ConclusionAge of Kasai and frequency of cholangitis are essential for the changes of native liver pathology and survival time of BA patients.For those with a longer native liver survival time,Kasai operationmay resolve cholestasis and decrease inflammation infiltration so as to delay the progress of liver fibrosis.
Biliary Atresia;Native Liver Survival;Liver Transplantation;Pathology
10.3969/j.issn.1671—6353.2017.06.007
国家自然科学基金(81570471);天津市卫生行业重点攻关项目(14KG129)
1.天津医科大学研究生院(天津市,300070);2.天津市儿童医院外科(天津市,300134);3.天津市第一中心医院(天津市,300192)
詹江华,Email:zhanjianghuatj@163.com
2017—09—04)
本文引用格式:余晨,詹江华,高伟,等.胆道闭锁Kasai术后肝移植患儿不同自体肝生存的临床与病理分析[J].临床小儿外科杂志,2017,16(6):552—558.
10.3969/j.issn.1671—6353.2017.06.007.
Citing this article as:Yu C,Zhan JH,Gao W,et al.Clinicopathological analysis with different native liver survivals for biliary atresia after Kasai[J].JClin Ped Sur,2017,16(6):552—558.DOI:10.3969/j.issn.1671—6353.2017.06.007.
