PeroxiredoxinⅡ基因敲除对高脂膳食下小鼠脂肪蓄积的影响
2017-12-29何超韩英浩金成浩
何超,韩英浩,金成浩
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
PeroxiredoxinⅡ基因敲除对高脂膳食下小鼠脂肪蓄积的影响
何超,韩英浩,金成浩
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
利用高脂饲料诱导小鼠肥胖模型和苏木精—伊红染色法(H&E染色)检测PeroxiredoxinⅡ(PrxⅡ)基因敲除对小鼠体重、内脏脂肪、肝脏和皮下脂肪的影响。结果表明,高脂饲料饲养9周后,高脂饲料饲养组PrxⅡ基因敲除对小鼠(HFD-PrxⅡ-/-)体重、腹膜后脂肪重量、肾脏周围脂肪重量和附睾脂肪垫重量与高脂饲料饲养组野生型小鼠(HFD-PrxⅡ+/+)相比均无统计学意义,HFD-PrxⅡ-/-小鼠的肝脏重量与HFD-PrxⅡ+/+小鼠相比显著增加(P<0.01),H&E染色观察发现,HFD-PrxⅡ-/-小鼠肝脏脂肪空泡明显多于HFD-PrxⅡ+/+小鼠。高脂饲料饲养9周后,H&E染色观察小鼠皮下脂肪厚度,HFD-PrxⅡ-/-小鼠皮下脂肪厚度与HFD-PrxⅡ+/+小鼠相比显著增厚(P<0.001)。研究证明,PrxⅡ基因敲除小鼠经高脂饲料喂养后能显著增加脂肪在肝脏和皮下的蓄积,为进一步探究PrxⅡ抑制脂肪形成和异常蓄积提供了基础研究数据。
高脂膳食;肥胖;PeroxiredoxinⅡ基因敲除;脂肪蓄积
世界卫生组织(WHO)公布的数据显示,2015年,全球超重人口约23亿,成年肥胖人口约7亿,中国超重人口2.66亿,成年肥胖人口5300万,肥胖症已经成为全球最为流行的慢性疾病之一[1-2]。肥胖症是体内脂肪组织过多蓄积和异常分布为特征的代谢综合征,内脏脂肪是肥胖症最重要的警示器,如腹膜后脂肪、肾脏周围脂肪、附睾脂肪垫和肠系膜脂肪[3]。长期的肥胖会导致多种代谢性疾病的发生,如胰岛素抵抗、Ⅱ型糖尿病、心血管疾病和非酒精性脂肪肝等[4]。
近年来的研究表明,氧化应激(Oxidative stress)是肥胖症和肥胖相关代谢并发症的重要参与因素[4-5]。在脂肪组织中,氧化应激导致炎性因子和脂肪因子调节异常,使脂肪组织释放大量的炎性因子(IL-1β、IL-6、TNF-α),脂肪因子(瘦素、脂联素、PAI-1)[4,6]。同时,大量的炎性因子和脂肪因子能促进脂肪的形成和脂肪组织的过多蓄积,如肝脏脂肪蓄积,利用苏木精—伊红染色(H&E染色)观察时,肝脏的切片出现脂肪空泡,皮下脂肪的蓄积使皮下脂肪的厚度增加。肥胖症患者产生过量活性氧(ROS)的主要有三条途径:(1)丙酮酸、脂肪酸和乙酰辅酶A等经线粒体氧化产生大量的活性氧;(2)分子氧通过线粒体的电子传递链(呼吸链)被过量消耗产生大量的活性氧;(3)高脂饲料增加机体的脂肪蓄积,改变氧化代谢途径,明显减弱抗氧化物酶的活性,如:超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)[5]。
PeroxiredoxinⅡ(PrxⅡ)是一种典型的含有两个半胱氨酸残基的抗氧化物蛋白,广泛分布在哺乳动物细胞的细胞质中[7]。PrxⅡ通过C端的半胱氨酸的巯基与另一分子N端半胱氨酸的巯基发生脱氢氧化反应形成分子间二硫键,清除一分子的过氧化氢[8]。在前期研究中发现,PrxⅡ基因敲除小鼠外周血的活性氧水平明显升高,处于氧化应激状态,肥胖症患者也因氧化应激导致脂肪组织过多的蓄积[9-11]。PrxⅡ能否降低肥胖症的氧化应激,抑制脂肪组织过多蓄积的研究均未见相关文献报道,利用高脂饲料诱导小鼠肥胖和苏木精—伊红染色法(H&E染色)探究PrxⅡ基因敲除对小鼠体重、内脏脂肪、肝脏和皮下脂肪的影响,为进一步探究PrxⅡ抑制脂肪形成和异常蓄积提供基础研究数据。
1 材料与方法
1.1 试剂
蒸馏水,10%中性福尔马林(Sigma),无水乙醇(华蓝化学科技),二甲苯(华蓝化学科技),苏木精(阿拉丁化学),伊红 Y(阿拉丁化学),高熔点石蜡(Lecia),中性树胶(上海懿洋仪器),氨水(天津基准化学试剂),冰乙酸(天津市化学试剂)。
1.2 材料仪器
D12492高脂饲料(Research Diets),D12450J对照组饲料(Research Diets),病理级显微镜载玻片(世泰),显微镜盖玻片(世泰),组织包埋盒(Oamay),病理切片刀片(FEATHER),石蜡切片机(Leica),生物组织摊片机(KEDEE),全自动生物组织脱水机(KEDEE),组织包埋机(KEDEE),冷冻台(KEDEE),多功能显微镜(Leica),ALC-310.3型电子天平(上海梅特勒-托利多仪器有限公司),DSLR-A200单反照相机(SONY)。
1.3 小鼠
129/SvJ野生型小鼠(PrxⅡ+/+),129/SvJ PrxⅡ基因敲除型小鼠(PrxⅡ-/-)(韩国生命工学研究院引进)。
1.4 方法
1.4.1 建立肥胖小鼠模型
取6周龄129/SvJ野生型(PrxⅡ+/+)和PrxⅡ基因敲除型(PrxⅡ-/-)公鼠各12只,称量小鼠体重(记为0周),并随机将小鼠分成 D12450J对照饲养组(NCD,6只/组)和D12492高脂饲料饲养组(HFD,6只/组):Prx Ⅱ+/+对照饲养组(NCD-Prx Ⅱ+/+)、Prx Ⅱ-/-对照饲养组(NCD-PrxⅡ-/-)、PrxⅡ+/+高脂饲料饲养组(HFD-PrxⅡ+/+)、PrxⅡ-/-高脂饲料饲养组(HFDPrxⅡ-/-)。分组结束后,给各组小鼠投食对应的饲料饲养9周。在建立小鼠肥胖模型过程中,各组小鼠自由采食和饮水,每周同一天上午09:00称量小鼠体重,并记录体重数据。
1.4.2 采集小鼠组织样本
小鼠饲养至9周时被宰杀。取小鼠背部皮肤约2 cm×2 cm平铺在硝酸纤维素膜(NC膜)上,置于10%中性福尔马林溶液中固定。取小鼠肝脏,用ALC-310.3型电子天平称量肝脏湿重,用DSLRA200单反照相机给肝脏拍照,置于10%中性福尔马林溶液中固定。取小鼠腹膜后脂肪、肾脏及周围脂肪和附睾脂肪垫,用ALC-310.3型电子天平称量上述组织湿重,用DSLR-A200单反照相机给上述组织拍照,置于10%中性福尔马林溶液中固定。
1.4.3 计算小鼠组织相对重量
组织相对重量=组织湿重/体重(mg·g-1),利用公式计算小鼠腹膜后脂肪、肾脏周围脂肪、附睾脂肪垫和肝脏的相对重量。
1.4.4 小鼠肝脏/皮肤组织H&E染色
小鼠肝脏和皮肤组织经10%中性福尔马林溶液固定24 h,用手术刀将肝脏切成约2 mm厚度的样品放入包埋盒中,皮肤组织切成约1 cm×1 cm放入包埋盒中,在流动的自来水中水洗1.5 h。将包埋盒放入生物组织脱水机进行样品组织脱水;利用组织包埋机进行石蜡包埋样品,放置在-20℃冷冻台上,待石蜡冷却凝固后将蜡块修成梯形,放入-20℃冰箱冷藏24 h;使用石蜡切片机将制备包的石蜡样本切成5 μm的样品薄片,附着在病理级显微镜载玻片上,室温干燥样本切片12 h;最后,染色封片,室温晾片24 h,多功能显微镜观察肝脏/皮肤组织H&E染色切片。
1.4.5 统计学方法
采用Excel绘图,多组均数比较采用t检验进行分析,P<0.05 为有差异,P<0.01 为差异显著,P<0.001为差异极显著。
2 结果
2.1 PrxⅡ基因敲除对高脂饲料导致的体重增长没有影响
如图1A所示,高脂饲料饲养组(HFD-PrxⅡ+/+,HFD-Prx Ⅱ-/-)和对照饲养组(NCD-Prx Ⅱ+/+,NCDPrxⅡ-/-)的小鼠随着饲养周数的延长体重逐渐增长。在第9周时,HFD-PrxⅡ+/+小鼠体重显著高于NCDPrx Ⅱ+/+小鼠($p<0.01),HFD-Prx Ⅱ-/-小鼠体重显著高于 NCD-Prx Ⅱ-/-小鼠(#p<0.01),HFD-Prx Ⅱ-/-小鼠体重与HFD-PrxⅡ+/+小鼠相比无统计学差异(p>0.05);高脂饲料饲养组小鼠比对照饲养组小鼠蓄积更多的腹部脂肪(图1B)。结果表明,PrxⅡ基因敲除小鼠经高脂饲料喂养后对小鼠体重的增长没有影响。
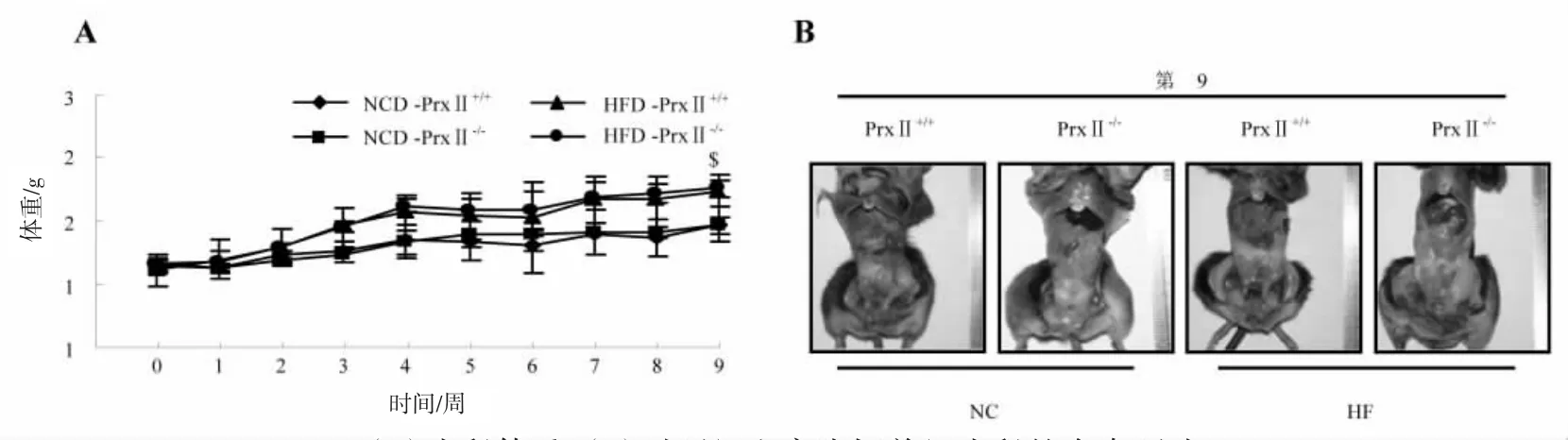
图1 饲喂高脂饲料对小鼠体重的影响Fig.1 Effects of feeding high-fat diet on body weight of mice
2.2 PrxⅡ基因敲除对小鼠内脏脂肪蓄积的影响
如图2所示,高脂饲料饲养组(HFD-PrxⅡ+/+,HFD-PrxⅡ-/-)小鼠腹膜后脂肪的相对重量显著高于对照饲养组(NCD-PrxⅡ+/+,NCD-PrxⅡ-/-)小鼠(图2B,p<0.01);高脂饲料饲养组(HFD-Prx Ⅱ+/+,HFDPrxⅡ-/-)小鼠肾脏周围脂肪的相对重量显著高于对照饲养组(NCD-PrxⅡ+/+,NCD-PrxⅡ-/-)小鼠(图2C,p<0.05);高脂饲料饲养组(HFD-Prx Ⅱ+/+,HFDPrxⅡ-/-)小鼠附睾脂肪垫的相对重量显著高于对照饲养组(NCD-PrxⅡ+/+,NCD-PrxⅡ-/-)小鼠(图 2D,P<0.01)。在第 9周时,HFD-PrxⅡ-/-小鼠腹膜后脂肪、肾脏周围脂肪和附睾脂肪垫与HFD-PrxⅡ+/+小鼠相比无统计学差异(P>0.05)。结果表明,PrxⅡ基因敲除小鼠经高脂饲料喂养后对小鼠的腹膜后脂肪、肾脏周围脂肪和附睾脂肪垫的蓄积没有影响。
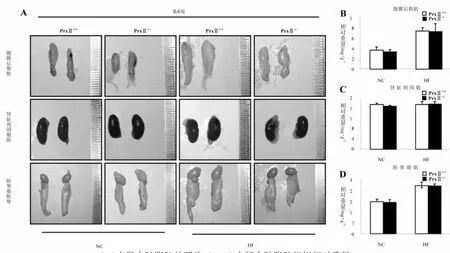
图2 饲喂高脂饲料对小鼠内脏脂肪的影响Fig.2 Effects of feeding high-fat diet on visceral fat of mice
2.3 PrxⅡ基因敲除对小鼠肝脏脂肪蓄积的影响
在第9周时,HFD-PrxⅡ-/-小鼠肝脏的相对重量显著高于HFD-Prx Ⅱ+/+小鼠(图3A,B,p<0.01)。H&E染色观察可知,高脂饲料饲养组(HFD-PrxⅡ+/+,HFD-PrxⅡ-/-)小鼠肝脏的脂肪空泡多于对照饲养组(NCD-Prx Ⅱ+/+,NCD-Prx Ⅱ-/-) 小鼠;HFD-Prx Ⅱ-/-小鼠肝脏的脂肪空泡多于HFD-PrxⅡ+/+小鼠(图3C)。结果表明,PrxⅡ基因敲除小鼠经高脂饲料喂养后能显著提高脂肪在肝脏的蓄积程度。

图3 饲喂高脂饲料对小鼠肝脏脂肪蓄积的影响Fig.3 Effects of feeding high-fat diet on the fat accumulation of liver of mice
2.4 PrxⅡ基因敲除对小鼠皮下脂肪蓄积的影响
H&E染色观察可知,高脂饲料饲养组(HFD-PrxⅡ+/+,HFD-PrxⅡ-/-)小鼠的皮下脂肪的厚度显著高于对照饲养组(NCD-PrxⅡ+/+,NCD-PrxⅡ-/-)小鼠(图 4 A,p<0.001);在第 9 周时,HFD-Prx Ⅱ-/-小鼠皮下脂肪的厚度显著高于HFD-PrxⅡ+/+小鼠(图4 B,p<0.001)。结果表明,PrxⅡ基因敲除小鼠经高脂饲料喂养后能显著增加皮下脂肪的厚度。

图4 饲喂高脂饲料对小鼠皮下脂肪蓄积的影响Fig.4 Effects of feeding high-fat diet on the fat accumulation of subcutaneous fat of mice
3 讨论
随着人民生活水平的显著提高,高脂、高糖和高热量的饮食摄入,导致内脏脂肪、皮下脂肪等脂肪组织的过度蓄积与异常分布,体重不断增长为特征的肥胖人群逐年增多。目前,国内外利用高脂饲料、高糖高脂饲料喂养实验动物诱导肥胖模型,研究肥胖或肥胖相关疾病的发病机制。研究利用脂肪含量为60%的D12492高脂饲料(Research Diets)诱导小鼠肥胖模型,饲养9周后,发现高脂饲养组小鼠的体重、腹膜后脂肪相对重量和附睾脂肪垫相对重量均显著增加(图1,图2);同时,首次发现PrxⅡ基因敲除小鼠经高脂饲料喂养后能显著增加脂肪在肝脏和皮下的蓄积程度(图3,图4)。
Fernandez Sanchez等[5]发表在《国际分子科学杂志》的“Inflammation,oxidative stress,and obesity.”提出:脂肪组织大量蓄积的同时分泌大量的TNF-α和IL-6,诱发机体产生氧化应激,而氧化应激产生过量的活性氧(ROS)加剧脂肪的蓄积,另一方面,减少机体脂肪的蓄积能显著增加氧化反应的标记物和显著提高机体的抗氧化能力。脂肪形成伴随着活性氧水平(ROS)的增加,同时,过多的活性氧刺激脂肪细胞的生成,抗氧化剂能抑制脂肪的形成[12-14]。据报道,细胞质中Prx I可以预防动脉粥样硬化[15]。PrxⅢ基因敲除小鼠经高脂饲料饲养后,白色脂肪组织大量蓄积,经皮下脂肪提取的ASCs(Adipose tissue-derived stem cells)表达更高的脂肪形成相关基因(aP2,C/EBP,PPAR);通过PrxⅢ在3T3-L1细胞的敲降和过表达,证明了PrxⅢ调节活性氧(ROS)的水平抑制前体脂肪细胞向成熟脂肪细胞的分化和降低脂肪形成相关基因的表达;存在细胞质和线粒体中的PrxⅣ,通过调节脂肪细胞线粒体的活性氧(ROS)抑制脂肪形成[4]。
动物脂肪细胞是由间充质干细胞分化形成前脂肪细胞,在不同的诱导因子下,前脂肪细胞又可以分化成能将甘油三酯储存在胞内单个大脂滴中的白色脂肪细胞和胞内含许多小脂滴、大量线粒体的棕色脂肪细胞[15]。大量的白色脂肪细胞、前脂肪细胞、成纤维细胞、淋巴细胞、巨噬细胞等形成白色脂肪组织,广泛的分布于附睾旁、肾脏、肠系膜周围、网膜等内脏组织周围和皮下,分别称为内脏脂肪和皮下脂肪。内脏脂肪与皮下脂肪相比含有大量的成熟脂肪细胞,更多的免疫和炎性细胞,因此,内脏脂肪高表达TNF-α、MIP-α、IL-6、IL-8、MCP-1、PAI-1 和血管紧张素原等,低表达脂联素等;皮下脂肪高表达瘦素、干扰素诱导蛋白10和APN等[16]。内脏脂肪与皮下脂肪相比,其低胰岛素敏感性,葡萄糖利用率低,脂肪合成和分解活跃,能产生大量的FFA直接进入门静脉循环,运输至肝脏和其他外周组织,促进肝脏的糖异生作用和葡萄糖的输出,降低外周组织对胰岛素的敏感性和血糖升高,诱导胰岛素抵抗的产生[17-18]。综上所述,内脏脂肪的蓄积更容易导致胰岛素抵抗、Ⅱ型糖尿病、血脂紊乱和心血管疾病等代谢综合征的发生,而皮下脂肪的蓄积有助于缓解高脂饮食诱导的胰岛素抵抗、内脏和异位脂肪蓄积[19-20]。
Yasunari Kanda,Takashi Hinata 等[13]的研究结果显示:在间充质干细胞形成脂肪细胞的过程中,PrxⅡ的过量表达抑制脂质的堆积。研究证明,PrxⅡ基因敲除小鼠经高脂饲料饲养9周后,肝脏脂肪的蓄积和皮下脂肪的厚度显著高于野生型小鼠(图3,图4),既内源性的PrxⅡ对脂肪的调节有着重要的生物学功能,但是PrxⅡ如何调节脂肪形成和异常蓄积的具体分子机制,尚需进一步的研究。
[1] 杨昆.夺命肥胖[J].疾病预防,2015(2):27-29.
[2] 吴涛.花色苷对肥胖的干预及其相关机理的研究[D].杭州:浙江大学,2014.
[3] Choi OM,Cho YH,Choi S,et al.The small molecule indirubin-3-oxime activates Wnt/β-catenin signaling and inhibits adipocyte differentiation and obesity[J].Int J Obes(Lond),2014,38(8):1044-1052.
[4] Huh JY,Kim Y,Jeong J,et al.Peroxiredoxin 3 is a key molecule regulating adipocyte oxidative stress,mitochondrial biogenesis and adipokine expression[J].Antioxid Redox Signal,2012,16(3):229-243.
[5] Fernández-Sánchez A,Madrigal-Santillán E,Bautista M,et al,Inflammation,oxidative stress,and obesity [J].Int J Mol Sci,2011,12(5):3117-3132.
[6] De Lorenzo A,Del Gobbo V,Premrov MG,et al,Normalweight obese syndrome:early inflammation [J].Am J Clin Nutr,2007,85(1):40-45.
[7] IshⅡ T,Warabi E,Yanagawa T.Novel roles of peroxiredoxins in inflammation,cancer and innate immunity[J].J Clin Biochem Nutr,2012,50(2):91-105.
[8] Park J,Lee S,Kang SW.2-cys peroxiredoxins:emerging hubs determining redox dependency of Mammalian signaling networks[J].Int J Cell Biol,2014,20:7158-7167.
[9] Han Y H,Kim SU,Kwon TH,et al.Peroxiredoxin Ⅱ is essential for preventing hemolytic anemia from oxidative stress through maintaining hemoglobin stability [J].Biochem Biophys Res Commun,2012,426(3):427-432.
[10] Rinalducci S.Oxidative stress-dependent oligom-eric status of erythrocyte peroxiredoxinⅡ(PrxⅡ)during storage under standard blood banking conditions[J].Biochimie,2011,93(5):845-53.
[11] 王昊乾,孔令祖,申贵男,等.新型萘醌类衍生物对细胞衰老的抑制作用[J].黑龙江八一农垦大学学报,2015,27(4):72-76.
[12] Lee H,Lee YJ,Choi H,et al.Reactive oxygen species facilitate adipocyte differentiation by accelerating mitotic clonal expansion[J].J Biol Chem,2009,284(16):10601-10609.
[13] Kanda Y,Hinata T,Kang SW,et al.Reactiveoxygen species mediate adipocyte differentiation in mesenchymal stem cells[J].Life Sci,2011,89(7-8):250-258.
[14] Samuni Y,Cook JA,Choudhuri R,et al.Inhibition of adipogenesis by Tempol in 3T3-L1 cells[J].Free Radic Biol Med,2010,49(4):667-673.
[15] 贾超.羟喜树碱对不同基因型小鼠内脏脂肪组织的影响[D].济南:山东师范大学,2015.
[16] 刘琼,肖新华.皮下脂肪组织与内脏脂肪组织[J].国际病理科学与临床杂志,2013,33(6):544-547.
[17] Lima-Martínez MM,Blandenier C,Iacobellis G.Epicardial adipose tissue:more than a simple fat deposit[J].Endocrinol Nutr,2013,60(6):320-328.
[18] De Souza Batista CM,Yang RZ,Lee MJ,et al.Omentin plasma levels and gene expression are decreased in obesity[ J].Diabetes,2007,56(6):1655-1661.
[19] 李艳云,史秋梅,王晓珊,等.紫锥菊多糖对内毒素血症小鼠炎症的保护作用[J].河北科技师范学院学报,2015,29(3):8-11.
[20] Hassan M,Latif N,Yacoub M.Adipose tissue:friend or foe[J].Nature Reviews Cardiology,2012(12):689-702.
PeroxiredoxinⅡKnock-out Effect of High-fat Diet on the Fat Accumulation of Mice
He Chao,Han Yinghao,Jin Chenghao
(1.College of Life Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
High-fat diet induced obese mice model and H&E staining were used to detect the effects of PrxⅡdeficiency on weight body,visceral fat,liver and subcutaneous fat of mice.Results showed that there were no statistical significance in weight body,retroperitoneal fat,perirenal fat and epididymal fat pads between HFD-Prx Ⅱ-/-and HFD-Prx Ⅱ+/+mice after high fat diet feeding for 9 weeks.However,the weight of HFD-Prx Ⅱ-/-mice livers were significantly higher than HFD-Prx Ⅱ+/+mice livers(P<0.01).H&E staining showed that,HFD-Prx Ⅱ-/-mice hepatic vacuolization obviously increased compared with the HFD-Prx Ⅱ+/+mice and the thickness of subcutaneous fat were markedly increased in HFD-PrxⅡ-/-mice compared with HFD-PrxⅡ+/+mice(P<0.001).This study demonstrated that Prx Ⅱ knock-out could promote the accumulation of liver fat and subcutaneous fat of mice,provided a foundation of further study the function of PrxⅡin inhibiting abnormal fat accumulation.
High-fat diet;Obesity;Peroxiredoxin Ⅱ knock-out;fat accumulation
R285
A
1002-2090(2017)06-0028-05
10.3969/j.issn.1002-2090.2017.06.008
2016-12-31
黑龙江八一农垦大学研究生创新科研项目(YJSCX2015-Y56)。
何超(1990-),男,黑龙江八一农垦大学生命科学技术学院2014级硕士研究生。
金成浩,男,教授,E-mail:jinchenghao3727@qq.com。
