广西桉树人工林根际土壤微生物群落功能多样性
2017-12-29宋贤冲项东云杨中宁张照远曹继钊
宋贤冲 ,项东云 ,杨中宁 ,张照远 ,曹继钊
(1.广西壮族自治区林业科学研究院,广西 南宁 530002;2.广西南宁桉树林生态系统定位观测研究站,广西南宁 530225;3.广西国有七坡林场,广西 南宁 530225)
广西桉树人工林根际土壤微生物群落功能多样性
宋贤冲1,2,项东云1,2,杨中宁3,张照远1,2,曹继钊1,2
(1.广西壮族自治区林业科学研究院,广西 南宁 530002;2.广西南宁桉树林生态系统定位观测研究站,广西南宁 530225;3.广西国有七坡林场,广西 南宁 530225)
为了揭示广西主要桉树人工林种植区桉树根际土壤微生物群落的功能多样性差异,借助BIOLOG检测法,比较了广西5个地区的桉树根际土壤微生物的群落特征。结果表明:各样点土壤微生物碳源平均颜色变化率排序为梧州样点(WZ)>田林样点(TL)>吴圩样点(WX)>鹿寨样点(LZ)>宁明样点(NM);5个地区的根际土壤中微生物群落碳源利用类型和微生物代谢多样性指数(丰富度和多样性)具有明显的分异,对根际土主成分1起分异作用的碳源为糖类及其衍生物、氨基酸类和羧酸类物质;5个地区的桉树根际土壤微生物群落功能性之间的差异显著,梧州样点土壤微生物活性和功能多样性最高。
桉树人工林;根际土壤;碳源;土壤微生物群落
作为我国三大速生树种之一,桉树已成为广西速生丰产人工林的主要造林树种,成片的桉树林已经成为广西的独特景观与优势[1]。在桉树人工林带来显著经济效益的同时,其土壤“退化”问题也越来越引起人们的关注。土壤微生物是森林生态系统的重要组成,其影响土壤生态系统的养分循环和能量流动[2]。土壤微生物已经作为衡量土壤质量、肥力以及健康程度的重要指标[3]。许多学者对桉树人工林的土壤微生物开展了研究,目前主要集中在不同经营方式[4-6]和立地条件[7]下土壤微生物的变化,对于桉树根际土壤微生物群落的相关研究较少。
根际是土壤与植物生态系统物质交换的活跃界面,也是微生物发育的一个特殊生境,其对外界环境极为敏感[2,8]。根际环境条件的改变,可以引起根际土壤微生物群落结构和功能的改变。吴凡等[9]对不同肥力条件下的桑树根际微生物种群进行分析,发现土壤肥力对根际细菌的种类和数量都有影响,肥沃土壤根际细菌和促生细菌的数量、种类均高于贫瘠土壤。展小云等[10]研究了小叶锦鸡儿根际土壤微生物群落功能多样性特征及其对大气CO2浓度、土壤氮水平和土壤水分等环境因子变化的响应,发现其利用比例较高的碳源为聚合物、糖类和氨基酸且根际土壤微生物群落的功能在很大程度上受到外界环境因子的影响。聂艳丽等[11]发现育苗基质不同,团花根际土壤微生物群落功能多样性也存在显著差异。秦韵婷等[12]研究结果表明,施用PGPR菌能够改变灰枣根际土壤养分和提高微生物总量。近些年,随着人们对森林生态系统重要性认识的加强,关于林地土壤微生物的研究日趋增多[13-14],但关于桉树根际土壤微生物的研究较多仍使用纯培养的方法[15-16]。
本研究选取广西主要的桉树人工林种植区,通过对不同区域的桉树人工林根际土壤微生物对Biolog Eco板碳源利用情况的测定分析,从不同碳源利用能力的大小来研究桉树人工林根际土壤微生物功能多样性。研究结果为揭示不同桉树种植区域根际土壤微生物群落特征的差异提供依据,而且为揭示桉树人工林生态系统“土壤—植物—微生物”三者之间的关系奠定基础。
1 材料与方法
1.1 采样点概况
采样点分别位于广西的东部(梧州,WZ)、西部(田林,TL)、南部(宁明,NN)、北部(鹿寨,LZ)和中部(吴圩,WX)的主要桉树人工林种植区。梧州采样点,25°11′N,110°58′E,属典型的亚热带湿润季风气候区,阳光充足,雨水充沛,资源丰富;地貌特征主要为丘陵、中低山为主,土壤主要以砖红壤或红壤为主,土层深厚,疏松。田林采样点,24°56′N,105°92′E,亚热带季风气候区,温度较高,热量丰富,雨量适中,气候温暖;土壤为砂页岩发育的砖红性红壤,土层厚度为80~140 cm。宁明采样点,21°91′N,107°08′E,属于北热带季风区,光照充足,雨量充沛;成土母岩以砂岩、砂页岩、紫色页岩为主,土壤主要为赤红土壤。鹿寨采样点,24°44′N,109°52′E,亚热带季风气候区,光照充足,雨量充沛;地貌以缓坡丘陵地貌为主,土壤为砂岩、砂页岩发育的红壤、山地黄红壤。吴圩采样点,22°32′N,107°86′E,属南亚热带季风气候,阳光充足,雨量充沛;地貌上属于低丘地形,土壤类型为砂页岩发育形成的赤红壤,成土母岩为砂页岩。采样点林分均为桉树2年生新造林。
1.2 土样的采集
2013年8月—10月,分批次进行土壤样品采集工作。土壤采集方法参照林业行业标准LY/T 1852—2011,在林地的上、中、下坡分别采取“之”字形5点取样法,采集桉树根际土,每个点取样量大体一致,5个点的土样混成一个混合样。每个样点共采集混合土样3个。根际土壤采样方法参考宋贤冲等[5]的方法,在树木周围,多点挖取0~20 cm土层内的根系,先抖落根系上的大块不含根系的土壤,然后取近根系表面的细粒土壤,装入塑料袋内混匀。
1.3 研究方法
微生物群落多样性测定应用BIOLOG方法,测定时间为2013年11月。10 g新鲜土壤加入100 mL无菌的生理盐水溶液,在摇床上振荡15 min,然后将土壤样品梯度稀释至10-3,再从中取150 μL该悬浮液接种到Eco板的每一个孔中,最后将接种好的板置于28℃的恒温培养箱中培养,培养周期为144 h,每隔24 h在BIOLOG读数仪进行读数。
每孔的平均颜色变化率(Average well color development,r)计算方法[17]如下:

式中:C为每个有培养基孔的光密度值;R为对照孔的光密度值;n为培养基种类,Eco板n值为31,C-R≤0的孔在计算中记为0[18]。丰富度指数指被利用碳源的总数目,微孔的光密度值≥0.2,则认为是阳性值并计入微生物群落的丰富度S[19]。多样性指数采用Shannon-Weinner指数(H′)[20]:

式中:Pi为有培养基的孔与对照孔的光密度值差与整板总差的比值,即:Pi= (C-R)/Σ(C-R)。
采取固定AWCD值的方法来消除接种密度带来的差异[21]。因此,本研究采用培养96 h的光密度值来进行主成分分析、单种培养基与主成分得分系数的相关分析、丰富度和多样性指数的分析。统计分析采用Excel和SPSS17.0进行。
2 结果与分析
2.1 土壤微生物碳源平均颜色变化率
Biolog Eco平板的平均颜色变化率(AWCD)是反映微生物群落利用某一碳源能力的重要指标[20]。由图1可知,随着培养时间的延长,各样点平均颜色变化率即土壤微生物利用碳源的能力呈上升趋势,各样点土壤微生物碳源平均颜色变化率排序为梧州样点(WZ)>田林样点(TL)>吴圩样点(WX)>鹿寨样点(LZ)>宁明样点(NM)。

图1 桉树人工林根际土壤平均颜色变化率Fig. 1 Average well color development (AWCD) in rhizosphere soil of different eucalyptus plantations
2.2 碳源利用类型的主成分分析
5个地区桉树人工林土壤微生物群落代谢多样性类型的比较结果可以提供广西不同桉树种植区域土壤微生物群落的信息。主成分分析结果表明,5个地区的根际土壤中微生物群落具有明显的分异,其中田林、梧州样点与其它样点在主成分1方向有较大的分异(位于坐标轴右侧),而梧州根际土的代谢多样性类型具有较大的变异(分散的数据点)(见图2)。各样点在主成分2方向的分异不明显,但宁明、鹿寨、田林、吴圩样点较为集中,数据重现性好。
通过对根际土壤中与主成分1相关显著的碳源进行分析,结果表明对根际土主成分1起分异作用的主要碳源分别为糖类及衍生物、氨基酸类和羧酸类物质。
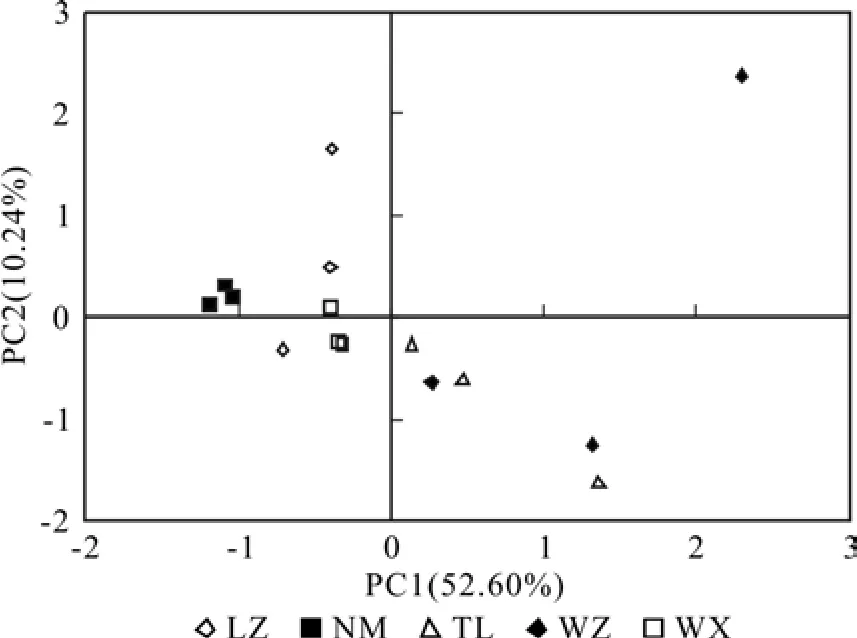
图2 桉树人工林根际和非根际土壤微生物碳源利用类型的主成分分析Fig. 2 Principal component analysis of carbon utilization pro files from rhizosphere soil of different eucalyptus plantations
2.3 被利用碳源的丰富度和多样性指数
被利用碳源丰富度指数和多样性指数表示在平均颜色变化率一致的情况下土壤微生物群落利用碳源类型的多少,即功能多样性[21]。根际土壤中丰富度指数和多样性指数均为梧州样点最高,宁明样点最低 (见表1)。丰富度和多样性指数分析结果与平均颜色变化率和主成分分析结果一致。
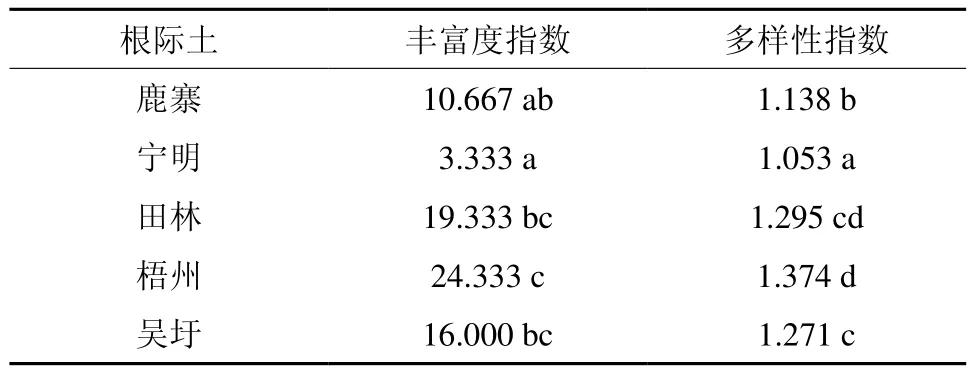
表1 根际土和非根际土被利用碳源丰富度和多样性指数†Table 1 Richness and diversity of utilized carbon sources for rhizosphere soil
3 讨 论
土壤微生物在生态系统中起着重要的作用,可以作为衡量土壤健康程度的指标[22]。植物在生长过程中,凋亡的根系以及其分泌的化合物,这些都为根际微生物的生长繁殖提供了天然的营养物质。本研究中桉树根际土壤微生物利用碳源的总量随着培养时间的延长呈逐渐增加的趋势,这与其它研究[5,23]一致。
根际微生物生物多样性及数量受到植物种类、年龄、根际内其它生物体和地上部分生物多样性等因素的影响[24]。本研究结果表明,不同样点根际土壤平均颜色变化率存在差异,各样点土壤微生物碳源平均颜色变化率排序为梧州样点(WZ)>田林样点(TL)>吴圩样点(WX)>鹿寨样点(LZ)>宁明样点(NM)。
土壤微生物碳源利用类型的主成分分析可以揭示不同样点在主成分1和主成分2的分异程度。主成分分析结果表明,5个样点的根际土壤中微生物群落具有明显的分异,其中田林根际土、梧州样点与其它样点在主成分1方向有较大的分异(位于坐标轴右侧),梧州样点根际土碳源利用多样性类型具有较大的变异;各样点在主成分2方向的分异不明显。由于各样点在主成分2方向分异不明显,故后续选取主成分1来比较相关显著的碳源。
不同样点桉树根际环境存在差异,其土壤微生物群落利用碳源类型也不同。宋贤冲等[5]对不同萌芽代数桉树根际土壤微生物群落功能进行研究,发现不同萌芽代数桉树根际土壤微生物群落具有明显的分异,对分异其主要作用的碳源类型分别为羧酸类、多聚物类和氨基酸类。张海涵等[25]研究了不同生态条件下油松菌根根际土壤微生物群落特征,发现对安塞油松和商南油松菌根根际土壤微生物群落起分异作用的主要碳源分别为糖类、羧酸类和氨基酸。本研究结果表明,对根际土主成分1起分异作用的主要碳源分别为糖类及衍生物、氨基酸类和羧酸类物质。衣康酸和2-羟基苯甲酸为本研究根际特有相关显著羧酸。有研究表明,2-羟基苯甲酸等酚酸物质是连作土壤中的植物根系分泌物[26],主要来自作物残体的分解[27],其对杉木具有自毒作用[28],由此推断桉树根际土壤微生物可能具有降解酚酸和自身代谢产物、避免自毒作用的能力。糖类及衍生物是自然界较丰富且微生物较容易利用的碳源,而氨基酸是土壤有机氮的重要组成部分,不同样点桉树根际土壤微生物群落利用碳源能力的差异可能与该样点土壤养分供应能力有关。
被利用碳源的丰富度和多样性反映土壤微生物群落的组成结构和多样性。根际土壤中丰富度指数和多样性指数均为梧州样点最高,宁明样点最低。丰富度和多样性指数分析结果与平均颜色变化率和主成分分析结果一致。梧州样点根际土壤碳源利用类型的丰富度和多样性均最高,表明该样点土壤微生物活性和功能多样性最高。
[1] 黄国勤,赵其国. 广西桉树种植的历史、现状、生态问题及应对策略[J].生态学报,2014,34(18):5142-5152.
[2] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010:170-171.
[3] 王 轶. 长期施肥对温室和大田土壤微生物的影响[D].北京:中国农业大学,2014.
[4] 张明慧,黄宝灵,程 亮,等. 桉树相思树混交林地土壤微生物特征研究[J]. 广西农业科学,2009(6):681-685.
[5] 宋贤冲,杨中宁,曹继钊,等. 萌芽更新对桉树根际土壤微生物群落功能多样性的影响[J]. 桉树科技,2014(3):36-40.
[6] 苏 丹, 张 凯, 陈法霖, 等.施氮对不同有机碳水平桉树林土壤微生物群落碳代谢的影响[J].生态学报,2015,35(18):5940-5947.
[7] 梁理勇. 雷州林业局桉树人工林地土壤微生物的分布规律[J].中南林学院学报,2004,24(4):59-61.
[8] Lynch J P. Root architecture and plant productivity [J]. Plant Physiology, 1995, 109: 7-13.
[9] 吴 凡,李传荣,崔 萍,等.不同肥力条件下桑树根际微生物种群分析[J].生态学报,2008, 28 (6):2674-2681.
[10] 展小云,吴冬秀,张 琳,等.小叶锦鸡儿根际微生物群落功能多样性对环境变化的影响[J].生态学报,2010, 30(12):3087-3097.
[11] 聂艳丽,陆 斌,刘金凤,等. 不同育苗基质的团花根际微生物群落功能多样性特征[J]. 中南林业科技大学学报,2014,34(1): 7-11,48.
[12] 秦韵婷,李建贵,郭艺鹏,等. PGPR对灰枣土壤养分及微生物数量影响的主成分分析[J]. 经济林研究,2015,33(3):39-43.
[13] 杨 琼,谭凤仪,吴苑玲,等.不同林龄海桑林和无瓣海桑林根际微生物特征[J].生态学杂志,2014, 33 (2):296-302.
[14] 郭春兰,张 露,叶素琼,等. 赣西油茶人工林土壤微生物群落的多样性[J]. 经济林研究,2015,33(1):25-32.
[15] 杨远彪.连栽桉树根际微生物分析及固氮菌的研究[D].南宁:广西大学林学院,2008.
[16] 袁耀彬.桉树根际土壤功能菌多样性与抗青枯病的关系研究[D].桂林:广西师范大学,2012.
[17] 陈晓倩, 殷浩文.微生物群落多样性分析方法的进展[J].上海环境科学,2003, 22(3):213-217.
[18] Garland J L. Analytical approaches to the characterization of samples of microbial communities using patterns of potential C source utilization [J]. Soil Biology and Biochemistry, 1996, 28: 213-221.
[19] Ratcliff A W, Busse M D, Shestak C J. Changes in microbial community structure following herbicide (glyphosate) additions to forest soils[J]. Applied Soil Ecology, 2006, 34: 114-124.
[20] 郑 华,欧阳志云,王效科,等.不同森林恢复类型对土壤微生物群落的影响[J].应用生态学报,2004, 15(11):2019-2024.
[21] 郑 华,欧阳志云,方治国,等.BIOLOG在土壤微生物群落功能多样性研究中的应用[J].土壤学报,2004, 41(3):456-461.
[22] 任丽娜,王海燕,丁国栋,等.森林生态系统土壤健康评价研究进展[J].世界林业研究,2011, 24(5):1-6.
[23] 卢鑫萍,杜 茜,闫永利,等.盐渍化土壤根际微生物群落及土壤因子对AM 真菌的影响[J].生态学报,2012,32(13):4071-4078.
[24] Prosser J. Molecular and functional diversity in soil microorganisms[J]. Plant Soil, 2002, 244: 9-17.
[25] 张海涵 ,唐 明 ,陈 辉 ,等 .不同条件下油松 (Pinus tabulaeformis)菌根根际土壤微生物群落[J].生态学报,2007,27(12): 5463-5470.
[26] 刘 军,温学森,郎爱东.植物根系分泌物成分及其作用的研究进展[J].食品与药品,2007, 9(3):63-65.
[27] Patrick Z A. Phytotoxic substance in arable soils associated with decomposition of plant residues[J]. Phytopathology, 1963,53:152-161.
[28] 杨 梅,林思祖,黄燕华,等.邻羟基苯甲酸胁迫下杉木叶片游离氨基酸的变化特征[J].东北林业大学学报,2007, 35(2):40-41, 63.
Microbial functional diversity of rhizosphere soil ofEucalyptusplantation in Guangxi
SONG Xianchong1,2, XIANG Dongyun1,2, YANG Zhongning3, ZHANG Zhaoyuan1,2, CAO Jizhao1,2
(1.Guangxi Zhuang Autonomous Region Forestry Research Institute, Nanning 530002, Guangxi, China; 2.Nanning Eucalyptus Forest Ecosystem Observation and Research Station of Guangxi, Nanning 530225, Guangxi, China; 3. Guangxi Qipo Stateowned Forest Farm, Nanning 530225, Guangxi, China)
In order to reveal the functional diversity of microbial community of rhizosphere soil in the mainEucalyptusplantations,five different regions of Guangxi were measured by Biolog assays. The results showed that the rank of average well color development in five sampling site was Wuzhou>Tianlin>Wuxu>Luzhai>Ningming. Carbon source utilization types of rhizosphere soil and the richness and diversity indexes have signi ficant differentiation in five sampling sites. The carbon sources which produced the differentiation of rhizosphere soil were carbohydrates and its derivates, amino acids and carboxylic acids. The functional diversity of microbial community of rhizosphere soil in five sampling sites was signi ficant difference, soil microbial activities and functional diversities in Wuzhou was the highest.
Eucalyptusplantation; rhizosphere soil; carbon source; soil microbial community
S792.39;S718.8
A
1673-923X(2017)01-0058-04
10.14067/j.cnki.1673-923x.2017.01.011
2015-10-13
国家林业局公益性行业科研专项项目(201204101-11);广西林业科技项目(桂林科字[2014]15号)
宋贤冲,博士生,工程师 通讯作者:曹继钊,教授级高工;E-mail: jizhaocao@163.com
宋贤冲,项东云,杨中宁,等. 广西桉树人工林根际土壤微生物群落功能多样性[J].中南林业科技大学学报,2017, 37(1):58-61.
致谢:感谢广西国有七坡林场、广西国有黄冕林场、广西国有派阳山林场、广西乐里林场、广西苍梧林场提供林地支持;感谢广西大学生命科技学院冯家勋教授课题组在BIOLOG分析上给予的指导和帮助!
[本文编校:谢荣秀]
