基于超高效液相色谱-质谱的胶质瘤患者血浆代谢组学研究
2017-12-27左莉华丁大领师莹莹李卓伦徐昙烨刘丽伟张晓坚
左莉华,丁大领,沈 燕,师莹莹,孙 志,李卓伦,周 霖,徐昙烨,刘丽伟,张晓坚
(1.郑州大学第一附属医院 药学部,河南 郑州 450052;2.郑州大学第一附属医院 神经外科,河南 郑州 450052;3.郑州大学第一附属医院 检验科,河南 郑州 450052)
研究报告
基于超高效液相色谱-质谱的胶质瘤患者血浆代谢组学研究
左莉华1*,丁大领2,沈 燕3,师莹莹1,孙 志1,李卓伦1,周 霖1,徐昙烨1,刘丽伟1,张晓坚1*
(1.郑州大学第一附属医院 药学部,河南 郑州 450052;2.郑州大学第一附属医院 神经外科,河南 郑州 450052;3.郑州大学第一附属医院 检验科,河南 郑州 450052)
采用超高效液相色谱-四极杆-静电场轨道阱质谱(UHPLC-Q-Orbitrap HRMS)技术对胶质瘤患者和正常对照人群的血浆进行代谢轮廓分析,筛选胶质瘤代谢标志物,为其发病机制阐明和临床早期诊断提供科学依据。通过对UHPLC-Q-Orbitrap HRMS采集得到的谱图进行峰识别、峰匹配和去噪等处理后,应用主成分和正交偏最小二乘-判别分析法对代谢组学数据进行统计分析,筛选VIP>1.0及P<0.05的差异代谢物,并进一步对其诊断能力进行评价。结果显示,胶质瘤患者的血浆代谢轮廓发生明显变化,发现并鉴定得到10个差异代谢物,其中亮氨酸、缬氨酸、色氨酸、胆碱和牛磺酸在胶质瘤患者血浆中含量降低,组氨酸、柠檬酸、乳酸、肌酸和丙酮酸含量升高,与正常对照组比较具有显著性差异(P<0.05),提示氨基酸和能量等代谢异常可能对胶质瘤的发生发展具有重要影响。此外,各差异性代谢物对胶质瘤均显示出较好的诊断能力(AUC>0.8),可作为潜在诊断标志物。
胶质瘤;超高效液相色谱-四极杆-静电场轨道阱质谱技术;代谢组学;诊断标志物
神经胶质瘤(Glioma)简称胶质瘤,是一种发生于神经外胚层的原发性颅内恶性肿瘤,约占所有颅内肿瘤的45%,其恶性程度高且发病率逐年递增[1-2]。尽管近年来胶质瘤在临床治疗和分子诊断方面取得了重大进展[3-5],但胶质瘤发病机制及患者预后仍不明确,虽然有积极的外科手术以及辅助放疗和化疗,其复发仍不可避免,尤其是胶质母细胞瘤患者2年的存活率仅为10%[6-7]。因此,临床早期诊断和及早治疗是降低胶质瘤死亡率的关键。目前临床上缺乏胶质瘤的特异性诊断标志物,其诊断主要依靠影像学检查和病理检查,而影像学检查不具有针对性,病理学检查会因组织标本取材的随机性、不同资历医师的诊断主观性而导致结果有所偏差[8-10],这些传统方法特异性差且易受主观经验影响,因此发现早期胶质瘤特异标志物对于临床诊断至关重要。
代谢组学是通过高通量分析手段如气相色谱-质谱联用(GC-MS)技术、核磁共振(NMR)技术、毛细管电泳质谱联用(CE-MS)技术等研究机体受扰动后内源性代谢物变化的一门学科[11]。近年来,随着高分辨质谱的快速发展,超高效液相色谱-四极杆-静电场轨道阱质谱(UHPLC-Q-Orbitrap HRMS)由于具有质量分辨率高、灵敏度高的特点在代谢组学研究中越来越受到人们的关注[12-14],Liu等[14]基于UHPLC-Q-Orbitrap-HRMS技术对健康女性饮用蔓越莓汁前后的血浆进行代谢组学研究,为蔓越莓有益于人体健康的物质基础提供了理论验证。本研究首次采用UHPLC-Q-Orbitrap HRMS技术探究胶质瘤血浆代谢指纹谱,结合多元统计分析方法进行非靶向代谢组学研究,寻找胶质瘤疾病早期诊断的生物标记物,并利用受试者工作曲线(ROC)评价生物标志物的诊断识别能力,为其发病机制阐明和临床早期诊断提供科学依据。
1 实验部分
1.1 仪器与试剂
Q-Exactive 超高效液相色谱-高分辨质谱联用仪器(美国Thermo Fisher Scientific公司);Vortex-Genie型涡旋振荡器(美国 Scientific Industries公司);BX7200HP台式超声波清洗器(上海新苗医疗器械制造有限公司);Heraeus Fresco 17 Centrifuge离心机、Forma 88000 Series超低温冰箱(美国Thermo Fisher公司)。
乙腈、甲酸(均为色谱纯,美国Thermo Fisher公司),实验用水为娃哈哈纯净水,其他试剂均为分析纯。
1.2 样品收集及制备
以磁共振成像检查结果及术后病理诊断为依据,收集2016年12月至2017年5月在郑州大学第一附属医院收入住院的胶质瘤患者28例(男18例,女10例,平均年龄54岁),所有胶质瘤患者均无其他代谢性疾病。收集健康志愿者26例(男15例,女11例,平均年龄53岁)。
所有血样采集于患者清晨空腹状态下,每个研究对象采集静脉血3 mL置于EDTA抗凝采血管中,采集后于4 ℃条件下3 000 r/min离心10 min,吸取上清(血浆),立即于-80 ℃冰箱内保存备用。
样品处理:血浆样品检测前于冰上解冻,取100 μL血浆样品,加入300 μL 4 ℃预冷的乙腈,涡旋5 min混匀,于4 ℃条件下13 000 r/min离心10 min,取上清随机进样分析。
质控(Quality control,QC)样本的制备:从所有血浆样品中各吸取10 μL,涡旋5 min混匀后,按照上述“样品处理”方法进行QC样品前处理。为保证数据的可靠性,QC样本穿插在所有样本数据采集过程中,每9个样本插入1个QC样本。
1.3 UHPLC-Q-Orbitrap HRMS分析
1.3.1色谱条件Waters ACQUITY UPLC HSS T3柱(100 mm×2.1 mm,1.8 μm);流动相:A 为乙腈,B 为0.1% 甲酸水。梯度洗脱程序:0~1.0 min,5% A;1.0~5.0 min,5%~40% A;5.0~7.0 min,40%~50% A;7.0~9.0 min,50%~80% A;9.0~15.0 min,80% A;15.0~18.0 min,80%~100% A;18.0~22.0 min,100% A;22.0~25.0 min,5% A;流速0.2 mL/min,进样量5 μL;柱温40 ℃。
1.3.2质谱条件采用可加热的电喷雾离子源(HESI),离子源温度350 ℃,辅助气温度300 ℃,辅助气流速10 μL/min,离子传输管温度320 ℃;正离子模式:鞘气流速40 μL/min,喷雾电压3.50 kV;负离子模式:鞘气流速38 μL/min,喷雾电压2.80 kV。质谱分析扫描模式:Full scan/dd-MS2,扫描范围m/z80.00~1 200.00,二级质谱分辨率为17 500,质荷比窗口宽度为2,碰撞能梯度为20、30、40 eV。
1.4 数据处理
血浆样品用 UHPLC-(±) ESI MS 进行检测,得到样品的总离子流色谱图,将检测得到的原始数据导入SIEVE 1.3软件对各组血浆样品图谱进行色谱峰对齐、基线校正以及峰面积归一化预处理。经过预处理的数据导入SIMCA 14.0软件进行多元统计分析,建立主成分分析和正交偏最小二乘法判别分析模型,通过得分图比较两组差异。所有数据运用SPSS 21.0进行两独立样本t检验,将重要变量性投影(Variable importance in projection,VIP)值大于1.0及P<0.05的变量作为潜在的差异标志物,将潜在差异化合物的二级谱图与Metlin、HMDB、KEGG等网络数据库进行比对鉴定。

表1 研究人群的人口统计学和临床病理特征Table 1 Demographic and clinical pathological characteristics of study population
2 结果与讨论
2.1 受试者临床病理特征
所有胶质瘤患者均进行影像学及病理学检查确诊,受试者的临床病理特征见表1。
2.2 血浆代谢轮廓分析
采用UHPLC-Q-Orbitrap HRMS分别在正负离子模式下对血浆样本进行检测,图1为随机选取的胶质瘤患者和健康人的血浆代谢指纹图谱,两组间代谢轮廓在正负离子模式下均有明显的差异,表明胶质瘤患者体内存在一定的代谢紊乱。
2.3 血浆模式识别分析
采用UHPLC-Q-Orbitrap HRMS对血浆进行代谢组学分析时,为考察方法稳定性,每分析9个血浆样本穿插1个QC样本进行检测,通过QC样本的稳定性来监测结果的可靠性。QC样本在正负离子模式下的PCA模型显示所有QC样本均在2倍SD范围内,说明分析方法稳定性好。
对胶质瘤组与对照组两组血浆进行模式识别,正负离子模式下两组间的PCA模型显示,沿PC1轴即第一主成分两组可明显区分(图2A和图2D),表明胶质瘤患者血浆代谢物相比于健康人有显著差异;OPLS-DA模型去除与样本分类无关因素,显示两组样本点完全分离,组内样本点趋于集中(图2B和图2E),表明胶质瘤患者体内代谢网络发生明显变化;在正离子模式下,OPLS-DA模型相关参数R2Y和Q2分别为0.992和0.997,负离子模式下R2Y和Q2分别为0.995和0.987,均大于0.5,说明模式识别建立成功,具有很好的拟合及预测能力(图2C和图2F)。
2.4 潜在标志物鉴定
根据精确分子量、二级质谱碎片信息和保留时间与数据库或标准品的比较进行潜在标记物的鉴定。以负离子模式下的离子m/z191.019 70 为例,说明生物标记物的鉴定过程。负离子模式下,该离子的提取离子色谱图及在保留时间1.61 min 时的质谱图如图3A 和图3B 所示。将精确分子量与数据库中化合物进行比对,初步鉴定该化合物为柠檬酸。如图3C,与标准品的二级质谱结果比对,两者完全一致。根据以上信息,此生物标记物被鉴定为柠檬酸。其它化合物的鉴定同上所述,但一些化合物未能完全定性,表2列出了潜在生物标记物的鉴定结果。图4为鉴定的潜在标志物在两组间的变化趋势热图,红色表示代谢物表达量升高,绿色表示代谢物表达量降低,直观显示出两组间代谢物的变化趋势。
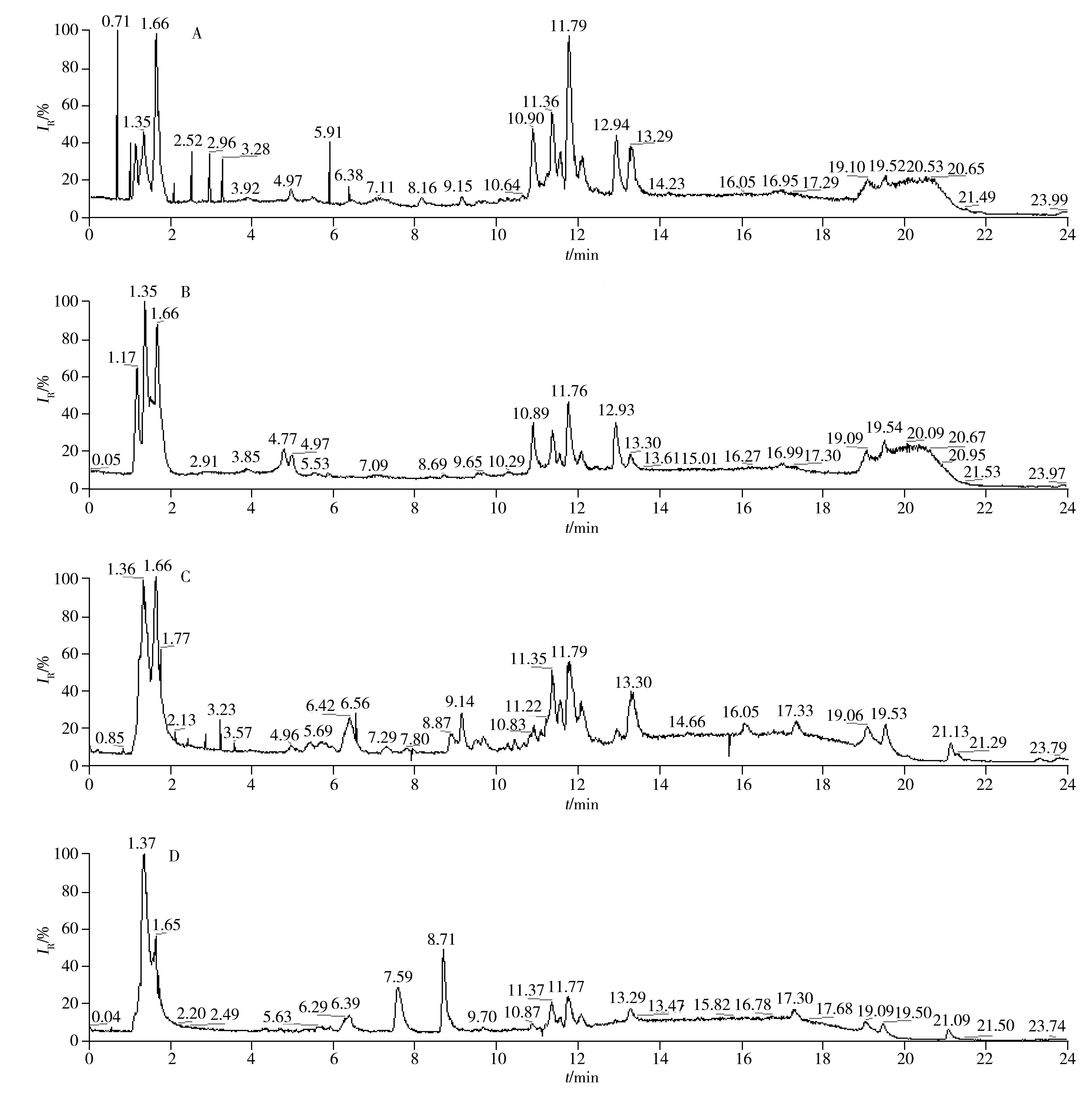
图1 胶质瘤患者与健康者的血浆代谢指纹谱Fig.1 Representative metabolic fingerprinting spectra of plasma from glioma patient and healthy controlESI+ mode:A.healthy control,B.glioma patient; ESI-mode:C.healthy control,D.glioma patient
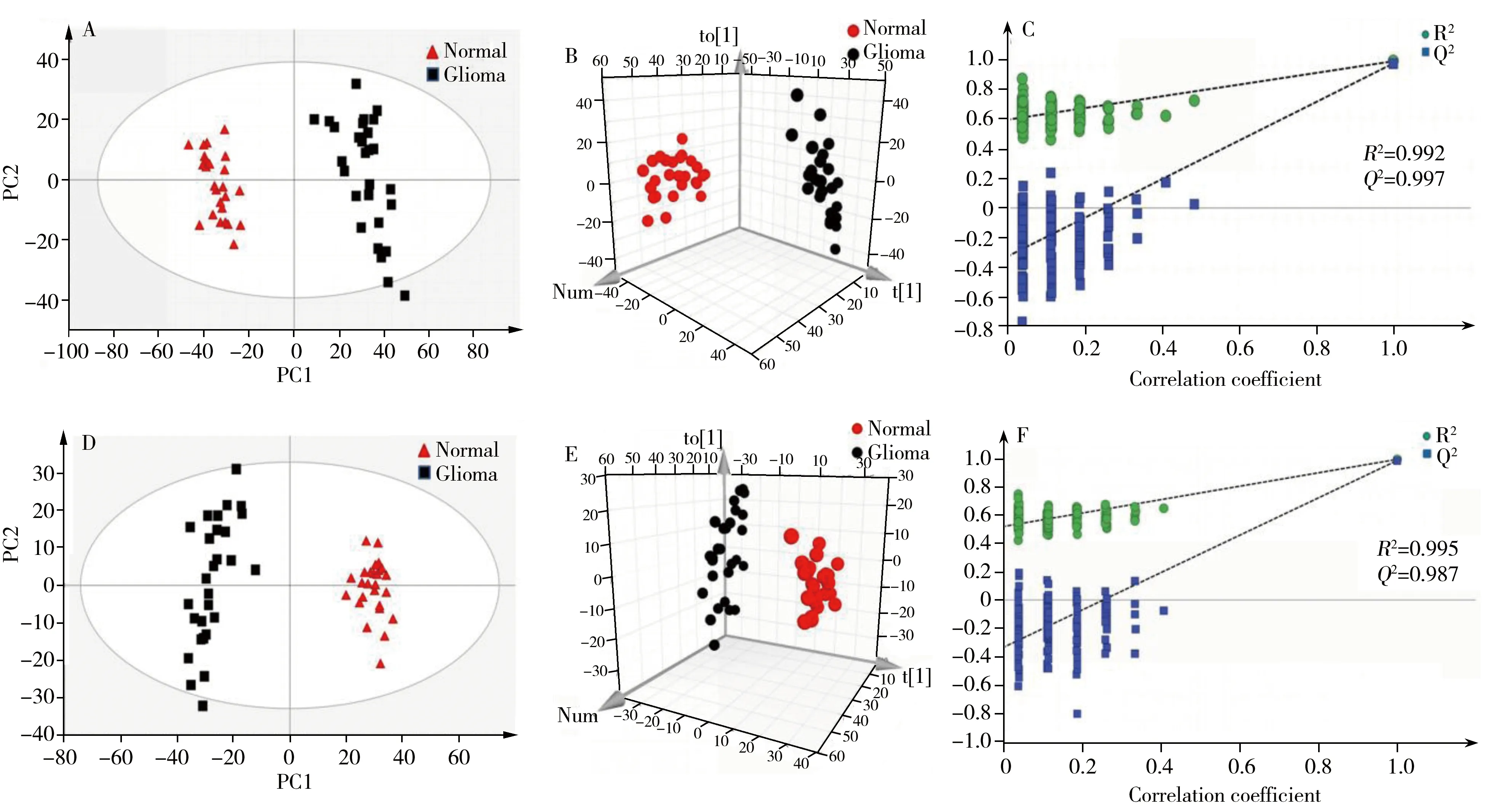
图2 正负离子模式下胶质瘤患者与健康者血浆LC-MS谱的多元统计分析Fig.2 Multivariate statistical analysis of LC-MS plasma spectra between gliomas and healthy controls in positive mode and negative modeESI+ mode:A.PCA plot,B.OPLS-DA prediction model,C.permutation analysis;ESI- mode:D.PCA plot,E.OPLS-DA prediction model,F.permutation analysis
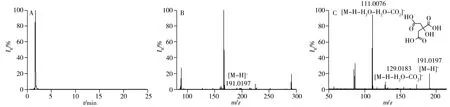
图3 负离子模式下柠檬酸的提取离子色谱图(A)、一级质谱图(B)与二级质谱图(C) Fig.3 Extraction ion chromatogram(A),full MS spectrum(B) and MS/MS spectrum(C) of citric acid in negative ion mode
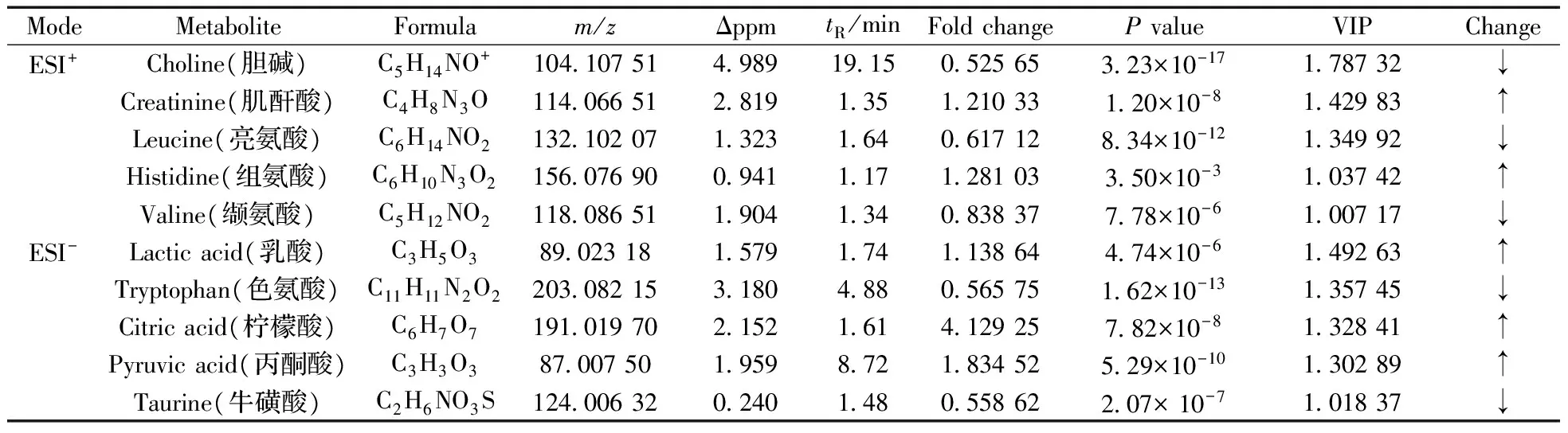
表 2 胶质瘤患者的血浆差异代谢物Table 2 Differential metabolites identified between glioma patients and healthy controls
2.5 血浆标志物的诊断能力
对筛选鉴定出的10个差异性标志物作受试者工作曲线(Receiver operator characteristic,ROC),用于评价各差异代谢物对胶质瘤的诊断识别能力(图5),曲线下面积(AUC)在大于0.5时方具有诊断价值,越接近1表明诊断效果越好。AUC在0.5~0.7之间诊断准确性较低,在0.7~0.9之间具有较好的准确性,在0.9以上具有极高的准确性。鉴定出的10个代谢物的ROC曲线下面积均大于0.8,表明各差异性代谢物对胶质瘤具有很好的辨别能力,研究发现胆碱与柠檬酸对胶质瘤患者具有很高的识别能力(AUC=1),显示胶质瘤患者体内存在显著的胆碱与柠檬酸的代谢异常。

图4 差异性代谢物热图分析Fig.4 The heat map of verified differential metabolites
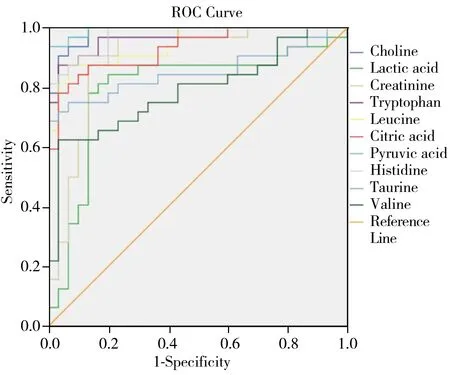
图5 10个差异代谢物的受试者工作曲线Fig.5 The receiver operating curves of 10 differential metabolites
2.6 胶质瘤潜在标志物的生物学意义
相比于健康受试者,胶质瘤患者体内氨基酸代谢存在明显紊乱,其中色氨酸、亮氨酸和缬氨酸与胶质瘤的发生呈负相关,组氨酸与胶质瘤的发生呈正相关。亮氨酸和缬氨酸的含量显著下降,这两者为体内支链氨基酸(Branched-chain amino acid,BCAA),与神经递质的合成、蛋白降解关系密切。Tönjes 等[15]研究发现,神经功能障碍与BCAAs分解代谢的下调密切相关。也有研究发现随着胶质瘤恶性程度增高,分解BCAAs的支链氨基酸氨基转移酶1的表达也逐渐增高[16]。针对BCAA的分解代谢以及支链氨基酸氨基转移酶1的表达,将有望为诊治胶质瘤找到关键代谢通路以及治疗靶点。
近年来,人们越来越关注色氨酸在脑胶质瘤中的异常代谢现象。色氨酸作为人体必需氨基酸之一,其在维持机体免疫细胞活性及增殖中具有重要作用。本研究结果显示,胶质瘤患者体内色氨酸含量显著降低,胶质瘤细胞通过2,3-双加氧酶(TDO)促进色氨酸的大量降解,一方面色氨酸缺乏会诱导免疫细胞发生凋亡;另一方面色氨酸代谢产生犬尿氨酸,有研究[17]发现犬尿氨酸会与肿瘤微环境中的免疫细胞芳香烃受体(AHR)结合诱导T细胞凋亡并抑制其他免疫细胞功能。Bessede等[18]发现TDO能将色氨酸转化成AHR的一个内生配体,从而直接作用于神经胶质瘤细胞上导致肿瘤的发生。
在能量代谢方面,乳酸、柠檬酸、丙酮酸、肌酸在胶质瘤患者体内表达量显著升高,这些物质为神经细胞提供能量。大量研究认为,大多数肿瘤细胞都会发生Warburg效应[19-20],即在线粒体氧化供能不足时,将进行有氧糖酵解,会产生大量乳酸改变肿瘤微环境,然而肿瘤细胞糖酵解的机制目前仍不清楚,还需后续大量研究进行探索。
胶质瘤患者体内胆碱含量的降低会引起体内脂质代谢紊乱,由甘油二酯和活化的胆碱合成的磷脂酰胆碱是细胞膜磷脂的主要成分之一,因此胆碱含量的变化能够反映出细胞的受损程度以及免疫能力,并能够调控细胞凋亡,该物质含量发生变化可表明胶质瘤患者体内发生代谢异常。本研究中也发现牛磺酸在胶质瘤患者血浆中表达量降低,牛磺酸是人体的一种必需氨基酸,亚牛磺酸作为牛磺酸的氧化产物,能够促进胶质瘤的发生发展,有研究发现其与胶质瘤恶性程度呈正相关[21],亚牛磺酸及牛磺酸代谢通路将是未来胶质瘤发病机制研究的重要方向。
3 结 论
本研究首次采用UHPLC-Q-Orbitrap HRMS技术进行胶质瘤血浆代谢组学研究,寻找到潜在的胶质瘤早期诊断标志物,为胶质瘤早期筛查提供了科学依据,也为临床上胶质瘤的发病机制研究及治疗靶点探索提供了新方向。
[1] Diao B,Liu Y,Zhang Y,Yu J,Xie J,Xu G Z.Mol.Med.Rep.,2017,15(4):2074-2082.
[2] Wen P Y,Reardon D A.Nat.Rev.Neurol.,2016,12(2):69-70.
[3] Vranic A.RadiolOncol.,2011,45(3):159-165.
[4] Shirai K,Chakravarti A.ExpertRev.AnticancerTher.,2011,11(12):1935-1944.
[5] Van Meir E G,Hadjipanayis C G,Norden A D,Shu H K,Wen P Y,Olson J J.Ca.CancerJ.Clin.,2010,60(3):166-193.
[6] Uhm J H,Porter A B.Mayo.Clin.Proc.,2017,92(6):995-1004.
[7] Zhang G B,Cui X L,Sui D L,Ren X H,Zhang Z,Wang Z C,Lin S.J.Neuro.Oncology,2013,113(2):251-258.
[8] Li D S,Sun X L,Shen B Z.RadiolPratice(李道爽,孙夕林,申宝忠.放射学实践),2015,6:626-628.
[9] Network T C G A.NewEngl.J.Med.,2015,372(26):2481-2498.
[10] Bent M J V D.ActaNeuropathol,2010,120(3):297-304.
[11] Lu W,Su X,Klein M S,Lewis I A,Fiehn O,Rabinowitz J D.Annu.Rev.Biochem.,2017,86(1):277-304.
[12] Dunn W B,Broadhurst D,Brown M,Baker P N,Redman C W,Kenny L C,Kell D B.J.Chromatogr.B,2008,871(2):288-298.
[13] Dervilly-Pinel G,Weigel S,Lommen A,Chereau S,Rambaud L,Essers M,Antignac J P,Nielen M W,Le Bizec B.Anal.Chim.Acta,2011,700(1/2):144-154.
[14] Liu H,Garrett T J,Su Z,Khoo C,Gu L.J.Nutr.Biochem.,2017,45:67-76.
[15] Tönjes M,Barbus S,Park Y J,Wang W,Schlotter M,Lindroth M,Pleier S V,Bai A H C,Karra D,Piro R M,Felsberg J,Addington A,Lemke D,Weibrecht I,Hovestadt V,Rolli C G,Campos B,Turcan S,Sturm D,Witt H,Chan T A,Herold-Mende C,Kemkemer R,König R,Schmidt K,Hull W E,Pfister S M,Jugold M,Hutson S M,Plass C,Okun J G,Reifenberger G,Lichter P,Radlwimmer B.Nat.Med.,2013,19(7):901-908.
[16] Zhang G B,Zhang J,Xu H Z,Zhou Y Q,Cheng S,Liu F S.Chin.J.Neurosurge.(张国滨,张晋,徐恒周,周益强,程森,刘福生.中华神经外科杂志),2015,31(12):1259-1262.
[17] Opitz C A,Litzenburger U M,Sahm F,Ott M,Tritschler I,Trump S,Schumacher T,Jestaedt L,Schrenk D,Weller M,Jugold M,Guillemin G J,Miller C L,Lutz C,Radlwimmer B,Lehmann I,von Deimling A,Wick W,Platten M.Nature,2011,478(7368):197-203.
[18] Bessede A,Gargaro M,Pallotta M T,Matino D,Servillo G,Brunacci C,Bicciato S,Mazza E M,Macchiarulo A,Vacca C,Iannitti R,Tissi L,Volpi C,Belladonna M L,Orabona C,Bianchi R,Lanz T V,Platten M,Della Fazia M A,Piobbico D,Zelante T,Funakoshi H,Nakamura T,Gilot D,Denison M S,Guillemin G J,DuHadaway J B,Prendergast G C,Metz R,Geffard M,Boon L,Pirro M,Iorio A,Veyret B,Romani L,Grohmann U,Fallarino F,Puccetti P.Nature,2014,511(7508):184-190.
[19] Xu X D,Shao S X,Jiang H P,Cao Y W,Wang Y H,Yang X C,Wang Y L,Wang X S,Niu H T.Oncol.Res.Treat.,2015,38(3):117-122.
[20] Chen X Z,Qian Y R,Wu S Y.FreeRadic.Biol.Med.,2015,79:253-263.
[21] Gao P,Yang C Z,Nesvick C L,Feldman M J,Sizdahkhani S,Liu H L,Chu H Y,Yang F X,Tang L,Tian J,Zhao S G,Li G H,Heiss J D,Liu Y,Zhuang Z P,Xu G W.Oncotarget,2016,7(12):15200-15214.
Study on Plasma Metabolomics of Glioma Patients by Ultra Performance Liquid Chromatography-Mass Spectrometry
ZUO Li-hua1*,DING Da-ling2,SHEN Yan3,SHI Ying-ying1,SUN Zhi1,LI Zhuo-lun1,ZHOU Lin1,XU Tan-ye1,LIU Li-wei1,ZHANG Xiao-jian1*
(1.Department of Pharmacy,The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China; 2.Department of Neurosurgery,The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China; 3.Department of Clinical Laboratory,The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China)
In this study,the ultra high performance liquid chromatography-Q exactive hybrid quadrupole-orbitrap high-resolution accurate mass spectrometry(UHPLC-Q-Orbitrap-HRMS) was firstly applied in the analysis of the plasma from the glioma patients and the normal control group to find the differential metabolites,which could provide the scientific evidence for clinical diagnosis and pathogenesis research.The spectra obtained by UHPLC-Q-Orbitrap HRMS were conducted to peak identification,peak matching and denoising.The data of metabolomics were statistically analyzed by using principal component analysis and orthogonal partial least-squares-discriminant analysis method to screen the differential metabolites with VIP>1.0 andP<0.05,which were investigated to further evaluate the diagnostic ability.The results showed that the plasma metabolic profiles of glioma patients were dramatically altered,and ten potential biomarkers were identified.The metabolites of leucine,valine,tryptophan,choline and taurine were significantly reduced in glioma patients,while histidine,citric acid,lactic acid,creatine and pyruvic acid were obviously increased compared with the normal controls(P<0.05),which suggested that amino acid and energy metabolism might play an important role in the development of glioma.In addition,the different metabolites showed good diagnostic ability toward gliomas(AUC>0.8),which could be used as potential diagnostic biomarkers.
glioma; ultra high performance liquid chromatography-Q exactive hybrid quadrupole-orbitrap high-resolution accurate mass spectrometry; metabolomics; diagnosis biomarker
2017-08-24;
2017-09-12
北京医卫健康公益基金会医学科学研究基金(YWJKJJHKYII-B17819)
*
张晓坚,主任药师,研究方向:医院药学,Tel:0371-66913047,E-mail:zhangxiaojian_yxb@163.com
左莉华,博士,主管药师,研究方向:代谢组学与质谱分析,Tel:0371-66862570,E-mail:zuolihua2013@126.com
10.3969/j.issn.1004-4957.2017.12.001
O657.7;O657.63
A
1004-4957(2017)12-1417-07
