雨生红球藻细胞形态转换和藻落形成差异研究
2017-12-27程天佑徐晓莹张文蕾袁冠华刘天中
程天佑, 徐晓莹, 张文蕾, 张 维, 陈 林, 袁冠华, 刘天中
雨生红球藻细胞形态转换和藻落形成差异研究
程天佑1, 2, 徐晓莹1, 2, 张文蕾1, 张 维1, 陈 林1, 袁冠华1, 2, 刘天中1
(1. 中国科学院 青岛生物能源与过程研究所, 中国科学院 生物燃料重点实验室, 山东 青岛 266101; 2. 中国科学院大学, 北京 100049)
基于雨生红球藻()培养过程中游动细胞和不动细胞的形态差异与转换, 对比研究了两种细胞类型在离心收集与藻落形成效率上的差异。结果表明, 雨生红球藻SCCAP K-0084在BYA培养基中培养 4~6 d和9~12 d分别以绿色游动细胞与绿色不动细胞为主; 早期游动细胞离心收集需要更高的离心力, 但500~1 000离心5 min可以在不影响细胞存活率的情况下有效收获所有类型细胞; 相比于传统直接涂布法, 双层琼脂平板法可有效提高平板藻落形成效率, 且游动细胞藻落形成效率比不动细胞藻落形成效率更高。TAP培养基由于藻落形成效率较低并不适合于雨生红球藻平板培养与筛选, 自养型培养基虽然具有较好的藻落形成效率但是藻落形成速度较慢, 相比而言, BYA培养基藻落形成效率较高且生长速度快, 更适合用于雨生红球藻细胞的后期平板培养与筛选过程。
雨生红球藻(); 游动细胞; 不动细胞; 形态转换; 藻落形成差异
虾青素具有极强的抗氧化活性和良好的着色能力[1], 在医药、保健、食品以及养殖业等方面均具有巨大应用价值[2]。雨生红球藻的虾青素含量可高达其干质量的4%, 是目前已知的虾青素含量最高的生物物种[3]。近年来, 随着雨生红球藻的技术产业化应用, 基于细胞与基因工程筛选[4-5]、选育与开发性状优良的雨生红球藻藻种越来越受到研究者们的关注。
许多国内外学者层通过电转化[6]、基因枪[7]、土壤农杆菌介导整合[8]等方法尝试建立稳定的雨生红球藻转化与外源基因表达技术, 但以色列Sammy Boussiba的研究[9]显示, 迄今为止仅有基因枪法实现了雨生红球藻稳定的遗传转化。相反, 普遍用作分子生物学研究模式物种的莱茵衣藻能够通过多种途径与手段实现外源基因的稳定转化与表达[10]。因此, 开发更丰富的雨生红球藻转化手段, 并建立更稳定的转化体系, 一直是学界关注的问题。
雨生红球藻在培养过程中存在游动细胞与不动细胞两种细胞类型, 这两种细胞在形态结构以及生理上存在明显差异[11]。当对雨生红球藻细胞进行分子生物学操作时, 这两种细胞类型在遗传转化效率上必定存在明显差异。因此要实现雨生红球藻细胞高效稳定的遗传操作, 比较理想的条件是首先要获得单一类型(或至少占绝大多数比例)的细胞。要实现这一点, 必须要了解雨生红球藻培养过程中的细胞形态转换及其影响因素。
本研究以雨生红球藻SCCAP-K0084为材料, 在含有低浓度醋酸钠和酵母提取物的BYA培养基中培养, 通过观测培养过程中细胞生长与形态转换, 确定培养过程中两种细胞类型的组成变化特点, 并考察了两种细胞的离心收集和藻落形成差异。研究结果证明雨生红球藻游动细胞和不动细胞的藻落形成效率存在明显差异, 而且不同的培养基组成对于细胞的藻落形成效率也存在重要影响。这一研究的报道, 对于根据不同细胞类型建立更高效与稳定的雨生红球藻分子生物学操作技术具有重要支持作用。
1 材料与方法
1.1 实验藻种
雨生红球藻(K-0084), 购于丹麦哥本哈根大学藻种保藏库(SCCAP), 本实验室保存。
1.2 培养基和培养条件
培养基包括: BG11培养基[12], 八倍磷酸二氢钾8P-BG11培养基, BG11基础上添加2 g/L的乙酸钠和2 g/L的酵母提取物的BYA培养基, BBM培养基[13], 三倍硝酸钠的3N-BBM培养基, TAP培养基[14]; 固体培养基(包括8P-BG11, 3N-BBM, BYA和TAP)则在相应的液体培养基中加入1.5%琼脂。
在250 mL锥形瓶中加入150 mL BYA培养基, 接入在BG11培养基中培养了10~15 d的雨生红球藻种子液, 接种密度控制在4×103~6×103个/mL。实验设两组平行, 控制培养温度为(25±1)℃, 持续光照为(25±1)µmol/(m2×s), 每天随机调换三角瓶位置并定时摇匀3次, 使得各组光照尽可能一致。每隔24 h定点取样2 mL, 用于细胞计数以及其他参数测定。平板则置于温度为(25±1)℃, 持续光照为15~20mmol/(m2×s)的环境下培养。
1.3 液体培养基细胞密度计数和形态转换观察
液体细胞密度计数: 培养期间每天定时观察取样, 取样前充分摇匀藻液, 游动细胞以0.25%戊二醛固定后用血球计数板在显微镜(Olympus BX51)下观察计数, 每个样本至少重复统计3次, 每个平行至少统计200 细胞。同时, 在显微镜下观察细胞是否有鞭毛结构、胶质鞘以及细胞大小形状等以确定不动细胞比例(不动细胞比例=不动细胞/总细胞数×100%), 同时用0.019%的Triton-X100对细胞进行处理以确定游动细胞比例[15-16](游动细胞计算公式为= 0.943+0.846, 其中为Triton敏感细胞比例,为游动细胞比例), 两个结果共同确定培养中游动细胞以及不动细胞比例。
1.4 细胞活力染色
细胞活力测定以酚番红花红为标准[17], 酚番红花红染色剂被配制成1 mg/mL保存于4℃冰箱中, 并在0.01% 浓度时检测细胞活力, 此浓度下只有死细胞才可被染色, 每次统计不低于200 细胞, 每个样本至少重复统计3次。绿色活细胞数记为, 红色死亡细胞数记为, 死细胞比例=/(+)×100%, 活细胞比例=/(+)×100%。
1.5 离心收集检查
在50 mL离心管中加入35 mL藻液后进行不同离心力和离心时间的收集(台式高速冷冻离心机, Beckman Coulter), 之后观察上清液是否澄清, 同时取1 mL进行镜检, 以确定上清残留细胞数, 收集率不小于90% 即认为能够有效离心收集, 记下其最低离心力和时间。2 mL EP管中加入1.8 mL的藻液后操作与50 mL离心管相同(H 1650-W台式离心机, 湘仪离心机仪器有限公司)。每一次离心之后重新摇匀藻液, 并取出1 mL进行细胞活力染色测定, 以确定离心对藻细胞的影响。收集率=(初始细胞密度–残留细胞密度)/初始细胞密度×100%。
1.6 不同细胞涂布方式藻落形成效率
直接涂平板: 液体细胞计数后将细胞密度稀释至 2×103个/mL, 取100 µL液体涂平板(TAP培养基), 每个样品至少3个重复, 20 d后进行平板藻落计数, 平板藻落形成效率=/200×100%。
双层琼脂法: 以常规方式倒底层培养基平板, 将加入1% 浓度的低熔点琼脂糖(low melting-point agarose, Solarbio)的培养基溶液灭菌后用42℃维持, 取1 mL该低熔点琼脂糖培养基于2 mL的EP管中, 加入100 µL细胞液, 混匀后置于平板表面并小心摇晃平板使其均匀分布于平板上。
玉米淀粉法(玉米淀粉, 国药): 将玉米淀粉用无菌水与无水乙醇依次各洗涤 2 次, 悬于灭菌水配制的75% (/)乙醇中, 并使得玉米淀粉终浓度为 20% (/)。使用的时候先用加入了0.4% PEG8000 (/)的灭菌液体培养基反复洗涤3次, 重悬后每1 mL悬液中加入 50 µL细胞液, 将这1 mL混悬液涂平板。
1.7 数据处理
用excel软件对平行样品进行方差分析, 用Sigmaplot作图, 用SPSS软件进行结果间的多重分析,<0.05差异显著。
2 结果
2.1 雨生红球藻培养中生长曲线和细胞形态转换
图1显示了雨生红球藻SCCAP K-0084在BYA培养基中培养12 d的生长以及细胞形态转换。培养2 d后细胞开始进入对数生长期, 第3天细胞密度从初始接种的6×103个/mL增长到 105个/mL以上, 到第6天对数生长期中止, 细胞密度达到6×105个/mL以上, 在整个对数生长期中, 雨生红球藻主要是以游动细胞的形式进行繁殖, 游动细胞比例基本维持在 80% 以上。从第7天培养开始, 细胞维持了2~3 d的缓慢生长, 细胞密度最高达到8×105个/mL左右, 并且细胞开始逐步的向不动细胞转换, 培养11~12 d后, 培养液中大约 80% 左右的细胞已完全进入绿色的不动细胞期。

图1 雨生红球藻在培养中细胞形态转换和细胞密度曲线
图2中分别显示了雨生红球藻SCCAP K-0084的绿色游动细胞和绿色不动细胞阶段的形态。相对于游动细胞, 不动细胞失去了鞭毛, 且部分细胞还失去了细胞外胶质鞘的包裹, 不同培养时期细胞类型存在明显差异, 对数期细胞(3~6 d)主要以游动细胞形式存在, 而稳定期的细胞(9~12d)则更多是以不动细胞形态存在。
2.2 雨生红球藻细胞的离心收集
雨生红球藻培养中细胞密度一般仅能达到 105~ 106个/mL, 然而对于遗传转化等分子生物学操作, 通常需要将细胞浓缩到 107~108个/mL的细胞密度, 因此离心收集是必不可少的环节。
BYA中培养4、8和12 d后的细胞分别在不同离心条件下进行离心, 结果如表1所示。培养4 d后的对数期细胞, 以游动细胞为主, 在50 mL和2 mL离心管中离心5 min需要的最低离心力分别为500和400; 培养8 d的细胞中游动细胞占60%, 其在50 mL和2 mL离心管中离心需要的最低离心力分别为400和300; 而培养12 d后不动细胞占80%以上, 其在50 mL和2 mL离心管中所需的离心力分别降低到了200和100。这一结果表明, 不动细胞相比于游动细胞, 离心收集需要的离心力更低, 研究还发现即使在最低离心力下提高离心时间也不能明显改善收集效果。实验中还考察了提高离心力和增加离心时间对细胞存活率的影响, 结果如图3 所示。游动细胞与不动细胞在离心力不大于1000时, 藻细胞存活率为85%~ 92%, 同未离心的对照样品没有明显差异(>0.05)。因此, 500~1000离心5~10 min完全能够适用于雨生红球藻不同类型细胞的高效收集。
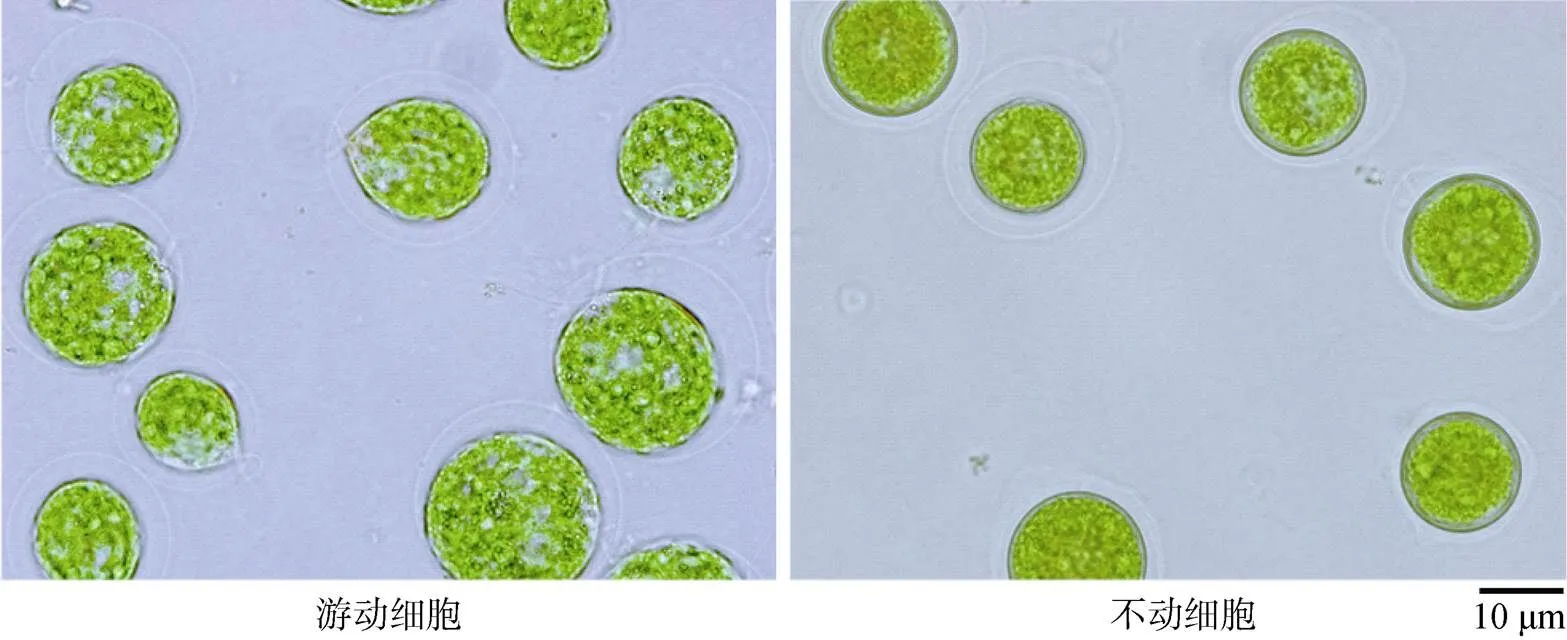
图2 雨生红球藻绿色游动细胞与绿色不动细胞的形态

表1 游动细胞与不动细胞离心最低离心力
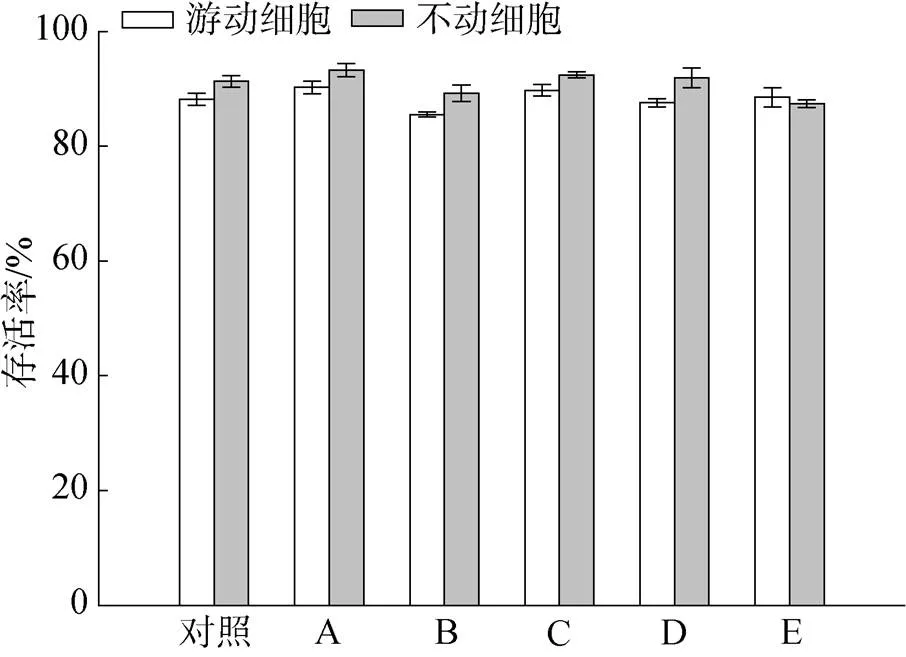
图3 不同离心条件对游动细胞与不动细胞存活率的影响
A. 300×10 min, B. 500×5 min, C. 500×10 min, D. 700×5 min, E. 1000×5 min
2.3 植板方式对藻落形成效率的影响
平板的筛选是细胞转化过程不可缺少的步骤, 因此平板藻落形成的效率对于高效与成功的转化过程非常重要。传统涂布器的涂布方式有可能对藻细胞产生物理损伤, 从而降低藻落形成效率。本研究对比了涂布器直接涂布、玉米淀粉法以及双层琼脂法3种植板方式下的藻落形成效率。
如表2所示, BYA培养4 d后的雨生红球藻游动细胞通过直接涂布方式在TAP平板上藻落形成效率很低, 仅为10.83%。通过玉米淀粉辅助的方法藻落形成效率可提高到13.83%, 效果仍不显著(>0.05)。顶生琼脂法则能够显著性的将藻落形成效率提高到21.67%(<0.05)。因此, 顶生琼脂法是较适合于雨生红球藻细胞藻落形成与筛选的植板方式。

表2 不同植板方式对藻落形成效率的影响
2.4 雨生红球藻在不同培养基上藻落形成效率的差异
为了进一步提高雨生红球藻的藻落形成效率, 对比考察了BYA液体培养基中培养4、8与12 d的细胞, 在8P-BG11、TAP、BYA和3N-BBM四种培养基中的藻落形成效率。
如图4, 在传统TAP平板上雨生红球藻藻落形成效率较低, 4 d、8 d和12 d细胞的藻落形成效率仅有18%、11.33% 和6%。而4 d培养获得的游动细胞在BYA、8P-BG11和3N-BBM平板上藻落形成效率可分别能达到52.83%、53.17%和42.67%, 显著性高于TAP平板的藻落形成效率(<0.05)。这种显著性的差异同样在培养8 d与12 d细胞的藻落形成中出现。结果还显示培养4 d后获得的细胞比培养8 d与12 d后获得的细胞具有更高的藻落形成效率。考虑到培养4d后获得的细胞主要是游动细胞(>80%), 这说明游动细胞比不动细胞有更高的藻落形成效率。另外, 四种平板培养基中, 在TAP和BYA培养基中细胞生长速率更快, 一般经过2周时间就能够出现明显的藻落, 如图5所示。经过25 d平板培养后, BYA和TAP上的克隆已经非常明显。在8P-BG11和3N-BBM平板培养基中才刚刚形成较为明显的克隆。因此, 对于雨生红球藻的平板培养与筛选, 游动细胞藻落形成效率较高, TAP培养基因藻落形成效率低并不适合培养与筛选, 8P-BG11和3N-BBM虽然藻落形成效率较高但生长缓慢, 只有BYA培养基能够更快更有效的用于雨生红球藻的平板筛选。

图4 8P-BG11、TAP、BYA和3N-BBM四种培养基对BYA培养4、8和12 d细胞藻落形成效率的影响
Fig. 4 Effects of different phycocolony forming rates of cells cultivated at 4, 8, and 12 days in the mixotrophic medium BYA on four types of solid plates (8P-BG11, TAP, BYA, and 3N-BBM)
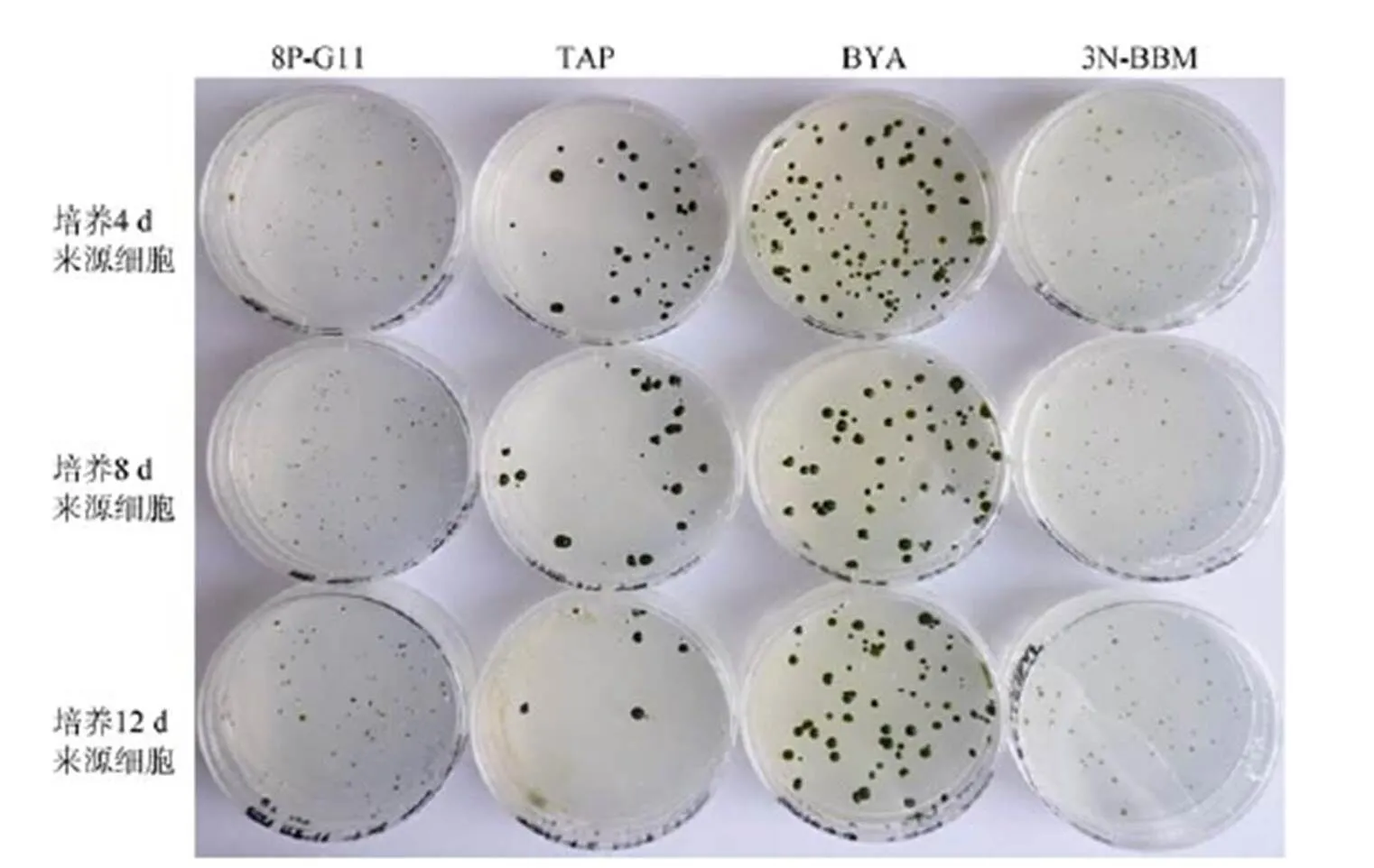
图5 BYA培养4、8和12 d的细胞在8P-BG11、TAP、BYA和3N-BBM四种固体培养基平板上生长25 d的藻落大小对比
3 讨论
雨生红球藻不仅可以进行光合自养生长, 而且可以基于乙酸(盐)为底物进行异养或兼养生长[18]。以往的研究证明乙酸钠的添加, 提高了雨生红球藻的生长速率, 且在乙酸钠浓度为1.5 g/L时细胞密度最高可达6×105个/mL[19]。本研究中采用的BYA培养基, 仅通过6 d的培养细胞密度就可达到6×105个/mL以上。而且研究发现在不同培养时期培养液中细胞类型存在巨大差异, 这可能与雨生红球藻复杂生活史有关[11, 20]。本研究中雨生红球藻BYA培养第3~6 d对数生长期时, 主要是以绿色游动细胞为主, 第7 d后, 绿色游动细胞逐渐向不动细胞阶段转变, 在培养9~12 d时, 以绿色不动细胞为主, 这可能是由于后期营养盐浓度降低所导致。BYA中第7~9 d的后期培养中, 细胞生长缓慢, 这一过程中仍然保持较为缓慢的细胞个数增殖, 龙元薷等[18]认为雨生红球藻不动细胞虽然呈现不游动的静止状态, 但仍然能以较低的概率进行无性的细胞增殖, 不动细胞可以通过形成孢子囊或出芽等方式释放游动或不动的子细胞。
离心是藻类分子生物学操作必不可少的环节, 藤长英等[21]在进行雨生红球藻基因枪转化实验中以 4 000离心 8 min收集藻细胞; Gutierrez等[22]以 2700离心 10 min收集细胞用于叶绿体基因枪转化; 卢水秀等[6]在雨生红球藻电转化研究中则以 1000离心 5 min收集藻细胞; Kathiresan等[8]在土壤农杆菌介导的雨生红球藻转化实验中以110离心 5 min收集细胞。这些离心条件的选择性差异可能源于实验中雨生红球藻细胞类型的不一致。本研究中发现, 雨生红球藻不动细胞在100~200离心力下即可实现高效率的收集, 而游动细胞则至少需要400~500的离心力条件。研究结果还发现, 500~ 1000离心5 min足以满足不同时期与不同类型雨生红球藻细胞的收集, 其对细胞活力没有明显影响, 能够满足后期分子生物学研究的需要。
固体平板的藻落形成与培养是细胞转化和筛选的最后一步。藻落形成效率的高低会直接影响转化和筛选成功与否。文献报道莱茵衣藻中淀粉粒包裹的方法被证明能够有效的提高细胞藻落形成与筛选效率[23], 双层琼脂平板也被证明能够有效的提高细胞的菌落形成效率[24-25]。本研究发现, 双层琼脂法能够有效的提高雨生红球藻的藻落形成效率, 但淀粉粒包裹法的效果并不明显。以往的雨生红球藻转化研究中大部分并未报道所采用的细胞来源中的主要细胞类型, 仅有卢水秀等[6]和Kathiresan等[8]的报道中分别提到采用不动期的细胞用于电转化和农杆菌介导转化研究, 而且都没有对细胞在平板上的藻落形成效率对转化过程的影响进行过相关分析。本研究发现不同时期细胞在双层琼脂平板上的藻落形成效率有显著差异。培养4 d获得的细胞大部分维持在游动细胞阶段, 比培养8 d和12 d后大部分处于不动细胞阶段的细胞有更高的藻落形成效率。
TAP培养基是一种较常用于莱茵衣藻培养与转化的培养基, 卢水秀等[6]和Sharon-Gojman等[9]分别在雨生红球藻的电转化和基因枪转化中均采用TAP平板筛选克隆子; Kathiresan等[8]在农杆菌介导的转化中采用TAP进行细胞的菌藻共生培养。然而本研究的结果发现, 无论雨生红球藻的游动细胞或不动细胞, 它们在TAP平板的藻落形成效率都明显较低, 其细胞藻落形成效率最高仅为21.67%, 而在8P-BG11,3N-BBM和BYA三种培养基中藻落形成效率最高均超过50%。表3中对比了四种培养基的主要成分与组成, TAP中的氮磷含量略低, 分别为7.5 mmol/L和1.13 mmol/L。Borowitzka等[26]的研究认为, 雨生红球藻适宜的氮磷浓度分别为4.95~9.89 mmol/L和0.57 mmol/L, TAP中的氮磷含量完全可以满足雨生红球藻生长的需要。但所不同的是TAP中的氮源完全是以铵根离子形式提供, Borowitzka等[26]认为雨生红球藻最适宜的氮源形式为硝酸盐, 因此, 氮源的形式有可能是导致TAP平板藻落形成效率低的主要原因。同时, 研究发现两种兼养型培养基TAP和BYA中, 由于乙酸盐的存在大大促进了藻细胞的生长速度, 其藻落往往仅需培养1~2周即可出现, 而纯自养型培养基8P-BG11和3N-BBM需要经过约4周的培养才能获得较明显的藻落。而且BYA培养基中, 酵母提取物作为一种丰富有机营养源, 满足了异养生长所需的其他类型营养, 在快速获得藻落的同时大大提高了平板藻落形成效率, 因此更适合应用于雨生红球藻的转化克隆筛选。

表3 四种培养基(8P-BG11, TAP, BYA and 3N-BBM)中主要营养元素含量对比
4 结论
综上所述, 本研究结果表明: (1)雨生红球藻在不同的培养时期具有不同的细胞类型; (2)雨生红球藻游动细胞比不动细胞离心收集时需要更高的离心力, 但500~1000离心5 min完全可以适用于两种类型细胞的收集; (3)相比于传统的直接涂布法, 双层琼脂平板法能有效地提高雨生红球藻细胞平板藻落形成效率; (4)雨生红球藻游动细胞藻落形成效率显著高于不动细胞, BYA培养基可能更适合用于雨生红球藻的平板藻落形成以及转化后的筛选。
[1] Kamath B S, Srikanta B M, Dharmesh S M, et al. Ulcer preventive and antioxidative properties of astaxanthin from[J]European Journal of Pharmacology, 2008, 590 (1-3): 387-395.
[2] Domínguez-Bocanegra A R, Ponce-Noyola T, Torres- Muño J A. Astaxanthin production byand: a comparative study[J]Applied Microbiology and Biotechnology, 2007, 75(4): 783-791.
[3] Boussiba S. Carotenogenesis in the green alga: cellular physiology and stress response[J]Physiologia Plantarum, 2000, 108(2): 111-117.
[4] 叶涛, 王明兹, 黄建忠, 等. 雨生红球藻原生质体制备与再生育种[J]福建师范大学学报(自然科学版), 2011, 27(4): 122-126.Ye Tao, Wang Mingzi, Huang Jianzhong, et al. Preparation and regeneration breeding of protoplasts from[J]. Journal of Fujian Normal University (Natural Science Edition), 2011, 27(4): 122-126.
[5] 王娜, 林祥志, 马瑞娟, 等. IPP异构酶基因遗传转化对雨生红球藻()虾青素含量的影响[J]海洋与湖沼, 2013, 44(4): 1033-1041. Wang Na, Lin Xiangzhi, Ma Ruijuan, et al. The effects of genetic transformation of isopentenyl diphosphate isomerase gene on the astaxanthin content of[J]. Oceanologia et Limnologia Sinica, 2013, 44(4): 1033-1041.
[6] 卢水秀, 陈谷和魏东. 电击条件对雨生红球藻细胞存活率的影响[J]现代食品科技, 2010, 26(6): 554-557.Lu Shuixiu, Chen Gu, Wei Dong. Effect of electroporation conditions on cell viability of[J]. Mordern Food Science & Technology, 2010, 26(6): 554-557.
[7] Steinbrenner J and Sandmann G. Transformation of the green algawith a phytoene desaturase for accelerated astaxanthin biosynthesis[J]Applied and Environmental Microbiology, 2006, 72(12): 7477-7484.
[8] Kathiresan S, Chandrashekar A, Ravishankar G A, et al.-mediated transformation in the green alga(Chlorophyceae, Volvocales)[J]Journal of Phycology, 2009, 45(3): 642-649.
[9] Sharon-Gojman R., Maimon E, Leu S, et al. Advanced methods for genetic engineering of(Chlorophyceae, Volvocales)[J]Algal Research, 2015, 10: 8-15.
[10] 王潮岗, 胡章立. 莱茵衣藻细胞核转化系统研究进展[J]仲恺农业工程学院学报, 2005, 18(2): 59-64.Wang Chaogang, Hu Zhangli. The research advance in nuclear transformation system of[J]. Journal of Zhongkai University of Agriculture and Technology, 2005, 18(2): 59-64.
[11] 刘建国, 殷明焱. 雨生红球藻的细胞周期初探[J]海洋与湖沼, 2000, 31(2): 145-150. Liu Jianguo, Yin Mingyan. Studies of cell cycle in[J]. Oceanologia et Limnologia Sinica, 2000, 31(2): 145-150.
[12] Stainier R Y, Kunisawa R, Mandel M, et al. Purification and properties of unicellular(order Chroococcales)[J]. Bacteriol Reviews, 1971, 35(2): 171-205.
[13] 张丹, 朱晓艳, 温小斌, 等. 微藻培养基平衡pH的研究[J]. 水生生物学报, 2014, 38(3): 401-406. Zhang Dan, Zhu Xiaoyan, Wen Xiaobin, et al. Studies on equilibrium pH values of microalgal medium[J]. Acta Hydrobiologica Sinica, 2014, 38(3): 401-406.
[14] Melis A, Zhang L, Forestier M, et al. Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green algae[J]. Plant Physiology , 2000, 122(1) : 127-135 .
[15] Tjahjono A E, Kakizono T, Hayama Y, et al. Formation and regeneration of protoplast from a unicellular green alga[J]Journal of Fermentation and Bioengineering, 1993, 75(3): 196-200.
[16] 徐晓莹, 程天佑, 陈林, 等. 两种培养基间雨生红球藻细胞生长分化差异及磷的作用[J]过程工程学报, 2016, 16(6): 86-94. Xu Xiaoying, Cheng Tianyou, Chen Lin, et al. Effects of phosphorus oncell propagation and differentiation in two medium[J]. The Chinese Journal of Process Engineering, 2016, 16(6): 86-94.
[17] Widholm J M. The Use of fluorescein diacetate and phenosafranine for determining viability of cultured plant cells[J]Stain Technology, 1972, 47(4): 189-194.
[18] 龙元薷, 刘建国, 张立涛. 兼养对雨生红球藻细胞生长的促进作用及藻株差异性[J]. 海洋科学, 2014, 38(12): 1-7.Long Yuanru, Liu Jianguo, Zhang Litao. The cell growth enhancement and difference of 4 strains ofunder mixotrophic culture mode[J]. Marine Sciences, 2014, 38(12): 1-7.
[19] 庄惠如, 陈必链, 王明兹, 等.雨生红球藻混合营养与异养培养研究[J]微生物学通报, 2000, 27(3): 198-201.Zhuang Huiru, Chen Bilian, Wang Mingzi, et al. Mixotrophicand heterotrophic growth of[J]. Microbiology, 2000, 27(3): 198-201.
[20] Elliott A M. Morphology and life history of[J]. Archiv fur Protistenkunde, 1934, 82: 250-272.
[21] Teng C Y, Qin S, Liu J G, et al. Transient expression of lacZ in bombarded unicellular green alga[J]Journal of Applied Phycology, 2002, 14(6): 497-500.
[22] Gutierrez C L, Gimpel J, Escobar C, et al. Chloroplast genetic tool for the green microalgae(Chlorophyceae, Volvocales)[J]Journal of Phycology, 2012, 48(4): 976-983.
[23] Shimogawara K, Fujiwara S, Grossman A, et al. High- efficiency transformation ofby electroporation[J]Genetics, 1998, 148(4): 1821-1828.
[24] 苏雄, 汪梦萍. 用双层平板和双温培养法分离支气管败血波氏杆菌[J]华中农业大学学报, 1994, 13(5): 487-491. Su Xiong, Wang Mengping. Isolation ofwith a double-layered plate at two different temperatures[J]. Journal of Huazhong Agricultural University, 1994, 13(5): 487-491.
[25] 王世梅, 周立祥. 提高氧化亚铁硫杆菌和氧化硫硫杆菌平板检出率的方法: 双层平板法[J]环境科学学报, 2005, 25(10): 1418-1420.Wang Shimei, Zhou Lixiang. A renovated approach for increasing colony count efficiency ofand: double-layer plates[J]. Acta Scientiae Circumstantiae, 2005, 25(10): 1418-1420.
[26] Borowitzka M A, Huisman J M, Osborn A. Culture of the Astaxanthin-Producing Green-alga: effects of nutrients on growth and cell type[J]. Journal of Applied Phycology, 1991, 3(4): 295-304.
(本文编辑: 梁德海)
Effect of morphological shift on phycocolony forming in
CHENG Tian-you1, 2, XU Xiao-ying1, 2, ZHANG Wen-lei1, ZHANG Wei1, CHEN Lin1, YUAN Guan-hua1, 2, LIU Tian-zhong1
(1. Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Difference in cell collection and phycocolony forming between motile and non-motile cells ofwas studied considering the morphological shift under mixotrophic conditions. The results showed that motile and non-motile cells could be enriched separately after 4~6 days and 9~12 days, respectively, through mixotrophic cultivation in BYA. Although a greater centrifugal force was required for motile cell collection, motile and non-motile cells could both be collected by centrifugation at 500~1000for 5 min without obvious negative effects on the cell viability. Furthermore, the plate data indicated that the phycocolony forming rate ofcould be significantly improved using double layer of the apical low melting point agarose in comparison with that using traditional direct coating, and the phycocolony forming rate of motile cells was significantly higher than that of non-motile cells. Besides, the phycocolony forming rate in TAP was lower than that in the other three mediums, indicating that TAP was not suitable for the screening of, and the growth rate of colonies in BG11 and BBM was significantly lower than that in TAP and BYA. Above results indicated that BYA is more suitable for phycocolony formation and the screening ofconsidering the high phycocolony forming rate and rapid growth.
; motile cell; non-motile cell; morphological shift; phycocolony forming
[2016 Sino-Thai Cooperation Project from the National Science Foundation of China (Grant No. 51561145015)]
Dec. 5, 2016
Q945.1
A
1000-3096(2017)08-0001-08
10.11759/hykx 20161109002
2016-12-05;
2017-03-22
国家自然科学基金中泰合作研究基金资助项目(51561145015)
程天佑(1991-), 男, 湖北咸宁人, 硕士研究生, 研究方向为微藻生物技术, 电话: 0532-80662737, E-mail: chengty@qibebt.ac.cn; 张维,通信作者, 男, 湖北襄阳人, 副研究员, 博士, 主要从事经济微藻的应用基础与藻类分子遗传学, 电话: 0532-80662737, E-mail: zhangwei@qibebt.ac.cn
