绿鳍马面鲀精子的超微结构
2017-12-27刘长琳陈四清张乐乐
刘 琨, 刘长琳, 陈四清, 张乐乐, 边 力
绿鳍马面鲀精子的超微结构
刘 琨1, 2, 刘长琳2, 陈四清2, 张乐乐1, 2, 边 力2
(1. 上海海洋大学 水产与生命学院, 上海 200090; 2. 中国水产科学研究院 黄海水产研究所, 山东 青岛, 266071)
为探讨绿鳍马面鲀()精子的超微结构, 作者应用扫描电镜和透射电镜观察了其精子外部形态与各部位的横切结构。结果表明: 绿鳍马面鲀精子由头部和尾部两部分组成。精子头部呈卵圆形, 无顶体, 头部主要结构是细胞核, 染色质致密, 核内存在少量染色质空隙, 无液泡; 核后端正中有凹入核内的植入窝, 呈棒状, 植入窝较深, 最深处占细胞核纵长的5/6, 最宽处在细胞核末端, 约占头部宽度的1/3。中心粒复合体位于植入窝内, 由近端中心粒、中心粒间体和基体组成, 近端中心粒的长轴与基体的纵轴垂直, 排列方式为“T”型; 头部末端为袖套, 内含5个或6个均匀分布的线粒体球和少量随机分布的囊泡。尾部细长, 自基体向后伸出, 尾部无侧鳍结构, 其核心结构是轴丝, 轴丝为典型的“9+2”微管复合体结构。揭示其精子的形态结构, 以期丰富硬骨鱼类繁殖生理学内容, 同时为鱼种鉴别提供依据。
绿鳍马面鲀(); 精子; 超微结构
绿鳍马面鲀()隶属于鲀形目(Tetraodontiformes)、单角鲀科(Monacanthidae)、马面鲀属()[1], 是温水性洄游鱼类[2-4], 分布于日本、朝鲜及中国东海、黄海海域。其肉质鲜美且营养价值高, 是中国重要的经济鱼类之一[5]。20世纪70年代, 绿鳍马面鲀成为中国海洋捕捞的主要对象之一, 而进入20世纪90年代, 由于过度捕捞与环境破坏等原因, 其捕捞产量逐步下降[6-7], 导致其市场价格不断攀升。为满足市场需求, 急需进行大规模人工养殖。目前国内有关绿鳍马面鲀繁殖习性、胚胎发育和性腺发育等方面的研究报道较多[8-10], 但关于其精子超微结构的研究未见报道。作者以黄海绿鳍马面鲀精子为研究对象, 揭示其精子的形态结构, 以期丰富硬骨鱼类繁殖生理学内容。
1 材料与方法
1.1 材料
实验用8尾绿鳍马面鲀雄鱼由青岛金沙滩水产开发有限公司提供, 体长范围23.5~31.5 cm, 体质量180.6~498.9 g。鱼龄两年以上, 且性成熟。
1.2 实验鱼培养
养殖用水为自然砂滤海水, 水温19~23℃, 海水盐度29~31, 光照强度700~1 200 lx。每天投喂定量鲜杂鱼, 投喂时间8: 00和15: 00各1次, 每天喂食前换水, 日换水率200%~400%。培养30 d后, 挑选体表完整且有活力的绿鳍马面鲀雄鱼, 轻轻挤压腹部, 即可挤出精液, 说明雄鱼性腺已发育成熟。
1.3 精液提取方法
随机挑取3条绿鳍马面鲀, 取精液时用湿毛巾盖住鱼体的鳃部, 再用干毛巾擦干鱼体生殖孔周围水分, 轻轻挤压腹部, 挤出精液。用经过消毒的干燥玻璃吸管吸取乳白色精液滴入干净管中保存。实验用精液要求新鲜、无血、无尿、无污染。
1.4 扫描电镜样品制备
取精液0.5 mL加入10倍体积的2.5 %戊二醛固定液(0.2 mol/L PBS配制, pH7.4, 4℃), PBS缓冲液漂洗。乙醇系列梯度脱水后, 进行乙酸异戊脂置换。采用Eiko公司XD-1型二氧化碳临界点干燥器干燥, Eiko公司IB-3型离子镀金仪喷金镀膜, JEOL公司JSM-840扫描电镜观察。
1.5 透射电镜样品的制备
取精液0.5 mL加入10倍体积的2.5 %戊二醛固定液(0.2 mol/L PBS配制, pH7.4, 4℃), 2 000 r/min离心5 min, 弃上清液。PBS缓冲液冲洗, 1%锇酸4℃后固定2h。PBS缓冲液冲洗, 乙醇系列梯度脱水, Epon812环氧树脂包埋。UltracutE超薄切片机半薄切片, 甲苯胺蓝染色, 半薄定位。醋酸双氧铀硝酸铅染色。JEOL公司JEM-1200EX透射电镜观察。
1.6 图像与数据处理
选择清晰的电镜样品图像, 采用Adobe Photoshop CS6 对图像进行编辑处理, 用Microsoft Excel 2010对精子各组成部分长度进行数据相关性分析。
2 结果
2.1 扫描电镜观察
扫描电镜结果表明, 绿鳍马面鲀精子由头部和尾部两部分部分组成(图1-1), 无颈部, 属于鞭毛型。头部呈卵圆形, 主要结构是细胞核(Nucleus), 且头部无顶体(Acrosome)和核前部凹陷(Nuclear pit)存在(图1-2), 尾部自头部后端的中心向后伸出, 纤细且较长, 尾部末端较短且不分叉(图1-3)。精子各部分长度见表1。
表1 绿鳍马面鲀精子各组成部分长度

Tab.1 Length of spermatozoa parts of Thamnaconus septentrionalis (n = 25)
2.2 透射电镜观察
2.2.1 头部微细结构
头部细胞核纵切呈椭圆形, 主要结构是细胞核, 细胞核后端正中间有一凹入核内较深的植入窝(Implantation fossa)(图1-4)。细胞核前端无顶体, 核内充满高度浓缩的染色质, 染色较深, 染色质中夹杂几个少量空隙, 即核泡, 核泡的形态和位置皆不定(图1-5)。精子质膜包裹整个头部, 中间原生质含有少量囊泡(Vesicle), 分布不均匀, 形态和数目不定(图1-5)。
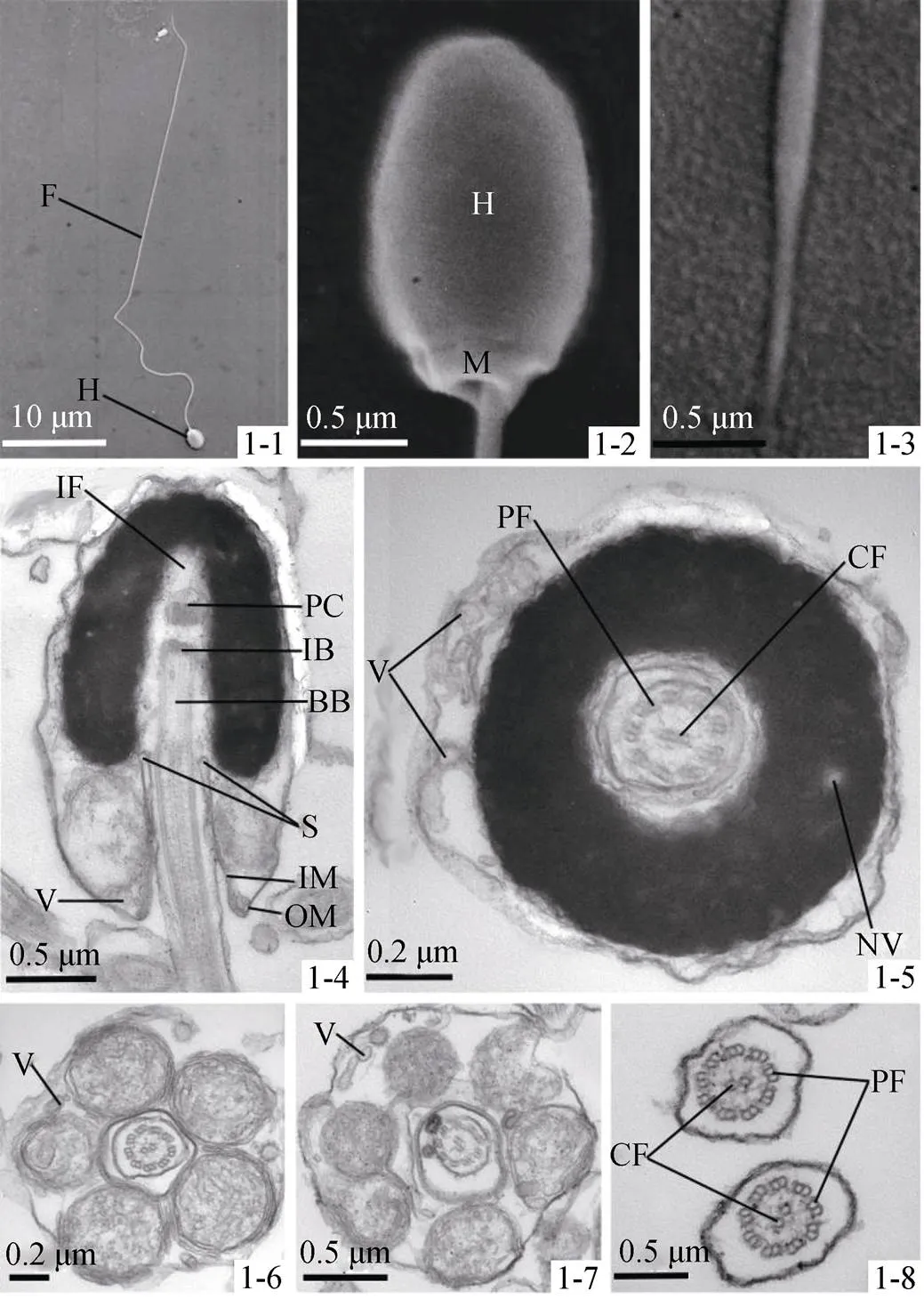
图1 绿鳍马面鲀精子超微结构
1-1. 精子整体, 示头部和鞭毛; 1-2. 精子头部, 示头部和线粒体; 1-3. 精子尾部末端; 1-4. 精子头部纵切, 示精子头部基本结构(细胞核, 植入窝, 袖套腔, 线粒体, 近端中心粒, 中心粒间体, 基体, 轴丝, 袖套内膜, 袖套外膜, 囊泡); 1-5. 精子头部中部横切, 示袖套, 中央微管, 双联体微管和核泡; 1-6. 精子头部中部横切, 示袖套腔, 5线粒体结构; 1-7. 精子头部中部横切, 示6线粒体结构; 1-8. 精子尾部横切, 示中心“9+2”结构: 中央微观和双联体微管; A. 轴丝; BB. 基体; CF. 中央轴丝; F. 鞭毛; H. 精子头部; IB. 中心粒间体; IF. 植入窝; IM. 袖套内膜; M. 线粒体; N. 细胞核; NV. 核泡; S. 袖套腔; OM. 袖套外膜; PC. 近端中心粒; PF. 外周二连微管; V. 囊泡
1-1. The total length of a sperm, showing head and flagellum; 1-2. The head of the spermatozoa, showing head and mitochondrion; 1-3. End piece of the flagellum; 1-4. Longitudinal section of the sperm head, showing the basic structure nuclear of sperm head (nuclues, implantation fossa, mitochondrion, proximal centriole, intercentriolar body, basal body, axoneme, inner memberane of the sleeve, outer memberane of the sleeve and vesicle; 1-5. Longitudinal section of sperm head, showing the center microtubule, doublet microtubule and nuclear vacuole; 1-6. Cross section of sperm’head at midpiece, showing central space of the sleeve and five mitochondria’s structure; 1-7. Cross section of sperm’head at midpiece, showing the six mitochondria’s structure; 1-8. Cross section of end piece of the sperm flagellum, showing the structure of “9+2”: center microtubule and doublet microtubule; A. Axoneme; BB. Basal body; CF. Center microtubule; F. Flagellum; H. Head of the spermatozoa; IB. Intercentriolar body; IF. Implantation fossa; IM. Inner menbrane of the sleeve; M. Mitochondrion; N. Nucleus; NV. Nuclear vacuole; S. Central space of the sleeve; OM. Outer memberane of the sleeve; PC. Proximal centriole; PF. Plasma membrane; V. vesicle
植入窝形似棒状, 长度0.89~1.11 μm, 宽度0.36~0.54 μm。中心粒复合体(Centriolar complex)位于窝内, 由近端中心粒(Proximal centriole)、中心粒间体(Intercentriolar body)和基体(Basal body) 3部分组成, 近端中心粒在植入窝最内端, 呈椭圆形, 长度约0.2 μm, 排列方向与基体纵轴垂直, 呈“T”型(图1-4); 中心粒间体位于近端中心粒和基体间, 并将两者隔开, 与核的长轴相垂直; 基体与核的长轴平行, 位于细胞核底部。从中心粒复合体开始, 开始延伸出尾部, 并出现“9+2”结构(图1-6)。
袖套(Sleeve)呈袖筒状, 由袖套膜包裹线粒体而成, 长约0.70 μm, 占头长的1/4。起始于核的后端。两侧的袖套大小形状近似且对称。其纵切可见两侧各有1个椭圆形线粒体(图1-4), 而横切则可见5个或6个呈正多边形均匀分布的线粒体(图1-6, 图1-7), 且彼此不融合。袖套末端的原生质中分布着少量含有电子致密物质的泡状囊泡与空囊泡(Vesicle)(图1-6, 图1-7)。袖套与鞭毛近核端围成空腔, 即袖套腔(Central space of the sleeve)(图1-4)。袖套膜分袖套内膜(Inner membrane of the sleeve)和袖套外膜(Outer membrane of the sleeve), 袖套内膜位于袖套内侧, 袖套外膜与袖套内膜平行且与细胞质膜相连, 袖套内膜略厚于袖套外膜(图1-4)。
2.2.2 尾部微细结构
在中心复合体末端开始出现尾部, 穿过袖套腔并向后方延伸, 近核端较短, 远核端较长, 尾部细长, 末端不分叉。尾部核心结构是轴丝(Axoneme)。轴丝始于中心粒复合体(图1-4), 可以清楚观察到典型的“9+2”二联微管对复合体结构, 即由外周的9组外周二联微管(Plasma membrane)和中央的2条中央纤维(Central fibril)组成(图1-8)。鞭毛未见侧鳍(Lateral fin)结构, 只有鞭毛质膜, 质膜内无液泡(图1-8)。
3 讨论
硬骨鱼的受精方式可分为体外和体内受精两类。体内受精种类的精子结构相对于体外受精的更为复杂[11]。绿鳍马面鲀为体外受精[1], 故精子结构较为简单, 绿鳍马面鲀精子属于鞭毛型, 这与黄鳍东方鲀()[12]、红鳍东方鲀()[13]和暗纹东方鲀()[14]等鲀形目鱼类一致, 但在细微结构上有所区别, 如黄鳍东方鲀和红鳍东方鲀精子皆由头部和尾部组成, 而暗纹东方鲀还存在粗短颈部。4种鲀形目鱼类的形态结构差异见表2, 而据表中数据显示, 4种鲀形目鱼类的结构差异主要为头部大小、线粒体数量和尾部长度。
表2 鲀形目鱼类精子形态特征
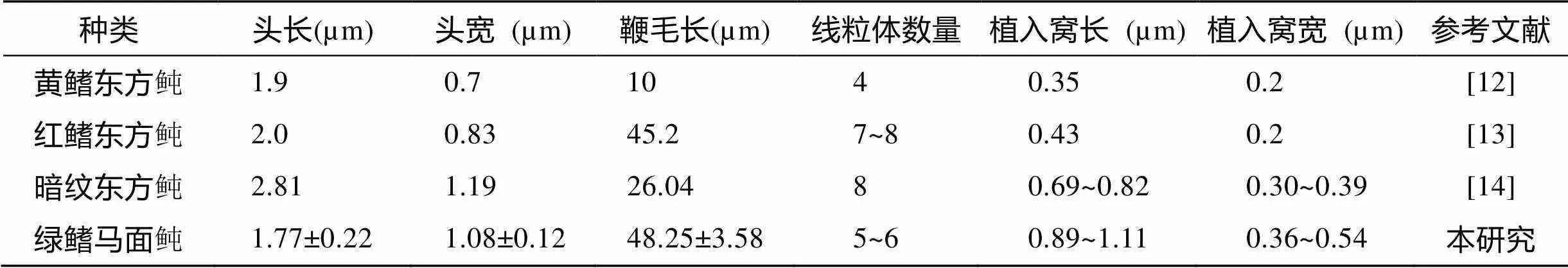
Tab.2 Morphological characteristics of the spermatozoa in Tetraodontiformes
3.1 头部
在这4种鲀形目鱼类中, 暗纹东方鲀[14]头部最大, 红鳍东方鲀[13]与绿鳍马面鲀依次减小, 黄鳍东方鲀[12]最小。而在具体结构上, 绿鳍马面鲀精子头部细胞核内充满高浓度染色质, 其中存在少量染色浅且形状不规则的空隙, 即核泡(Nuclear vacuole), 此结构在黄鳍东方鲀[12]和红鳍东方鲀[13]中也有出现。实际上该结构是精子细胞核中的核泡致密染色质中相对稀疏的区域[12~13]。核泡内有少量电子致密小颗粒存在, 这种电子致密小颗粒的形状和大小与浓缩的染色质有明显差异, 对于这种核泡结构, Billard[15]在硬头鳟的研究中认为该结构可能是顶体的前身, 而刘利平[16]等则认为是在受精过程中起到缓冲保护的作用, 同时刘利平[16]也认为袖套腔作为鞭毛和袖套膜的空隙, 可能起到缓冲运动的作用。
3.2 植入窝
这4种鲀形目鱼类都具有植入窝结构, 但大小存在差异, 由表2可知, 绿鳍马面鲀植入窝最大, 暗纹东方鲀[14]与红鳍东方鲀[13]依次减小, 黄鳍东方鲀[12]最小, 推测这种大小差异首先可能与精子头部大小相关, 然后与精子细胞核染色质浓缩程度有关, 即染色质浓缩程度大, 植入窝随之增大。研究表明, 不同硬骨鱼的精子植入窝长度有较大区别, 其中较高等的鱼类大多数精子植入窝较深[17]。绿鳍马面鲀精子植入窝最深处约占整个细胞核的5/6, 最宽处在细胞核末端, 约占头部宽度的1/3左右, 因此绿鳍马面鲀精子属于植入窝较深种类。绿鳍马面鲀植入窝周围空隙处还分布少量囊泡和小颗粒。而根据Walker[18]对动物精子细胞形成过程的研究, 将核染色质浓缩形态分为颗粒状、纤维状、片状, 因此推测绿鳍马面鲀的这种小颗粒结构可能为小颗粒状染色体, 且其他3种鲀形目鱼类也有类似结构[12-14]。
3.3 近端中心粒排列方式
目前硬骨鱼类精子近端中心粒的排列方式可分为4种类型[13]: (1)近端中心粒长轴与精子纵轴呈“T”形[19]; (2)呈倒“L”形, 如鲤鱼()[20]; (3)近端中心粒体与其精子纵轴互为125°角关系, 呈“亻”形, 如鲫鱼()[21]精子; (4)近端中心粒与精子纵轴平行且在同一条直线上, 即呈“I”形, 如黄颗鱼()[22]。绿鳍马面鲀近端线粒体呈椭圆形, 其纵轴与基体纵轴成垂直关系, 基体纵轴与精子纵轴在同一条直线上, 因此其排列方式属于第一种类型。而黄鳍东方鲀和红鳍东方鲀精子近端中心粒与基体纵轴既不垂直也不平行[12-13], 这与绿鳍马面鲀精子相区别。因此推测精子近端中心粒与基体纵轴的排列方式可作为鲀形目鱼类分类的重要依据。
3.4 袖套
4种鲀形目鱼类袖套结构相似, 皆由袖套外膜和袖套内膜包裹线粒体而成, 而线粒体数量存在差异, 黄鳍东方鲀袖套内纵切面可见2个球形线粒体, 横切显示有4个[12]; 红鳍东方鲀袖套内纵切面可见2个球形线粒体, 横切有7~8个[13]; 而绿鳍马面鲀头部横切有5~6个线粒体, 而像这种线粒体数量差异在4种虾虎鱼()[23]中也有出现; 暗纹东方鲀横切显示有8个球形线粒体[14]。同时红鳍东方鲀[13]和绿鳍马面鲀的精子尾部较长, 在40 μm以上, 而黄鳍东方鲀[12]和暗纹东方鲀[14]的精子尾部尾部较短, 均在40μm以下。关于这种线粒体和尾部长度的差异, 推测可能是因为较大的精子头部和较长的鞭毛活动需要更多的能量支持。
3.5 尾部
绿鳍马面鲀精子尾部无侧鳍结构且尾部末端不分叉, 而暗纹东方鲀尾部末端具有2根细而长的裸露尾丝[14], 而黄鳍东方鲀和红鳍东方鲀都具有侧鳍[12-13]。Stoss[24]认为精子鞭毛的侧鳍结构可能改善精子鞭毛的游泳速率, 从而提高受精率; Afzelius[25]则认为侧鳍与精子游泳速率的提高无关。绿鳍马面鲀精子尾部外周有鞭毛质膜, 质膜内无液泡, 除轴丝外没有其他明显结构, 这与红鳍东方鲀[13]近核端有较多小囊泡相区别。因此, 精子的长度、头部形状、线粒体数目及鞭毛长宽等都可作为鲀形目种间鉴定的依据。
[1] 张家男. 绿鳍马面鲀的生殖调控与苗种繁育技术[D]. 青岛: 中国海洋大学, 2011. Zhang Jianan. Reproductive regulation and fry breeding technology ofGünther[D]. Qingdao: Ocean University of China, 2011.
[2] 徐自勤. 马面鲀鱼综合利用途径的探讨[J]. 水产科技情报, 1983, 1: 7-9. Xu Ziqin. The study of the comprehensive use of(Günther)[J]. Fishery science and technology information, 1983, 1: 7-9.
[3] 薛美岩. 绿鳍马面鲀早期发育及生长的研究[D]. 上海: 上海海洋大学, 2011. Xue Meiyan. Study on early development and growth of[D]. Shanghai: Shanghai Ocean University, 2011.
[4] 丁民权. 东海绿鳍马面鲀群体及其分布[J]. 水产学报, 1994, 18(1): 45-56. Ding Minquan. On the stocks of filefishand their distributions in the East China Sea[J]. Journal of Fisheries of China, 1994, 18(1): 45- 56.
[5] 林新濯, 甘金宝, 郑元甲, 等. 绿鳍马面鲀洄游分布的研究[J]. 海洋渔业, 1984, 3: 99-108. Lin Xinyao, Gan Jinbao, Zheng Yuanjia, et al. The study of(Günther)’s migratory distribution[J]. Marine fisheries, 1984, 3: 99-108.
[6] 许学龙, 郑元甲, 刘松. 东、黄海绿鳍马面鲀的资源评估[J]. 海洋与湖沼, 1992, 23(6): 651-656. Xu Xuelong, Zheng Yuanjia, Liu Song. Estimation of stock size of filefishin the East China Sea and Yellow Sea[J]. Oceanologia et Limnologia Sinica, 1992, 23(6): 651-656.
[7] 陈丕茂, 詹秉义. 绿鳍马面鲀年龄生长与合理利用[J].中国水产科学, 2000, 7(1): 35-40. Chen Pimao, Zhan Bingyi. Age and growth ofand rational exploitation[J]. Journal of Fishery Sciences of China, 2000, 7(1): 35-40.
[8] 宓崇道, 钱世勤, 秦忆芹. 东海绿鳍马面鲀繁殖习性的初步研究[J]. 水产科技情报, 1980, 3: 1-3. Mi Chongdao, Qian Shiqin, Qin Yiqin. A preliminary study of breeding habits of[J]. Fishery Science and Technology Information, 1980, 3: 1-3.
[9] 温海深, 杨艳平, 陈彩芳, 等. 绿鳍马面鲀重复发育雄性生殖腺结构与发育组织学观察[J]. 海洋科学进展, 2010, 28(2): 209-215. Wen Haishen, Yang Yanping, Chen Caifang, et al. Histological observation of gonad structure and its repeated development in male[J]. Advances in Marine Science, 2010, 28(2): 209-215.
[10] 关健, 陈志信, 张家男, 等. 绿鳍马面鲀仔、稚鱼生长发育特征研究[J]. 海洋与湖沼, 2011, 42(4): 561- 566. Guan Jian, Chen Zhixin, Zhang Jianan, et al. Post-embryonic development of filefish[J]. Oceanologia et Limnologia Sinica, 2011, 42(4): 561- 566.
[11] 施瑔芳. 鱼类性腺发育研究新进展[J]. 水生生物学报, 1988, 12(3): 248-258. Shi Xianfang. Recent advances in the studies on gonad development in Fishes[J]. Acta Hydrobiologica Sinica, 1988, 12(3): 248-258.
[12] 舒琥, 谭嘉敏, 赵会宏, 等. 黄鳍东方鲀精子的超微结构[J]. 广东海洋大学学报, 2008, 28(6): 9-13. Shu Hu, Tan Jiamin, Zhao Huihong, et al. Ultrastructure of spermatozoa ofobserved by scanning and transmission electron microscopy[J]. Journal of Guangdong Ocean University, 2008, 28(6): 9-13.
[13] 张筱兰, 姜明, 姚斐, 等. 红鳍东方鲀精子形态的研究[J]. 中国海洋大学学报(自然科学版), 1999, 2: 255- 259. Zhang Xiaolan, Jiang Ming, Yao Fei, et al. On the ultrastructure of the spermatozoa of Oriental Red globefish ()[J], Journal of Ocean University of Qingdao, 1999, 2: 255-259.
[14] 卢敏德, 葛志亮, 倪建国, 等. 暗纹东方鲀精、卵超微结构及精子入卵早期电镜观察[J]. 中国水产科学, 1999, 6(2): 5-8. Lu Minde, Ge Zhiliang, Ni Jianguo, et al. Ultrastructura observation on sperm egg and early sperm-penetration in[J]. Journal of Fishery Sciences of China, 1999, 6(2): 5-8.
[15] Billard R. Spermiogenesis and spetmatololgy of sane teleost fish species[J]. Reprod Nutr Sci Develop, 1986, 26 (4): 877-920.
[16] 刘利平, 王武, 赵雷蕾, 等. 江黄颡鱼精子的超微结构[J]. 上海海洋大学学报, 2004, 13(3): 198-202. Liu Liping, Wang Wu, Zhao Leilei, et al. Ultrastructure of spermatozoa in[J]. Journal of Shanghai Fisheries University, 2004, 13(3): 198-202.
[17] Medina A, Megina C, Abascal F J, et al. The sperm ultrastructure of, (Teleostei, Gadiformes): phylogenetic considerations[J]. Acta Zoologica, 2003, 84(2): 131-137.
[18] Walker M H. In Comparative Spetmatolog[M]. New York: Acadanic Press, 1970: 383-391.
[19] Van D B, Lastein U. Ultrastructure of the spermatozoa of the teleostPeters, with particular reference to the midpiece[J]. Journal of Ultrastructure Research, 1973, 42(5): 517-533.
[20] 尤永隆, 林丹军. 鲤鱼精子超微结构的研究[J]. 动物学研究, 1996, 4: 377-383. You Yonglong, Lin Danjun. A study on the fine structure of the spermatozoon of teleost(linnaeus)[J]. Zoological Research, 1996, 4: 377-383.
[21] 曹伏君. 鲫(♀)鲤(♂)杂交F1代精巢超微结构的研究[J]. 动物学报, 2000, 46(4): 366-371. Cao Fujun. Ultrastructure of testis of F1Hybrids between(♀) and(♂)[J]. Acta Zoologica Sinica, 2000, 46(4): 366-371.
[22] 龙永隆, 林丹军. 黄颡鱼精子的超微结构[J]. 实验生物学报, 1996, 29(3): 235-245. You Yonglong, Lin Danjun. The ultrastructure of spermatozoon of the teleost pseudobagrus fulyidraco[J]. Acta Biologiae Experimentalis Sinica, 1996, 29(3): 235-245.
[23] 王茜, 王小刚, 李鹏, 等. 4种虾虎鱼类精子超微结构的研究与比较[J]. 江苏农业科学, 2015, 43(11): 320- 322. Wang Qian, Wang Xiaogang, Li Peng, et al. Comparatively studies on the ultrastructures of the spermatozoon of 4 goby[J]. Jiangsu Agricuiltural Sciences, 2015, 43(11): 320-322.
[24] Stoss J. Six fish gamete preservation and spermatozoan physiology[J]. Fish Physiology, 1983, 9: 305-350.
[25] Afzelius B A. Fine structure of the garfish spermatozoa[J]. Journal of Ultrastructure Research, 1978, 64: 309-314.
(本文编辑: 谭雪静)
Ultrastructure of spermatozoa of
LIU Kun1, 2, LIU Chang-lin2, CHEN Si-qing2, ZHANG Le-le1, 2, BIAN Li2
(1. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 200090, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China)
To study the ultrastructure of the spermatozoa of, we observed its external form and cross-section structure by scanning and transmission electron microscopy. The spermatozoa ofconsists of a head and tail. The head has no acrosome, is shell-shaped, and its main structure is the nucleus. At its caudal end there is a deep implantation fossa, 5/6 as deep as the head length. We observed the nucleus to consist of electron dense chromatin materials, with a head pit and nuclear vacuole whose chromatin was free. The centriolar compound of the midpiece is situated in the implantation fossa, which consists of three parts: the proximal centriole, the intercentriolar, and the basal body. The proximal centriole and the basal body were arranged orthogonally in a “T” structure, whereas the basal body was parallel to the spermatozoa. The sleeve was very deep, with the deepest point one third of the head length. The implantation fossa are shaped like rods and the sleeve is located behind the nucleus, which contains five to six mitochondria arranged in a circle. We found there to be a few ellipse vesicles in the sleeve outside the mitochondrion. The structure of the flagellum was such that it facilitated spermatozoa movement. The main structure of the tail was the axoneme, which was slim and long. The tail structure was a typical “9 + 2” model. The flagella were fine and they had no lateral fins. In this paper, we describe the morphological structure of the spermatozoa to enrich our understanding of the physiological contents of teleosts and to provide the basis for the identification of fish species.
; spermatozoa; ultrastructure
[The Basic Research Business of Yellow Sea Fisheries Research Institute Chinese Academy of Fishery Sciences, No.20603022016005]
Jan. 19, 2017
S962.1
A
1000-3096(2017)08-0040-06
10.11759//hykx20170119003
2017-01-19;
2017-03-30
中国水产科学研究院黄海水产研究所基本科研业务(20603022016005)
刘琨(1991-), 男, 山东青岛人, 在读研究生, 主要从事水产养殖学研究, 电话: 13045085912, E-mail: lkstardust@163.com;通信作者: 陈四清, 电话: 13589271079, E-mail: chensq@ysfri.ac.cn
