血浆游离DNA在非小细胞肺癌诊断中的价值
2017-12-27杜洁隋永杰李红艳王水利
杜洁 隋永杰 李红艳 王水利
·论著·
血浆游离DNA在非小细胞肺癌诊断中的价值
杜洁 隋永杰 李红艳 王水利
目的探讨血浆游离DNA水平在非小细胞肺癌(non-small cell lung cancer, NSCLC)中的诊断价值。方法选取陕西省人民医院健康中心120例健康对照者,并提取收治呼吸内科的116例非小细胞肺癌患者的,采用荧光定量PCR方法检测血浆游离DNA水平。结果非小细胞肺癌组患者的血浆游离DNA水平为200.70±88.54 ng/ml,健康对照组的血浆游离DNA水平为18.65±6.30 ng/ml,组间比较差异有统计学意义(P<0.01);Ⅰ/Ⅱ期非小细胞肺癌患者的血浆游离DNA水平为172.75±72.87 ng/ml,Ⅲ/Ⅳ期非小细胞肺癌血浆游离DNA水平为221.88±93.86 ng/ml,组间比较差异有统计学意义(P<0.05)。血浆游离DNA水平与患者的年龄、性别、吸烟状况及组织学类型无明显相关性(P>0.05)。结论血浆游离DNA是一种新发现的肿瘤标志物,可作为非小细胞肺癌早期诊断和临床分期的有效工具。
非小细胞肺癌; 血浆游离DNA; 早期诊断; 肿瘤标志物
肺癌是目前全球发病率及死亡率最高的恶性肿瘤之一,对人类健康已构成严重威胁[1]。肺癌构成比中约85%为非小细胞肺癌(non-small cell lung cancer, NSCLC),且约有70%的NSCLC患者发现时已确诊为肺癌晚期[2],其生存率显著下降。因此,早期诊断是提高NSCLC治疗效果的重要措施和手段。近年来有研究表明,肿瘤组织不断生长并释放DNA进入外周血成为血浆游离DNA,其与肿瘤细胞的基因组DNA遗传特性相同,有望成为新的潜在肿瘤标志物,从而为肿瘤的早期诊断提供新的思路和方法[3]。本研究通过荧光定量PCR检测NSCLC患者的血浆游离DNA,评估其在NSCLC患者诊断中的应用价值。
资料与方法
一、一般资料
入选病例为2015年12月至2016年12月陕西省人民医院呼吸内科就诊的116例NSCLC患者(NSCLC组),包括女52例,男64例;年龄范围41~78岁,平均年龄(58.6±10.5)岁。所有患者均经细胞学或病理学检查确诊为NSCLC,其中腺癌60例,鳞癌56例。根据国际抗癌联盟(union for international cancer control, UICC)2009年公布的第7版肺癌TNM分期标准对所有NSCLC患者进行TNM分期。患者血标本采集前均未行手术、放疗及化疗等相关抗肿瘤治疗。排除标准:病毒性肝炎、HIV等病毒感染性疾病、自身免疫性疾病及严重肝肾损害性疾病。同时收集本院120例健康体检者作为对照组,包括女59例,男61例,年龄范围38~79岁,平均年龄57.4岁。所有研究对象均知情同意。研究获院伦理委员会批准。
二、研究方法
1. 外周血样本的采集: 抽取所有受检者空腹静脉血约5 ml,采用离心机离心10 min (20 ℃,离心半径8 cm,3 000 r/min),吸取血浆上清部分转移至2 ml无菌EP管中,采用低温高速离心机离心10 min(4 ℃,离心半径8 cm,12 000 r/min),取血浆上清以1 ml/管分装,最后放置于-80 ℃冰箱冻存备用,操作过程在2 h内完成。
2. 血浆游离DNA的提取: 采用QIAamp DNA Blood Midi Kit (Qiagen公司,德国)试剂盒严格按照操作步骤说明进行血浆DNA的提取。取血浆样本500 μl,依次调制50 μl蛋白酶、500 μl Buffer AL及500 μl乙醇,最后加入50 μl的 Buffer AE洗脱液。将提取到的血浆游离DNA放置于-20 ℃冰箱保存备用。
3. 血浆游离DNA水平的测定: ①参考Yoon文献[4]中的β-actin引物序列:上游引物5′-CCACACTGTGCCCATCTACG-3′,下游引物5′-AGGATCTTCATGAGGTAGTCAGTCAG-3′,扩增产物长度99 bp,引物序列由上海工生物工程技术服务有限公司提供;②将DNA模板以及所有DNA样品分别配置RT-PCR反应体系,总反应体系为20 μl,包括荧光PCR反应液(SYBR Premix Ex Taq) 11 μl,1 μmol/L上、下游引物各1 μl,DNA模板1 μl,ddH2O 6 μl。根据引物序列设置循环参数: 95 ℃、1 min,95 ℃、20 s,60 ℃、30 s,68 ℃、45 s,共40个循环。
4. 标准曲线绘制及DNA水平计算: 用已知浓度的DNA标准品得到的ct值绘制标准曲线,见图1。ct值与DNA含量的对数呈线性关系,采用PCR仪自带的分析软件根据样品中的ct值得到样品浓度。分析NSCLC组患者的血浆游离DNA水平与临床参数及组织学类型之间的关系。
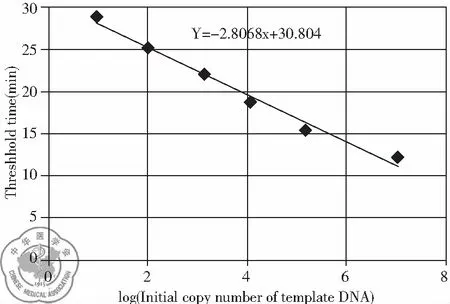
图1 标准曲线图
三、统计学方法
结 果
一、NSCLC组和健康对照组之间血浆游离DNA水平的比较
研究结果表明,NSCLC组的血浆游离DNA水平为(200.70±88.54)ng/ml,明显高于健康对照组的血浆游离DNA水平(18.65±6.30)ng/ml,两组之间比较差异有统计学意义(P<0.01)。
二、NSCLC组患者的血浆游离DNA水平与临床相关参数及组织学类型的相关性
NSCLC组患者的血浆游离DNA水平与性别、年龄、吸烟状况及组织学类型均无明显相关性(P>0.05),与临床分期存在相关性(P<0.05),NSCLC患者血浆游离DNA水平与临床参数及组织学类型的关系,见表1。

表1 NSCLC患者血浆游离DNA 水平与临床参数及组织学类型的关系 (ng/ml)
讨 论
目前,临床上常见的肺癌诊断方法主要包括血清肿瘤标志物检测、痰脱落细胞学检查、纤维支气管镜检查、肺穿刺活检及影像学等相关检查,然而在特异度、灵敏度或患者依从性方面都还存在一些局限性。
游离DNA存在于循环系统中的结论已经被证实,它是含有DNA双螺旋结构的核苷酸片段,长度为160~200个碱基对,与细胞凋亡后经酶降解产生的核小体加上一个连接片段的长度大致相同,说明游离DNA可能多系细胞凋亡所产生[5]。健康人血浆中存在少量游离DNA,而肿瘤患者的血浆游离DNA水平显著升高,约为健康人的10倍以上,其来源主要是[6]:①肿瘤细胞或微转移灶;②肿瘤细胞凋亡及坏死;③肿瘤细胞自身释放DNA。随着DNA从肿瘤组织中释放进入血液,导致血浆游离DNA水平显著升高。游离DNA可以出现与原发肿瘤DNA相同的遗传特征或基因改变, 两者有着共同的遗传特性,进一步研究表明游离DNA与肿瘤的发生、生展有着重要的相关性[7-8]。
与临床常用的五项血清肿瘤标志物(CEA、CA125、NSE、CYFRA21-1、SSC-Ag)相比,血浆游离DNA对肺癌检测的阳性率比单一肿瘤标志物检测高得多,且和五项血清肿瘤标志物联合检测的总阳性率相接近。另有学者认为,当血浆游离DNA联合血清五项肿瘤标志物(CEA、CA125、NSE、CYFRA21-1、SSC-Ag)共同对肺癌进行检测时,诊断的灵敏度可显著提高[9]。Newman等[10]研究发现血浆游离DNA对Ⅱ~Ⅳ期NSCLC患者检测的灵敏度为100%,对Ⅰ期NSCLC患者检测的灵敏度为50%;对各期NSCLC患者检测的特异度均为96%。
本研究结果显示,NSCLC组患者的血浆游离DNA水平明显高于健康对照组(P<0.01),与Ulivi等[11]研究报告的结果一致。NSCLC组患者的血浆游离DNA水平具有较高的区分度,提示血浆游离DNA有可能作为NSCLC早期诊断的肿瘤标志物。并且外周血样本取材相对容易、微创或无创,血浆游离DNA检测犹如“液体活检”,是一种方便、快捷的分子生物学检测手段[12]。血浆游离DNA水平在NSCLC组患者的性别、年龄及吸烟状况中作比较,差异无统计学意义(P>0.05),提示患者的性别、年龄及吸烟状况对血浆游离DNA的释放可能无影响。通过分析NSCLC不同组织学类型的血浆游离DNA水平发现,腺癌患者和鳞癌患者的血浆游离DNA水平之间比较,差异无统计学意义(P>0.05)。Szpechcinski等[13]研究也指出,血浆游离DNA水平在不同组织学类型上无显著差异。然而邓水秋等[14]的研究结论却不相同,称血浆游离DNA水平在腺癌患者中明显高于鳞癌患者。考虑结论不相同的原因可能与研究样本例数较少、DNA提取方法不同或不同组织学类型存在增殖动力学差异有关,但仍有待进一步验证。本研究结果提示血浆游离DNA水平在Ⅲ/Ⅳ期NSCLC患者中明显高于Ⅰ/Ⅱ期NSCLC患者,与肺癌临床分期存在相关性(P<0.05),这一结果与Madhavan等[15]研究结论相一致。其原因可能是Ⅲ/Ⅳ期NSCLC患者肿瘤负荷量较大,肿瘤细胞数量较多,凋亡、坏死几率较大及释放量增多,从而导致中晚期NSCLC患者的血浆游离DNA水平显著升高,提示根据NSCLC患者的血浆游离DNA水平有可能成为判断患者生存及预后的有效方法[16-20]。
综上所述,尽管游离DNA与其他肺癌血清标志物相比具有明显的优势,但是该研究尚处于初级阶段,仍然具有一定的局限性。另外,血浆游离DNA水平的检测还有赖于灵敏度高、特异性强的现代化标准检测手段。血浆游离DNA水平与NSCLC的发生、发展密切相关,是一种潜在的有价值的生物学标志物,其量化可成为临床上NSCLC早期诊断和肿瘤分期的工具,为评估疾病的严重程度及判断患者预后提供更加准确的信息。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及原因[J/CD].中华肺部疾病杂志(电子版), 2011, 4(1): 1-6.
2 Maione P, Rossi A, Sacco PC, et al. Advance in chemotherapy in advanced non-small-cell Lung cancer[J]. Expert Opin Pharmacother, 2010, 11(18): 2997-3007.
3 Diaz LA Jr, Bardelli A. Liquid Biopsies: Genotyping circulating tumor DNA[J]. J Clin Oncol, 2014, 32(6): 579-586.
4 Yoon KA, Park S, Lee SH, et al. Comparison of circulating plasma DNA levels between lung cancer patients and healthy controls[J]. J Mol Diagn, 2009, 11(3): 182-185.
5 Heitzer E, Auer M, Hoffmann EM, et al. Establishment of tumor-specific copy number alterations from plasma DNA of patients with cancer[J]. Int J Cancer, 2013, 133(2): 346-356.
6 Nakao M, Muramatsu H, Sone K, et al. Epidermal growth factor receptor-tyrosine kinase inhibitors for non-small-cell lung cancer patients aged 80 years or older: a retrospective analysis[J]. Mol Clin Oncol, 2015, 3(2): 403-407.
7 Shao ZM, Nguyen M. Tumor-specific DNA in plasma of breast cancer patients[J]. Anti-cancer Drngs, 2002, 13(4): 353-357.
8 Lee HS, Hwang SM, Kim TS, et al. Circulating methylated septin 9 nucleic Acid in the plasma of patients with gastrointestinal cancer in the stomach and colon[J]. Transl Oncol, 2013, 6(3): 290-296.
9 Wu Y, Du X, Xue C, et al. Quantification of serum SOX2 DNA with FQ-PCR potentially provides a diagnostic biomarker for lung cancer[J]. Med Oncol, 2013, 30(4): 737.
10 Newman AM, Bratman SV, To J, et al. An ultrasensitive method for quantitating circulating tumor DNA with broad patient coverage[J]. Nat Med, 2014, 20(5): 552-558.
11 Ulivi P, Mercatali L, Casoni GL, et al. Multiple marker detection in peripheral blood for NSCLC diagnosis[J]. PLoS One, 2013, 8(2): e57401.
12 Lebofsky R, Decraene C, Bernard V, et al. Circulating tumor DNA as a non-invasive substitute to metastasis biopsy for tumor genotyping and personalized medicine in a prospective trial across all tumor types[J]. Mol Oncol, 2015, 9(4): 783-790.
13 Szpechcinski A, Chorostowska-Wynimko J, Struniawski R, et al. Cell-free DNA levels in plasma of patients with non-small-cell lung cancer and inflammatory lung disease[J]. Br J Cancer, 2015, 113(3): 476-483.
14 邓水秋, 欧阳学农, 余宗阳, 等. 晚期非小细胞肺癌血清游离 DNA 水平变化及意义[J]. 山东医药, 2013, 53(30): 6-8.
15 Madhavan D, Wallwiener M, Bents, et al. Plasma DNA integrity as a biomarker for primary and metastatic breast cancer and potential marker for early diagnosis[J]. Breast Cancer Res Treat, 2014, 146(1): 163-174.
16 Perrone F, Lampis A, Bertan C, et al. Circulating free DNA in a screening program for early colorectal cancerdetection[J]. Tumori, 2014, 100(2): 115-121.
17 Battaglia P, Baritono E, Remo A, et al. KRAS mutations and M2PK upregulation in stool samples from individuals with positive fecal occult blood tests screened for colorectal cancer[J]. Tumori, 2014, 100(2): 122-127.
18 Tabernero J, Lenz HJ, Siena S, et al. Analysis of circulating DNA and protein biomarkers to predict the clinical activity of regorafenib and assess prognosis in patients with metastatic colorectal cancer: a retrospective, exploratory analysis of the CORRECT trial[J]. Lancet Oncol, 2015, 16(8): 937-948.
19 Spindler KL, Pallisgaard N, Andersen RF, et al. Changes in mutational status during third-line treatment for metastatic colorectal cancer-results of consecutive measurement of cell free DNA, KRAS and BRAF in the plasma[J]. Int J Cancer, 2014, 135(9): 2215-2222.
20 Tabernero J, Lenz HJ, Siena S, et al. Analysis of circulating DNA and protein biomarkers to predict the clinical activity of regorafenib and assess prognosis in patients with metastatic colorectal cancer: a retrospective, exploratory analysis of the CORRECT trial[J]. Lancet Oncol, 2015,16(8): 937-948.
ValueofplasmafreeDNAinthediagnosisofnon-smallcelllungcancer
DuJie,SuiYongjie,LiHongyan,WangShuili.
Medicalexaminationcenter,ShanxiProvincialPeople′sHospital,Xi′an710068,China
DuJie,Email:dujie123._@163.com
ObjectiveTo evaluate the value of plasma free DNA in the diagnosis of non-small cell lung cancer (NSCLC).MethodsPlasma was collected from 116 patients with non-small cell lung cancer admitted to respiratory department, and 120 healthy subjects from Medical examination center, Shanxi Provincial People′s Hospital. Plasma free DNA was extracted and detected by fluorescence quantitative polymerase chain reaction, PCR.ResultsThe plasma free DNA level of healthy people was (18.65±6.30) ng/ml, and the plasma free DNA level in patients with non-small cell lung cancer was (200.70±88.54) ng/ml, the difference was statistically significant(P<0.01). The plasma free DNA content of stage Ⅰ/Ⅱ non-small cell lung cancer was (172.75±72.87) ng/ml, and the plasma circulating DNA content in stage Ⅲ/Ⅳ non-small cell lung cancer was (221.88±93.86) ng/ml,(P<0.05). There was no significant correlation between sex, age, smoking status and histological type (P>0.05).ConclusionPlasma circulating DNA is a potentially valuable biomarker that may be an effective tool for early diagnosis and clinical staging of non-small cell lung cancer.
Non-small cell lung cancer; Plasma free DNA; Early diagnosis; Tumor marker
10.3877/cma.j.issn.1674-6902.2017.06.011
陕西省科技厅2013年科技惠民专项(2013K14-02-09)
710068 西安,陕西省人民医院健康体检中心
杜洁, Email: dujie123._@163.com
R563
A
2017-07-16)
王亚南)
杜洁,隋永杰,李红艳,等. 血浆游离DNA在非小细胞肺癌诊断中的价值[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(6): 686-689.
