血清胱抑素C与稳定期慢性阻塞性肺疾病患者疾病严重程度相关性分析
2017-12-27庞志刚成孟瑜许建英
庞志刚 成孟瑜 许建英
·论著·
血清胱抑素C与稳定期慢性阻塞性肺疾病患者疾病严重程度相关性分析
庞志刚 成孟瑜 许建英
目的探讨稳定期慢性阻塞性肺疾病 (COPD)患者不同气流受限及疾病严重程度时血清胱抑素C(Cys-C)水平的变化及其相关性, 寻找评估稳定期COPD患者疾病严重程度的生物标志物。方法选取山西大医院2016年1月至12月门诊随访的94例COPD患者作为COPD组;选取同期本院体检中心的31例健康体检者作为健康对照组,分别行肺功能检查,同时检测血清胱抑素C和肌酐(Cr)水平,计算肾小球滤过率(GFR)。根据肺功能FEV1%预计值将COPD组患者分为GOLD1、2、3、4级;根据过去1年的加重次数、生活质量评分(CAT)又将COPD组患者分为A、B、C、D四个亚组。结果COPD组患者血清Cys-C水平高于健康对照组,差异有统计学意义(P<0.05);COPD患者全球慢性阻塞性肺疾病防治倡议(GOLD)1、2、3、4级血清Cys-C水平差异有统计学意义(P<0.01),GOLD 4级患者血清Cys-C水平高于GOLD1、2和3级;COPDA、B、C、D组患者血清Cys-C水平差异有统计学意义(P<0.01),D组血清Cys-C水平高于A、B组,C组血清Cys-C水平高于A组;相关性分析显示血清Cys-C与CRP呈正相关,与GFR、FEV1%预计值呈负相关。结论稳定期COPD患者血清胱抑素C水平增高,并且随着气流受限及综合评估严重程度的加重而升高,提示胱抑素C可作为评估COPD严重程度的生物标志物。
肺疾病,慢性阻塞性; 胱抑素C; 肺功能
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD) 是一种常见的以持续性呼吸道症状和气流受限为特征的可以预防和治疗的疾病,呼吸症状和气流受限是由于气道和/或肺泡异常导致的,其原因通常是明显的有毒颗粒和气体暴露,临床上分为急性加重期与稳定期[1-3]。在2017年新版全球慢性阻塞性肺疾病防治倡议(GOLD)指南中将稳定期COPD患者疾病严重程度评估分为两个部分,第一部分根据气流受限严重程度,即GOLD的肺功能分级进行评估;第二部分根据在过去的1年中急性加重次数及症状评分进行综合评估[4]。胱抑素C (cystatin C, Cys-C) 是一种非糖化蛋白,属于半胱氨酸蛋白酶抑制剂,由体内大部分有核细胞产生、生成速度相对恒定,其生理功能是影响蛋白水解酶的活性,影响COPD患者的蛋白酶及抗蛋白酶代谢过程[5-6]。研究发现COPD急性加重期患者存在血清胱抑素C的高水平,且胱抑素C水平变化与肺功能第一秒呼吸容积( forced expiratory volume in one second, FEV1)呈负相关,但胱抑素C水平与COPD患者疾病严重程度综合评估的相关性尚未检索到相关文献报道[7-8]。本研究通过观察稳定期COPD患者不同气流受限及疾病严重程度时血清胱抑素C水平的变化及其相关性,寻找评估稳定期COPD患者疾病严重程度的生物标志物。
对象与方法
一、研究对象
选择山西大医院2016年1月至12月门诊随访的94例稳定期COPD患者作为COPD组,其中男76例(80.9%),女18例(19.1%);年龄43~89岁,平均年龄65.9岁;均符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》及稳定期慢性阻塞性肺疾病的诊断标准[2]。选取同期山西大医院体检中心健康体检者31例作为健康对照组,其中男16例(51.6%),女15例(48.4%);年龄46~79岁,平均年龄63.4岁。
根据GOLD2017,过去一年加重次数、生活质量评分(CAT)将COPD组患者又分为症状少、风险低组(A组)33例;症状多、风险低组(B组)26例;症状少、风险高组(C组)12例;症状多、风险高组(D组)23例。根据肺功能FEV1%预计值将COPD组患者分为GOLD 1级(80%预计值≤FEV1)26例、GOLD2级(50%预计值≤FEV1<80%预计值)28例、GOLD3级(30%预计值≤FEV1<50%)33例、GOLD4级(FEV1<30%预计值)7例。
二、研究方法
1. 标本采集: 患者与健康体检者入组后均抽取清晨空腹静脉血5 ml,待血液凝固后以离心半径8 cm,4 000 r/min离心10 min,分离血清于-80 ℃低温保存。
2. 血清胱抑素C、肌酐、C反应蛋白测定: 使用贝克曼AU400全自动生化分析仪检测血清学标志物。采用免疫比浊法测定血清胱抑素C,采用肌氨酸氧化酶法检测血清肌酐(creatinine, Cr),采用乳胶增强免疫比浊法测定C反应蛋白(C-reactive protein, CRP)水平;采用MDRD方程计算肾小球滤过率(glomerular filtration rate, GFR),GFR=186×血肌酐-1.154×年龄-0.203×0.742 (女性)[9]。
3. 肺功能指标: 肺功能测定使用Master Screen肺功能检测仪(德国Jaeger公司),按规定校准温度、湿度、大气压后测定。每位受试者测定前均需休息15 min,吸入支气管扩张剂(沙丁胺醇气雾剂)后测定FEV1、用力肺活量(forced vital capacity, FVC)及FEV1/FVC的值。
三、统计学方法
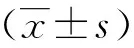
结 果
一、COPD组与健康对照组血清学指标比较
COPD组与健康对照组相比年龄、血清CRP、肌酐、肾小球滤过率,差异无统计学意义;COPD组患者血清胱抑素C高于健康对照组,差异有统计学意义,见表1。
二、COPD患者GOLD肺功能分级各亚组血清学指标比较
GOLD 1、2、3、4级四个亚组间患者血清肌酐、CRP水平比较,差异均无统计学意义;GOLD4级患者血清胱抑素C高于GOLD 1、2和3级患者,差异均有统计学意义,肾小球滤过率低于GOLD 1级和2级患者,差异均有统计学意义,见表2。
三、COPD患者A、B、C、D各亚组血清学指标比较
A、B、C、D四个亚组间患者血清肌酐水平比较,差异均无统计学意义;D组患者血清胱抑素C水平高于A、B组,C组患者血清胱抑素C水平高于A组,差异均有统计学意义,D组患者肾小球滤过率低于A、B组患者,差异均有统计学意义,D组患者血清CRP水平高于A、B组患者,差异均有统计学意义,见表3。
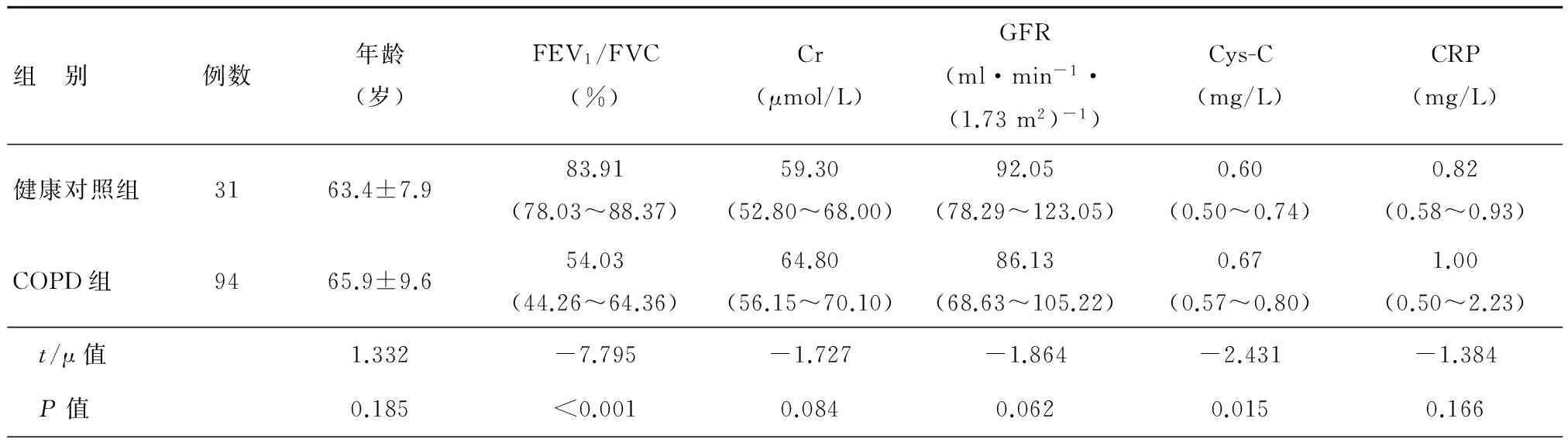
表1 两组血清学指标比较[M(QR)]
注:年龄描述用组间比较采用t检验;其余变量描述用[M(QR)],采用秩和检验进行组间比较。FEV1:第一秒用力呼气容积;FVC:用力肺活量;Cr:血清肌酐;GFR:肾小球滤过率;Cys-C :血清胱抑素C;CRP :血清C反应蛋白
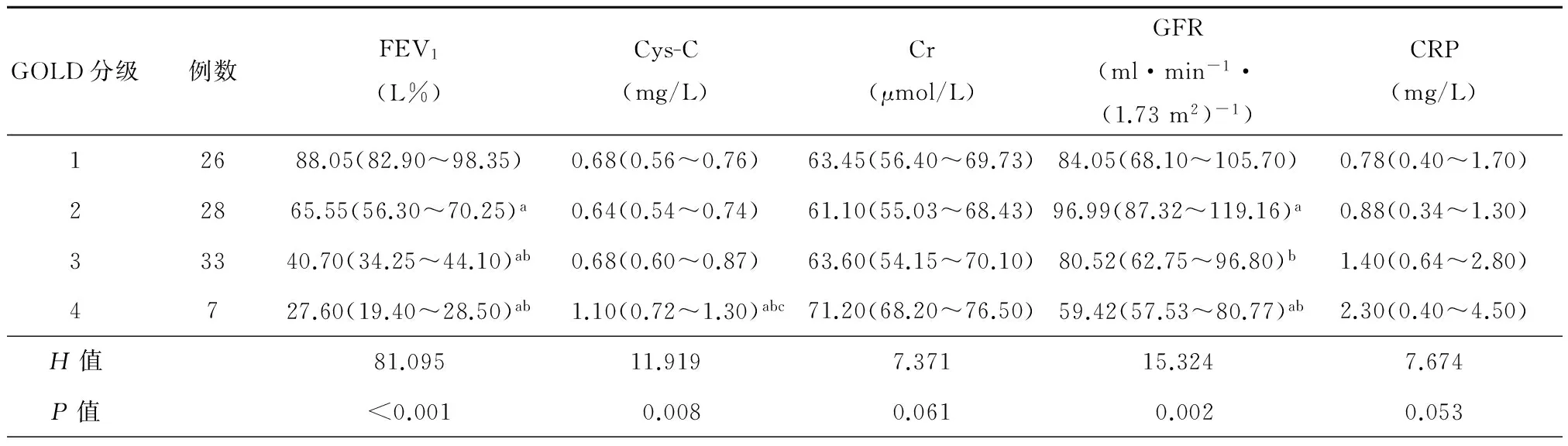
表2 GOLD分级四组血清学指标比较[M(QR)]
注:a:与A组相比P<0.05;b:与B组相比P<0.05;c:与C组相比P<0.05。FEV1:第一秒用力呼气容积;Cr:血清肌酐;GFR:肾小球滤过率;Cys-C :血清胱抑素C;CRP :血清C反应蛋白

表3 A、B、C、D四组血清学指标比较[M(QR)]
注:a:与A组相比P<0.05;b:与B组相比P<0.05。Cr:血清肌酐;GFR:肾小球滤过率;Cys-C :血清胱抑素C;CRP :血清C反应蛋白
四、胱抑素-C与肺功能、血清学标志物的相关性
血清胱抑素C与CRP呈正相关(r值分别为0.375,P<0.001),与肾小球滤过率、肺功能FEV1%预计值呈负相关(r值为-0.504、-0.215,P分别为<0.001、0.005)。
讨 论
COPD是一种常见的以持续呼吸道症状和气流受限为特征的可以预防和治疗的疾病,FEV1占预计值的百分比是评价COPD患者气流受限严重程度的敏感指标。COPD患者主要病理表现为慢性气道炎症及气道壁结构破坏,最终导致气道重塑,气道重塑过程中大量炎症细胞、上皮细胞、细胞因子和蛋白酶等多重因素参与气道重塑,尤其是细胞外间质成分的改变是气道重塑的重要原因之一,蛋白酶与内源性蛋白酶抑制剂失衡是COPD进展的重要发病机制之一,参与了细胞外基质损伤过程[10-11]。蛋白酶按其活性中心不同(催化蛋白水解机制不同),可分为:丝氨酸蛋白酶、天冬氨酸蛋白酶、金属蛋白酶和半胱氨酸蛋白酶[12]。组织蛋白酶(cathepsin, Cath)是一大类主要存在于各种动物组织细胞(特别是溶酶体内)内的肽键水解酶,其大部分属于半胱氨酸蛋白酶(cysteineprotease),其中组织蛋白酶S是重要的溶酶体蛋白酶,更是主要的组织蛋白酶,与金属基质蛋白酶和丝氨酸蛋白酶(各种凝血因子及纤溶系统)一起是参与细胞外蛋白降解[13]。胱抑素C是人类细胞外组织蛋白抑制剂之一,它由炎症细胞分泌至血液中,是体内重要的内源性半胱氨酸蛋白酶抑制剂和各种慢性炎症的标记物[14]。Nakajima等[15]对66例吸烟健康者、52例非吸烟健康者及94例COPD患者行血清组织蛋白酶S、胱抑素C水平检测后发现,COPD患者组织蛋白酶S与血清胱抑素C的水平均明显高于吸烟与非吸烟健康者。Zhang等[7]对93例急性加重期及299例稳定期COPD患者进行研究,发现急性加重期和稳定期COPD患者血清胱抑素C水平均明显增高,而且稳定期COPD患者血清胱抑素C水平与FEV1%预计值及FEV1/FVC均呈负相关,FEV1和年龄被作为血清胱抑素C水平的独立预测因子。本研究结果显示,稳定期COPD患者血清胱抑素C水平高于健康对照组,血清胱抑素C水平与FEV1%预计值呈负相关,与上述报道相一致。提示COPD患者存在较高水平的血清胱抑素C,并且随着气流受限严重程度的加重而升高。
有关胱抑素C水平与COPD患者疾病严重程度综合评估的相关性研究报道较少,本研究通过观察经综合评估后不同严重程度稳定期COPD患者的血清胱抑素C水平,发现D组患者血清胱抑素C水平最高,C组患者次之,A组最低,即症状评分越高、过去一年急性加重次数越多的COPD患者血清胱抑素C水平也越高。COPD是以气道、肺实质和肺血管的慢性炎症为特征,在肺的不同部位有肺泡巨噬细胞、T淋巴细胞和中性粒细胞增加,激活的炎症细胞释放多种介质,导致肺结构的破坏。同时肺局部炎症介质的“溢出”,最终诱发全身炎症反应[16-21]。在其病程中反复的感染、急性加重是引起COPD疾病进展的重要因素。而血清CRP由肝细胞所合成,具有激活补体和促进粒细胞及巨噬细胞吞噬的作用,是临床上常用的机体各种炎症反应的敏感指标。胱抑素C是一种低分子量蛋白质,可经肾小球自由滤过,在近曲小管被重吸收并降解,肾脏是清除循环中胱抑素C的重要脏器,正常人血清胱抑素C浓度主要由肾小球滤过率决定。本研究结果还发现血清胱抑素C与血清CRP呈正相关,与肾小球滤过率呈负相关,推测COPD患者血清胱抑素C水平的增高,一方面源于局部和全身的炎症反应生成增多,另一方面这些患者有可能存在比较早期的、临床尚未表现出的肾功能损伤(肌酐水平正常)所致的清除减少。
综上所述,本研究结果显示稳定期COPD患者血清胱抑素C水平增高,并且随着气流受限及综合评估严重程度的加重而升高,提示胱抑素C可作为评估COPD严重程度的生物标志物。
1 任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志(电子版), 2009, 2(2): 104-115.
2 Vogelmeier CF, Criner GJ, Martinez FJ, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report: GOLD executive summary[J]. Arch Bronconeumol, 2017, 53(3): 128-149.
3 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版) [J]. 中华结核和呼吸杂志, 2013, 36(4): 484-491.
4 Mittal R, Chhabra SK. GOLD Classification of COPD: Discordance in criteria for symptoms and exacerbation risk assessment[J]. COPD, 2017, 14(1): 1-6.
5 Mussap M, Plebani M. Biochemistry and clinical role of human cystatin C[J]. Crit Rev Clin Lab Sci, 2004, 41(5-6): 467-550.
6 Rokadia HK, Agarwal S. Serum cystatin C and emphysema: results from the National Health and Nutrition Examination Survey (NHANES)[J]. Lung, 2012, 190(3): 283-290.
7 Zhang Y, Zhu Y, Wu Y, et al. Serum cystatin C as a potential biomarker for the evaluation COPD[J]. Int J Clin Exp Med, 2014, 7(12): 5484-5490.
8 Zhang M, Li Y, Yang X, et al. Serum cystatin C as an inflammatory marker in exacerbated and convalescent COPD patients[J]. Inflammation, 2016, 39(2): 625-631.
9 Matsushita K, Mahmoodi BK, Woodward M, et al. Comparison of risk prediction using the CKD-EPI equation and the MDRD study equation for estimated glomerular filtration rate[J]. JAMA, 2012, 307(18): 1941-1951.
10 Pain M, Bermudez O, Lacoste P, et al. Tissue remodelling in chronic bronchial diseases: from the epithelial to mesenchymal phenotype[J]. Eur Respir Rev, 2014, 23(131): 118-130.
11 Abboud RT, Vimalanathan S. Pathogenesis of COPD. Part I. The role of protease-antiprotease imbalance in emphysema[J]. Int J Tuberc Lung Dis, 2008, 12(4): 361-367.
12 Owen CA. Roles for proteinases in the pathogenesis of chronic obstructive pulmonary disease[J]. Int J Chron Obstruct Pulmon Dis, 2008, 3(2): 253-268.
13 Vasiljeva O, Dolinar M, Pungercar JR, et al. Recombinant human procathepsin S is capable of autocatalytic processing at neutral pH in the presence of glycosaminoglycans[J]. FEBS Lett, 2005, 579(9): 1285-1290.
14 Xu Y, Ding Y, Li X, et al. Cystatin C is a disease-associated protein subject to multiple regulation[J]. Immunol Cell Biol, 2015, 93(5): 442-451.
15 Nakajima T, Nakamura H, Owen CA, et al. Plasma cathepsin S and cathepsin S/cystatin C ratios are potential biomarkers for COPD[J]. 2016, 2016: 4093870.
16 Gan WQ, Man SF, Senthilselvan A, et al. Association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis[J]. Thorax, 2004, 59(7): 574-580.
17 Karadag F, Kirdar S, Karul AB, et al. The value of C-reactive protein as a marker of systemic inflammation in stable chronic obstructive pulmonary disease[J]. Eur J Intern Med, 2008, 19(2): 104-108.
18 Valipour A, Schreder M, Wolzt M, et al. Circulating vascular endothelial growth factor and systemic inflammatory markers in patients with stable and exacerbated chronic obstructive pulmonary disease[J]. Clin Sci (Lond), 2008, 115(7): 225-232.
19 Broekhuizen R, Wouters EF, Creutzberg EC, et al. Polyunsaturated fatty acids improve exercise capacity in chronic obstructive pulmonary disease[J]. Thorax, 2005, 60(5): 376-382.
20 Stockley RA. Progression of chronic obstructive pulmonary disease: impact of inflammation, comorbidities and therapeutic intervention[J]. Curr Med Res Opin, 2009, 25(5): 1235-1245.
21 Sin DD, Man SF. Systemic inflammation and mortality in chronic obstructive pulmonary disease[J]. Can J Physiol Pharmacol, 2007, 85(1): 141-147.
Correlativeanalysisofthelevelofserumcystatin-Cindifferentseverityofpatientswithstablechronicobstructivepulmonarydisease
PangZhigang,ChengMengyu,XuJianying.
DepartmentofRespiratoryMedicine,ShanxiDayiHospitalAffiltatedtoShanxiMedicalUniversity,Taiyuan030032,China
XuJianying,Email:xujyty@tom.com
ObjectiveTo observe change and the correlation of serum Cystatin C ( Cys-C) levels of the stability of stable chronic obstructive pulmonary disease (COPD) patients with different limited airflow and the severity of disease.MethodsA total of 94 COPD patients of Shanxi Dayi hospital from January 2016 to December were followed up as COPD group; 31 healthy subjects in the hospital physical examination center were selected as healthy control group. Pulmonary function tests, serum cystatin C and creatinine (Cr) levels were measured respectively, meanwhile, Calculated glomerular filtration rate. According to the estimated percentage of pulmonary function FEV1, the patients with COPD were divided into four different subgroups: GOLD1, 2, 3 and 4stage; According to the history of acute exacerbation number and COPD assessment test, the patients with COPD were divided into four different subgroups: A, B, C and D.ResultsThe serum Cys-C level in patients with stable COPD was higher than those in healthy controls (P<0.05). There were significant differences in the serum Cys-C among stable COPD patients of GOLD1, 2, 3 and 4stage(P<0.01), the serum Cys-C levels in GOLD4 stage were higher than GOLD1, 2, 3 stage.There were significant differences in the serum Cys-C among stable COPD patients of A, B, C and D subgroup(P<0.01), the serum Cys-C levels in D subgroup were higher than A, B subgroup, the serum Cys-C levels in C subgroup were higher than A subgroup. The serum Cys-C levels were positive correlated with CRP (P<0.01) and significantly negative correlated with FEV1(P<0.01) and GFR(P<0.01).ConclusionsCOPD patients serum Cys-C level is higher, and increased with COPD disease severity. The serum Cys-C level may become biomarkers of the assessment of severity in patients with COPD.
Chronic obstructive pulmonary disease; Cystatin-C; Lung function
10.3877/cma.j.issn.1674-6902.2017.06.007
山西省青年科技研究基金资助(2014021040-4)
030032 太原,山西医学科学院 山西大医院呼吸与危重症医学科
许建英, Email: xujyty@126.com
R563
A
2017-10-16)
黄红稷)
庞志刚,成孟瑜,许建英. 血清胱抑素C与稳定期慢性阻塞性肺疾病患者疾病严重程度相关性分析[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(6): 668-672.
