银杏叶提取物对慢性阻塞性肺疾病大鼠气道及肺血管重塑的影响
2017-12-27谭玉萍王朝晖姚萍梁爱武杨益宝潘玲张鹏飞黎展华
谭玉萍 王朝晖 姚萍 梁爱武 杨益宝 潘玲 张鹏飞 黎展华
·论著·
银杏叶提取物对慢性阻塞性肺疾病大鼠气道及肺血管重塑的影响
谭玉萍1王朝晖2姚萍3梁爱武1杨益宝1潘玲1张鹏飞1黎展华1
目的探讨银杏叶提取物(GBE)对慢性阻塞性肺疾病(COPD)大鼠气道及肺血管重塑的干预作用。方法将清洁级同龄雄性Wistar大鼠90只称重后,按照随机数字表法,随机分为A、B、C、D、E和F组,每组15只。B、C、D、E、F五组采用烟雾吸入、脂多糖气管内注入等进行COPD造模,C、D组分别在1~14 d和29~42 d腹腔内注射GBE(0.40 ml/kg/d),E、F组分别在1~14 d和29~42 d腹腔内注射红霉素(10 mg/kg2),43 d后对各组大鼠肺脏行病理学检测。结果B、C、D、E、F五组均有COPD特征性改变,但程度不同。各组标准肺泡数的比较:A组与B、C、D、E、F组相比,差异均有统计学意义(P<0.05),B组与C、E两组相比较差异均有统计学意义(P<0.05)。各组平均肺泡面积的比较:A组与B、C、D、E及F组相比差异均有统计学意义(P<0.05);B组与C、E两组相比较差异均有统计学意义(P<0.05),C组与D、F两组相比较差异有统计学意义(P<0.05)。各组细支气管结构改变和肺泡内肺动脉的结构改变在统计学上意义上表现均相同:B组与A、C、D、E、F组相比较差异均有统计学意义(P<0.05),A、C、D、E、F各组之间比较差异均无统计学意义(P>0.05)。结论GBE对COPD大鼠模型气道重塑及肺血管重塑有抑制作用,与红霉素组干预作用相类似。
肺疾病,慢性阻塞性; 银杏叶提取物; 气道重塑; 肺血管重塑
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是最常见的呼吸系统疾病之一,其发生率、致残率以及病死率都较高,而且其发病率近年来呈上升趋势[1]。但是现有的治疗方法并不能有效的阻止或逆转COPD的进行性发展。近期研究表明在COPD的早期就已经出现了气道、肺泡及肺血管重塑,而早期的气道、肺泡及肺血管重塑具有一定的可逆性[2-3],因此如何在COPD的早期对其加以干预以阻止其进行性发展成为当前研究的热点。本研究通过观察银杏叶提取物(ginkgo bibloba extract, GBE)对COPD大鼠模型细支气管、肺泡和肺小动脉病理结构的影响,从病理学角度论证该药对COPD气道重塑、肺血管重塑的干预作用,为防治COPD与肺动脉高压带来新思路,为临床应用GBE防治COPD提供科学依据。应用小剂量红霉素治疗COPD是近年的研究热点,有研究表明红霉素能够部分减轻气道腔内炎症反应,改善中膜肌层增厚与细胞外基质沉积,纠正气道重塑[4-6],可作为COPD早期预防气道重塑和降低气道慢性炎症的药物。因此本研究用GBE药物干预及红霉素对照,检测大鼠的一般情况及肺泡、气管、血管的变化。
材料与方法
一、实验动物
健康清洁级7周龄雄性Wistar大鼠(广西医科大学动物实验中心提供,动物编号为SCXK20090002)90只,称重后随机取分为正常对照组(A组)、COPD对照组(B组)、GBE早期干预组(C组)、GBE后期干预组(D组)、红霉素早期干预组(E组)、红霉素后期干预组(F)六组。并对实验大鼠进行称重,A组与B、C、D、F组相比较差异均有统计学意义(P<0.05),E组与B、D组相比较差异均有统计学意义(P<0.05),其他各组之间相互比较差异均无统计学意义(P>0.05)。
二、试剂和器械
脂多糖由美国Sigma公司提供;过滤嘴香烟(焦油含量19 mg,尼古丁1.2 mg,真龙牌,南宁卷烟厂生产);有机玻璃密闭箱(80 cm×60 cm×50 cm,上方有一直径为1.2 cm的通气孔),CM1900型恒冷切片机;100倍、400倍奥林巴斯光学显微镜及图像分析软件(德国EPPENDORF公司);GBE选用舒血宁注射液(规格5 ml×1支,折合GBE 17.5 mg,含总黄酮醇苷4.2 mg,银杏内酯0.70 mg)为河北神威药业有限责任公司产品。注射用乳糖酸红霉素30万U/瓶,大连美罗大药厂生产(国药准字H21021227)。
三、实验方法
1. 造模方法: 参照文献[7]的造模方法,采用烟雾吸入、脂多糖气管内注入、冷空气刺激复合因素对大鼠进行COPD模型。参照文献[8]的药物干预时间点,A组于第1天和第14天气管内注入生理盐水(2 ml/kg)。B、C、D、E和F组在造模的第1天和第14天将大鼠用10%乌拉坦腹腔注射麻醉后,向大鼠气管内注入LPS100 μ(1 mg/ml)。第2~13天及第15~28天,每天在有机玻璃密闭箱持续吸入点燃的香烟雾30 min,香烟用量15支/d,熏烟后立刻将大鼠移至低温环境(15 ℃)冷空气刺激1 h,造模28 d结束。28 d后B﹑C﹑D、E、F各组随机处死大鼠两只,以确认造摸成功。
2. 给药方法: 分两阶段给药:第一阶段:在实验第1~14天,C组用GBE干预,E组用红霉素干预;A、B、D、F组用生理盐水对照。第二阶段:在实验第29~42天,D组用GBE干预,F组用红霉素干预; A、B、C、E组用生理盐水对照。用药量:C、D组GBE用药量为0.4 ml·kg-1·d-1(按照成人标准量0.29 ml/kg体重,采用体表面积比值法:成人量×70/56=大鼠用药量来换算); E、F 组红霉素用药量根据体表面积换算方法为100 mg/kg2;A、B组用生理盐水(1 ml/只,1次/d)对照。采用腹腔注射给药。
3. 标本采集及制作: 各组于全部用药结束后(第43天)各组大鼠称重后处死,取右肺下叶用10%甲醛固定,取距离肺门3 mm处的肺组织做连续切片,并分别进行苏木精-伊红染色、维多利亚蓝-范吉逊染色。
4. 病理检测: 采用100~400倍光学显微镜下观察及测量:肺泡(主要检测平均肺泡面积及标准肺泡数。)、支气管(选取膜性细支气管-直径750-1 100 μm,测量各组大鼠管壁厚度、管壁平滑肌厚度并计算比值,测量管壁面积、管腔面积并计算比值;重点检测管壁炎症细胞浸润情况)、肺血管(选取腺泡内肺动脉-直径<400 μm,测量血管平滑肌厚度、血管壁厚度并计算比值,测量血管壁面积、血管面积并计算比值,检测血管平滑肌增殖情况,微小血管类型变化,重点检测血管壁炎症细胞浸润情况等)。
四、统计学方法
结 果
一、实验大鼠一般情况比较
实验过程中由于麻醉意外导致E组1只大鼠死亡。实验前B组与C、D、E、F组之间进行两两比较,差异均无统计学意义(P>0.05);实验后测六组大鼠体重,见表1,B组与A、C、D、E、F组比较差异均有统计学意义(P<0.05),E组与C、D组相比较差异均有统计学意义(P<0.05),其他各组之间相互比较差异均无统计学意义(P>0.05)。A组精神状况良好,B组较差,C、E组一般,D、F组稍差;A组进食情况良好,B组较差,C、E组一般,D、F组稍差。

表1 各组大鼠实验前后体重变化的比较
二、实验大鼠肺泡病理改变
1. 标准肺泡数与平均肺泡面积: 各组大鼠细支气管形态改变,见图1。A组为正常肺泡结构,肺泡无融合,无炎症细胞浸润,肺泡结构整齐。B、C、D、E、和F组都可见肺组织炎症浸润、肺泡融合、肺大疱形成等COPD特征性改变,但其程度不同,各组大鼠平均肺泡面积及标准肺泡数比较,见表2。

表2 各组标准肺泡数及平均肺泡面积的比较
注:1. 标准肺泡数:a与A组比较,P<0.05;c与B组比较,P<0.05;b与B组比较(P>0.05);b与c相比P>0.05;2. 平均肺泡面积:a与A组比较,P<0.05;c与B组比较,P<0.05;b与B组比较(P>0.05);C组与E组相比差异无统计学意义(P>0.05),与D、F两组相比较差异有统计学意义(P<0.05);D、E、F两两相比,差异均无统计学意义(P>0.05)

图1 实验大鼠细支气管形态的病理改变(HE×400)
2. 实验大鼠细支气管病理改变: 各组大鼠细支气管形态改变见,图2。A组支气管结构正常;B组支气管平滑肌断裂、增生,支气管壁有大量炎症细胞浸润,支气管壁变薄;C组支气管平滑肌基本完整、轻度增生,支气管壁轻度增生,仅有少量散在炎症细胞;D组支气管平滑肌基本完整、轻度增生,支气管壁轻度增生,有中等量炎症细胞。E组支气管平滑肌基本完整、轻度增生,支气管壁轻度增生,仅有少量炎症细胞;F组的细支气管病理改变同E组。各组支气管结构的比较,见表3。

表3 各组支气管结构的比较
注:B组与a相比较差异均有统计学意义(P<0.05);a之间两两相比较差异均无统计学意义(P>0.05)
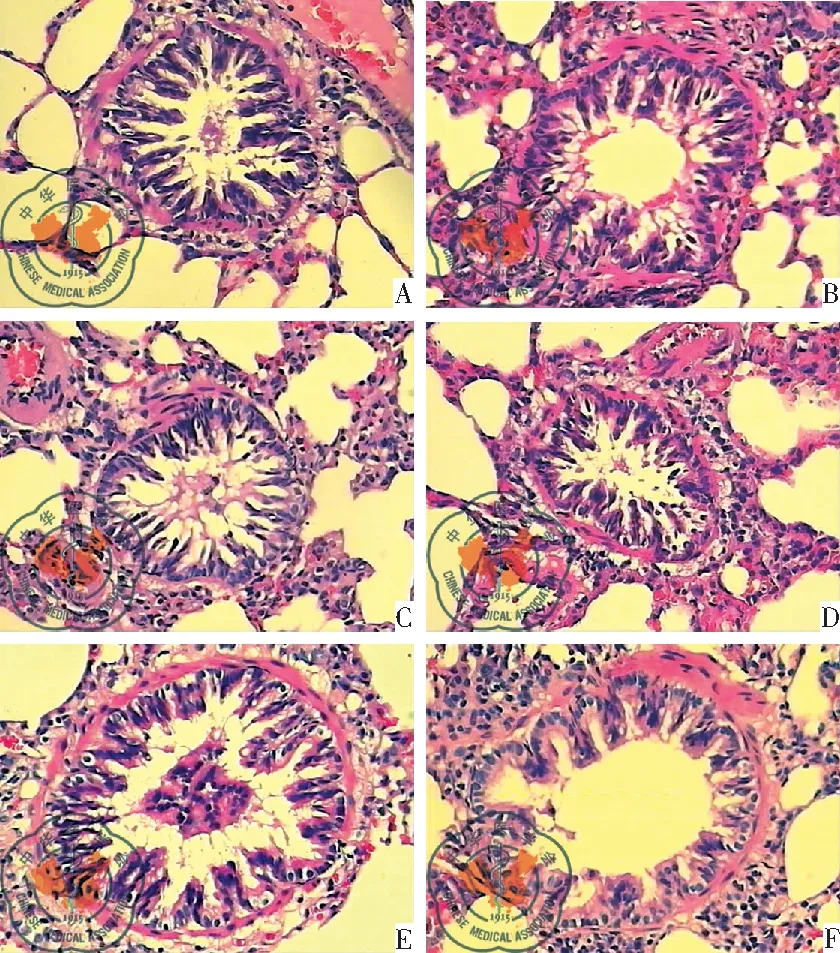
图2 实验大鼠细支气管病理改变(HE×100)
3. 实验大鼠腺泡内肺动脉病理改变: 各组腺泡内肺动脉病理改变见,图3。A组血管平滑肌均匀、无增生,血管壁无增厚,周围无炎症细胞浸润;B组血管平滑肌增生明显,几乎占据整个血管管壁,周围有大量炎症细胞浸润;C组、E组血管平滑肌轻度增生、血管壁轻度增厚,周围有少量炎症细胞浸润。D组和F组血管平滑肌中度增生,血管壁比较厚,周围可见中等量炎症细胞浸润。各组血管平滑肌厚度/血管壁厚度比较及各组血管壁面/总血管面积比较,见表4。
讨 论
肺泡、支气管、肺血管的结构破坏和重塑是COPD患者肺功能进行性下降并进一步发展为肺源性心脏病的主要病理基础[9]。目前认为气道、肺实质、肺血管的慢性炎症反应在COPD发病机制中起主要作用[10]。张伟等[11]研究显示慢性炎症可导致COPD大鼠气道及血管结构的破坏和重建。GBE 是从银杏叶中提取的化合物,目前被确证的发挥独特药理活性的有效成分主要包括黄酮类、萜内酯类化合物,具有清除自由基、抗炎、抑制血小板聚集等作用[12-14]。有研究表明GBE对大鼠COPD气道重塑和肺血管重塑均有明显的抑制作用,其作用机制可能与抑制气道、肺组织、肺血管的炎症反应有关[8,15-17]。应用小剂量红霉素治疗COPD是近年的研究热点,钟小宁等[18-19]研究发现红霉素能减轻慢性支气管炎与肺气肿的气道重构。因此我们的实验中采用烟雾吸入、脂多糖气管内注入、冷空气刺激的方法制作大鼠COPD模型,用GBE药物干预及红霉素对照,检测大鼠的一般情况及肺泡、气管、血管的变化。

表4 各组血管壁结构比较
注:B组与a相比较差异均有统计学意义(P<0.05);a之间两两相比较差异均无统计学意义(P>0.05)

图3 实验大鼠腺泡内肺动脉病理改变(HE×100)
本研究结果显示,与A组相比,COPD模型的B组大鼠体重明显减轻,肺泡病理可见肺泡大量融合,肺泡总数减少,单个肺泡面积增大,且周围有大量的炎症细胞浸润。肺细支气管可见平滑肌断裂、增生,支气管壁有大量炎症细胞浸润,支气管壁变薄。肺细小动脉病理可见平滑肌增生明显,几乎占据整个血管管壁,周围有大量炎症细胞浸润。提示香烟烟雾等引起的慢性炎症可导致肺泡,肺细支气管、肺泡内小动脉的结构改变和结构重塑,与张伟等[11]的研究结果基本一致。长期累积的肺脏结构和功能改变最终会造成COPD患者肺功能的持续进行性下降及通气/血流的失衡等后果。最近研究显示,COPD对机体的影响不单只局限于肺部,对机体多个组织器官(例如骨骼肌)都有影响[20]。B组大鼠体重明显减轻提示可能与COPD炎症造成的骨骼肌萎缩有关。与B组相比,C、D、E、F组总体上体重有所增加,肺泡扩张、肺泡融合及炎症细胞浸润现象均有所减轻。且GBE早期干预及红霉素早期干预效果更显著。另外,C、D、E、F组均显示细小支气管及肺泡内小动脉周围炎症细胞浸润减轻和细小支气管壁厚度及肺泡内小动脉壁厚度的增加减缓。本研究结果说明GBE能在一定程度上减轻肺泡、小气道和小动脉周围的炎症反应和抑制肺泡、细小支气管和肺泡内小动脉的结构重塑以及抑制,而且能部分减轻COPD炎症造成的肌肉萎缩;其作用和红霉素基本一致。炎症反应是肺泡、细支气管、肺血管结构重塑的病理基础。被氧化应激、炎症反应激活的T细胞、中性粒细胞等炎症细胞,可释放大量的活性细胞因子,造成肺血管内皮损伤,损伤的内皮合成内皮型一氧化氮合酶减少,内皮素-1增加,引起血管舒缩功能失调,致血管平滑肌增殖及胶原形成而发生血管重塑[21]。Mikura等[22]研究显示红霉素能通过减少枯否细胞(kupffer cell, KC)和肿瘤坏死因子(tumor necrosis factor, TNF-α)的表达从而改善香烟烟雾引起的肺部炎症反应。因此,红霉素可能通过抑制炎症基因的表达,减少炎症细胞的聚集,减轻炎症反应从而抑制肺脏的结构重塑。杜春玲等[23]研究发现GBE可降低诱导痰上清中IL-8含量。刘忠等[24]研究证明GBE可降低COPD急性加重期患者血清中IL-8和TNF-α浓度,抑制炎症反应。Huang等[25]以U937为研究对象,研究发现GBE能显著减少TNF-α、IL-1β、IL-10、前列腺素E2的分泌以及环氧酶-2的蛋白表达。因此,GBE抑制肺泡、肺气管及肺血管重塑的机制也可能是通过抑制炎症介质的分泌,炎症基因的表达,进一步阻止炎症细胞的活化和聚集,从而减轻肺组织的炎症反应,但具体机制尚需进一步探讨。并且本研究发现早期应用GBE及红霉素抑制肺泡结构重塑及炎症反应的效果更好。提示GBE及红霉素的早期干预治疗对COPD患者获益更大[26-28]。此外,本研究还显示GBE和红霉素可能具有抑制COPD导致的大鼠骨骼肌萎缩的作用,但具体机制尚不清楚。
综上所述,本实验验证了GBE能在一定程度上减轻COPD大鼠的肺泡、支气管、肺血管的结构重塑,其作用效果与红霉素相类似,其机制可能与GBE的抗炎作用有关。进一步研究GBE的具体抗炎机制将为GBE的临床应用提供更有力理论依据。
1 任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志(电子版), 2009, 2(2): 104-115.
2 Yanbaeva DG, Dentener MA, Creutzberg EC. Systemic effects of smoking[J]. Chest, 2007, 131(5): 1557-1566.
3 Vassilakopoulos T, Katsaounou P, Karatza MH. Strenuous resistive breathing induces plasma cytokines:role of antioxidants and monocytes[J]. Am J Respir Crit Care Med, 2002, 166(12 Pt 1): 1572-1578.
4 林芄, 白晶, 钟小宁. 红霉素在慢性阻塞性肺疾病中的作用及其机制[J]. 中国药学杂志, 2008, 43(13): 978-981.
5 邵有和, 陈昌枝, 覃淑娟, 等. 小剂量红霉素对慢性阻塞性肺疾病稳定期患者免疫功能的干预研究[J/CD]. 中华肺部疾病杂志(电子版), 2015, 8(4): 431-435.
6 Montuschi P, Malerba M, Santini G, et al. Pharmacological treatment of chronic obstructive pulmonary disease: from evidence-based medicine to phenotyping[J]. Drug Discov Today, 2014, 19(12): 1928-1935.
7 朱慧志, 韩明向, 丁小娟, 等. 多因素慢性阻塞性肺疾病大鼠模型的建立[J]. 中国临床保健杂志, 2005, 8: 145-146.
8 谭玉萍, 王朝晖, 蒙定水, 等. 银杏叶提取物可抑制慢性阻塞性肺疾病大鼠气道及肺血管重塑[J]. 中国呼吸与危重监护杂志, 2008, 7(4): 274-276.
9 Pauwels RA, Buist AS, Calverley PM, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO Global Initiative for Chronic Obstructive Lung Disease (GOLD) Workshop summary[J]. Am J Respir Crit Care Med, 2001, 163(5): 1256-1276.
10 Barnes PJ. Immunology of asthma and chronic obstructive pulmonary disease[J]. Nat Rev Immunol, 2008, 8(3): 183-192.
11 张伟, 谷明明, 孙璐璐, 等. COPD大鼠肺血管重构与气管重塑的实验研究[J]. 安徽医科大学学报, 2013, 48(3): 245-248.
12 刘秀萍, 臧恒昌, 于洪利. 银杏叶提取物的研究进展与应用前景[J]. 药学研究, 2014, 33(12): 721-723.
13 梁炜, 杨红梅, 梁爱武, 等. 银杏叶提取物对慢性阻塞性肺疾病大鼠CRP、TNF-α的影响[J]. 实用医 学杂志, 2017, 33(12): 1936-1938.
14 张华玲, 谭玉萍, 李可成, 等. 银杏叶提取物对慢性阻塞性肺疾病大鼠炎症反应的影响[J]. 广西中医药大学学报, 2012, 15(4): 40-44.
15 张鹏飞, 梁炜, 谭玉萍, 等. 银杏叶提取物对慢性阻塞性肺疾病大鼠肺组织MMP-1及MMP-9表达的 影响[J]. 辽宁中医杂志, 2017(4): 849-851.
16 丁明桥, 许朝霞, 陈瑞, 等. 银杏叶提取物对肺纤维化大鼠模型肺组织MMP-9及TIMP-1表达的影响[J]. 北京中医药, 2011, 30(11): 869-871.
17 Sakarcan A, Sehirli O, Velioglu-OvünA, et al. Ginkgo biloba extract improves oxidative organ damage in a rat model of thermal trauma[J]. J Burn Care Rehabil, 2005, 26(6): 515-524.
18 钟小宁, 白晶, 施焕中, 等. 慢性支气管炎与肺气肿大鼠气道炎症与气道重建的实验研究[J]. 中华结核和呼吸杂志, 2003, 26(11): 750-755.
19 徐锋, 徐作军, 梁希军. 小剂量罗红霉素增加稳定期慢性阻塞性肺疾病常规治疗疗效的研究[J]. 国际呼吸杂志, 2005, 25(11): 804-807.
20 Degens H, Gayan-Ramirez G, van Hees HW. Smoking-induced Skeletal Muscle Dysfunction: From Evidence to Mechanisms[J]. Am J Respir Crit Care Med, 2015, 191(6): 620-625.
21 老启芳, 曾小良, 钟小宁, 等. 肺功能正常吸烟者和慢性阻塞性肺疾病患者肺动脉炎症与气道炎症的相关性研究[J]. 中华结核和呼吸杂志, 2014, 37(12): 903-908.
22 Mikura S, Wada H, Higaki M, et al. Erythromycin prevents the pulmonary inflammation induced by exposure to cigarette smoke[J]. Transl Res, 2011, 158(1): 30-37.
23 杜春玲, 涂明利, 刘为舜. 银杏叶提取物对慢性阻塞性肺疾病患者诱导痰炎症细胞计数及IL-8水平的影响[J]. 实用医学杂志, 2006, 22(11): 1246-1248.
24 刘忠, 刘馨, 许国岩. 银杏叶提取物对慢性阻塞性肺疾病急性加重期患者白细胞介素-8和肿瘤坏死因子-α的影响[J]. 中国生化药物杂志, 2011, 32(6): 482-484.
25 Huang LT, Chao JC, Jiang BS, et al. Ginkgo biloba extract and saikosaponin a suppress lipopolysaccharide-induced inflammatory cytokines in human U-937 monocytes[J]. FASEB J, 2011, 25(1): 981.6
26 张鹏飞, 谭玉萍. 银杏叶提取物治疗呼吸系统疾病的研究进展[J]. 辽宁中医杂志, 2016, 43(7): 1546-1548.
27 Sener G, Sehirli O, Tozan A, et al. Ginkgo biloba extract protects against mercury(Ⅱ)-induced oxidative tissue damage in rats[J]. Food Chem Toxicol, 2007, 45(4): 543-550.
28 Seemungal TA, Wilkinson TM, Hurst JR, et al. Long-term erythromycin therapy is associated with decreased chronic obstructive pulmonary disease exacerbations[J]. Am J Respir Crit Care Med, 2008, 178(11): 1139-1147.
Effectsofginkgobilobaextractonairwayandvascularremodelinginratmodelofchronicobstructivepulmonarydisease
TanYuping1,WangZhaohui2,YaoPing3,LiangAiwu1,YangYibao1,PanLing1,ZhangPengfei1,LiZhanhua1.
1DepartmentofRespiratoryMedicine,RuikangHospitalAffiliatedtoGuangxiTraditionalChineseMedicineUniversity,Nanning530011,China;2DepartmentofRespiratoryMedicine,NanningTraditionalChineseMedcineHospital,Nanning530011,China;3Departmentofpathology,RuikangHospitalAffiliatedtoGuangxiTraditionalChineseMedicineUniversity,Nanning530011,China
TanYuping,Email:tanlaoshi1226@126.com
ObjectiveTo study the intervention effect of ginkgo biloba extract(GBE)on airway and vascular remodeling in rat model of chronic obstructive pulmonary disease(COPD).Methodsninety wistar rats were randomly divided into group A, B, C, D, E and F. The rat model of COPD were established by exposure to cigarette smoke, intratracheally injection of lipopolysaccharide and the cold air stimulation composite factors in groups B, C , D, E and F five groups. Groups C and D were given intraperitoneally injection with GBE (0.4 ml/kg/d) from dayl to dayl 4 and day 29 to day 42. Groups E and F were given intraperitoneally injection with erythromycin (10 mg/kg2) from dayl to dayl 4 and day 29 to day42. Forty-three days later, the rats were sacrificed for lung pathological examination.ResultsGroup B, C, D, E and F all showed pathological changes characteristic of COPD to different extent. The comparison of standard number of alveolar of each groups: The differences between group A with B, C, D, E, F have statistical significance (P<0.05); The differences between Group B with C, E have statistical significance (P<0.05). The comparison of average alveolar area of each groups: The differences between group A with B, C, D, E, F have statistical significance (P<0.05); The differences between Group B with C, E have statistical significance (P<0.05); The differences between group C with D, F have statistical significance (P<0.05). The bronchioles structure and the pulmonary artery structure in alveoli changes of each groups have the same statistical significance: The differences between group A with B, C, D, E, F have statistical significance (P<0.05 ); The differences of group C, D, E, F compare with each other have no statistical significance (P>0.05).ConclusionGBE has inhibitory effects on airway and vascular remodeling in rat model of COPD.
Chronic obstructive pulmonary disease; Ginkgo bibloba extract; Airway remodeling; Pulmonary vascular remodeling
10.3877/cma.j.issn.1674-6902.2017.06.006
国家自然科学基金资助项目(81260005)
530011 南宁,广西中医药大学附属瑞康医院呼吸内科1、病理科3
530011 南宁,南宁市中医院肺病科2
谭玉萍, Email: tanlaoshi1226@126.com
R541.5
A
2016-09-19)
王亚南)
谭玉萍,王朝晖,姚萍,等. 银杏叶提取物对慢性阻塞性肺疾病大鼠气道及肺血管重塑的影响[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(6): 662-667.
