重组蛋白Rv2346c抑制巨噬细胞对结核分枝杆菌的免疫灭活效应
2017-12-27姚静邵燕杜兴冉冯旰珠
姚静 邵燕 杜兴冉 冯旰珠
·论著·
重组蛋白Rv2346c抑制巨噬细胞对结核分枝杆菌的免疫灭活效应
姚静1邵燕2杜兴冉3冯旰珠1
目的探讨重组蛋白Rv2346c对卡介苗 (BCG)感染鼠巨噬细胞(RAW264.7)后的免疫效应的影响及其机制。方法通过DNA合成、基因扩增、载体构建、诱导表达、纯化等过程制备重组蛋白Rv2346c;利用Cell Counting Kit-8 (CCK8)方法检测RAW264.7增殖水平;采用菌落形成试验评估BCG生长情况;运用 ELISA方法检测BCG和RAW264.7共培养上清中的肿瘤坏死因子-α (TNF-α)、 白细胞介素-6 (IL)-6的浓度;采取Western blot方法检测RAW264.7细胞中核转录因子κB(NF-κB)p65的表达水平。结果DNA测序及Western blot检测证实成功制备重组蛋白Rv2346c;BCG可以抑制RAW264.7细胞增殖(P<0.05),而RAW264.7细胞对BCG有灭活作用(P<0.05);重组蛋白Rv2346c可以增强BCG对RAW264.7细胞增殖的抑制作用(P<0.05),并降低RAW264.7对BCG的灭活效应(P<0.05);Rv2346c还可以抑制 RAW264.7分泌TNF-α和IL-6(P<0.05),并抑制NF-κB p65的表达(P<0.05)。结论重组蛋白Rv2346c可以抑制小鼠巨噬细胞RAW264.7对BCG的免疫灭活效应,该作用可能与抑制细胞因子分泌和NF-κB p65活化有关,具体机制值得进一步深入探讨。
重组蛋白Rv2346c; 巨噬细胞; 结核分枝杆菌
结核病是全球范围内高发病率和高致死率的传染病,全球每年大约有960万新发病例,约有150万患者死亡[1-2]。尽管卡介苗(bacillus calmette-guerin, BCG)在预防结核病的应用已有80多年的历史,但是其有效率至多达到80%,保护期仅10~15年,并且存在诸多不稳定因素[3]。因此,如何有效应对结核分枝杆菌感染、控制其蔓延与传播成为当前十分重要的临床问题。BCG是减毒的牛分枝杆菌,与结核分枝杆菌野生株相比,共丢失16个区域(region of difference 1~16, RDl~RDl6)的DNA片段。有文献报道,结核分枝杆菌对巨噬细胞发挥免疫抑制作用可能与BCG丢失区域编码的某些蛋白有关[4]。早期分泌靶抗原6 (early secreted antigenic target-6, ESAT-6)是结核分枝杆菌早期培养或感染阶段产生的一系列低分子抗原,具有很强的特异性,只存在于致病的结核分枝杆菌野生型菌株中,而在BCG中则已丢失[5]。结核分枝杆菌RD7区Rv2346c基因编码的分泌蛋白为ESAT-6家族成员,与其他ESAT-6家族蛋白具有超过90%的同源性,有研究表明,Rv2346c蛋白可能成为区分结核感染与疫苗免疫的标志物[6-7]。巨噬细胞是体内参与抗结核杆菌的重要细胞,结核分枝杆菌活化后的巨噬细胞可以分泌肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、 白介素-6(interleukin-6, IL-6)等细胞因子,这些细胞因子不仅可以促进巨噬细胞的吞噬-溶酶体免疫反应,还能对结核分枝杆菌发挥直接杀灭功能[8-9]。本实验就重组蛋白Rv2346c对BCG感染鼠巨噬细胞后的免疫反应的影响进行了观察研究,报道如下。
材料与方法
一、实验材料
大肠埃希菌(E.Coli)感受态细胞BL21(DE3)购自Novagen公司;E3(pET-30a(+))载体购自Novagen公司;RAW264.7细胞购自美国ATCC公司;BCG 冻干粉由江苏省疾病预防控制中心提供。T4DNA连接酶、DNA聚合酶和限制性内切酶NdeI-HindIII(NEB)等购自Thermo公司;PCR产物纯化试剂盒、DNA胶回收试剂盒和质粒抽提试剂盒均购自AXYGEN公司;蛋白质相对分子质量标准购自金斯瑞公司;相对分子质量3×103超滤浓缩管购自sartorius公司;Ni-IDA亲和纯化柱购自金斯瑞公司。细胞计数试剂盒8 (Cell Counting Kit-8, CCK8)试剂盒购自日本同仁公司;ELISA试剂盒购自R&D Systems公司;抗 His 单抗购自Sigma公司;抗核转录因子κB (nuclear transcription factor-kappa B, NF-κB) p65抗体、抗GAPDH抗体购自Abcam公司;辣根过氧化物酶 (horse radish peroxidase, HRP)标记的山羊抗兔IgG二抗、HRP标记的山羊抗小鼠IgG二抗购自Bioworld公司。
二、实验方法
1. Rv2346c的PCR引物的设计和合成: 根据GenScript密码子优化网站得出的Rv2346c基因序列,Primer 5.0设计引物,上游引物序列:5′-AACTTTAAGAAGGAGATATA-3′;下游引物序列:5′-GCGGCCGCACTCGAGCAC-3′,由南京金斯瑞公司合成。
2. 目的基因扩增与载体构建: 根据GenScript密码子优化网站得出的Rv2346c基因序列,由金斯瑞公司合成DNA模板。PCR扩增反应条件:94 ℃ 预变性5 min; 96 ℃变性25 s、58 ℃退火25 s、72 ℃延伸l min,共30个循环。PCR产物在加有0.5 μg/ml溴化乙啶(EB)的1.0%琼脂糖凝胶上电泳后,紫外灯下观察条带,根据相对分子质量割胶后回收。用限制性内切酶NdeI-HindⅢ(NEB)酶切E3质粒和PCR产物后,T4DNA连接酶连接,转化于BL21(DE3)感受态中,接种于含卡那霉素(50 μg/ml)的TB培养基上,37 ℃培养过夜,挑选阳性克隆进行测序鉴定。
3. 目的基因的诱导表达与纯化: 将测序正确的质粒转化于BL21(DE3)感受态中,涂布于含卡那霉素的固体平板上,37 ℃培养过夜。挑取单克隆接种于含卡那霉素的TB培养基中,37 ℃震荡培养至波长600 nm处的吸光度为0.6时,保菌种后加入β-硫代半乳糖苷至终浓度为1.0 mmol/L,37 ℃振荡培养4 h,以离心半径8 cm,8 000 r/min,4 ℃离心10 min。加入破碎缓冲液重悬菌体,超声波破碎(300 w,间歇6 s,工作3 s,共计15 min)后,以离心半径8 cm,13 000 r/min,4 ℃离心30 min,收取上清。用Ni-IDA柱进行亲和纯化,收集洗脱组分。4%~12.0%聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,合并目标蛋白峰,用截留量为相对分子质量3×103的超滤管以离心半径8 cm,5 000 r/min,4 ℃离心进行浓缩。Bradford法测定蛋白浓度后,用0.22 μm的除菌膜过滤除菌,分装后-80 ℃保存蛋白。
将纯化的Rv2346c重组蛋白进行SDS-PAGE电泳,考马斯亮蓝R-250染色,于Tanon凝胶成像仪下拍照,获取图片,图像分析软件通过灰度分析估计纯度。利用Western blot方法检测纯化的 Rv2346c重组蛋白。将纯化的重组蛋白进行SDS-PAGE电泳,转膜,含5%脱脂奶粉的TBST缓冲液(Tris缓冲盐溶液,含20 mmol/L Tris-HCl、150 mmol/L NaCl、0.1% v/v Tween-20,pH 7.4)室温下封闭1 h。然后用含5% BSA的TBST按照1︰1000稀释的一抗(抗His抗体)于4 ℃孵育过夜,TBST在室温下洗3次;再用含5% BSA的TBST按照1︰5 000稀释的二抗(HRP标记的山羊抗小鼠IgG二抗)室温下孵育2 h,然后用TBST在室温下洗3次。最后采用ECL进行化学发光,于Tanon凝胶成像仪下拍照,获取图片,条带灰度值利用Image J 软件进行分析。
4. BCG和Rv2346c重组蛋白干预影响RAW264.7细胞增殖: RAW264.7细胞在37 ℃,5% CO2的条件下进行培养,培养基为含10%胎牛血清、100 U/ml青霉素、100 U/ml链霉素及2 mmol/L谷氨酰胺的DMEM。BCG疫苗用专用稀释液稀释后接种于罗氏培养基斜面上,37 ℃培养21 d后,取罗氏培养基上生长良好的BCG于匀浆器中,加少量含0.05% Tween-80的生理盐水研磨均匀,以不含抗生素的DMEM培养液(含10%胎牛血清)稀释成菌悬液,采用麦氏比浊法,调整细菌浓度为 1.0×107/ml。
将处于对数生长期的细胞以无抗DMEM培养液(含10%胎牛血清)重悬后,按照细胞密度为5 000个/孔铺于96孔板中,培养箱内孵育过夜。然后对照组加入相应剂量培养液以代替细菌悬液,BCG组按照感染复数(multiplicity of infection, MOI)依次为1︰1,1︰5,1︰10,1︰50加入BCG,BCG+Rv2346c组加入BCG(MOI为1︰5)及Rv2346c重组蛋白(孔内终浓度依次为50, 100, 500, 1 000 pg/ml),利用培养液调整每孔总体积至100 μl。培养箱内分别孵育24、48、72 h,在相应培养时间结束后加入无血清培养基及10 μl CCK8试剂继续培养2 h,放入酶标仪490 nm波长检测OD值。
5. BCG菌落形成试验: 按上述条件培养的RAW264.7细胞按照1×105个/孔接种于24孔细胞培养板中,培养过夜。对照组加入相应剂量培养液代替细菌悬液;BCG组加入BCG(MOI为1︰5);BCG+Rv2346c组加入BCG(MOI为1︰5)及Rv2346c重组蛋白(孔内终浓度为500 pg/ml)。在每孔加无抗DMEM培养液调整每孔体积至500 μl,分别继续培养24 h、48 h和72 h。培养结束后用预温的不含血清的DMEM培养液洗涤细胞培养板2次,每孔加入250 μl 1% Triton X-100裂解巨噬细胞。倒置显微镜下观察巨噬细胞的裂解情况,待巨噬细胞全部裂解后每孔加入250 μl完全DMEM培养液(含10%胎牛血清)终止裂解。混匀后每孔分别做1︰10稀释,取100 μl接种罗氏培养基,37 ℃恒温培养箱培养28 d后进行菌落计数。
6. ELISA检测细胞因子: RAW264.7细胞以1×105个/孔接种于24孔细胞培养板中,培养过夜。然后对照组加入相应剂量培养液以代替细菌悬液,BCG组加入BCG(MOI为1︰5),BCG+Rv2346c组加入BCG(MOI为1︰5)及Rv2346c重组蛋白(孔内浓度500 pg/ml),利用无抗DMEM培养液调整每孔总体积至500 μl。分别收集感染孵育24、48、72 h后的培养上清,按照试剂盒说明操作,对上清中TNF-α、IL-6进行检测,根据吸光度值计算其含量。
7. Western blot检测蛋白表达: RAW264.7细胞以2×106个/孔接种于6孔细胞培养板中,培养过夜。然后对照组加入相应剂量培养液以代替细菌悬液,BCG组加入BCG(MOI为1︰5),BCG+Rv2346c组加入BCG(MOI为1︰5)及Rv2346c重组蛋白(孔内浓度500 pg/ml),利用无抗DMEM培养液调整每孔总体积至2 ml。分别收集感染孵育24、48、72 h后的细胞,加入RIPA裂解液,冰上裂解30 min,以离心半径8 cm,4 ℃下12 000 r/min离心5 min。Bradford法测定上清蛋白含量。将提取蛋白进行SDS-PAGE电泳,转膜,5%脱脂奶粉TBST溶液室温下封闭1 h。然后用含5% BSA的TBST按照1︰1 000稀释的一抗(抗NF-κB p65抗体、抗GAPDH抗体)于4 ℃孵育过夜,TBST在室温下洗3次;再用含5% BSA的TBST按照1︰5 000稀释的二抗(HRP标记的山羊抗兔IgG二抗、HRP标记的山羊抗小鼠IgG二抗)室温下孵育2 h,然后用TBST在室温洗3次。最后采用ECL进行化学发光,于Tanon凝胶成像仪下拍照,获取图片,条带灰度值利用Image J软件进行分析。
三、统计学方法
结 果
一、扩增基因Rv2346c并构建重组质粒的鉴定
经基因扩增、酶切、连接、转化表达菌体,挑选阳性克隆进行测序鉴定。测序结果表明,与预期序列100%匹配,提示重组质粒构建成功,测序结果,见图1。

图1 重组表达的Rv2346c基因测序结果
二、重组质粒的诱导表达
重组质粒pET-30a-Rv2346c转化大肠埃希菌,经诱导表达及亲和纯化后,纯化后的蛋白SDS-PAGE结果显示在相对分子量约12 kDa处可见明显的目的蛋白条带,与预期的蛋白分子相对分子质量(12×103)相符,测得纯化的重组蛋白浓度为2.5 mg/ml,图像软件分析表明纯化后其纯度为90%,见图2。

图2 SDS-PAGE分析;注:泳道1: BSA (2.00 μg),泳道2: 重组蛋白Rv2346c (1.65 μg);箭头指示重组蛋白Rv2346c条带
三、Western Blot鉴定
纯化的Rv2346c重组蛋白(含His标签)与抗His抗体反应后,在相对分子质量约为12×103处出现1条与预期大小一致的特异性条带,见图3。

图3 Western Blot分析;注:泳道 3: 重组蛋白Rv2346c;箭头指示重组蛋白Rv2346c条带
四、Rv2346c联合BCG抑制RAW264.7增殖
利用CCK-8试验研究重组蛋白Rv2346c和BCG对RAW264.7增殖的影响。如图4所示,BCG分别按照MOI依次为1︰1,1︰5,1︰10,1︰50感染细胞后,在24、48、72 h三个培养时间下,随着BCG浓度的增加,对细胞增殖的抑制越明显。结合既往文献报道[10],我们选择在MOI为1︰5条件下,利用不同浓度重组蛋白Rv2346c进行干预,结果显示,随着Rv2346c的浓度增加,对细胞增殖的抑制作用逐渐增强,且培养时间越长,表现出抑制作用的Rv2346c的浓度越低,见图5。
五、Rv2346c减轻RAW264.7对BCG的灭活作用
如表1及图6所示,随着BCG与RAW264.7共培养的时间延长,菌落形成的数量减少,各组之间差别有统计学意义(P<0.05),结果提示RAW264.7对BCG存在抑制作用;在BCG与RAW264.7共培养过程中加入重组蛋白Rv2346c后,在各个作用时间下,BCG+Rv2346c组菌落数量均较BCG组增加,差别有统计学意义(P<0.05),该结果表明Rv2346c可以减少RAW264.7对BCG的抑制作用。

图4 BCG对RAW264.7增殖的影响;注:*与对照组相比,P<0.05;#直线两端之间两组比较,P<0.05
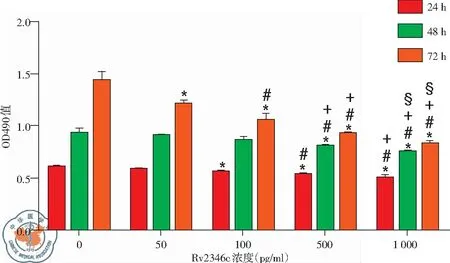
图5 BCG和Rv2346c共同作用对RAW264.7增殖的影响;注:*P<0.05,与相同培养时间下的对照组相比;#P<0.05,与相同培养时间下的BCG + Rv2346c (50 pg/ml)组相比;+,P<0.05, 与相同培养时间下的BCG+Rv2346c (100 pg/ml)组相比;§P<0.05,与相同培养时间下的BCG + Rv2346c (500 pg/ml)组相比

表1 Rv2346c影响巨噬细胞对BCG的免疫抑制作用
注:aP<0.05,与相同培养时间下的BCG组相比;bP<0.05,相同干预条件下,与培养24 h组相比;cP<0.05,相同干预条件下,与培养48 h组相比

图6 Rv2346c影响BCG与巨噬细胞共培养后形成的菌落数量
六、Rv2346c抑制RAW264.7分泌TNF-α和IL-6
研究结果表明,与对照组相比,BCG可以诱导RAW264.7分泌TNF-α和IL-6明显增加,差别有统计学意义(P<0.05);且随BCG和RAW264.7共培养时间延长,RAW264.7分泌的TNF-α、IL-6增多,并且具有统计学差异(P<0.05);但是在各个培养时间下,与单纯BCG感染组相比,Rv2346c可以明显抑制BCG诱导的TNF-α和IL-6分泌增加(P<0.05),见表2。
七、Rv2346c影响RAW264.7中NF-κB p65的表达
利用Western Blot检测RAW264.7中NF-κB p65的蛋白表达水平,结果显示,与对照在相比,BCG抑制细胞中NF-κB p65的表达,差别有统计学意义(P<0.05);随干预时间延长,抑制作用增强(P<0.05),与单纯BCG感染组相比,Rv2346c能进一步增强BCG对NF-κB p65表达的抑制作用(P<0.05) 见表3,图7。
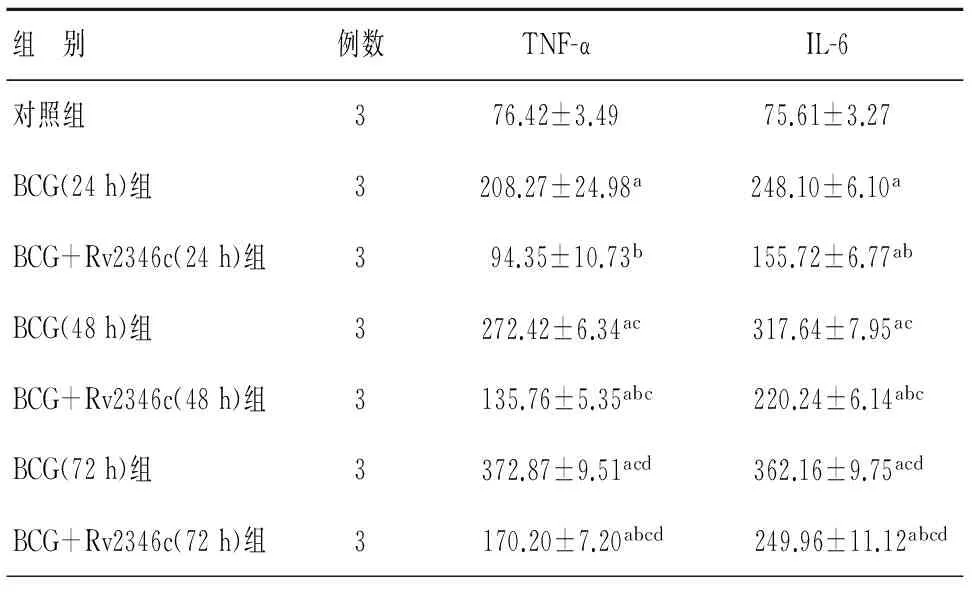
表2 BCG与RAW264.7共培养上清中TNF-α和IL-6水平
注:aP<0.05,与对照组相比;bP<0.05,相同干预时间下,BCG+Rv2346c组与BCG组相比;cP<0.05,相同干预条件下,与干预24 h组相比;dP<0.05,相同干预条件下,与干预48 h组相比

图7 RAW264.7中NF-κB p65的表达
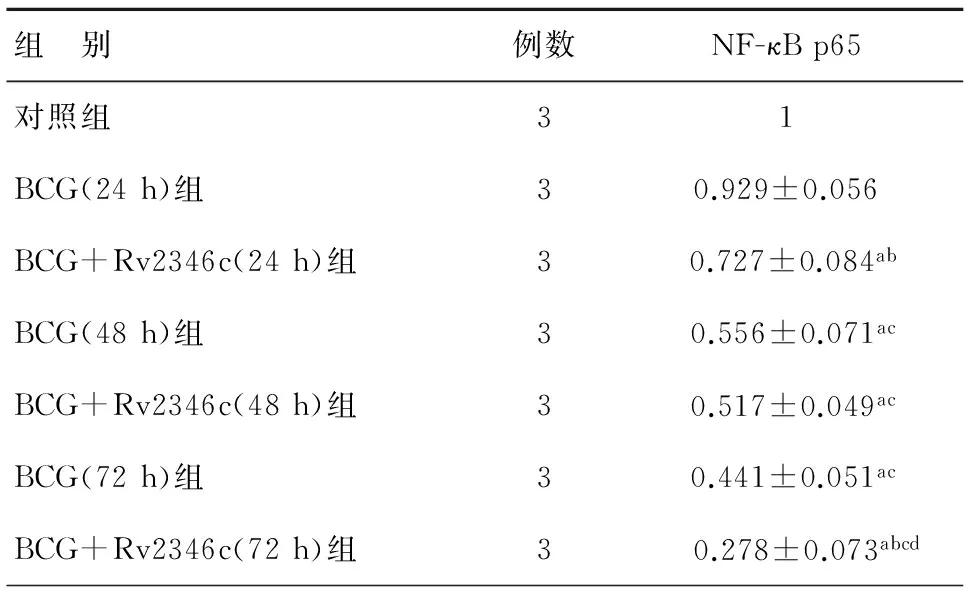
表3 BCG与RAW264.7共培养后细胞内NF-κB蛋白表达水平
注:aP<0.05,与对照组相比;bP<0.05,相同干预时间下,BCG+Rv2346c组与BCG组相比;cP<0.05,相同干预条件下,与干预24 h组相比;dP<0.05,相同干预条件下,与干预48 h组相比
讨 论
BCG作为结核疫苗保留了结核分枝杆菌的免疫原性,而降低了致病性,这与BCG丢失了部分毒性蛋白的编码基因有关,本实验选取缺失基因编码的蛋白Rv2346c,研究其是否影响巨噬细胞对BCG的杀灭作用,进而对其在结核分枝杆菌毒力中的作用进行评价。我们首先表达纯化了重组蛋白Rv2346c,并进行测序验证,然后利用重组蛋白Rv2346c对BCG感染RAW264.7的过程进行干预。研究发现,Rv2346c可以促进BCG抑制RAW264.7增殖的作用,也可以减轻RAW264.7对BCG的杀伤作用,该结果表明Rv2346c增强了BCG抵抗巨噬细胞的免疫抑制作用,因而Rv2346c可能在结核分枝杆菌致病性中发挥重要作用。
结核分枝杆菌是一种细胞内寄生菌,感染机体后在与机体固有免疫系统作用的过程中,首先被巨噬细胞通过病原模式识别受体结合,继之启动吞噬-溶酶体酸化灭活、caspase途径诱导细胞凋亡等应答反应,最终引起对结核杆菌的杀灭[11]。巨噬细胞在免疫过程中通过产生多种细胞因子直接或间接对结核杆菌发挥杀伤作用。已有研究表明,巨噬细胞产生TNF-α能够促进IL-6的分泌,还能诱导活性氧的产生,产生直接杀菌效应,TNF-α缺失可影响巨噬细胞对结核分枝杆菌的免疫杀伤,且固化结核分枝杆菌的肉芽肿也不能形成;同样在IL-6缺乏的状况下,也会导致其诱导免疫应答的弱化,从而使感染宿主组织中的结核分枝杆菌负荷增加[12]。因而,TNF-α、IL-6等细胞因子的合成与分泌对巨噬细胞抵抗结核分枝杆菌至关重要,甚至影响感染后整体状况的转归[13-14]。本实验研究发现,在BCG感染RAW264.7后,巨噬细胞分泌TNF-α、IL-6明显增多,而重组蛋白Rv2346c干预后能够抑制RAW264.7产生TNF-α、IL-6,该结果表明Rv2346c可能通过抑制细胞因子的产生对巨噬细胞的抑菌作用产生影响。核转录因子NF-κB通过诱导细胞内TNF-α等细胞因子的分泌来实现在结核分枝杆菌感染后宿主免疫细胞应答中的调控作用[15-21]。NF-κB被激活后与相应的调控靶基因上的κB特异序列位点结合,可启动或增强相应基因的转录(如TNF-α、IL-1和IL-6等细胞因子),而这些转录产物中的TNF-α及IL-6也可再激活NF-κB,形成正反馈调节,进一步增强其调控的基因表达,因而NF-κB是控制结核分枝杆菌感染的关键分子[16]。为了探究介导Rv2346c对巨噬细胞发挥免疫抑制效应的相关信号分子,我们对NF-κB p65活化水平进行了检测。本研究显示Rv2346c干预后可以进一步促进BCG对NF-κB蛋白表达的抑制作用,因而,NF-κB可能是Rv2346c发挥免疫抑制作用的关键靶点。
综上所述,本研究发现重组蛋白Rv2346c可以减少鼠巨噬细胞RAW264.7对BCG的免疫灭活,其作用可能与抑制巨噬细胞细胞因子的分泌及NF-κB p65的表达有关,但是其作用的具体机制尚需进一步深入探究。本实验通过对结核分枝杆菌RD7区Rv2346c基因编码蛋白的研究,为阐明结核分枝杆菌在体内的免疫逃避机制提供了新的研究思路。
1 方源扬, 刘国强, 黄显聪, 等. 景东县2004-2013年肺结核防治的卫生经济学分析[J/CD]. 中华肺部疾病杂志(电子版), 2016, 9(1): 36-40.
2 Raviglione M, Sulis G. Tuberculosis 2015: Burden, Challenges and Strategy for Control and Elimination[J]. Infect Dis Rep, 2016, 8(2): 6570.
3 Moliva JI, Turner J, Torrelles JB. Prospects in Mycobacterium bovis Bacille Calmette et Guerin (BCG) vaccine diversity and delivery: why does BCG fail to protect against tuberculosis?[J]. Vaccine, 2015, 33(39): 5035-5041.
4 Lu M, Xia ZY, Bao L. Enhancement of antimycobacterial Th1-cell responses by a Mycobacterium bovis BCG prime-protein boost vaccination strategy[J]. Cell Immunol, 2013, 285(1-2): 111-117.
5 Brodin P, Rosenkrands I, Andersen P, et al. ESAT-6 proteins: protective antigens and virulence factors?[J]. Trends Microbiol, 2004, 12(11): 500-508.
6 Mohanty S, Dal Molin M, Ganguli G, et al. Mycobacterium tuberculosis EsxO (Rv2346c) promotes bacillary survival by inducing oxidative stress mediated genomic instability in macrophages[J]. Tuberculosis (Edinb), 2016, 96: 44-57.
7 Jones GJ, Hewinson RG, Vordermeier HM. Screening of predicted secreted antigens from Mycobacterium bovis identifies potential novel differential diagnostic reagents[J]. Clin Vaccine Immunol, 2010, 17(9): 1344-1348.
8 Hossain MM, Norazmi MN. Pattern recognition receptors and cytokines in Mycobacterium tuberculosis infection-the double-edged sword?[J]. Biomed Res Int, 2013, 2013: 179174.
9 Carmona J, Cruz A, Moreira-Teixeira L, et al. Mycobacterium tuberculosis Strains Are Differentially Recognized by TLRs with an Impact on the Immune Response[J]. PLoS One, 2013, 8(6): e67277.
10 Hwang SA, Actor JK. Lactoferrin modulation of BCG-infected dendritic cell functions[J]. Int Immunol, 2009, 21(10): 1185-1197.
11 Hussain BK, Mukhopadhyay S. Macrophage takeover and the host-bacilli interplay during tuberculosis[J]. Future Microbiol, 2015, 10(5): 853-872.
12 Zuniga J, Torres-Garcia D, Santos-Mendoza T, et al. Cellular and humoral mechanisms involved in the control of tuberculosis[J]. Clin Dev Immunol, 2012, 2012: 193923.
13 Dube A, Reynolds JL, Law WC, et al. Multimodal nanoparticles that provide immunomodulation and intracellular drug delivery for infectious diseases[J]. Nanomedicine, 2014, 10(4): 831-838.
14 Zhao W, Zhou X, Lu Y, et al. Mycobacterium bovis ornithine carbamoyltransferase, MB1684, induces proinflammatory cytokine gene expression by activating NF-kappa B in macrophages[J]. DNA Cell Biol, 2014, 33(5): 311-319.
15 Fallahi-Sichani M, Kirschner DE, Linderman JJ. NF-kappaB Signaling Dynamics Play a Key Role in Infection Control in Tuberculosis[J]. Front Physiol, 2012, 3: 170.
16 Deng W, Li W, Zeng J, et al. Mycobacterium tuberculosis PPE family protein Rv1808 manipulates cytokines profile via co-activation of MAPK and NF-kappaB signaling pathways[J]. Cell Physiol Biochem, 2014, 33(2): 273-288.
17 Parveen N, Varman R, Nair S, et al. Endocytosis of Mycobacterium tuberculosis heat shock protein 60 is required to induce interleukin-10 production in macrophages[J]. J Biol Chem, 2013, 288(34): 24956-24971.
18 Bansal K, Sinha AY, Ghorpade DS, et al. Src homology 3-interacting domain of Rv1917c of Mycobacterium tuberculosis induces selective maturation of human dendritic cells by regulating PI3K-MAPK-NF-kappaB signaling and drives Th2 immune responses[J]. J Biol Chem, 2010, 285(47): 36511-36522.
19 Zhao Q, Li W, Chen T, et al. Mycobacterium tuberculosis serine protease Rv3668c can manipulate the host-pathogen interaction via Erk-NF-κB axis-mediated cytokine differential expression[J]. J Interferon Cytokine Res, 2014, 34(9): 686-698.
20 Futosi K, Fodor S, Mócsai A. Reprint of Neutrophil cell surface receptors and their intracellular signal transduction pathways[J]. Int Immunopharmacol, 2013, 17(4): 1185-1197.
21 Yu X, Zeng J, Xie J. Navigating through the maze of TLR2 mediated signaling network for better mycobacterium infection control[J]. Biochimie, 2014, 102: 1-8.
RecombinantproteinRv2346cinhibitstheimmunologicalresponseofmacrophageagainstMycobacteriumtuberculosis
YaoJing1,ShaoYan2,DuXingran3,FengGanzhu1.
1Departmentofrespiration,thesecondaffiliatedhospitalofNanjingmedicaluniversity,Nanjing210011,China;2Jiangsuprovincialcenterfordiseasepreventionandcontrol,Nanjing210009,China;3Departmentofinfectiousdisease,thesecondaffiliatedhospitalofNanjingmedicaluniversity,Nanjing210011,China
FengGanzhu,Email:zhu1635253@163.com
ObjectiveTo investigate the effect of recombinant protein Rv2346c on murine macrophage-induced immunological response on Bacillus Calmette-Guerin (BCG) and the molecular mechanism related.MethodsDNA synthesis, gene amplification, vector construction, induced expression and protein purification were used to synthesize recombinant protein Rv2346c. Cell Counting Kit-8 (CCK8) kit was applied to tested the proliferation of RAW264.7. Colony formation unit was observed to estimate the growth of BCG. Enzyme-linked immuno sorbent assay (ELISA) was utilized to detect tumor necrosis factor-α (TNF-α) and interleukin (IL)-6 in co-culture supernatant. Western blot was conducted to measure the expression of NF-κB (nuclear transcription factor-kappa B) p65. T test was applied to compare the means of two independent groups andP<0.05 was considered statistically significant.ResultsRecombinant protein Rv2346c was verified by DNA sequencing and Western blot. BCG inhibited the proliferation of RAW264.7 (P<0.05 ) while RAW264.7 inactivated BCG (P<0.05 ). Recombinant protein Rv2346c enhanced the BCG-induced inhibition on the proliferation of RAW264.7 (P<0.05 ) and reduced RAW264.7-medicated immunological killing effect against BGG (P<0.05 ). Rv2346c also suppressed the secretion of TNF-α and IL-6 by RAW264.7 (P<0.05 )and accelerated the protein expression of NF-κB p65 (P<0.05 ).ConclusionRecombinant protein Rv2346c could reduce macrophage-medicated immunological killing effect on BCG, which could be associated with the reduced secretion of cytokines and the suppression of NF-κB p65 expression. The exact mechanisms remain to be further explored.
Recombinant protein Rv2346c; Macrophage;Mycobacteriumtuberculosis
10.3877/cma.j.issn.1674-6902.2017.06.005
国家自然科学基金资助项目(81470209)
210011 南京,南京医科大学第二附属医院呼吸科1、感染科3
210009 江苏省疾病预防控制中心2
冯旰珠, Email: zhu1635253@163.com
R563
A
2017-07-26)
张大春)
姚静,邵燕,杜兴冉,等. 重组蛋白Rv2346c抑制巨噬细胞对结核分枝杆菌的免疫灭活效应[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(6): 655-661.
