魏斯氏菌在发酵食品中的应用
2017-12-26李巧玉方芳堵国成陈坚
李巧玉,方芳*,堵国成,陈坚
1(江南大学 生物工程学院,江苏 无锡,214122) 2(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)3(江南大学,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)4(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
魏斯氏菌在发酵食品中的应用
李巧玉1,2,方芳1,2*,堵国成1,3,陈坚1,4
1(江南大学 生物工程学院,江苏 无锡,214122) 2(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)3(江南大学,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)4(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
魏斯氏菌是一类存在于酱油、泡菜、豆豉、香肠等多种发酵食品的乳酸菌。它是参与食品发酵的重要微生物,在发酵食品中具有广泛应用价值。在食品发酵过程中,魏斯氏菌对食品中有机酸、酯类及短链脂肪酸等风味物质的合成具有重要作用。此外,魏斯氏菌属的有些菌株具有合成细菌素、低聚糖、胞外多糖和纤维素等特性,具有潜在的益生菌特性。该文主要对魏斯氏菌的分离鉴定、生理生化特性以及菌株在发酵食品中的应用特性等几方面的研究进展进行了综述。
魏斯氏菌;发酵食品;乳酸菌;分类;特性
1 魏斯氏菌简介
魏斯氏菌(Weissella)是一类存在于发酵食品中的乳酸菌,早期被归类于副肠系膜明串珠菌属(Leuconostocparamesenteroides)。1993年科林等在研究香肠来源的菌株时发现有些菌株与明串珠菌属不同,在系统发育树上形成了新的分支,提出将其重新分类并命名为魏斯氏菌属[1]。1957年,尼文等从熏肉中分离得到1株绿色乳杆菌(Lactobacillusviridescens),现命名为绿色魏斯氏菌(Weissellaviridescens),是这个属的第1个被分离的种。目前已被分离和鉴定的魏斯氏菌共有19个种[1-5],在基于16S rRNA基因序列构建的系统发育树(图1)中可分为5个分支:第1分支包含5种亲缘关系较近的魏斯氏菌,分别是:独魏斯氏菌(Weissellasoli)、Weisselladiestrammenae、Weissellakoreensis、坎氏魏斯氏菌(Weissellakandleri)和大米魏斯氏菌(Weissellaoryzae),这类魏斯氏菌常存在于发酵饮料中;第2分支由食窦魏斯氏菌(Weissellacibaria)和融合魏斯氏(Weissellaconfusa)组成,它们常分布在含盐的发酵食品中;第3个分支包括Weissellathailandensis、赫伦魏斯氏菌(Weissellahellenica)和类肠膜魏斯氏菌(Weissellaparamesenteroides),它们具有产细菌素的特性;鲸魏斯氏菌(Weissellaceti)、Weissellahalotolerans、绿色魏斯氏菌(Weissellaviridescens)、微小魏斯氏菌(Weissellaminor)和葡萄魏斯氏菌(Weissellauvarum)是第4分支,它们通常分布在以果蔬为原料的发酵食品中;第5个分支有Weissellabeninensis、雁魏斯氏菌(Weissellafabalis)、Weissellafabaria和Weissellaghanensis,它们均可产葡聚糖。

图1 魏斯氏菌的系统发育树[1]Fig.1 Phylogenetic tree of Weissella bacteria
1.1 魏斯氏菌的遗传特性和生理生化特性
魏斯氏菌是革兰氏阳性不产孢子的细菌,细胞不运动,显微镜下是不规则短棒状,常成对或者短链存在[6]。魏斯氏菌菌落形态为白色,圆形,菌落微隆起、光滑不透明,可在MRS液体培养基中正常生长(约1~2 d)[7]。过氧化氢酶阴性、兼性厌氧、在微氧培养条件下有利于其生长。其可生长的盐浓度范围为0%~200 g/L,可在 pH 3.0~9.5范围内生长。魏斯氏菌在15 ℃能生长,一般最适生长温度30~37 ℃,有些菌株在42~45 ℃能生长[8-11]。
魏斯氏菌通过磷酸己糖和磷酸酮酶途径异型发酵葡萄糖产乳酸。通常此菌属的所有菌株均可发酵葡萄糖、麦芽糖、蔗糖等糖类产酸;不发酵淀粉和木糖等糖类;能否利用阿拉伯糖、纤维二糖、甘露糖、甘油、棉子糖、核糖和海藻糖等碳源在不同菌株间情况不同。例如,分离自植物发酵饮料的魏斯氏菌可发酵纤维二糖和阿拉伯糖产酸,而分离自香肠、奶酪中的魏斯氏菌不能发酵这两种糖类,说明不同来源的魏斯氏菌对于糖类的发酵和利用有所区别。此外,从嵩草中分离到的食窦魏斯氏菌、融合魏斯氏菌对于半乳糖、阿拉伯糖、蜜二糖和甘露醇的发酵情况也不相同[12]。这说明相同来源的不同魏斯氏菌对于糖的利用也有所区别。
1.2 魏斯氏菌的来源
魏斯氏菌分布广泛,食物、土壤、胃肠道和呼吸道等环境中均含有多种魏斯氏菌,其中发酵食品是魏斯氏菌的丰富来源(表1)。
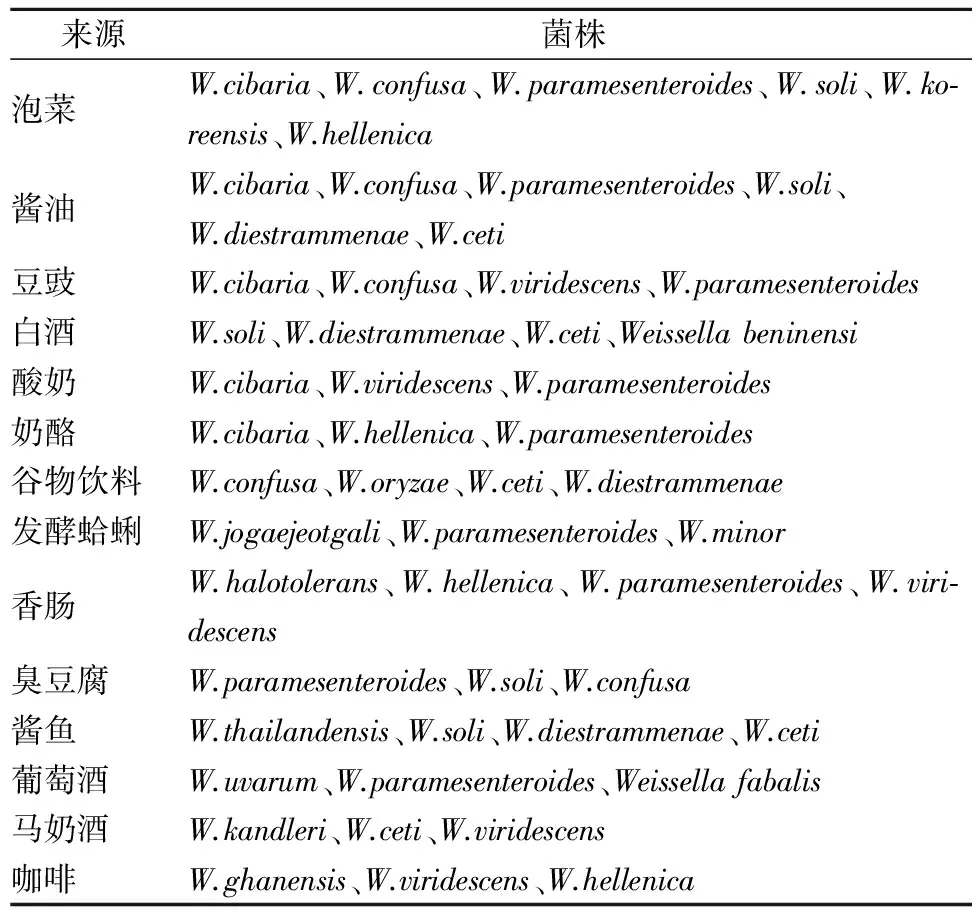
表1 魏斯氏菌在发酵食品中的分布Table 1 Diversity of Weissella in fermented foods
胡传旺等通过二代测序解析酱油发酵过程中微生物多样性发现,乳酸菌是细菌中的优势菌,其中魏斯氏菌占细菌总数的80%左右,酱油中主要含有Weissellacibaria、Weissellaconfusa、Weisselladiestrammenae、Weissellaparamesenteroides、Weissellaceti和Weissellasoli六个种的魏斯氏菌[13-14]。不同来源的魏斯氏菌对环境中盐胁迫的耐受情况以及菌株代谢产生的功能物质存在差异,根据筛选的目标选择合适的分离样品,有利于分离和筛选得到目标菌株[15-17]。
1.3 魏斯氏菌的分离鉴定
魏斯氏菌与明串珠菌的细胞均为短棒状,常成对或成链出现,共同存在于多种腌制品与发酵食品中。这两个属的菌具有相似的生理特征与遗传学特征,较难区分。魏斯氏菌参与食品发酵过程,起有益作用;明串珠菌对某些食品的加工有不利影响,例如它常使糖液变得黏稠而无法进行后续加工。因此鉴别和区分两种菌并监测食品发酵过程及发酵体系中魏斯氏菌与明串珠菌的存在具有重要意义。
魏斯氏菌属于乳酸菌,其分离和鉴定方法可采用常规分离和鉴定乳酸菌的方法。然而,对魏斯氏菌的特异性分离或根据生理生化特性进行菌株鉴定与区分,则需要更为有效的方法。由于乳酸菌的多个菌属以及葡萄球菌和芽孢杆菌等细菌都可以在MRS培养基中生长,因此MRS培养基不能特异性分离魏斯氏菌。卡马尔等根据魏斯氏菌有万古霉素(Vancomycin)抗性这一特性,建立了在MRS培养基中添加万古霉素对魏斯氏菌进行选择性培养的方法[5]。此外,也可以采取先用MRS培养基分离菌株,再利用保守基因(recN、pheS、rpoA、dnaA)的特异性引物通过PCR的方法精确筛选魏斯氏菌,将它们与相近的乳酸菌菌株进行区分。
魏斯氏菌的生理生化特性及对发酵食品的作用存在种间差异,因此区分不同的魏斯氏菌,系统的了解各种的特性对其在食品中更好的应用具有重要意义。常采用的区分菌株的方法有生理生化试验[18],通过考察菌株在4%和6.5%NaCl下的生长情况,以及菌株在10、40、45 ℃下是否生长,可以初步进行魏斯氏菌的种间鉴定[19-21]。利用通用引物扩增菌株的保守基因,并比较序列的异同,可以准确将各种菌株进行区分[22-24]。
2 魏斯氏菌与发酵食品
乳酸菌(Lactic acid bacteria,LAB)是发酵泡菜、干香肠和其他肉类衍生产品生产发酵剂的主要来源,魏斯氏菌是生产发酵食品的发酵剂的重要微生物组成,它们具有提高发酵食品产品质量或者缩短发酵周期等作用[25]。魏斯氏菌是腌制类发酵食品中微生物的重要组成之一,广泛存在于酱油、发酵豆制品、鱼酱和咸鱼等发酵食品中[26]。研究表明,在酱油、泡菜和豆豉等高盐食品发酵过程中,耐盐魏斯氏菌通过代谢葡萄生成乳酸,形成特殊的香味可使发酵食品的口感更醇厚颜色更加鲜亮和红润[27]。此外,魏斯氏菌在食品发酵过程中,可将原料分解转化生成短链脂肪酸(short-chain fatty acids,SCFA)和胞外多糖(exopolysaccharides,EPS),对增加酱油的风味和营养有重要贡献[28-30]。
2.1 魏斯氏菌对发酵食品风味的影响
食品中的风味物质主要包括芳香类风味物质和味感风味物质,是表征发酵食品的重要特征之一。根据化合物结构可将风味物质分为酮类、醛类、醇类、酯类、萜类以及氨基酸等。发酵食品中风味物质的形成主要通过化学反应和微生物代谢或转化合成。微生物合成食品中的风味物质主要有2种途径,一是微生物通过发酵原料产生风味物质,即微生物代谢葡萄糖、蛋白质等物质合成某些风味物质;二是前体物质经过微生物的酶或酶系催化作用转化为风味物质。
魏斯氏菌不仅参与食品发酵过程,也是食品风味形成的重要贡献者。MOHAMMED将来源于发酵香肠的魏斯氏菌制成发酵剂用于肉类产品发酵,由微生物产生的乙酸、丙酸、丁酸等挥发性酸和酯类促进了组织蛋白酶D活性的增加,从而加速了肌肉蛋白的水解,有利于人体对营养的吸收,同时也赋予产品独特的风味[25]。马欢欢通过比较传统四川泡菜和韩国泡菜的微生物组成与风味的比较分析发现,四川泡菜发酵过程中不含或含少量的魏斯氏菌,而在韩国泡菜中魏斯氏菌是优势乳酸菌之一。传统四川泡菜中的风味物质主要包括有机酸、醇类、酯类和氨基酸;而韩国泡菜中除包含上述风味物质以外还含有酚类、烯类和脂肪酸类物质,使得泡菜具有更鲜甜香脆的口感[31]。通过在泡菜发酵时强化不同乳酸菌,发现强化食窦魏斯氏菌的泡菜比强化植物乳杆菌的泡菜中挥发性酯、醛、醇和酮的含量都有所提高,其中酯类增至2.1倍、醇类增至1.8倍;有机酸的含量也有不同程度的提高,其中草酸增加了16.9 mg/kg、乳酸增加了5.1 mg/kg。此外,添加了食窦魏斯氏菌的泡菜呈红色、香味明显、酸咸适中且较脆,在感官评价时得分最高[32]。
魏斯氏菌也是白酒窖内发酵过程酒醅中细菌的重要组成,对于将原料中的糖类转化生成乳酸和其他有机酸,进而与乙醇反应生成乳酸乙酯和乙酸乙酯,赋予白酒的醇香感和果味具有重要作用[34]。酱油盐水发酵阶段,魏斯氏菌是酱醪中细菌的优势菌,它们的存在对酱油风味的形成也有重要的影响[36]。研究证实,分离自酱醪的类肠膜魏斯氏菌(Weissellaparamesenteroides)CQ03分泌的蛋白酶在高盐环境下仍有活性(36 U/mL),其发酵液中总氨基酸的含量高于相同培养条件下唾液乳杆菌(Lactobacillussalivarius)B1和葡萄球菌(Staphylococcussp.)JY09的。此外,同葡萄球菌(Staphylococcussp.)JY09相比,酱醪来源的食窦魏斯氏菌(Weissellacibaria)CQ02在高盐低pH条件下可生成较多的富马酸(1 135.4 mg/L)。因此,同其他细菌相比,魏斯氏菌可能在提高酱油中氨基酸和有机酸含量有较大的优势[26]。
2.2 魏斯氏菌与发酵食品安全
发酵食品在发酵过程中由于微生物对含氮物质的不完全利用会产生氨基甲酸乙酯(ethyl carbamate, EC)、生物胺等可致癌或有害的胺类物质,对食品的安全性有潜在的影响。氨基甲酸乙酯是由体系中含有的尿素、瓜氨酸等前体与乙醇反应生成。尿素的合成和积累与原料来源、原料分解和酵母菌对氮源的利用有关;瓜氨酸则是细菌通过精氨酸脱亚氨基途径(arginine deiminase pathway, ADI)利用精氨酸生成。生物胺是体系中的氨基酸在细菌氨基酸脱羧酶作用下脱羧产生的。乳酸菌中的很多菌属(明串珠菌属、短乳杆菌、足球菌和布氏乳杆菌)的菌株都具有氨基脱羧酶活性,它们在食品发酵过程中可能产生组胺、尸胺和酪胺等生物胺。酪胺可导致人体血压升高、心悸不适等症状,组胺可引起头痛、呼吸紊乱、过敏等反应[35]。控制和降低发酵食品中有害物质的含量对于保障食品安全具有重要意义,因此选择用于发酵食品的微生物时不仅要考虑它们的发酵特性和功能,也要评估菌株的安全性和是否会产生有害代谢产物及其前体,避免使用可导致氨基甲酸乙酯前体积累和产生物胺的菌株。
酱油中与氨基甲酸乙酯前体瓜氨酸积累相关的ADI途径3个关键基因(arcA,arcB,arcC)的转录水平在不同乳酸菌中是不同的,受环境因素调控的机制也不同。已经证实具有此途径的嗜酸乳酸足球菌和葡萄球菌是酱油发酵过程中导致瓜氨酸积累的主要微生物[36]。虽然分离自酱油成曲的魏斯氏菌具有编码ADI途径关键酶的3个基因,但是研究表明,食窦魏斯氏菌(Weissellacibaria)在18% NaCl下几乎不利用精氨酸,不会产生瓜氨酸,因而也不是产生氨基甲酸乙酯前体的菌株[36]。此外,分离自韩国泡菜的Weissellakoreensis利用培养体系中的精氨酸时不积累瓜氨酸,而是将其代谢为终产物鸟氨酸,不仅降低了有害物前体的含量,还助于具有提高产品风味[37]。这说明,魏斯菌与酱油和泡菜中氨基甲酸乙酯前体瓜氨酸的积累关联性不大。
魏斯氏菌属的菌株既有产生物胺的菌株,也有不产生物胺的菌株。对来源于泡菜的45株魏斯氏菌进行的筛查发现,38.2%的魏斯氏菌(26株)可产一种或多种生物胺,其组胺和酪胺的合成量超过50 mg/L,尸胺和丁二胺含量为0~20 mg/L[38]。YOUHEI等考察来源于豆腐的菌株时发现,分离到的魏斯氏菌均为生物胺产生菌,而且均含有编码酪氨酸脱羧酶基因,但是合成生物胺的种类在菌株间存在差异[34]。GUARCELLO团队从奶酪中筛选得到94株具有不同生物胺降解能力的菌株,通过高通量测序发现这些菌株都含有编码多铜氧化酶的基因sufI。其中有1株类肠膜魏斯氏菌(Weissellaparamesenteroides)CP2,不产生物胺且可降解组胺、尸胺、腐胺、酪氨、精胺等多种生物胺[39]。佟婷婷将来源与植物乳杆菌中sufI在大肠杆菌BL21进行了表达和纯化,发现SufI蛋白可显著降低体系中的生物胺含量,说明来源于乳酸菌的sufI基因产物,可能具有降解生物胺的作用[40]。
2.3 魏斯氏菌的益生作用
乳酸菌是益生菌的重要和主要来源,具有益生特性的菌株可以调节人体胃肠道正常菌群和保持微生态平衡,提高食物消化率和生物价,降低血清胆固醇,控制内毒素,抑制肠内腐败菌生长和腐败产物的产生等,对人体的营养、生理功能、药物效应、毒性反应和免疫反应等具有重要意义。近年来,一些报道指出魏斯氏菌也可起到促进健康的益生作用。
魏斯氏菌应用于食品发酵时,可合成葡聚糖、果聚糖和异麦芽低聚糖,这些低聚糖是可促进益生菌如双歧杆菌增值的益生元。食用经魏斯氏菌发酵的含益生元的发酵食品,有效地促进了人体肠道中双歧杆菌的生长和繁殖[41]。在食品发酵过程中强化魏斯氏菌,生成的葡聚糖和果聚糖等低聚糖可减少人体肠胃不适,增加人体对微量元素的吸收[42-43]。
研究表明,窦氏魏斯氏菌有抗癌、免疫调节、抑制炎症水平和抗氧化的活性。SHIN-HYEKWAK等人从泡菜中分离得到1株食窦魏斯氏菌(Weissellacibaria)148-2,具有较强抗氧化性且具有降胆固醇作用的。通过小鼠实验发现其体内的胆固醇向胆酸的异化以及向体外排泄均有明显增加,证明了该菌株具有降低炎症大于炎症反应和减少血胆固醇作用。此外,在泡菜发酵过程中添加Weissellakoreensis,能够促进细菌纤维素的合成,从而使泡菜具有保持身材的作用[44-45]。
食品原料中或发酵过程中可能存在或污染变形杆菌、肉毒杆菌、弯曲乳杆菌和金黄色葡萄球菌等对人体有害或产生对人体不利代谢产物的菌株。有些魏斯菌属的菌可通过核糖体合成机制产生的一类具有抑菌活性的多肽或前体多肽,如Ⅱ型细菌素,可抑制腐败微生物和致病菌的生长。
从儿童唾液中分离的食窦魏斯氏菌(Weissellacibaria)能抑制致龋菌变异链球菌(Streptococcusmutans)的增殖和其生物膜的形成[46]。该菌可通过产过氧化氢抑制具核梭杆菌(Fusobacteriumnucleatum)在牙周的增殖,从而减少挥发性硫化物的产生,减少口臭[47]。PAPAGIANNI筛选到1株产魏斯氏菌素(Weissellin)A的类肠膜魏斯氏菌(Weissellaparamesenteroides)DX[48]。魏斯氏菌素A是一种Ⅱ型细菌素,它具有较窄抗菌谱细菌素,能够抑制弯曲乳杆菌(Lactobacilluscurvatus)、米酒乳杆菌(Lactobacillussakei)和单核细胞李斯特氏菌(Listeriamonocytoges)等一些革兰氏阳性细菌的生长,对革兰氏阴性菌株并没有抑制作用。乳酸菌细菌素是有乳酸菌产生的具有抑菌活性的多肽或蛋白质,是公认安全的食品生物防腐剂,魏斯氏菌素是一种有前景的食品和饲料防腐剂[49]。
3 展望
魏斯氏菌是参与食品发酵的重要乳酸菌之一,对于发酵食品的发酵进程和风味有重要的影响和贡献。研究来源于发酵食品的魏斯氏菌的遗传特性和生理生化特性,一方面有助于拓展乳酸菌的知识领域,另一方面可以为其在食品发酵中的应用提供理论支持和参考依据。最近对魏斯氏菌的研究表明,魏斯氏菌代谢产生细菌素可预防致腐微生物的生长,延长食品保质期的作用。发酵食品来源的一些魏斯氏菌由于基因组中含有编码铜氧化酶的sufI基因,能显著降低发酵食品中的生物胺。魏斯氏菌还具合成低聚糖的能力,其产物可作为调味剂用于糖尿病人、肥胖病人的食物中,也可用于化妆品和饲料行业。综上所述,魏斯氏菌可广泛应用于食品和饲料加工中,不仅对发酵食品的风味、营养和功能均有一定的贡献,在提高了食品的安全性和延长食物保质期方面也具有广阔的应用前景和市场潜力。
[1] FUSCO V, QUERO G M, CHO G S, et al. The genusWeissella: taxonomy, ecology and biotechnological potential [J]. Frontiers in Microbiology, 2015, 6(155): 155.
[2] KIM T W, LEE J Y, SONG H S, et al. Isolation and identification ofWeissellakimchiifrom green onion by cell protein pattern analysis [J]. Journal of Microbiology & Biotechnology, 2004, 14(1): 105-109.
[3] SADE E, LASSILA E, BJORKROTH J. Lactic acid bacteria in dried vegetables and spices [J]. Food Microbiology, 2016, 53:110-104.
[4] 翁佩芳, 陈希, 沈锡权,等.榨菜低盐腌制细菌群落多样性的分析 [J]. 中国农业科学, 2012, 45(2): 338-345.
[5] KAMBOJ K, VASQUEZ A, BALADA-LLASAT J M. Identification and significance ofWeissellaspeciesinfections [J]. Frontiers in Microbiology, 2015, 6(254): 670-672.
[6] KOT W, NEVE H, HELLER K J, et al. Bacteriophages ofLeuconostoc,Oenococcus, andWeissella[J]. Frontiers in Microbiology, 2014, 5(2): 186.
[7] LYNCH K M, LUCID A, ARENDT E K, et al. Genomics ofWeissellacibariawith an examination of its metabolic traits [J]. Microbiology, 2015, 161:914-930.
[8] PAL A, RAMANA K V. Purification and characterization of bacteriocin fromWeissellaparamesenteroidesdfr-8, an isolate from cucumber (cucumis sativus) [J]. Journal of Food Biochemistry, 2010, 34(5): 932-948.
[9] DUSKOVA M, KAMENIK J, KARPISKOVA R.Weissellaviridescensin meat products-a review [J]. Acta Veterinaria Brno, 2013, 82(3): 237-241.
[10] OH S J, SHIN N R, HYUN D W, et al.Weisselladiestrammenaesp nov., isolated from the gut of a camel cricket (Diestrammena coreana) [J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63:2 951-2 956.
[11] NISIOTOU A, DOUROU D, FILIPPOUSI M E, et al.Weissellauvarumsp. nov., isolated from wine grapes [J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64:3 885-3 890.
[12] 高静, 郭旭生, 王国成. 西藏地区藏北嵩草附着乳酸菌的理化特性 [J]. 草业科学, 2013(8): 1 266-1 271.
[13] PEREIRA C I, ROMO M V S, LOLKEMA J S, et al.WeissellahalotoleransW22 combines arginine deiminase and ornithine decarboxylation pathways and converts arginine to putrescine [J]. Journal of Applied Microbiology, 2009, 107(6): 1 894.
[14] BEASLEY S S, MANNINEN T J K, SARIS P E J. Lactic acid bacteria isolated from canine faeces [J]. Journal of Applied Microbiology, 2006, 101(1): 131-138.
[15] YANAGIDA F, CHEN Y S, SHINOHARA T. Isolation and characterization of lactic acid bacteria from soils in vineyards [J]. Journal of General and Applied Microbiology, 2005, 51(5): 313-318.
[16] 金红星, 杨希寅, 成文玉. 辣白菜中分离含内源性质粒的魏斯氏菌及其鉴定 [J]. 中国酿造, 2012, 31(1): 77-79.
[17] 史斌. 猪源肠道与呼吸道细菌的分离鉴定 [D]. 郑州:河南科技大学, 2013.
[18] 商婷婷,张日俊.乳酸乳球菌和魏斯氏菌的分离及鉴定[J]. 饲料工业, 2013 (16) :31-34
[19] SUJAYA I N, AMACHI S, YOKOTA A, et al. Identification and characterization of lactic acid bacteria in ragi tape [J]. World Journal of Microbiology & Biotechnology, 2001, 17(4): 349-357.
[20] DE GRAEF E M, DEVRIESE L A, BAELE M, et al. Identification of enterococcal, streptococcal andWeissellaspecies in the faecal flora of individually owned dogs [J]. Journal of Applied Microbiology, 2005, 99(2): 348-353.
[21] CHIN H S, BREIDT F, FLEMING H P, et al. Identifications of predominant bacterial isolates from the fermenting kimchi using ITS-PCR and partial 16S rDNA sequence analyses [J]. Journal of Microbiology and Biotechnology, 2006, 16(1): 68-76.
[22] 崔艳伟. 健康人粪便乳杆菌的分离、鉴定及遗传多态性的初步研究 [D].哈尔滨: 东北农业大学, 2008.
[23] 黄道梅, 贾秋思, 胡露,等.四川传统泡菜中抗氧化活性食窦魏斯氏菌的筛选、鉴定及其特性分析 [J]. 食品工业科技, 2015, 36(17): 121-126.
[24] 王海娟. 大熊猫和泡菜样品来源魏斯氏菌的益生特性分析 [D].成都:成都医学院, 2016.
[25] AMMOR M S, MAYO B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production: An update [J]. Meat Science, 2007, 76(1): 138-146.
[26] 胡传旺, 李巧玉, 周朝晖,等.酱醪细菌菌株的分离及功能分析 [J]. 微生物学通报,2017,44(8):1 899-1 907.
[27] 张巧云. 豆酱中微生物多样性及人工接种多菌种发酵豆酱的研究 [D].哈尔滨:东北农业大学, 2013.
[28] PARK J H, AHN H J, KIM S G, et al. Dextran-like exopolysaccharide-producingLeuconostocandWeissellafrom kimchi and its ingredients [J]. Food Science and Biotechnology, 2013, 22(4): 1 047-1 053.
[29] LYNCH K M, MCSWEENEY P L H, ARENDT E K, et al. Isolation and characterisation of exopolysaccharide-producingWeissellaandLactobacillusand their application as adjunct cultures in Cheddar cheese [J]. International Dairy Journal, 2014, 34(1): 125-134.
[30] WOLTER A, HAGER A-S, ZANNINI E, et al. Influence of dextran-producingWeissellacibariaon baking properties and sensory profile of gluten-free and wheat breads [J]. International Journal of Food Microbiology, 2014, 172:83-91.
[31] 马欢欢, 吕欣然, 白凤翎,等.传统中韩泡菜乳酸菌菌相分析与风味物质组成的比较 [J]. 食品与发酵工业, 2015, 41(12): 184-190.
[32] 刘春燕, 戴明福, 夏姣,等.不同乳酸菌接种发酵泡菜风味的研究 [J]. 食品工业科技, 2015, 36(7): 154-158.
[33] WANG X S, DU H, XU Y. Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor [J]. International Journal of Food Microbiology, 2017, 244:27-35.
[34] TAKEBE Y, TAKIZAKI M, TANAKA H, et al. Evaluation of the biogenic amine-production ability of lactic acid bacteria Isolated from Tofu-misozuke [J]. Food Science and Technology Research, 2016, 22(5): 673-678.
[35] PRADENAS J, GALARCE-BUSTOS O, HENRíQUEZ-AEDO K, et al. Occurrence of biogenic amines in beers from Chilean market [J]. Food Control, 2016, 70:138-144.
[36] ZHANG J R, FANG F, CHEN J, et al. The arginine deiminase pathway of koji bacteria is involved in ethyl carbamate precursor production in soy sauce [J]. FEMS Microbiology Letters, 2014, 358(1): 91-97.
[37] YU J J,PARK H J,KIM S G, et al. Isolation, identification, and characterization ofWeissellastrains with high ornithine producing capacity from Kimchi [J]. Korean Journal of Microbiology, 2009, 45(4): 339-345.
[38] JEONG D W, LEE J H. Antibiotic resistance, hemolysis and biogenic amine production assessments ofLeuconostocandWeissellaisolates for kimchi starter development [J]. LWT-Food Science and Technology, 2015, 64(2): 1 078-1 084.
[39] GUARCELLO R, DE ANGELIS M, SETTANNI L, et al. Selection of amine-oxidizing dairy lactic acid bacteria and identification of the enzyme and gene involved in the decrease of biogenic amines [J]. Applied and Environmental Microbiology, 2016, 82(23): 6 870-6 880.
[40] 佟婷婷. 四川泡菜细菌多样性分析及降生物胺菌株筛选 [D].无锡: 江南大学, 2015.
[41] KWAK S H, CHO Y M, NOH G M, et al. Cancer preventive potential of kimchi lactic acid bacteria (Weissellacibaria,Lactobacillusplantarum) [J]. Journal of Cancer Prevention, 2014, 19(4): 253-258.
[42] 杨晓露. 产胞外多糖乳酸菌对馒头品质影响研究 [D].郑州:河南工业大学, 2014.
[43] BOUNAIX M-S, ROBERT H, GABRIEL V, et al. Characterization of dextran-producingWeissellastrains isolated from sourdoughs and evidence of constitutive dextransucrase expression [J]. FEMS Microbiology Letters, 2010, 311(1): 18-26.
[44] PARK J A, TIRUPATHI PICHIAH P B, YU J J, et al. Anti-obesity effect of kimchi fermented withWeissellakoreensisOK1-6 as starter in high-fat diet-induced obese C57BL/6J mice [J]. Journal of Applied Microbiology, 2012, 113(6): 1 507-1 516.
[45] JANG M H, PARK E H, YU J G, et al. Isolation of highly efficient beta-glucosidase producing lactic acid bacteria from Korean fermented vegetable Kimchi [J]. Journal of Biotechnology, 2010, 150:S368-S369.
[46] KANG M S, LIM H S, KIM S M, et al. Effect ofWeissellacibariaon fusobacterium nucleatum-induced interleukin-6 and interleukin-8 production in kB cells [J]. Journal of Bacteriology and Virology, 2011, 41(1): 9.
[47] KANG M S, CHUNG J, KIM S M, et al. Effect ofWeisseliacibariaisolates on the formation ofStreptococcusmutansbiofilm [J]. Caries Research, 2006, 40(5): 418-425.
[48] PAPAGIANNI M, PAPAMICHAEL E M. Purification, amino acid sequence and characterization of the class IIa bacteriocin weissellin A, produced byWeissellaparamesenteroidesDX [J]. Bioresource Technology, 2011, 102(12): 6 730-6 734.
[49] HUANG D, JIA Q, HU L, et al. Screening and identification ofWeissellacibariawith antioxidant activity in Sichuan traditional pickles and analysis of its characteristics [J]. Science and Technology of Food Industry, 2015, 36(17): 121-126.
TheapplicationofWeissellastrainsinfermentedfood
LI Qiao-yu1,2, FANG Fang1,2*, DU Guo-cheng1, 3, CHEN Jian1, 4
1(School of Biotechnology, Jiangnan University, Wuxi 214122, China)2(Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan Universiity, Wuxi 214122, China)3(Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan Universiity, Wuxi 214122, China)4(National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan Universiity, Wuxi 214122, China)
Weissellabelongs to the group of lactic acid bacteria found in many fermented foods, including soy sauce, pickled vegetables, fermented soybean and sausage.Weissellacontributes toshort chain fatty acids synthesis production of esters and organic acids in food fermentation, and is widely used in fermented food manufacture. Some strains from this genera exhibit the capability of production of bacteriocin,oligosaccharide, exopolysaccharide (EPS) and microbial cellulose, demonstrate their potential probiotic properties. In this review, isolation and identification ofWeissella, the physiological and biochemical characteristics, as well as the functional properties in fermented foods were discussed.
Weissella; fermented foods; lactic acid bacteria; taxonomy; characteristics
10.13995/j.cnki.11-1802/ts.014934
硕士研究生(方芳副教授为通讯作者,E-mail:ffang@jiangnan.edu.cn)。
国家自然科学基金(31771955);广东省科技计划项目(2015B020205002);江南大学自主科研计划重点项目(JUSRP51734B)
2017-06-12,改回日期:改回日期:2017-06-20
