过表达mqo对重组谷氨酸棒杆菌L-异亮氨酸和4-羟基异亮氨酸合成的影响
2017-12-26卢正珂史锋
卢正珂,史锋, 2*
1(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
过表达mqo对重组谷氨酸棒杆菌L-异亮氨酸和4-羟基异亮氨酸合成的影响
卢正珂1,史锋1, 2*
1(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
4-羟基异亮氨酸(4-hydroxyisoleucine,4-HIL)具有促进胰岛素分泌、降低胰岛素抵抗活性功能,在治疗糖尿病方面有潜在的应用价值。在产L-异亮氨酸(L-isoleucine,Ile)的谷氨酸棒杆菌SN01菌株中过表达ido基因后可以合成4-HIL。为了促进草酰乙酸的供应和4-HIL合成,在这株重组菌中又过表达了mqo。发酵144 h后,ido-mqo过表达菌的4-HIL产量是(60.86±2.24)mmol/L,低于ido过表达菌(72.06±5.60)mmol/L;但是,Ile的积累量高达(101.39±2.20)mmol/L,显著高于ido过表达菌(5.00±1.43)mmol/L。对ido-mqo过表达菌代谢途径中部分关键基因的RT-PCR分析表明,进入TCA循环的碳流由异柠檬酸裂解酶分流,进入乙醛酸循环,导致4-HIL合成所需的另一底物α-酮戊二酸(α-ketoglutarate,α-KG)供应不足和Ile过剩。于是添加α-KG,当添加量为40 mmol/L时,4-HIL的产量提高到(77.7±10.91)mmol/L,Ile到4-HIL的转化率提高到75%。因此,过表达mqo能够促进Ile合成,添加α-KG后能够促进Ile向4-HIL转化,从而提高4-HIL产量。
4-羟基异亮氨酸;谷氨酸棒杆菌SN01;L-异亮氨酸;mqo;α-酮戊二酸
据世界卫生组织报道,从1980年到2014年,糖尿病患者人数由1.08亿增加到4.22亿[1],其中II型糖尿病患者人数最多。研究表明,葫芦巴种子可用于临床治疗II型糖尿病[2-3],这其中起关键作用的生物活性物质是(2S,3R,4S)-4-羟基异亮氨酸(4-hydroxyisoleucine,4-HIL)[4],它具有促进胰岛素分泌、降低胰岛素抵抗作用[5],因此4-HIL在治疗II型糖尿病方面有潜在的应用价值。
目前,4-HIL的制备方法主要有:葫芦巴种子提取法、化学-酶合成法、酶合成法和微生物发酵法,其中微生物发酵法是适于工业生产4-HIL最简单、有效和经济的方法。2009年,研究人员在苏云金芽孢杆菌2e2 AKU 0251中发现了异亮氨酸双加氧酶(L-isoleucine dioxygenase,IDO)[6-8]。IDO催化L-异亮氨酸(L-isoleucine,Ile)发生4-羟化反应,生成4-HIL,同时使α-酮戊二酸(α-ketoglutarate,α-KG)发生氧化反应,生成琥珀酸,伴随消耗氧气并生成二氧化碳。随后,SMIRNOV等通过在大肠杆菌(Escherichiacoli)中克隆表达IDO编码基因ido,将外源添加的Ile转化成了4-HIL[9],但发酵中外源添加Ile会增加4-HIL的生产成本。
谷氨酸棒杆菌(Corynebacteriumglutamicum)SN01是1株工业用Ile生产菌,实验室前期在SN01中克隆和表达来自苏云金芽孢杆菌YBT 1520的ido基因,将SN01中自身合成的Ile成功转化为4-HIL[10](图1),实现了4-HIL的一步从头合成,摇瓶发酵144 h后4-HIL产量达到(65.44±2.27)mmol/L,Ile向4-HIL转化率是85%。

图1 重组谷氨酸棒杆菌中4-HIL的合成途径Fig.1 Biosynthesis pathway of 4-HIL in recombinant C.glutamicum
在谷氨酸棒杆菌中,草酰乙酸不仅是TCA循环中关键的中间物质,也是IDO催化反应的两个底物α-KG和Ile的共同前体物质,因此在4-HIL的合成途径中,草酰乙酸的供应很重要。本研究中,在外源表达ido的基础上,构建过表达苹果酸:醌氧化还原酶(malate:quinone oxidoreductase,MQO)编码基因mqo的重组菌,来增加草酰乙酸的供应,探究重组菌摇瓶发酵中4-HIL产量的变化,为4-HIL的工业化生产提供重要依据。
1 材料方法
1.1 材料
1.1.1 菌株和质粒
所用菌株包括大肠杆菌和谷氨酸棒杆菌SN01,质粒包括pJYW-4-ido[10]和pJYW-4-ido-mqo,均为本实验室保藏。
1.1.2 主要培养基
发酵种子培养基:用于发酵前期活化菌株培养,含有24.0 g/L葡萄糖,0.4 g/L (NH4)2SO4,1.25 g/L尿素,40.0 g/L玉米浆,1.0 g/L KH2PO4,0.5 g/L MgSO4,pH 7.2。灭菌条件为121 ℃,15min。
发酵培养基:用于发酵生产氨基酸,含有140.0 g/L葡萄糖,20.0 g/L (NH4)2SO4,10.0 g/L玉米浆,1 g/L KH2PO4,0.5 g/L MgSO4,0.5 g/L FeSO4,20 g/L CaCO3,pH 7.2;需要时添加20、30或40 mmol/L α-KG。灭菌条件为115 ℃,15 min。
1.2 实验方法
1.2.1 重组菌的摇瓶发酵
谷氨酸棒杆菌的摇瓶发酵主要参照方慧敏[11]的操作,其中种子培养基置于回旋式摇床30 ℃、150 r/min培养;发酵培养基置于回旋式摇床30 ℃、200 r/min培养。每隔12 h取1次样,测定菌体浓度、残糖、氨基酸含量和α-KG含量等。
1.2.1.1 氨基酸含量的测定
测定胞内外氨基酸含量时发酵样品的处理方法参照文献[12],之后用HPLC测定氨基酸含量[13]。在计算胞内氨基酸含量时首先计算出DCW (g/L) =0.34×OD562,然后再根据1 g DCW = 1.6 mL的公式计算得出胞内体积[14],最后得出胞内氨基酸的实际含量。
1.2.1.2 α-KG含量的测定
胞内α-KG含量测定方法参照牛腾飞[15]的操作。测定胞外α-KG含量时样品的处理方法是,首先将发酵液12 000 r/min离心5 min,取上清液经0.22 μm孔径的水相针式滤膜过滤后,再进行后续HPLC操作测定α-KG含量。胞内外α-KG的计算方法参照胞内外氨基酸的计算方法。
1.2.2 基因转录水平分析
利用RNA反转录和RT-PCR分析菌株中关键基因的转录水平。取48 h的发酵液200 μL,12 000 r/min离心3 min,沉淀用100 mg/mL的溶菌酶于37 ℃处理30 min,后续具体操作参照RNA提取试剂盒说明书、cDNA反转录试剂盒说明书。反应以16S rRNA作为内参进行校正,通过Ct值来比较基因转录水平差异,最终通过计算2-ΔΔCt来获得目的基因相对于对照菌株的转录水平[16],数值>1为上调,<1则为下调。
2 结果与分析
在谷氨酸棒杆菌中,依赖黄素腺嘌呤二核苷酸(FAD)和脂质的膜结合蛋白MQO[17]不仅能催化苹果酸回补草酰乙酸,还能加快TCA循环的下游途径,因此在本文中,构建了过表达mqo的重组菌,并分析重组菌中4-HIL产量的变化。
2.1 构建质粒pJYW-4-ido-mqo
以SN01基因组为模板,用引物mqo-F(5’-CAAGGATCCAGAAGGAGATATTGCATGTCAGATTC-C-C-CGAAG-3’)和mqo-R(5’-TATGTCGACTTAGGCTTCCTCAAGCTTCAGG-3’)PCR扩增基因片段BamHI-mqo-SalI,连接到质粒pJYW-4-ido上,获得重组质粒pJYW-4-ido-mqo。质粒pJYW-4-ido-mqo的PCR验证和酶切验证结果见图2。pJYW-4-ido-mqo全长9 260 bp。
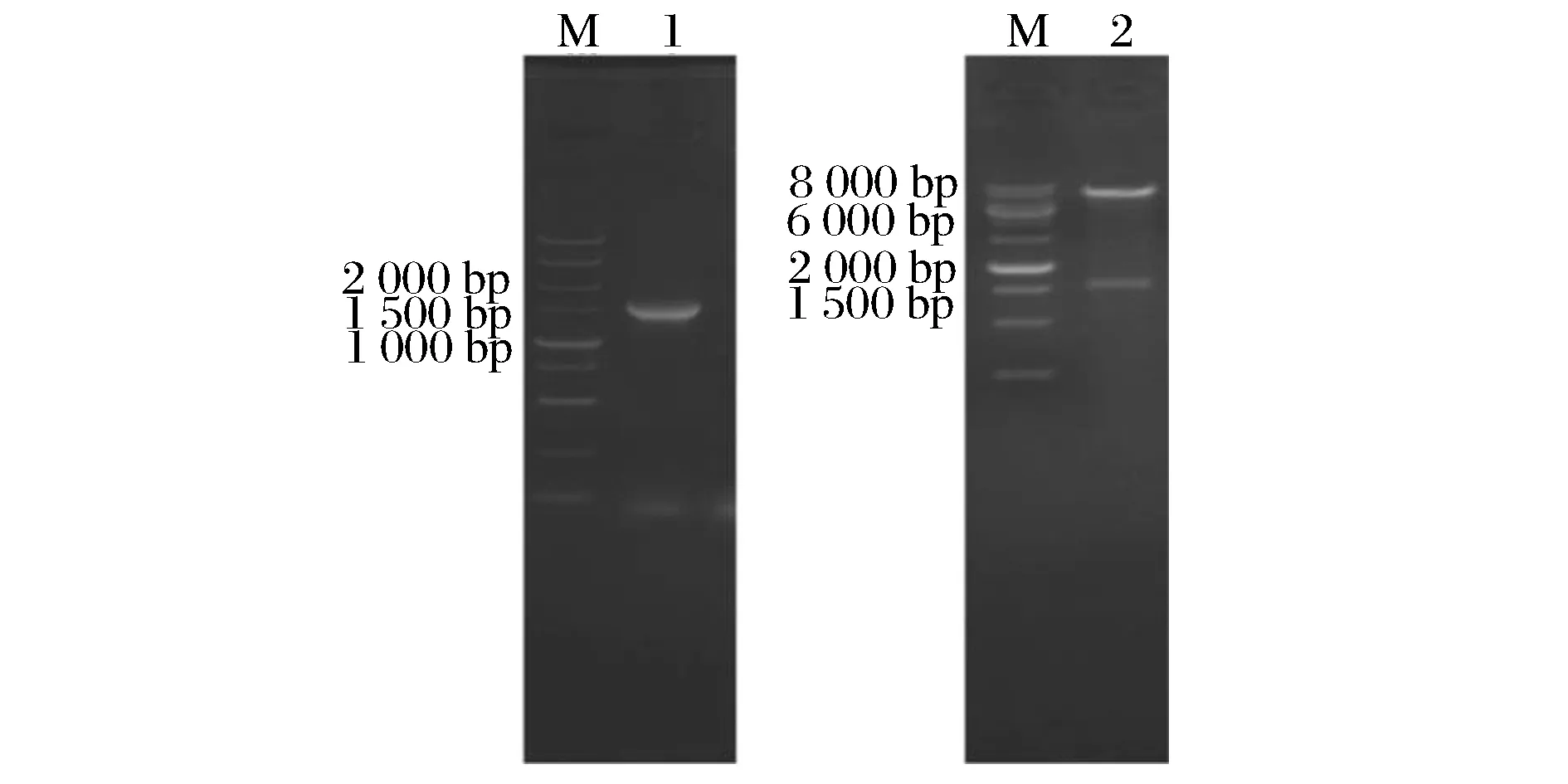
图2 质粒pJYW-4-ido-mqo的PCR验证和酶切验证图Fig.2 Verification of plasmid pJYW-4-ido-mqo by PCR and restriction enzyme digestion
1号泳道是用引物mqo-F/mqo-R PCR验证质粒的结果,扩增片段预计大小是1503 bp,实际验证正确;2号泳道是用BamHI/SalI酶切质粒验证,酶切后片段预计大小分别是1 524 bp和7 736 bp,实际验证正确。验证结果表明,质粒pJYW-4-ido-mqo构建成功。
再将质粒pJYW-4-ido-mqo电转入SN01感受态细胞中,筛选出转化子进行验证,将验证正确的重组菌命名为SN01/pJYW-4-ido-mqo(以下简称SZ05)。
2.2 过表达mqo对菌株生长状况的影响
通过摇瓶发酵对mqo过表达菌株SZ05生长情况进行考察,图3显示摇瓶发酵过程中,菌株SN01/pJYW-4-ido(以下简称SZ01)和SZ05的OD562和残糖变化。0 h~132 h,菌株SZ05的OD562低于菌株SZ01(图3a),在发酵末期144 h,SZ05的菌体浓度稍高于SZ01。0~12 h,2株菌的耗糖率相同(图3b),12 h后,菌株SZ05的残糖量一直高于SZ01,到发酵结束,SZ01的糖耗尽,SZ05剩余14.50 g/L葡萄糖。由此可见mqo过表达影响菌株的生长状况。据文献报道,TCA循环减弱不利于菌株生长[18],因此,菌株SZ05生长变慢可能是由于TCA循环碳流减弱所致。TCA循环碳流减弱原因会进一步分析。

图3 SZ01和SZ05摇瓶发酵过程的菌浓(a)和残糖(b)Fig.3 Biomass (a) and residual glucose (b) of SZ01 and SZ05 strains in shake flask cultivation
2.3 过表达mqo对菌株发酵氨基酸产量的影响
通过摇瓶发酵对菌株SZ05产4-HIL的能力进行考察,图4显示摇瓶发酵过程中,菌株SZ01和SZ05中氨基酸产量的变化。发酵前60 h,ido单表达菌SZ01快速积累4-HIL(图4a),60 h后4-HIL的积累速度变慢,Ile在36 h时积累量最高(图4b),随后伴随着4-HIL的不断生成,Ile浓度逐渐降低。发酵全程中,ido-mqo共表达菌SZ05中4-HIL的产量逐渐升高,但产量一直低于SZ01,Ile的积累量也逐渐升高,没有降低。发酵144 h后,SZ01积累(72.06±5.60)mmol/L的4-HIL,剩余(5.00±1.43)mmol/L的Ile,Ile到4-HIL的转化率是94%;而SZ05合成(60.86±2.24)mmol/L的4-HIL,产量稍低于SZ01,但剩余(101.39±2.20)mmol/L的Ile,Ile到4-HIL的转化率只有38%。发酵144 h后,SZ05中天冬氨酸族氨基酸总产量是(205.76±5.30)mmol/L(图4c),显著高于SZ01中天冬氨酸族氨基酸总产量(115.58±8.11)mmol/L,且发酵液中L-谷氨酸(Glu)和L-苏氨酸(Thr)含量明显降低(图4d),L-丙氨酸(Ala)含量降低不明显,L-甘氨酸(Gly)和L-赖氨酸(Lys)含量增加,但副产物总量降低。综上说明,过表达mqo增加了天冬氨酸族氨基酸的产量,但降低了Ile向4-HIL的转化率。

图4 菌株SZ01和SZ05发酵氨基酸产量的差异Fig.4 Amino acids production of SZ01 and SZ05
有研究表明,在谷氨酸棒杆菌AHP-3中,敲除mqo后减少了TCA循环的代谢流,增加了草酰乙酸到Lys合成的碳流,提高了Lys的产量[19]。而在本研究中,过表达mqo的菌株出现生长速率下降和Lys积累量增加的现象,且天冬氨酸族氨基酸的产量显著提高,猜测可能是由于更多的碳流流入天冬氨酸族氨基酸合成途径,减弱了TCA循环,于是对SZ05中关键基因的转录水平进行了分析。
2.4 过表达mqo的菌株中关键基因转录水平变化
根据代谢途径分析表明,过表达mqo回补的草酰乙酸可分别进入天冬氨酸族氨基酸合成途径和TCA循环。针对菌株SZ05中天冬氨酸族氨基酸的产量显著提高的结果,对菌株SZ01和SZ05代谢途径中的关键基因(天冬氨酸激酶基因lysC、异柠檬酸裂解酶基因aceA、柠檬酸合酶基因gltA、琥珀酸脱氢酶基因sdhA、异柠檬酸脱氢酶基因icd、α-酮戊二酸脱氢酶基因odhA和ido)的转录水平进行了分析(图5)。

图5 菌株SZ01和SZ05中主要基因的转录水平分析结果Fig.5 The transcription level of target genes
与SZ01相比,SZ05中lysC、aceA、gltA和sdhA的转录水平明显升高,icd的转录水平基本无变化,而odhA和ido的转录水平稍有降低。这说明过表达mqo有利于加强进入天冬氨酸族氨基酸合成途径和TCA循环的碳流,但由于aceA和sdhA的转录水平显著升高,使得进入TCA循环的碳流由异柠檬酸裂解酶分流,进入乙醛酸循环,很可能造成IDO酶促反应中底物α-KG供应不足,导致Ile到4-HIL的转化率降低,从而导致Ile过剩。
研究表明,TCA循环和天冬氨酸族氨基酸合成途径中碳流分布不均匀会影响菌株生长和产物产量,TCA循环减弱会导致菌株生长变慢[18]。因此,在菌株SZ05中,由于基因lysC和aceA的转录水平明显提高,使得天冬氨酸族氨基酸合成途径中的碳流增加,TCA循环碳流减少,从而导致菌株SZ05生长变慢。
2.5 过表达mqo后α-KG含量和胞内氨基酸含量的变化
针对过表达mqo后Ile到4-HIL的转化率低和Ile过剩的问题,进一步测定了胞内外的α-KG含量。在菌株SZ05中,发酵48 h胞内α-KG的含量(0.61 mmol/L)低于SZ01胞内α-KG含量(1.13 mmol/L)(图6a),发酵液中α-KG含量(0.81 mmol/L)也明显低于菌株SZ01发酵液中α-KG含量(3.67 mmol/L),由此说明,过表达mqo导致底物α-KG供应量降低。
另外,IDO酶促反应会受到过量底物Ile的抑制作用[12, 20],当Ile浓度在0~10 mmol/L时,IDO的酶活随底物的增加而提高,当Ile高于20 mmol/L时,IDO的活性受到抑制。IDO是一种胞内蛋白,在胞内起催化反应,胞内Ile的过多积累会抑制IDO酶活。为此进一步测定了60、84和108 h的胞内Ile含量(图6b),菌株SZ05中胞内Ile含量(108.13~125.34 mmol/L)显著高于菌株SZ01中Ile含量(49.12~11.25 mmol/L),且随着发酵的进行,SZ01中Ile的积累量是降低的,而SZ05的积累量一直在升高,并显著高于20 mmol/L。所以Ile过多过快的积累也影响了SZ05中IDO的活性,从而降低了Ile到4-HIL的转化率。
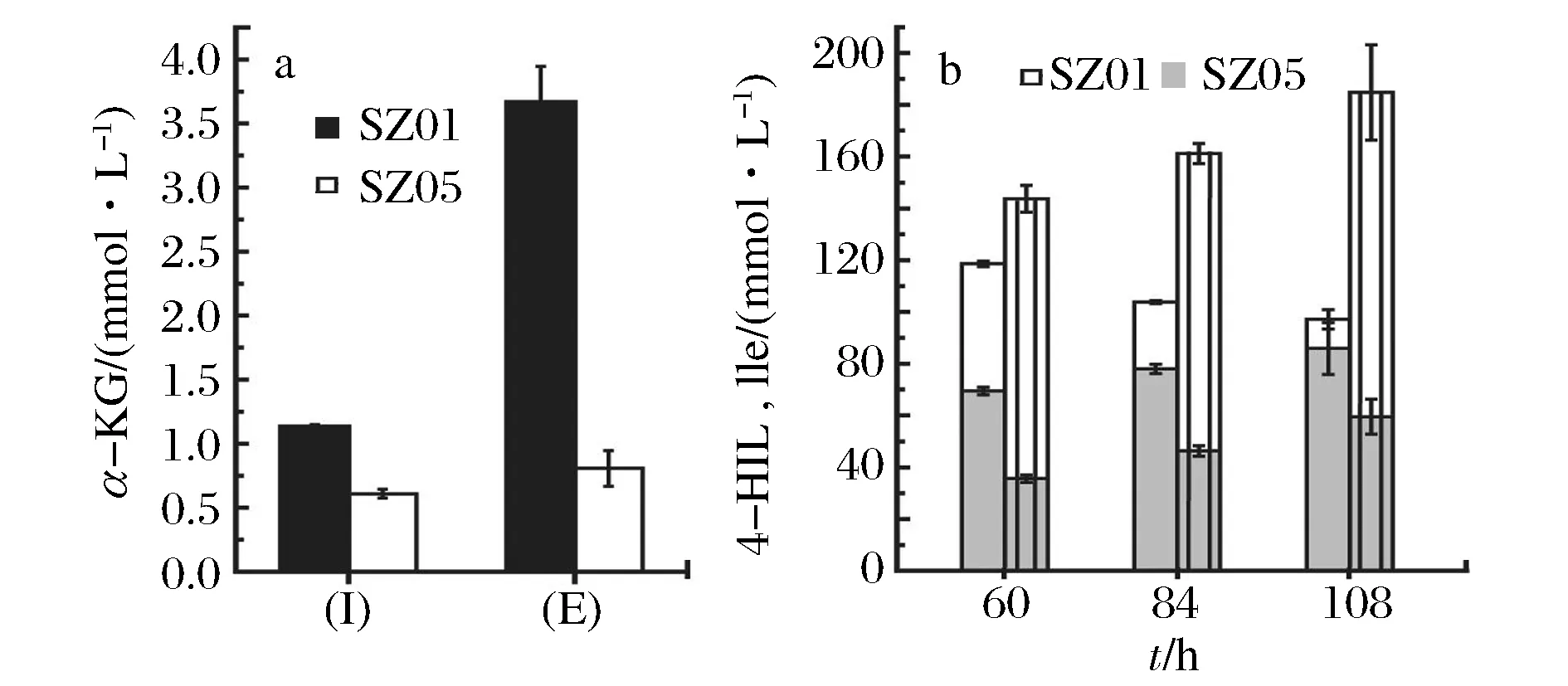
图6 菌株SZ01和SZ05中α-KG含量和胞内氨基酸含量的测定结果Fig.6 (a) Intracellular (I) and extracellular (E) concentrations of α-KG at 48 h, (b) intracellular concentrations of 4-HIL and Ile at 60 h, 84 h and 108 h
2.6 添加α-KG对4-HIL产量的影响
由于SZ05中α-KG的供应量明显不足,导致Ile过剩。因此,进一步研究了添加不同浓度的α-KG对合成4-HIL的影响(图7)。添加20、30和40 mmol/L的α-KG后,菌株SZ05在发酵144 h后,Ile到4-HIL的转化率分别提高到70%、81%和75%,4-HIL的产量均比不添加α-KG时高,当添加40 mmol/L的α-KG时,4-HIL的产量提高到(77.7±10.91)mmol/L。因此,在菌株SZ05发酵中添加α-KG有利于提高4-HIL的产量,提高Ile到4-HIL的转化率。
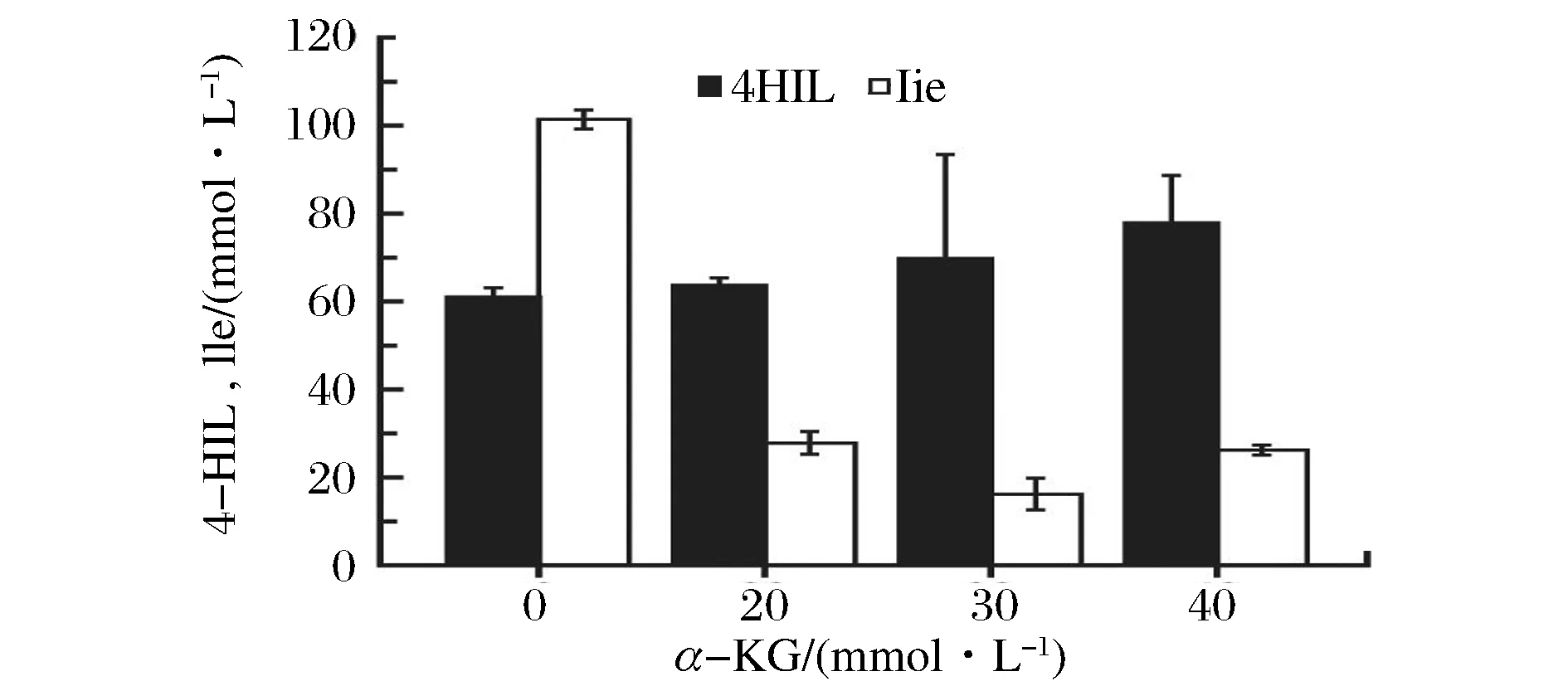
图7 α-KG的添加浓度对4-HIL产量的影响Fig.7 Effects of addition of α-KG on 4-HIL production
3 结论
过表达mqo后,过多积累了Ile和天冬氨酸族氨基酸的含量,不利于Ile向4-HIL的转化,降低了4-HIL的产量。通过对mqo过表达菌株的代谢途径中部分关键基因的RT-PCR分析表明,进入TCA循环的碳流由异柠檬酸裂解酶分流,进入乙醛酸循环,导致IDO酶促反应中另一底物α-KG供应不足和菌株生长变慢,出现Ile过剩的结果。另外,胞内Ile的过多过快的积累也会影响mqo过表达菌株中IDO的活性,从而降低了Ile到4-HIL的转化率。随后,通过外源添加α-KG提高了重组菌中4-HIL的产量。在后期的研究中可以通过代谢工程改造敲除异柠檬酸裂解酶编码基因aceA加强TCA循环提高α-KG的供应,进一步提高4-HIL的产量。本研究为4-HIL的工业化生产提供了重要依据。
[1] World Health Organization. Global report on diabetes[R].Switzerland:Geneva,2016.
[2] NEELAKANTAN N,NARAYANAN M,DE Souza R J,et al.Effect of Fenugreek (Trigonellafoenum-graecumL.) intake on glycemia:a meta-analysis of clinical trials[J].Nutrition Journal,2014,13(1):7.
[3] GADDAM A,GALLA C,THUMMISETTI S,et al.Role of fenugreek in the prevention of type 2 diabetes mellitus in prediabetes[J].Journal of Diabetes and Mmetabolic Ddisorders,2015,14(1):74.
[4] FOWDEN L,PRATT H M,SMITH A.4-Hydroxyisoleucine from seed ofTrigonellafoenum-graecum[J].Phytochemistry,1973,12(7):1 707-1 711.
[5] JETTE L,HARVEV L,EUGENI K,et al.4-Hydroxyisoleucine: a plant-derived treatment for metabolic syndrome[J].Current Opinion in Investigational Drugs,2009,10(4):353-358.
[6] KODERA T,SMIRNOV S V,SAMSONOVA N N,et al.A novelL-isoleucine hydroxylating enzyme,L-isoleucine dioxygenase fromBacillusthuringiensis,produces (2S,3R,4S)-4-hydroxyisoleucine[J].Biochemical and Biophysical Research Communications,2009,390(3):506-510.
[7] HIBI M,KAWASHIMA T,KODERA T,et al.Characterization ofBacillusthuringiensisL-isoleucine dioxygenase for production of useful amino acids[J].Applied and Environmental Microbiology,2011,77(19):6 926-6 930.
[8] OGAWA J,KODERA T,SMIRNOV S V,et al.A novelL-isoleucine metabolism inBacillusthuringiensisgenerating (2S,3R,4S)-4-hydroxyisoleucine,a potential insulinotropic and anti-obesity amino acid[J].Applied Microbiology and Biotechnology,2011,89(6):1 929-1 938.
[9] SMIRNOV S V,KODERA T,SAMSONOVA N N,et al.Metabolic engineering ofEscherichiacolito produce (2S,3R,4S)-4-hydroxyisoleucine[J].Applied Microbiology and Biotechnology,2010,88(3):719-726.
[10] SHI F,NIU T,FANG H.4-Hydroxyisoleucine production of recombinantCorynebacteriumglutamicumssp.lactofermentumunder optimal corn steep liquor limitation[J].Applied Microbiology and Biotechnology,2015,99(9):3 851-3 863.
[11] SHI F,FANG H,NIU T,et al.Overexpression ofppcandlysCto improve the production of 4-hydroxyisoleucine and its precursorL-isoleucine in recombinantCorynebacteriumglutamicumssp.lactofermentum[J].Enzyme and Microbial Technology,2016,87-88:79-85.
[12] 方惠敏.表达ido的重组谷氨酸棒杆菌代谢途径改造以提高4-羟基异亮氨酸的产量[D].无锡:江南大学,2016.
[13] SHI F,LI K,HUAN X,et al.Expression of NAD(H) kinase and glucose-6-phosphate dehydrogenase improve NADPH supply andL-isoleucine biosynthesis inCorynebacteriumglutamicumssp. lactofermentum[J].Applied Biochemistry and Biotechnology,2013,171(2):504-521.
[14] KENNERKNECHT N,SAHM H,YEN M R,et al.Export ofL-isoleucine fromCorynebacteriumglutamicum: a two-gene-encoded member of a new translocator family[J].Journal of Bacteriology,2002,184(14):3 947-3 956.
[15] 牛腾飞.异亮氨酸双加氧酶的酶学性质及重组谷氨酸棒杆菌合成4-羟基异亮氨酸的研究[D].无锡:江南大学,2015.
[16] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2012,25(4):402-408.
[17] MOLENAAR D,van der Rest M E,DRYSCH A,et al.Functions of the membrane-associated and cytoplasmic malate dehydrogenases in the citric acid cycle ofCorynebacteriumglutamicum[J].Journal of Bacteriology,2000,182(24):6 884-6 891.
[18] KOFFAS M A G,JUNG G Y,STEPHANOPOULOS G. Engineering metabolism and product formation inCorynebacteriumglutamicumby coordinated gene overexpression[J].Metabolic Engineering,2003,5(1):32-41.
[19] MITSUHASHI S,HAYASHI M,OHNISHI J,et al.Disruption of malate:quinone oxidoreductase increasesL-lysine production byCorynebacteriumglutamicum[J].Bioscience Biotechnology and Biochemistry,2006,70(11):2 803-2 806.
[20] 付敏杰,聂尧,穆晓清,等.新型异亮氨酸双加氧酶及其重组大肠杆菌合成羟基异亮氨酸[J].化工进展,2014(11):3 037-3 044.
EffectsofmqooverexpressiononthesynthesisofL-isoleucineand4-hydroxyisoleucineinrecombinantCorynebacteriumglutamicum
LU Zheng-ke1,SHI Feng1,2*
1(State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China)2(Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology,Jiangnan University, Wuxi 214122, China)
4-hydroxyisoleucine (4-HIL), which can exhibit unique insulinotropic and insulin-sensitizing activities, has potential medical value in treating diabetes. AnL-isoleucine (Ile)-producer,Corynebacteriumglutamicumssp.lactofermentumSN01 can synthesize 4-HIL whenidogene. In order to promote the supply of oxaloacetate and synthesis of 4-HIL,mqowas overexpressed in this recombinant strain. After 144 h of fermentation, 4-HIL production of ido-mqo-expressing strain was (60.86±2.24) mmol/L, lower than that ofido-expressing strain (72.06±5.60) mmol/L. However, its Ile concentration was (101.39±2.20) mmol/L, significantly higher than that ofido-expressing strain (5.00±1.43) mmol/L. The RT-PCR analysis of some key genes in the metabolic pathway ofido-mqo-expressing strain showed that the carbon flow entering the TCA cycle was diverted by the isocitrate lyase to the glyoxylic acid cycle, resulting in the insufficient supply of another substrate for 4-HIL synthesis, i.e. α-ketoglutarate (α-KG) and excessive Ile concentration. Therefore, α-KG was added. When 40 mmol/L of α-KG was added, the yield of 4-HIL increased to (77.7±10.91) mmol/L and the conversion ratio of Ile to 4-HIL increased to 75%. Therefore, overexpression ofmqocan promote Ile synthesis, and addition of α-KG can promote the conversion of Ile to 4-HIL, thereby increasing the yield of 4-HIL.
4-hydroxyisoleucine;Corynebacteriumglutamicumssp.lactofermentumSN01;L-isoleucine;mqo;α-ketoglutarate
10.13995/j.cnki.11-1802/ts.014845
硕士研究生(史锋副教授为通讯作者,E-mail: shifeng@jiangnan.edu.cn)。
江南大学食品科学与技术国家重点实验室自由探索资助课题(编号SKLF-ZZB-201405)
2017-05-28,改回日期:2017-06-25
