梯度平板法定量分析啤酒污染细菌的四氢异-α-酸抗性
2017-12-26郑飞云钮成拓朱林江张逸秋李永仙刘春凤王金晶李崎
郑飞云,钮成拓,朱林江,张逸秋,李永仙,刘春凤,王金晶,李崎*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学,食品安全与营养协同创新中心,江苏 无锡,214122)3(浙江工业大学 生物工程学院,浙江 杭州,310014)
梯度平板法定量分析啤酒污染细菌的四氢异-α-酸抗性
郑飞云1,2,钮成拓1,2,朱林江3,张逸秋1,2,李永仙1,2,刘春凤1,2,王金晶1,2,李崎1,2*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学,食品安全与营养协同创新中心,江苏 无锡,214122)3(浙江工业大学 生物工程学院,浙江 杭州,310014)
快速定量分析啤酒污染细菌的酒花抗性和腐败啤酒能力,对啤酒的工业生产具有重要的应用价值。该研究首先优化并建立了基于酒花苦味物质四氢异-α-酸梯度平板的定量分析方法,并通过该方法定量分析23株啤酒污染细菌的四氢异-α-酸最小抑制浓度、比较分析液体培养基中的生长情况和菌株的腐败啤酒能力。研究结果表明,酒花苦味物质四氢异-α-酸的浓度梯度平板法,能够简单快速并定量分析啤酒污染细菌的四氢异-α-酸抗性,同时能够评估菌株的腐败啤酒能力。
啤酒污染细菌;酒花抗性;酒花苦味物质;四氢异-α-酸;快速检测
啤酒污染细菌(beer spoilage bacteria)是在接种酵母、发酵、过滤等啤酒酿造过程和成品啤酒等环境中能够生存或繁殖,对啤酒的酿造和贮存构成威胁的细菌总称[1]。虽然随着现代啤酒酿造技术和灌装技术的不断发展,极大地降低了啤酒污染细菌的危害,但是在啤酒酿造过程中对啤酒污染细菌的监控依然是必不可少的。目前普遍采用丰富培养基的检测方法[2],如添加环己酰亚胺的MRS和Rka-Ray培养基;也有添加啤酒中营养成分和生长因子的培养基UBA和NBB等。不过,通过这些检测培养基的分析,只能分析啤酒污染细菌的数量,难以对分离菌株的腐败性能进行快速鉴定[3]。鉴定啤酒污染细菌腐败能力的传统方法是植菌实验,即将分离菌株重新接种到啤酒中进行实验,分析其生长情况,一般需要花费1个月以上,难以有效地指导生产。所以,需要发展快速鉴定方法,用于快速鉴定啤酒污染细菌腐败能力。
啤酒污染细菌的腐败能力,取决于污染细菌在啤酒环境中的生长能力。一般而言,啤酒是一种安全的饮料,这是由于啤酒中不仅含有一定浓度的乙醇、低pH环境、痕量的氧气和高浓度的二氧化碳,而且含有一定浓度的酒花苦味物质。这种环境能够抑制绝大多数细菌的生长。然而,仍有少量细菌能够在啤酒环境中生长,对啤酒的发酵和保藏构成威胁。这种细菌主要是一些乳杆菌、片球菌以及一些绝对厌氧菌。这些细菌在啤酒环境中生长的一个典型特征是必须具有酒花抗性,即耐受啤酒中存在的酒花苦味物质[4]。四氢异-α-酸是基于酒花苦味物质α-酸开发的一种新型酒花苦味物质,具有更高的苦味值和更强的抑菌效果,已成为啤酒工业常用的酒花制品。因此,目前本文使用四氢异-α-酸进行啤酒污染细菌的抑制实验。已有研究表明,在啤酒污染细菌中,腐败啤酒能力与与其酒花抗性能力具有一定的相关性[5-7]。所以,酒花抗性是研究啤酒污染细菌的一个重要生理特征。也已探索了基于酒花抗性机制而建立的快速检测方法,如基于酒花抗性相关基因horA和horC的多重PCR检测方法[8]、基于酒花抗性菌株表面抗原特征的单克隆抗体检测方法[3,9]、基于菌种的PCR检测方法[10]和荧光原位杂交技术[11]等。而这些快速检测方法,仍难以定量检测啤酒污染细菌的酒花抗性和腐败啤酒能力。
为了快速评价啤酒污染细菌的腐败能力,本次研究选用实验室保藏的啤酒污染细菌资源库中的多个菌株,建立梯度平板快速定量分析啤酒污染细菌四氢异-α-酸抗性的方法,并比较分析啤酒污染细菌酒花苦味物质四氢异-α-酸最小抑制浓度与其腐败能力的相关性。
1 材料和方法
1.1 菌株及培养方法
本次研究所使用的啤酒污染细菌,是实验室保藏,分离自国内多个不同啤酒厂,并经过菌种鉴定,主要属于乳杆菌属。培养条件:采用MRS培养基或添加了四氢异-α-酸的MRS培养基,在28 ℃进行厌氧培养。厌氧环境:培养皿的培养在厌氧罐中进行;液体培养在厌氧管或厌氧瓶中进行。
1.2 四氢异-α-酸梯度平板的制备
四氢异-α-酸制品(美国哈斯公司)是含有9 g/L的四氢异-α-酸的溶液,将其作为母液,用于配制不同浓度的四氢异-α-酸的培养基。四氢异-α-酸梯度平板的制作采用方形培养皿,制作方法如下:配制含高浓度四氢异-α-酸0.5 g/L的MRS琼脂培养基和不含四氢异-α-酸的MRS培养基;将方形培养皿倾斜10°,倒入20 mL含高浓度四氢异-α-酸的MRS培养基;待第1层凝固后,将培养皿放平,然后倒入20 mL不含四氢异-α-酸的MRS培养基;凝固后放入自封袋,放入4 ℃冰箱,至少放置 1 d,使下层培养基中的四氢异-α-酸向上渗透,使培养基表面形成酒花梯度,待用。
1.3 菌株的四氢异-α-酸最小抑制浓度的分析
首先采用MRS培养基活性菌株:将保藏管中的啤酒污染细菌接入装有20mL MRS液体培养基的厌氧管中进行活化,接种量为5%,30 ℃下厌氧培养24~48 h;转接活化细胞到新鲜的20 mL MRS中,相同条件下厌氧培养12~24 h,使细胞生长至对数期;通过培养皿背面标记均分涂布区域:将方形梯度平板分为6块平行区域;每1块区分平均分为6个小格,从低浓度端开始依次将每个小格标记为格子1#—格子6#;取10 μL培养液,均匀滴加到四氢异-α-酸梯度平板的相应位置;用涂布棒在平板的固定区域涂布均匀,并使培养液被吸干;在28 ℃,厌氧罐中,培养3~5 d;观察细胞生长情况。
各个四氢异-α-酸最小抑制浓度(MIC)的计算如公式(1)所示:

(1)
式中:MIC,菌株的四氢异-α-酸的最小抑制浓度,%;C高,高浓度端的四氢异-α-酸浓度,%;C低,低浓度端的四氢异-α-酸浓度,%;6,每个菌株生长的培养基平板上平均分为6格;n,实验菌株生长的格子数。
1.4 四氢异-α-酸胁迫条件下的菌株生长能力分析
将活化菌株接种到含不同四氢异-α-酸浓度的MRS液体培养基中;厌氧管中,28 ℃培养;每24 h取样300 μL到1.5 mL的离心管中;取200 μL到96孔板,通过酶标仪分析OD600;比较分析不同菌株的生长情况。
1.5 紫外分光光度法测定酒花浸膏苦味值
将制备好的样品10 mL置于50 mL刻度离心管中,加0.5 mL 6 mol/L HCl酸化,加入20 mL异辛烷;拧紧塑料盖,放入自动振荡器,设置振幅为2~3 cm,频率为200次/min,振荡30 min后取出,放入离心机,3 000 r/min离心10 min;取离心后的上清液置于1 cm石英比色皿中,于波长275 nm处,以异辛烷作空白测定吸光度。苦味值按公式(2)计算:
苦味值(BU)=A275×50
(2)
1.6 菌株的腐败啤酒能力分析
1.6.1 污染细菌的活化
将保藏管中的啤酒污染细菌接入装有20 mL MRS液体培养基的厌氧管中进行活化,接种量为5%,30 ℃下厌氧培养24~48 h;转接活化细胞到新鲜的20 mL MRS中,相同条件下厌氧培养3 d,使细胞生长至稳定期。
1.6.2 成品啤酒的消毒
对成品啤酒进行巴士消毒,开盖用灭菌纱布包好静置2 d除气;将啤酒分装入已灭菌的厌氧管中,每管20 mL。
1.6.3 植菌实验
将已活化的菌液接入啤酒中,接种量为1%,28 ℃下培养1个月,能使啤酒变浑浊的即为啤酒污染细菌,并取200 μL通过96孔板测定最终OD600值。
2 结果和讨论
2.1 四氢异-α-酸梯度平板快速检测啤酒污染细菌的四氢异-α-酸抗性
优化后的四氢异-α-酸梯度平板的制作方法如图1A所示。方型培养皿有利于梯度平板的制作,提高其重复性。在制作梯度平板方面还需注意的其他细节包括:1)制做第1层高浓度酒花浸膏的培养基时,应在稍高温度下时倒置,有利于培养基表面的平整;2)第2层低浓度酒花浸膏的培养基倒置完成后,尽量吹干,有利于活化菌液的涂布。
从实验室保藏的啤酒污染细菌资源库中,活化了其中23株,如表1所示,用于本次研究。这些菌株主要来自于长三角地带的啤酒工厂,具备一定的繁殖能力。采用四氢异-α-酸高浓度为0.05%和低浓度为0%的梯度平板,对这些菌株的四氢异-α-酸抗性进行分析,结果如图1B所示。不同菌株在梯度平板中的生长能力存在显著差异,其四氢异-α-酸的MIC如表1所示。
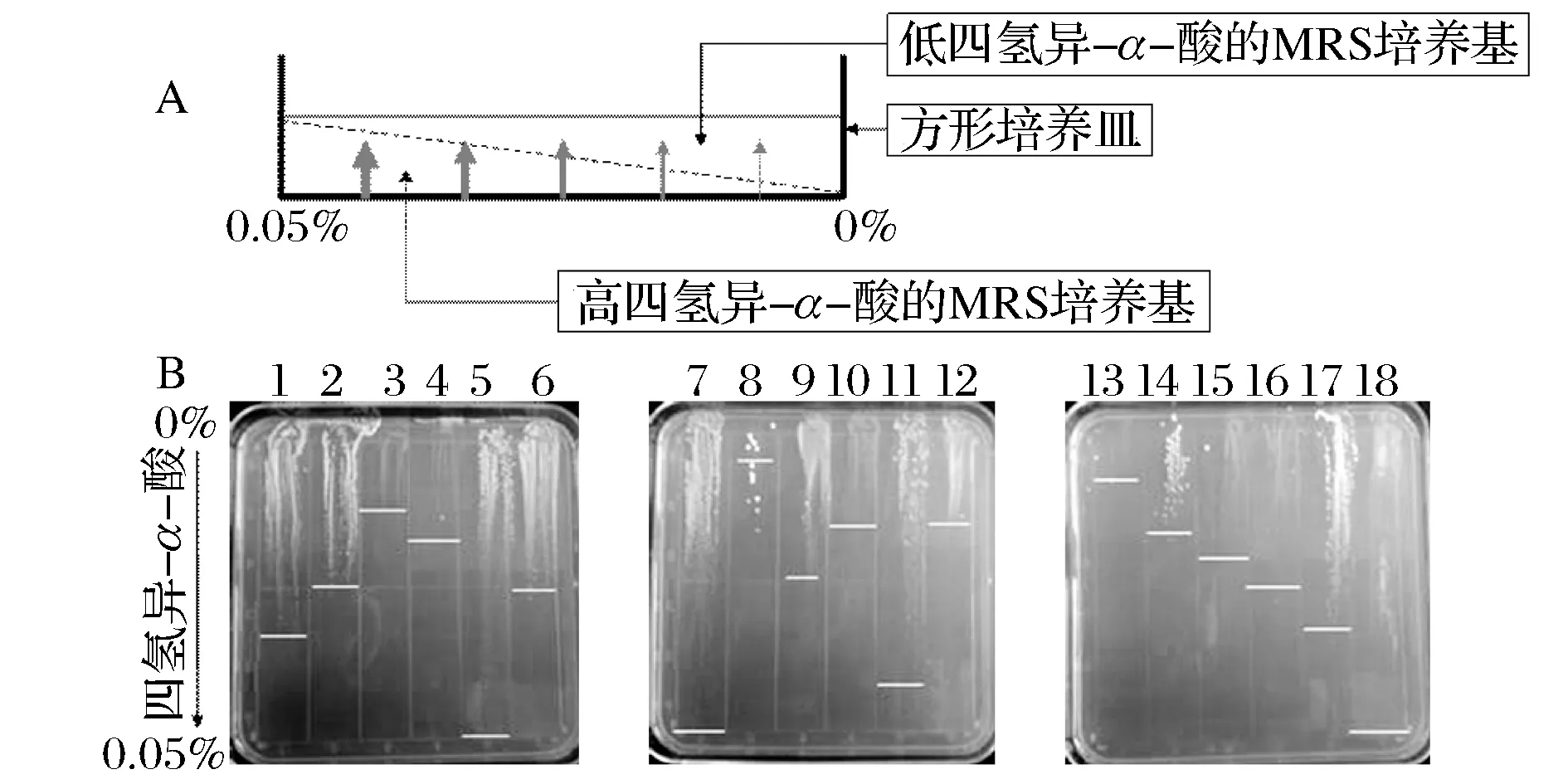
A:四氢异-α-酸梯度平板的制作方法示意图;B:梯度平板分析啤酒污染细菌菌株的四氢异-α-酸最小抑制浓度1-18的菌株编号依次为:2-9-2、1-8-2、2-5-3、3-6-3、6-12-4、6-14-3、3-14-2、6-17-3、6-20-2、3-13-4、6-20-2、2-13-1、1-5-3、2-14-1、3-13-1、1-6-1、2-9-5图1 梯度平板快速分析菌株的四氢异-α-酸抗性Fig.1 Resistance of strains towards tetrahydro-iso-α-acid

表1 各个菌株的四氢异-α-酸最小抑制浓度和12°P啤酒中的生长能力Table 1 MIC values and growth ability of different strains in 12°P beer
续表1
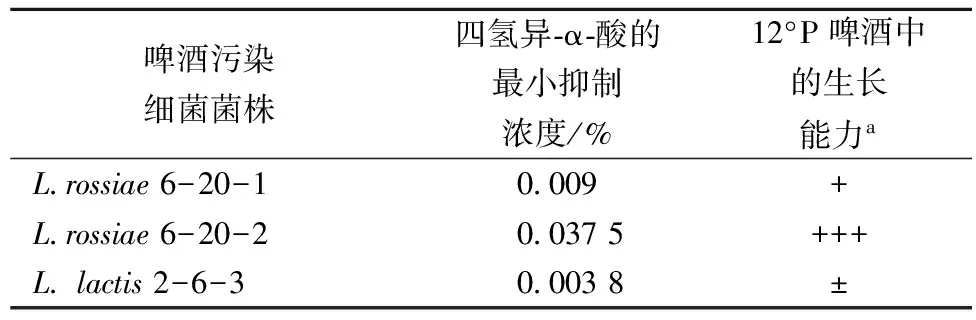
啤酒污染细菌菌株四氢异⁃α⁃酸的最小抑制浓度/%12°P啤酒中的生长能力aL rossiae6-20-10 009+L rossiae6-20-20 0375+++L lactis2-6-30 0038±
注a:12°P啤酒中的生长能力:接种到12°P啤酒中培养30 d后,通过96孔板测定其OD600值,“±”:OD = 0~0.02;“+”:OD = 0.02~0.04;“++”:OD = 0.04~0.06;“+++”:OD = 0.06~0.12。
在3块梯度平板中,5#、7#和18#涂布区域的菌株具有最好的生长能力,菌斑遍及全部的6个格子,其四氢异-α-酸应接近或高于0.05%,其对应的菌株分别是L.plantarum6-12-4、L.plantarum3-14-2和L.paracasei2-9-5。所以,四氢异-α-酸梯度平板能够有效地鉴定不同四氢异-α-酸抗性能力的菌株,并根据生长菌斑的长度,对各个菌株的四氢异-α-酸MIC进行了初步地定量分析。
2.2 四氢异-α-酸胁迫条件下菌株生长能力的比较
采用四氢异-α-酸梯度平板,能够快速有效地定量分析各个菌株对酒花苦味物质四氢异-α-酸的耐受能力。为了验证其分析结果,选取了6株啤酒污染细菌,比较其在含有一定浓度四氢异-α-酸的液体MRS培养基中的生长情况,结果如图2所示。

图2 0.005%(A)和0.01%(B)浓度四氢异-α-酸胁迫条件下的菌株生长曲线Fig.2 Growth curves of different strains in MRS media with 0.005% (A) and 0.01% (B) tetrahydro-iso-α-acid
采用的胁迫条件为,四氢异-α-酸含量分别为0.005%和0.01%的液体MRS培养基,通过紫外分光光度法测定其对应的苦味值分别是42.6 BU和80.5 BU。这6株菌在0.005%四氢异-α-酸的胁迫条件下,均表型出一定的生长能力,具有一定的四氢异-α-酸抗性能力。在0.01%四氢异-α-酸的胁迫条件下时,L.brevis1-5-1和L.paracasei2-15-2的生长已被抑制,其最小抑制浓度应在0.005%~0.01%,而梯度平板分析结果表明其MIC分别为0.009%和0.007 5,具有较好匹配性。菌株L.plantarum6-12-4和L.plantarum1-8-2在这两种条件下,生长能力并未发生明显变化,表现出较强的四氢异-α-酸抗性,而梯度平板分析结果表明其MIC也较高。L.casei2-14-1在这2种条件下,生长的细胞密度(OD值)较小,但是变化不大,其在0.01%四氢异-α-酸的胁迫条件下仍能够生长,表明其最小抑制浓度应大于0.01%,而梯度平板分析结果表明其MIC值为0.015%。L.plantarum1-6-1的情况比较特别,在低浓度四氢异-α-酸(0.005%)胁迫,其生长速率较快,而在0.01%四氢异-α-酸胁迫下,生长能力显著下降。尽管通过梯度平板分析,其MIC为0.03%,大于L.casei2-14-1和L.plantarum1-8-2的MIC。所以,四氢异-α-酸的梯度MRS平板,能够快速区分不同菌株的四氢异-α-酸抗性能力,具有较好的准确性,但同时其定量分析的准确性有待进一步完善。
2.3 四氢异-α-酸抗性菌株的啤酒腐败能力
对细菌而言,在啤酒环境中,除了酒花苦味物质外,还存在其他的胁迫条件,包括低pH值、极少量的O2、低浓度的营养物质和一定浓度的酒精等。为了评价啤酒污染细菌的酒花抗性强弱与其腐败啤酒能力之间的相关性,对实验的啤酒污染细菌菌株进行传统的植菌实验,结果如表1所示。表1不同菌株,在12°P啤酒环境中的生长能力差异较大。根据其生长的OD值,将23株啤酒污染细菌分为4类,即4种腐败强度。具有“+++”的菌株,经过1个月培养,存在明显的浑浊现象,具有很强的腐败啤酒能力。
2.4 酒花抗性与啤酒腐败能力的相关性分析
按照菌株在12°P啤酒中生长能力区分,其四氢异-α-酸抗性具有一定的分布特征,如表2所示。除了L.paracasei2-9-5外,其啤酒腐败能力为“+”,但四氢异-α-酸的MIC为大于0.05%,其它菌株的四氢异-α-酸抗性与啤酒腐败能力存在正相关性,即四氢异-α-酸抗性越强,其啤酒腐败能力也越强。这一结果表明,在啤酒环境中,限制啤酒污染细菌生长的主要因素是酒花苦味物质四氢异-α-酸。在实验的23株菌株中,大部分菌株的啤酒污染细菌能力为“+”,其四氢异-α-酸的在0.007 5%~0.022 5%之间。所以,酒花苦味物质四氢异-α-酸的梯度平板能够快速定量分析啤酒污染细菌的四氢异-α-酸抗性,进而初步判断其啤酒腐败能力。
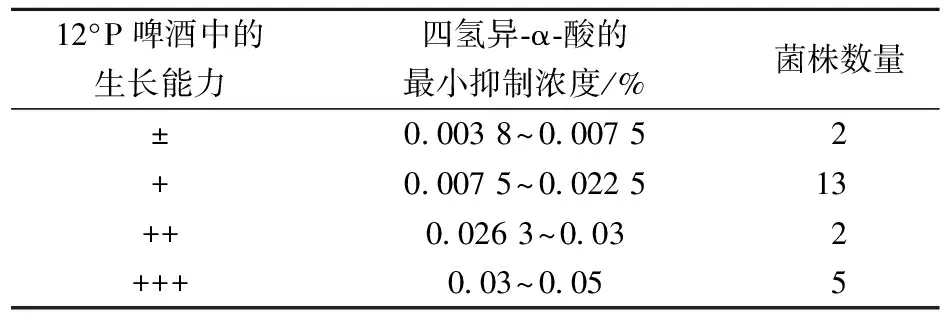
表2 啤酒腐败能力与四氢异-α-酸抗性的相关分析Table 2 Relative analysis of corruption ability and tetrahydro-iso-α-acid resistance ability
3 结论
本次研究开发了一种快速分析啤酒腐菌酒花四氢异-α-酸抗性和腐败啤酒能力的方法。该方法是采用方形培养皿,制作四氢异-α-酸的梯度浓度固体培养基,通过划线和培养鉴定其酒花抗性。通过菌膜生长长度,初步估计菌株的四氢异-α-酸最小抑制浓度,达到定量分析。通过对实验室保藏的23株啤酒污染细菌菌株的四氢异-α-酸最小抑制浓度分析,并比较菌株在液体培养基中生长情况和在12°P啤酒中的生长情况,证实酒花苦味物质梯度浓度固体培养基方法,在分析菌株的酒花四氢异-α-酸抗性和腐败啤酒能力方面,具有简单快速的优点,定量分析结果具有一定准确性和参考价值,能够指导实际生产。此外,从啤酒污染细菌四氢异-α-酸抗性与腐败啤酒能力的相关性分析,证实酒花苦味物质四氢异-α-酸是限制啤酒污染细菌在啤酒环境中生长的主要因素。
[1] SUZUKI K.125th anniversary review,microbiological instability of beer caused by spoilage bacteria [J]. Journal of Institute of Brewing,2011,117(2): 131-155.
[2] SAKAMOTO K,KONINGS W N. Beer spoilage bacteria and hop resistance [J]. International Journal of Food Microbiology,2003,89(2-3): 105-124.
[3] 朱林江,郑飞云,李崎,等. 啤酒腐败菌的检测方法[J]. 食品科学,2007,28(1): 360-366.
[4] 郑飞云,朱林江,李崎,等. 啤酒腐败菌的酒花抗性[J]. 生命的化学,2006,26(5): 419-421.
[5] SAKAMOTO K,MARGOLLES A,VEEN H W.,et al. Hop resistance in the beer spoilage bacteriumLactobacillusbrevisis mediated by the ATP-binding cassette multidrug transporter HorA [J]. Journal of Bacteriology,2001,183(18): 5 371-5 375.
[6] IIJIMA K,SUZUKI K,OZAKI K,et al. horC confers beer-spoilage ability on hop-sensitiveLactobacillusbrevisABBC45cc[J]. Journal of Applied Microbiology,2006,100(6): 1 282-1 288.
[7] FERNANDEZ J L,SIMPSON W J. Aspects of the resistance of lactic acid bacteria to hop bitter acids[J]. Journal of Applied Bacteriology,1993,75(4): 315-319.
[8] HAAKENSEN M,SCHUBERT A,ZIOLA B. Multiplex PCR for putativeLactobacillusandPediococcusbeer-spoilage genes and ability of gene presence to predict growth in beer[J]. Journal of American Society of Brewing Chemists,2008,66(2): 63-70.
[9] YASUI T,YODA K. The group E antigen is masked by the paracrystalline surface layer inLactobacillusbrevis[J]. Journal of Fermentation and Bioengineering,1997,84(1): 35-40.
[10] 郑飞云,金建中,顾国贤. 啤酒污染乳酸菌PCR引物的设计[J]. 酿酒,2002,29(2): 44-47.
[11] 孟思,刘晓宇,王德良,等. 优化用FISH检测啤酒中乳酸菌流程研究[J]. 食品与发酵工业,2010,36(9): 110-115.
Quantitativetestoftetrahydro-iso-α-acidresistanceofbeerspoilagebacteriausinghoptetrahydro-iso-α-acid-gradientmedium
ZHENG Fei-yun1,2, NIU Cheng-tuo1,2, ZHU Lin-jiang3, ZHANG Yi-qiu1,2,LI Yong-xian1,2,LIU Chun-feng1,2,WANG Jin-jingg1,2,LI Qi1,2*
1(The Key Laboratory of Industrial Biotechnology, Ministry of Education,School of Biotechnology,Jiangnan University, Wuxi 214122,China)2(Synergetic Innovation Center of Food Safety and Nutrition, Jiangnan University, Wuxi 214122,China)3(College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014,China)
Rapid and quantitative detection of hop resistance and beer spoilage capability in beer spoilage bacteria can effectively guide the beer manufacture of breweries. In this study, a new culture-dependent rapid test method based on hop tetrahydro-iso-α-acid-gradient medium plate was constructed. 23 beer spoilage bacteria strains were used to test the accuracy of method. The minimum inhibitory concentrations of tetrahydro-iso-α-acid, a compound of hop bitter acid, were rapidly detected by the method. The growth capabilities in MRS broth contained tetrahydro-iso-α-acid and 12°P beer broth were compared. These results indicate that the method based on hop tetrahydro-iso-α-acid-gradient plate quite rapid and simple to quantitatively assay hop resistance of beer spoilage bacteria, meantime, evaluate the beer spoilage capability.
beer spoilage bacteria;tetrahydro-iso-α-acid resistance; hop bitter compound;tetrahydro-iso-α-acid; rapid detection
10.13995/j.cnki.11-1802/ts.014777
博士研究生,讲师(李崎教授为通讯作者,E-mail: liqi@jiangnan.edu.cn)。
国家自然科学基金(No. 31571942 & No.31601558);国家高新技术研究发展计划(863计划,No.2013AA102106-03);江苏高校优势学科建设工程资助项目(PAPD);江苏省自然科学基金(BK20150159);江苏基础研究资助项目(JUSRP51306A, JUSRP51402A & JUDCF13008);111引智计划(No. 111-2-06)
2017-05-16,改回日期:2017-06-29
