基于低场核磁共振技术研究不同热风干燥工艺条件下香菇复水过程中的水分传递特性
2017-12-26石芳肖星凝杨雅轩郭晓晖吴素蕊明建
石芳,肖星凝,杨雅轩,郭晓晖,吴素蕊,明建,3*
1(西南大学 食品科学学院,重庆,400715)2(中华全国供销合作总社昆明食用菌研究所,云南 昆明,650223)3(重庆市特色食品工程技术研究中心,重庆,400715)
基于低场核磁共振技术研究不同热风干燥工艺条件下香菇复水过程中的水分传递特性
石芳1,肖星凝1,杨雅轩1,郭晓晖1,吴素蕊2,明建1,3*
1(西南大学 食品科学学院,重庆,400715)2(中华全国供销合作总社昆明食用菌研究所,云南 昆明,650223)3(重庆市特色食品工程技术研究中心,重庆,400715)
以6种不同热风干燥工艺制备的干香菇为研究对象,利用低场核磁共振(low-field nuclear magnetic resonance, LF-NMR)与核磁共振成像(nuclear magnetic resonance imaging, MRI)技术研究干香菇复水过程中水分变化规律。结果表明,根据T2弛豫时间显示,伴随复水时间的延长,香菇体内水分的主要状态是不易流动水而并非自由水。非均匀间歇干燥(non-uniform intermittent drying, NUID)组水分信号明显强于其他各组,复水能力较强,均匀间歇干燥(uniform intermittent drying, UID)组复水能力相对较弱。因此,提升复水效率的关键在于保证干燥过程中香菇水分的均匀转移,以便复水时具有良好的保持不易流动水的能力。
香菇;复水;低场核磁共振;核磁共振成像;水分
香菇(Lentinusedodes)是一种生长在木材上的真菌,是世界第二大食用菌,也是我国特产之一。新鲜香菇含水量高,不耐储存,目前市场上的香菇多为香菇干制品,需经过复水后才可烹调食用,在复水过程中,随着水分逐渐向香菇内部渗透,水分分布和状态变化对香菇物化特性的改变有着重要影响。
低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)是一种新兴的分析检测技术,通过低场核磁共振中T2弛豫时间的变化可以获得样品中水分状态的迁移规律[1-2],通过核磁共振成像(nuclear magnetic resonance imaging,MRI)技术可以获得物料内部结构的可视化图像信息,进而对样品中水分的分布和流动进行在线监测[3-5]。NMR技术因其无损、非侵入性的特点已被国内外学者广泛应用于食品工业[6-11]。但借助NMR和MRI技术研究干香菇复水过程中水分传递特性的研究还未见报道。

1 材料与方法
1.1 材料
干香菇:鲜香菇“808”购于重庆市北碚区农贸市场,干燥前清理香菇表面灰尘并按直径[(6±0.5)cm]筛选香菇,将香菇柄沿香菇伞1 cm处切分去除。选取500 g香菇均匀放置于干燥箱载物中央,制备香菇干品,备用。
1.2 仪器与设备
数显恒温水浴锅 HH-6金坛市富华仪器有限公司;核磁共振成像分析仪 MinniMR-60 上海纽迈电子科技有限公司;电子天平 FA2004 上海恒丰科学仪器有限公司;电热恒温鼓风干燥箱 DHG-9140A型上海齐欣科学仪器有限公司。
1.3 实验方法
1.3.1 六种不同干燥工艺[12]制备香菇干品
(1) 恒温干燥(isothermal drying, ID):初始温度为55 ℃,保持恒温至干燥结束。
(2) 均匀变温干燥(uniform raise drying, URD):初始温度为40 ℃,每干燥1 h,温度提升2 ℃,直至干燥终点。
(3) 非均匀变温干燥(non-uniform raise drying, NURD):初始温度为40 ℃,前5 h每干燥1 h温度提升2.5 ℃;之后7 h内每干燥1 h,温度提升2 ℃;之后每干燥1 h,温度提升1℃,直至干燥终点。
(4) 均匀间歇干燥(uniform intermittent drying, UID):初始温度为55 ℃,每干燥50 min,关闭电源间歇10 min后继续干燥,保持温度周而复始直至干燥终点。
(5) 非均匀间歇干燥(non-uniform intermittent drying, NUID):初始温度为55 ℃,前5 h每干燥55 min,关闭电源间歇5 min后继续干燥;之后7 h内每干燥50 min,关闭电源间歇10 min后继续干燥;之后每干燥45 min,关闭电源间歇15 min后继续干燥直至干燥终点。
(6) 非均匀变温间歇干燥(combined drying, CD):初始温度为40 ℃,前5 h每干燥55 min,关闭电源间歇5 min后继续干燥,且下一时段干燥时温度提升2.5 ℃;之后7 h内每干燥50 min,关闭电源间歇10 min后继续干燥,且下一时段干燥时温度提升2 ℃;之后每干燥45 min,关闭电源间歇15 min后继续干燥,且下一时段干燥时温度提升1 ℃直至干燥终点。
采用直接干燥法(GB 5009.3—2010)测定干燥后的香菇中水分含量(见表1)。干制香菇的水分控制在3.16~3.28 g/100 gDW,其不同组别之间香菇干重差异不显著,表明干燥工艺稳定可靠。

表1 不同热风干燥工艺下香菇水分含量 单位:g/100g DWTable 1 Moisture content of dried mushroom (Lentinus edodes) under different drying methods
注:不同字母表示差异显著(p<0.05)。
1.3.2 复水率的测定
将香菇干制品置于45 ℃的恒温水浴环境中,水分与样品质量比为100∶1(mL∶g)。测定浸泡过程中香菇重量,计算其复水率。测定间隔时间分别为5,10,15,20,30,45,60,90 min。每个试验重复测定3次,取平均值。
复水率计算如公式(1):
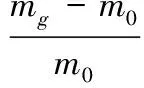
(1)
式中:Rf为复水率,mg为复水后样品质量,g;m0为复水前样品质量,g。
1.3.3 低场核磁共振检测
利用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品的横向弛豫时间,将复水过程中的香菇置于45℃水浴中,分别在间隔10,20,30,60,90 min时取出在空气中沥干水分,置于磁场中心位置的射频线圈的中心,利用FID信号调节共振中心频率,然后进行CPMG脉冲序列扫描试验。其中共振频率为23.309 MHz,磁体强度0.55T,线圈直径为60 mm,磁体温度为32 ℃;其余试验参数为CPMG:P90(μs)=15;P180(μs)=30.00;TD=480 160;SW(KHz)=200;D3(μs)=80;TR(ms)=3 000;RG1=20;RG2=3;NS=4;Echo Time(μs)=200;Echo Count=6 000,扫描试验结束后利用T2Fit软件拟合出T2值。
1.3.4 核磁共振成像检测
当复水样品进行完CPMG序列实验后,立即进行MSE成像序列实验,即质子密度成像。样品置于线圈中央,选取3个层面进行成像,层面间距离差为4.8 mm。试验参数为P1=P2=1 200;RFA1/%=4.8;RFA2/%=9.2;GxOffest=10;GyOffest=50;GzOffest=100;GSliceY=1;GPhaseX=1;GReadZ=1;RG1=25;DRG1=5;NS=4;RP2CounT=128;D0=2500 μs;D4=1 μs;D5=0.5 μs,图像大小200×128。利用OsiriS 6.0软件处理样品的质子密度像。
1.4 数据统计与分析
实验数据采用Excel软件,SPSS软件,OsiriS 6.0软件,Origin 8.0软件,T2Fit软件分析。
2 结果与分析
2.1 复水率测定
图1为6种不同热风干燥工艺制备的香菇干品的复水曲线图。由图1可知,NUID组复水率最高,达到453.91%,而URD组复水率最低,仅为356.82%,其余依次是UID组> NURD组> CD组> ID组。复水过程中,随着复水时间的延长,其复水效率下降。类似结论与GARCA-PASCUAL和GARCA-SEGOVIA等[19-20]学者相吻合。

图1 不同热风干燥工艺后香菇复水曲线Fig.1 Rehydration curves of mushroom(Lentinus edodes) at different hot-air drying methods
NURD组在复水初期其复水率高于NUID组,复水20 min后NUID组复水率高于NURD组。其原因可能是在香菇干燥过程中,因干燥工艺不同,导致香菇内部组织和结构有所差异。NURD组表面收缩情况较NUID组较好,因而复水初期其复水率较高,而复水后期,因NUID在干燥过程中留有足够的间歇时间,内部组织较为松散,因此,后期复水率得以提高。
2.2 复水过程中低场核磁共振的检测
T2弛豫时间反映了样品中水分的自由度,T2值越大,说明水分越自由,反之,T2值越小,说明水分与底物结合越紧密,核磁共振信号幅值与样品中氢质子数量成正比,因此,T2反演谱上的峰面积可间接表示出对应状态水的含量[15]。
图2为不同热风干燥工艺下香菇复水过程中的T2扫描时间图。由图2可知,复水香菇中含有3个峰:T21(0.01~10 ms),T22(10~100 ms),T23(100~1 000 ms),分别代表结合水,不易流动水和自由水。前期干燥过程中香菇水分散失主要是自由水[12],对比分析发现,复水过程中T2弛豫时间的最大差异在于,伴随复水时间的延长,T2弛豫时间逐渐延长,但主要集中于100 ms以内,表明复水后的香菇体内水分主要是不易流动水而非自由水。

图2 香菇复水过程中T2弛豫时间反演谱Fig.2 Inversion spectrum of transverse relaxation time of mushroom (Lentinus edodes) during rehydration process注:1~6分别表示0、10、20、30、60、90 min
对比6种不同干燥工艺的香菇干制品复水过程发现,复水初期,水分快速进入香菇体内并与香菇细胞组织结合,以不易流动水的形式保留在香菇体内。伴随复水继续,水分含量不断上升,复水末期则水分含量变化不大。NUID组的复水效果最好,其T2弛豫信号明显强于其他各组;URD组复水效果最差,信号强度也相对较弱。其原因可能是在干燥过程中因缺乏间歇时间导致内部组织分布不均匀,导致水分再进入时无法完全进入到香菇内部空间,从而吸收水分能力下降;而NUID组结合不同时期的干燥特点,内部组织较为均匀,有利于水分的再吸收和保持。其余各组中,ID组复水能力相对较弱,其原因也可能是干燥过程中由于前期干燥速率过快,水分在香菇内无法及时转移,因此干香菇内各处密度不同所致。UID组的复水率仅次于NUID,尽管干燥过程中UID组耗时最长[16],但表面适当的间歇时间有利于香菇的再吸水过程,并且T2弛豫时间表明,UID组具有吸收少量自由水的能力,进一步验证了不同热风干燥工艺对香菇复水品质有不同影响。
2.3 复水过程中T21,T22,T23变化
图3为不同热风干燥工艺下的香菇复水过程中同一时刻不同状态的水分比较图,其目的在于对比分析,如何控制干燥过程以提高香菇的复水率。

图3 香菇复水过程中T21,T22,T23的变化Fig.3 Change in T21, T22 and T23 in mushroom (Lentinus edodes) during during rehydration process
总体上看,复水过程中,香菇体内的结合水依旧保持相对稳定的状态,几乎不随复水时间的延长有所改变,其弛豫时间稳定在0.2~2.2 ms之间;香菇吸收不易流动水的差异是导致香菇不同复水率的主要原因,伴随复水时间的延长,其含水量不断增大;自由水在复水过程中无法被香菇吸收,伴随复水时间的延长,其自由水含量有所上升,但不同热风干燥工艺下的香菇干制品复水过程中的自由水差异不大。
T21表示的复水过程中香菇体内的结合水,对比干燥过程中结合水的变化[12]发现,无论是干燥还是复水过程,结合水都是香菇体内最稳定的存在状态的水,不易受到外界环境的影响。
T22表示的复水过程中香菇体内不易流动水,结合T2弛豫时间发现,NUID组不易流动水含量明显高于其余各组,因而其复水率最高,且在复水初期,其水分转移速度最快。其余各组T22扫描时间略低于NUID组,由此推断,提高香菇复水率的方法在于如何快速提高香菇中不易流动水含量。
T23表示的复水过程中香菇体内自由水变化,复水过程中香菇无法保持外界水分,虽然伴随时间的延长,其自由水含量有所上升,但主要附着在香菇的表面,无法被香菇内部吸收,因此复水结束后其自由水分含量差异不大。
表2为复水过程中不同干燥过后的香菇不同状态的水分含量。由表2可知,不同干燥工艺条件下的香菇复水过程中各状态水分的变化均存在显著差异(p<0.05)。结合水比例在复水初期迅速下降,而自由水比例缓慢上升,不易流动水比例上升最快,所占比例最高,为复水后香菇内水分的主要存在形式。复水结束时,NUID组中不易流动水比例为84.13%,自由水比例为13.85%;而URD组中不易流动水比例为91.58%,自由水比例为6.88%。由此推断,复水后期,URD组中水分转化能力弱于NUID,即自由水向不易流动水方向转化能力下降,因而降低其复水效率。
2.4 复水过程中MRI核磁共振成像测定
核磁共振成像是一种无损、非侵入性、高效、准确的现代分析技术,可以对食品加工过程的控制及贮藏过程的生理生化反应等进行跟踪研究[16],LIU等[17]利用 MRI 研究了魔芋葡甘聚糖对蛋清蛋白凝胶过程中水分状态的变化,实验发现不同样品磁共振成像结果和持水力结果相一致,并且每个样品表面和内部水分分布有所不同。图4为通过MRI技术扫描的6种干香菇在复水过程中2D质子密度图,其目的在于宏观上观察复水过程中水分在香菇内的分布差异。图中通过其灰白度表示水分的含量及分布,颜色越白表示此处水分活信号强,颜色越暗则表示水分信号弱[18]。

表2 复水过程中不同状态水分含量 单位:%Table2 Moisture content of different water during rehydration process
注: (1)B,结合水;NF不易流动水;F,自由水。(2)同列中不同小写字母表示差异显著(p<0.05);同一行中同一指标不同大写字母表示差异显著(p<0.05)。

图4 复水过程中2D质子密度图对比Fig.4 Pseudo color of 2D proton density images of mushroom duringrehydration process
从图4中可知,香菇复水过程中水分主要集中在香菇伞顶部,水分由外向中心扩散。香菇伞与香菇柄接壤处水分含量较低;对比6种香菇干制品复水情况发现,NUID组水分信号明显强于其余各组,说明其复水能力最强,其次是ID组复水能力,UID组复水能力相对较差。因复水是干燥过程的逆过程,良好的干燥工艺是提高复水率的保证。
3 结论
复水是干燥的逆过程,复水率是评价干燥品质的重要指标。对比6种干燥工艺下的香菇干制品,NUID组复水效果最好。利用NMR和MRI技术监测了干香菇复水过程水分的传递,结果表明,随着复水时间的延长,香菇体内不易流动水含量不断增加,结合水无明显变化,而自由水无法保留于复水后的香菇,因此提升复水效率的关键在于在保证干燥过程中香菇水分的均匀转移,以便复水时具有良好的保持不易流动水的能力。
[1] MCDONNELL C K, ALLEN P, DUGGAN E, et al. The effect of salt andfibre direction on water dynamics, distribution and mobility in pork muscle: a low field NMR study[J]. Meat Science, 2013, 95(1): 51-58.
[2] HONG Y S, CHO J H, KIM N R, et al. Artifacts in the measurement of water distribution in soybeans using MR imaging[J]. Food Chemistry, 2009, 112(1): 267-272.
[3] MARIETTE F. Investigations of food colloids by NMR and MRI[J]. Current Opinion in Colloid &Interlace Science, 2009, 14(3): 203-211.
[4] ZHANG Lu, MCCARTHY M J. NMR study of hydration of navy bean during cooking[J]. LWT-Food Science and Technology, 2013, 53(2): 402-408.
[5] 宋平, 徐静, 马贺男, 等. 利用低场核磁共振及其成像技术分析水稻浸种过程中的水分传递[J]. 农业工程学报, 2016, 32(17): 274-280.
[6] LI Wei-ming, WANG Peng, XU Xing-lian, et al. Use of low-field nuclear magnetic resonance to characterize water properties in frozen chicken breasts thawed under high pressure[J]. European Food Research and Technology, 2014, 239(2): 183-188.
[7] LI Miao-yun, WANG Hai-biao, ZHAO Gai-ming, et al. Determining the drying degree and quality of chicken jerky by LF-NMR[J]. Journal of Food Engineering, 2014, 139: 43-49.
[8] 马天兰, 吴龙国, 王松磊, 等. 基于低场核磁共振技术检测冷鲜滩羊肉的嫩度[J]. 食品工业科技, 2017, 30(2): 69-74.
[9] MONAKHOVA Y B, KUBALLA T, TSCHIERSCH C, et al. Rapid NMR determination of inorganic cations in food matrices: Application to mineral water[J]. Food Chemistry, 2016, 221(15): 1 828-1 833.
[10] KHAN M I H, WELLARD R M, NAGY S A, et al. Investigation of bound and free water in plant-based food material using NMRT2relaxometry[J]. Innovative Food Science and Emerging Technologies, 2016, 38: 252-261.
[11] 邵小龙, 宋伟, 李云飞. 粮油食品低场核磁共振检测技术研究进展[J]. 中国粮油学报, 2013, 28(7): 114-118.
[12] LU Ke-ke, GUO Xiao-hui, LI Yao, et al. Characterization of moisture transformation and distribution in mushroom (Lentinusedodes) during hot-air drying[J]. Journal of Food Processing and Preservation, 2016, 6, First published.
[15] 刘宗博, 张钟元, 李大婧, 等. 双孢菇远红外干燥过程中内部水分的变化规律[J]. 食品科学, 2016, 37(9): 82-86.
[16] YANG Hong, DING Liang, AN Lu, et al. A d-f heteronuclear complex for dual-mode phosphorescence and magnetic resonance imaging[J]. Biomaterials, 2012, 33(33): 8 591-8 599.
[17] LIU Jin-jin, ZHU Kun-kun, Ye Ting, et al. Influence of konjac glucomannan on gelling properties and water state in egg white protein gel[J]. Food Research International, 2013, 51(2): 437-443.
[18] MCCARTHY M J, LASSEUX D, MANEVAL J E. NMR imaging in the study of diffusion of water in foods[J]. Journal of Food Engineering, 1994, 22(1): 211-224.
Characterizationofmoisturetransferinrehydrationprocessfordriedmushroom(Lentinusedodes)bydifferentdryingmethods
SHI Fang1, XIAO Xing-ning1, YANG Ya-xuan1, GUO Xiao-hui1,WU Su-rui2, MING Jian1,3*
1(College of Food Science, Southwest University, Chongqing 400715, China)2(Kunming Edible Fungi Institute, All China Federation of Supply and Marketing Cooperatives, Kunming 650223, China)3(Chongqing Engineering Research Center for Special Foods, Chongqing 400715, China)
The objective of this study was to analysis the moisture change of dried mushroom (Lentinusedodes) by six different drying methods during rehydration process. The tests were performed by low-field nuclear magnetic resonance and nuclear magnetic resonance imaging technology. TheT2relaxation test showed that with the extension of rehydration time, the main state of water in dried mushroom was immobilized water instead of free water. The water signal of non-uniform intermittent drying (NUID) group was significantly stronger than other groups, which indicated its best rehydration capacity. The Uniform intermittent drying (UID) group had the poorest rehydration capacity. The key to improve the rehydration efficiency is to ensure the uniform transfer of water in the process of drying in order to have a good ability to maintain the immobilized water during rehydration process.
Lentinusedodes; rehydration; low-field nuclear magnetic resonance; nuclear magnetic resonance imaging; moisture
10.13995/j.cnki.11-1802/ts.014277
硕士研究生(明建教授为通讯作者,E-mail:mingjian1972@163.com)。
重庆市社会民生科技创新专项(cstc2015shmszx80019);云南省科技厅科技创新人才计划(2008OC008);重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
2017-03-10,改回日期:2017-04-20
