1株耐高温酸性脂肪酶产生菌的筛选鉴定与其酶学特性研究
2017-12-26张月月汪燕彭青春羊秀美马振刚
张月月,汪燕,彭青春,羊秀美,马振刚
(重庆师范大学 生命科学学院,重庆,401331)
1株耐高温酸性脂肪酶产生菌的筛选鉴定与其酶学特性研究
张月月,汪燕,彭青春,羊秀美,马振刚*
(重庆师范大学 生命科学学院,重庆,401331)
以菜籽油为唯一碳源,经过富集、驯化、平板分离初筛和复筛,从长期淤积油污的食堂下水道中筛选获得1株脂肪酶产生菌CQNU 3-3。利用16S rDNA序列系统发育分析,结合形态学与生理生化特征确定CQNU 3-3为代尔夫特菌,并将其命名为Delftiatsuruhatensisstrain CQNU 3-3。研究发酵条件对菌株产酶的影响发现,该菌株在初始pH为2的酸性条件下,发酵酶活力最高;发酵第1天酶活力即可达到最大,发酵温度为32~37 ℃较为适宜。对其产生脂肪酶的酶学特性进行分析,表明该酶最适反应pH为7.0,最适反应温度为50 ℃,Cu2+、尿素、Mg2+和Na+对酶活力有显著的抑制作用,而Zn2+和EDTA可以显著提高酶活力。油脂降解率实验表明该菌株对样品中油脂的降解率可高达73.54%。
脂肪酶产生菌;筛选鉴定;耐高温酸性脂肪酶;酶学性质;代尔夫特菌
随着肉类、乳品等食品加工行业、油脂加工行业以及餐饮行业的发展,所排放的含油脂废水不断增加,这类含油脂废水的成分往往较为复杂, 且富含有机物[1],如果未经处理就直接排放至环境中,对自然环境将产生极大的影响[2]。对含油脂废水的高效处理,可以大大缓解其带来的环境压力[3]。目前,对含油脂废水的主要处理方法包括化学法、物理法和生物法[4]。其中,生物处理法主要是微生物在驯化选择过程中,利用油脂作为生长所需的能源和碳源,通过所产生的脂肪酶等降解酶系使废水中的油脂水解为脂肪酸和甘油,最后分解氧化为H2O,CO2等[5]。由于生物处理法具备应用范围广、简便、能耗低、效果持久等特点,同时还具有避免化学处理法带来的二次污染等优点[6],因此高产脂肪酶微生物的筛选越来越受到研究者的关注。
脂肪酶已被广泛应用于粮油食品加工、洗涤工业、生物柴油、有机合成、手性化合物合成、环境保护等方面[7-8]。其中,粮油食品加工、油脂废水处理等诸多领域要求脂肪酶具备耐高温、耐酸度的特点,这使得很多工业用脂肪酶在应用过程中失活,从而使得其应用受限。目前,国内对脂肪酶产生菌的研究主要集中在高产、耐碱性和耐高温菌株的分离鉴定,而工业酸性脂肪酶的来源主要还是进口,因此,筛选耐高温酸性脂肪酶产生菌,并对其发酵及酶学特性进行分析,可为工业化生产耐高温酸性脂肪酶奠定基础[9]。至今,脂肪酶产生菌的筛选样本主要来源于长期淤积油脂的下水道[10]、长期受油脂污染的土壤[11]、生活用水排污口[12]、含油污泥的堆肥[13]等。本研究利用分子生物学鉴别法结合常见细菌鉴定法鉴定了1株从长期淤积油污的食堂下水道分离获得的菜籽油降解细菌CQNU 3-3;通过驯化与多次传代后,对该菌株的产酶发酵条件、酶的最适反应条件和对油脂的降解率进行了研究,这为其进一步的开发利用研究提供依据。
1 材料与方法
1.1 实验材料
1.1.1 样品来源
含油脂废水样品取自重庆师范大学(大学城校区)学生第二食堂下水道,分3点取样,每点50 mL。
1.1.2 培养基
(1)富集培养基(g/L):蛋白胨 5.0 g,酵母粉2.5 g,葡萄糖10 g,菜籽油2.5 g,Tween-80 3.0 g,加蒸馏水定容至500 mL,121 ℃高温灭菌20 min。
(2)驯化培养基(g/L):K2HPO40.5 g,KH2PO40.5 g,NaHPO40.5 g,NaCl 0.25 g,MgSO4·7H2O 0.25 g,菜籽油2.5 g,pH自然,加蒸馏水定容至500 mL,121 ℃高温灭菌20 min。
(3)选择性平板培养基(g/L):(NH4)2SO40.25 g,K2HPO40.15 g,NaCl 0.25 g,MgSO4·7H2O 0.1 g,酵母粉0.25 g,琼脂 10.0 g,吐温-80 6.0 g,菜籽油5.0 g,pH 7.0,加蒸馏水定容至500 mL, 121 ℃高温灭菌20 min,制备成平板。
(4)发酵培养基(g/L):(NH4)2SO41.0 g,K2HPO41.0 g,NaH2PO41.0 g,MgSO4·7H2O 0.25 g,NaCl 1.0 g,菜籽油 5.0 g,pH 7.0,加蒸馏水定容至500 mL, 121 ℃高温灭菌30 min,备用。
(5) LB培养基:蛋白胨1.0 g,酵母粉0.5 g,NaCl 1.0 g,蒸馏水100 mL,121 ℃高温灭菌30 min,备用。
1.1.3 实验试剂
95%酒精,1%酚酞,0.05 mol/L NaOH,0.05%石油醚,菜籽油,4%聚乙烯醇。
1.2 实验方法
1.2.1 样品的处理
采集获得的含油脂废水,加入适量无菌水,摇匀,3层纱布过滤收集,备用。
1.2.2 菌种的富集培养
取25 mL过滤样品,接种于含150 mL富集培养基的三角瓶中,置于30 ℃,150 r/min恒温摇床培养72 h。
1.2.3 驯化培养
取25 mL富集培养后的菌液,接种于含150 mL含菜籽油5.0 g/L驯化培养基的三角瓶中,置于37 ℃,150 r/min的恒温摇床上培养。4 天为1个周期,驯化培养28天,每个周期结束后将驯化菌液接种至含油量递加5.0 g/L的驯化培养基中进行培养。
1.2.4 筛选平板初筛
主要采用吐温-80筛选法:取1 mL驯化培养后的菌液,加入9 mL灭菌蒸馏水中,混匀;随后吸取0.1 mL涂布于选择性平板培养基(含吐温-80)上,置于37 ℃培养72 h,观察菌落的生长情况及降解圈的大小。
1.2.5 筛选平板复筛
从初筛的选择性平板基中选取抑菌圈直径与菌落比较大的菌株进行多次重复划线分离,置于37 ℃培养72 h直至得到纯菌株。挑取纯化的菌株至LB液体培养基中,置于37 ℃,150 r/min摇床中至摇匀浑浊,存于4 ℃备用。
1.2.6 菌株的形态学与生理生化特征分析
取CQNU 3-3菌种在LB固体培养基上划线,随后将平板放入37 ℃恒温培养箱内倒置培养,待菌落长出后观察菌落特征,包括形状、大小、颜色、光泽、表面状况、质地以及是否分泌色素等特征。生理生化特征分析主要参照伯杰氏细菌鉴定手册进行。
1.2.7 菌株的16S rDNA序列分析
对所挑选的菌株进行菌落以及细胞形态观察后,扩大培养,以16S rDNA通用引物进行菌液PCR,PCR扩增条件:95 ℃预变性5 min,94 ℃变性40 s,55.3 ℃退火30 s,72 ℃延伸90 s,PCR循环数:32次,72 ℃温育 10 min,4℃保存。切胶回收16SrDNA片段,并送至公司测序。获取序列后,使用NCBI的在线BLAST工具对其进行同源序列比对,并利用MEGA6构建系统发育树。
1.2.8 脂肪酶产生菌产酶活性检测与分析
1.2.8.1 脂肪酶产生菌的初步发酵
取2 mL的 LB培养基菌液接至100 mL发酵培养基中,置于37 ℃,150 r/min的恒温摇床上培养24 h。然后使用离心机3 000 r/min 离心10 min,取上清液测定脂肪酶活力,即可以获得脂肪酶产生菌CQNU 3-3初步发酵后发酵液中的酶活力。
1.2.8.2 脂肪酶产生菌的碱滴定法测定酶活
(1)取4个100 mL锥形瓶,进行空白对照和平行重复实验。分别加入底物溶液4 mL和NaHPO4-KH2PO4缓冲液5 mL,再向空白对照瓶中加入95%乙醇15 mL,于40 ℃水浴锅中预热5 min,然后实验组中各加入1 mL上清酶液,空白对照瓶中加入1 mL蒸馏水,立即混匀计时。40 ℃水浴15 min后,向实验组中补加15 mL酒精终止反应,取出。
(2)向4个锥形瓶中分别加入2~3滴酚酞,用NaOH标准溶液滴定,直至呈现微红色,并保持30 s不褪色,即为滴定终点,纪录消耗NaOH标准溶液的体积[14]。
(3)酶活力按公式(1)计算:
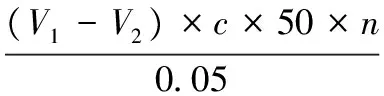
(1)
式中:Y,样品的酶活力,U/mL;V1,滴定样品时消耗NaOH标准溶液的体积,mL;V2,滴定空白时消耗NaOH标准溶液的体积,mL;c,NaOH标准溶液浓度,mol/L;50,0.05 mol/L NaOH溶液1 mL相当于脂肪酸50 U/mol;n,样品的稀释倍数;0.05,NaOH标准溶液浓度换算系数;15,反应时间15 min,以1 min计算。
(4)每个实验条件下计算获得3组平行实验数据,使用SPSS11.0软件对不同实验条件下所获取的数据进行T检测,分析数据差异是否具有统计学意义。
1.2.8.3 油脂降解率的测定
根据菜籽油对光的吸收特性,采用722S可见分光光度计测定样品在355 nm波长下的吸光度值,同时以菜籽油为溶质,石油醚为溶剂,测定不同菜籽油质量浓度的吸光度值。以0.01 g/mL菜籽油的石油醚溶液,分别取0、1.5、3.0、4.5、6.0、7.5 mL,加石油醚至标线,混匀,以零浓度为对照,在355 nm波长下测量吸光值,绘制标准曲线,得到回归方程:Y=1.093 3x+0.002 0,R2=0.981 2。根据标准曲线计算菌株的油脂降解率[15]。
2 结果与讨论
2.1 脂肪酶产生菌的分离与筛选
收集到的含油脂废水样品按方法所述进行稀释,涂布到选择性平板培养基的平板上,37 ℃培养72 h,以菜籽油为唯一碳源进行培养与筛选,结果如图1A所示,共分离获得6株不同的脂肪酶产生菌,其中菌株CQNU 3-3的乳白色圈和直径比最大,达到6∶1。将其在含有吐温-80的选择性培养基上反复筛选纯化,见图1B。观察其菌落较小,中间突起,边缘不规则,表面光滑,不分泌色素。

图1 脂肪酶产生菌的初筛(A)与CQNU 3-3菌株的纯化(B)Fig.1 Screening of and re-screening of lipid degrading strains (A) and purification of CQNU 3-3 strain
2.2 CQNU3-3菌株的鉴定
2.2.1 生理生化鉴定
对CQNU3-3菌株进行淀粉水解、葡萄糖发酵等生理生化实验,结果如表1所示。生理生化实验分析表明,CQNU 3-3菌株为革兰氏阴性菌,菌体为稍弯曲的短杆状,不能利用葡萄糖、蔗糖,不水解淀粉,七叶苷实验、乙酰甲基甲醇试验(V-P实验)和甲基红(M.R)反应呈阴性,接触酶实验、尿素分解实验、油脂水解实验反应呈阳性。各项生理生化指标结果与代夫特菌属的代表种一致。

表1 CQNU3-3菌株的生理生化特征Table 1 Physiological and biochemical characteristics of CQNU 3-3 strain
“+”表示阳性;“-”表示阴性。
2.2.2 16S rDNA序列鉴定
采用细菌16S rDNA基因的PCR通用引物进行CQNU3-3菌株的16S rDNA基因的扩增。扩增产物经琼脂糖凝胶电泳检测,结果显示获得单一的DNA条带,分子量约为1.6 kb,结果如图2A所示。
将获取的PCR产物进行测序,获得1条1 497 bp的16S rDNA序列。使用NCBI在线BLAST工具进行基因的多重序列比对分析。结果表明,CQNU 3-3菌株的16S rDNA序列与Delftiatsuruhatensisstrain Cl-23的16S rDNA序列同源性最高,达到99%。系统发育分析所需的基因序列从Genbank中下载获得,使用Cluster X软件对序列进行多重序列比对,使用MEGA6软件中的Neighbor-Joining法对序列进行系统发生分析,采用Bootstrap方法1000 个重复进行可靠性检验(见图2B)。结果表明,CQNU 3-3菌株与Delftiatsuruhatensisstrain Cl-23进化关系最近。

A-16S rDNA的PCR扩增;B-16S rDNA序列的系统发育分析图2 CQNU3-3菌株的16S rDNA序列分析Fig.2 Sequence analysis of 16S rDNA of CQNU 3-3 strain
综上分析表明,CQNU 3-3的菌落形态、生理生化特性与代尔夫特菌属一致,16S rDNA基因序列与Delftiatsuruhatensis的同源性达到99%,系统发育分析表明其与Delftiatsuruhatensis的进化关系最近。因此,确定CQNU 3-3菌株为代尔夫特菌(Delftiatsuruhatensis),命名为Delftiatsuruhatensisstrain CQNU 3-3。目前,已报道的产脂肪酶微生物约来自于65个属[16],但尚未发现关于Delftiatsuruhatensis菌降解菜籽油的报道。代尔夫特菌属(Delftia)是新建立的一个菌属,属于变形菌β亚纲、从毛单胞菌科[17]。目前已经发表的种包括食酸代夫特菌、湖生代夫特菌和Delftiatsuruhatensis。其中食酸代夫特菌研究于临床,为人类少见的机会致病菌[18]。
2.3 发酵条件对CQNU3-3菌株产酶活力的测定
2.3.1 发酵时间对产酶活力的影响
配制发酵培养基,置于37 ℃,150 r/min的恒温摇床上分别培养1、2、3、4、5 d。获得的粗酶液在pH 7.0的磷酸缓冲液,40 ℃的水浴锅中反应,测定不同发酵天数对脂肪酶活力的影响,见图3A。结果表明,当发酵在第1~3天时,酶活力较好;发酵第3天以后酶活力急剧下降。因此,CQNU 3-3菌株的发酵时间应控制在3天以内。
2.3.2 发酵pH对产酶活力的影响
调节不同初始pH值的发酵培养基,置于37 ℃,150 r/min的恒温摇床上培养24 h。获得的粗酶液在磷酸缓冲液pH=7.0,40 ℃的水浴条件下进行酶活测定,分析不同发酵pH值对酶活力的影响,见图3B。当初始发酵培养基的pH为2时,产酶活力最高;当pH=11时,酶活力最低。因此,CQNU 3-3菌株表现出较强的耐酸性,其对极碱性条件的耐受能力较弱。其耐酸性水平,与经诱变选育后的酸性脂肪酶产生菌相当[9],这表明CQNU 3-3菌株可作为诱变育种的良好素材,其具有一定的应用开发潜力。
2.3.3 发酵温度对产酶活力的影响
分别在不同温度的摇床上发酵培养24 h,粗酶液在磷酸缓冲液pH=7.0,40 ℃的水浴条件下反应, 测定不同发酵温度对产酶活力的影响,如图3C所示。结果表明,发酵温度为32~37 ℃时,酶活力都较好;发酵温度高于42 ℃时酶活力下降显著。

图3 发酵条件对CQNU3-3菌株产酶活力的影响Fig.3 Effects of fermentation conditions on enzyme activity of CQNU3-3 strain
2.4 反应条件对CQNU3-3菌株的脂肪酶活力的影响
2.4.1 温度对酶活力的影响
取发酵培养24 h后离心收集的上清液作为粗酶液,保持pH=7.0的反应pH, 调节反应温度, 测定不同温度对脂肪酶活力的影响,如图4A所示。该酶最适反应温度为50~60 ℃,且在温度高达70 ℃时,仍保留约55%的脂肪酶活力。而前人报道的脂肪酶产生菌的最适反应温度主要在28~45 ℃[19-20],这表明该酶具有较宽的温度适用性。
2.4.2 pH对酶活力的影响
取发酵培养24 h后离心收集的上清液作为粗酶液,调节不同的磷酸缓冲液的pH值,在40 ℃的水浴条件下反应,测定不同pH对脂肪酶活力的影响,见图4B。该脂肪酶的最适反应pH为7.0;另外,该酶在酸性条件pH=6.0时仍能保持66%左右的酶活力;而在pH达到8.5的碱性条件下,也保留了约60%的酶活力,这表明该脂肪酶在较酸和较碱条件下,均具有较好的反应活性。
2.4.3 离子与添加物对酶活力的影响
取发酵培养24 h后离心收集的上清液作为粗酶液,在40 ℃下反应,分别配制含有各种离子的反应缓冲液,测定不同pH对脂肪酶活力的影响,见图4C。Zn2+、EDTA对酶活力有显著的促进作用,而Mg2+、Cu2+、尿素、Na+对酶活力有显著地抑制作用。K+和Ca2+对酶活力没有显著的影响。该菌株对EDTA的耐受性,暗示其在食品加工业及洗涤工业废水处理过程中有良好的应用前景。
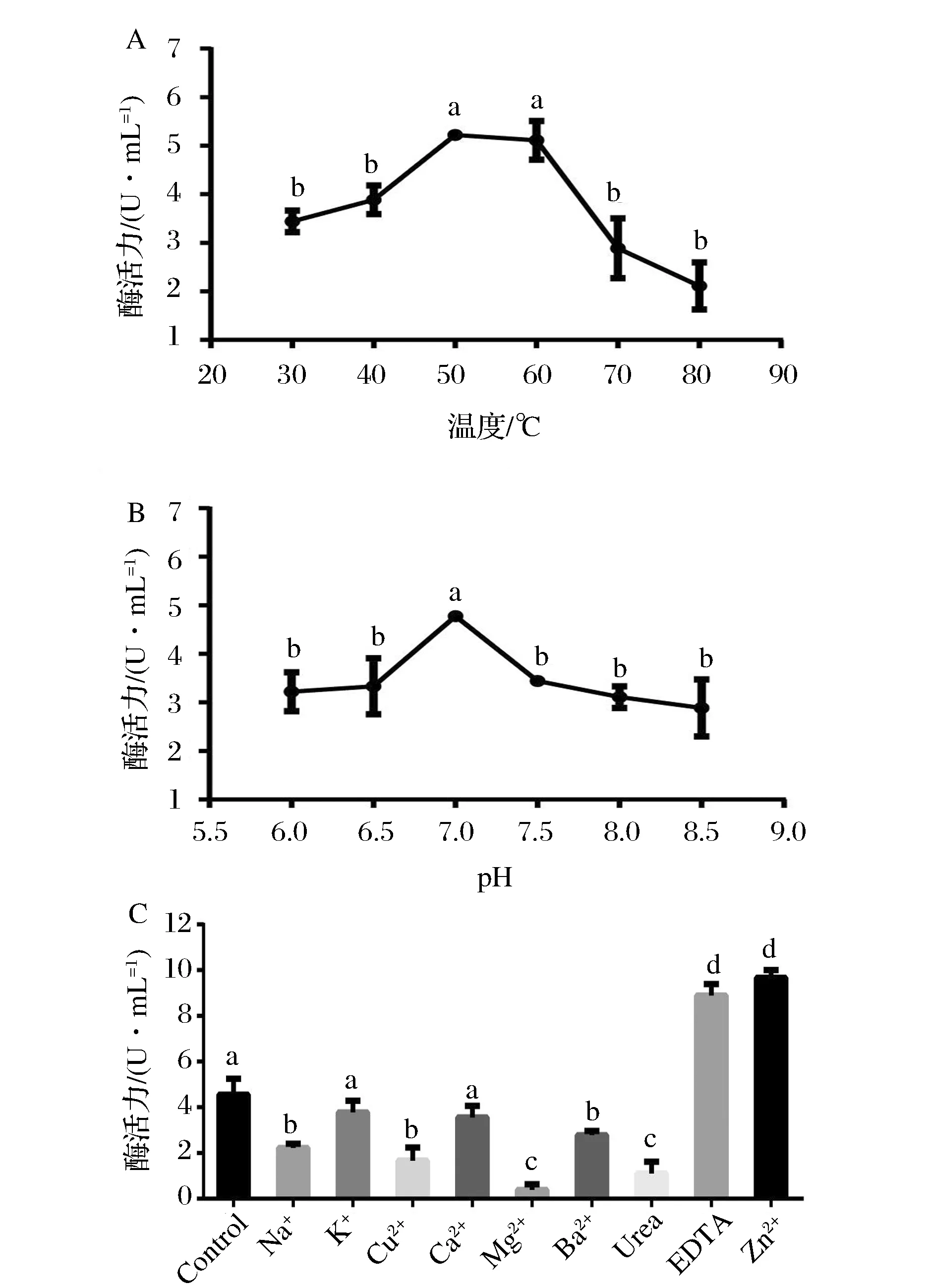
图4 反应条件对CQNU3-3菌株脂肪酶活力的影响Fig.4 Effects of reaction conditions on lipase activity of CQNU3-3 strain
2.5 油脂降解率分析
将筛选到的菌株接种到选择培养液中,置于37 ℃,150 r/min恒温摇床培养6 d。测定含油量,根据菜籽油标准曲线计算油脂降解率,结果表明该菌株对样品中油脂的降解率达到73.54%。
3 结论
本研究通过对长期淤积油脂的食堂下水道内废水中的微生物进行富集、驯化、分离培养,筛选得到1株耐高温酸性脂肪酶产生菌株CQNU 3-3,通过对其进行菌落形态学特征、生理生化特性以及16S rDNA序列分析,鉴定其为代尔夫特菌属(Delftia)的Delftiatsuruhatensis。研究结果显示,菌株CQNU 3-3发酵时间在1~3 d时酶活力最佳,到第3天后酶活力急剧下降;发酵培养基初始pH为2时酶活力最高,而当pH为11时几乎没有酶活力;发酵初始最适温度可以控制在32~37 ℃,这表明菌株能够在较低温度与酸性条件下发酵产酶;菌株CQNU 3-3分泌的脂肪酶酶活力最适pH=7.0,同时在酸性和碱性条件下均能保留60%左右的酶活力;酶反应最适温度为50~60 ℃,表明该酶能够在较酸和较碱性,以及较高温度下保持较高酶活力,筛选获得1株性状优良、适合粮油食品加工、洗涤工业污水处理和医药生产等行业需求的耐高温酸性脂肪酶产生菌株具有一定的应用价值。同时,发现在摇床转速为150 r/min,37 ℃下培养6 d,该菌的油脂降解率达73.54%。经10次传代后,菌株的油脂降解能力稳定存在,这暗示其具有应用于环境与食品工业等领域的潜力,可为生物法处理含油脂废水,食品加工工艺等提供有用的菌株资源。
[1] 闫亚娟,秦广雍,李宗义,等.油脂废水的生物处理研究进展[J].环境科学与技术,2007,30(10):86-89.
[2] 刘婕,杨博.一株高效油脂降解菌的分离鉴定及其性能研究[J].中国油脂,2010,35(1):41-44.
[3] MA J,YAN G,MA W,et al. Isolation and characterization of oil-degrading microorganisms for bench-scale evaluations of autochthonous bioaugmentation for soil remediation[J].Water,Air,& Soil Pollution,2015,226(8):272.
[4] LOPERENA L,Ferrari M D,DIAZ A L, et al. Isolation and selection of native microorganisms for the aerobic treatment of simulated dairy waste waters[J]. Bioresource Technology,2009,100(5):1 762-1 766.
[5] 吴兰,葛刚,罗玉萍.油脂废水的生物处理研究进展[J].江西科学,2003,21(4):317-320.
[6] BAYAT Z,HASSANSHAHIAN M,HESNI MA. Study the symbiotic crude oil-degrading bacteria in the mussel Mactra stultorum collected from the Persian Gulf[J]. Marine Pollution Bulletin,2016,105(1):120.
[7] 王自社,张继,马君义,等.脂肪酶的研究及应用进展[J].安徽农业科学,2011,39(7):3 798-3 800.
[8] JAEGER K E,EGGER T. Lipases for biotechnology[J]. Current Opinion in Biotechnology,2002,13(4):390-397.
[9] 张开平.耐高温酸性脂肪酶产生菌的选育及其酶学特性研究[D].郑州:河南工业大学, 2013.
[10] 张印,薛永常.油脂降解菌种的鉴定及降解条件优化[J].微生物学杂志,2015(2):90-94.
[11] 肖翰,刘标,尹红梅,等.病死猪堆肥高效油脂降解菌的筛选及堆肥效果研究[J].浙江农业学报,2017,29(1):44-50.
[12] 韩雪,童攀.一株产脂肪酶蜡状芽孢杆菌的分离鉴定[J].江汉大学学报:社会科学版, 2017, 45(1):68-71.
[13] ONYEDIKACHI U, HARRISON A, MAPITSI T, et al. Characterisation of oil degrading bacteria from tailored compost containing crude oil sludge[J]. Indian Journal of Biotechnology,2016, 15(2):243-245.
[14] 杨华, 娄永江. 国产碱性脂肪酶的测定方法及特性研究[J].中国食品学报, 2006, 6(3):138-142.
[15] 沈叔平,汪小梅.废水中动植物油脂的紫外分光光度测定法[J].中国环境监测, 1994, 10(3):4-7.
[16] 熊杰,王仿,程模香,等.几株脂肪酶产生菌的筛选及生长特性的研究[J].中国酿造,2009, 28(4):65-67.
[17] SHIGEMATSU T,YUMIHARA K,UEDA Y,et al.Delftiatsuruhatensissp. nov. a terephthalate-assimilating bacterium isolated from activated sludge[J].International Journal of Systematic & Evolutionary Microbiology,2003,53(5):1 479-1 483.
[18] 李金钟,刘利平.代夫特菌属的研究进展[J].中国热带医学,2008,8(12):2 254-2 255.
[19] 雷健美,兰时乐,曹杏芝,等.1株耐热脂肪酶产生菌的筛选及产酶条件研究[J].中国食品学报,2012,12(3):61-68.
[20] 韩生义,赵淑琴,刘晓丽,等.一株碱性脂肪酶产生菌的筛选、鉴定及酶学性质研究[J].甘肃农业大学学报,2017, 52(1):119-125.
Screening,identificationandcharacterizationsofathermostableacidlipasestrain
ZHANG Yue-yue,WANG Yan,PENG Qing-chun,YANG Xiu-mei,MA Zhen-gang*
(College of Life Sciences, Chongqing Normal University, Chongqing 401331, China)
Using rapeseed oil as the only carbon source, a thermostable acid lipase strain CQNU 3-3 was isolated from the sewage of the school dining hall through enrichment, domestication, screening and re-screening. The analysis of morphology, physiological and biochemical characteristics, the phylogeny of 16S rDNA sequence indicated that the strain CQNU 3-3 was as a member ofDelftiatsuruhatensisand namedDelftiatsuruhatensisstrain CQNU 3-3. The analysis on the effects of fermentation conditions to the production of enzyme showed that the enzyme activity was the highest at the initial pH 2, the suitable fermentation temperature was 32-37 ℃. The study on enzymatic properties of lipase showed that the optimum reaction pH was 7.0, the reaction temperature was 50 ℃. Zn2+and EDTA could significantly increase the enzyme activity and Cu2+, Mg2+, Na+and urea could significantly decrease the enzyme activity. Additionally, the degradation rate of the added oil in the sample was high to 73.54%.
lipase-producing bacterium; screening and identification; thermostable acid lipase; enzyme characterization;Delftiatsuruhatensis
10.13995/j.cnki.11-1802/ts.014944
硕士研究生(马振刚副教授为通讯作者,E-mail:mzgcqnu@126.com)。
重庆市教委科学技术研究项目(KJ1500325)
2017-06-12,改回日期:2017-06-25
