基于智能手机的麻痹性贝毒现场快速检测试纸条分析仪*
2017-12-26钟隆洁万梓健苏凯麒潘宇祥黎洪波
钟隆洁,万梓健,苏凯麒,潘宇祥,黎洪波,王 平*
(1.浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州 310027;2.中国科学院传感技术国家重点实验室,上海 200050)
基于智能手机的麻痹性贝毒现场快速检测试纸条分析仪*
钟隆洁1,2,万梓健1,2,苏凯麒1,潘宇祥1,黎洪波1,王 平1,2*
(1.浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州 310027;2.中国科学院传感技术国家重点实验室,上海 200050)
石房蛤毒素(STX)是常见的麻痹性贝毒(PSP),通过食物链积累在贝类食品中,人类若食用这种有毒的贝类会影响健康,甚至中毒。因此迫切需要一种简便的方法来检测这种麻痹性贝毒以避免中毒事件的发生。基于竞争性免疫原理的试纸条可以和石房蛤毒素产生特异性显色反应,采用研发的新型手持式分析仪进行检测分析。毒素分析仪采用智能手机作为光探测器,配合3D打印配件,再通过智能手机上研发的用于图像采集和数据处理的应用程序,可对显色后的试纸条进行分析处理并得出所测毒素的浓度。这种方法简单、快速、检出限低、灵敏度高。目前,本仪器可测得的STX的检出限:5.2 ng/mL,检测范围:5.2 ng/mL~100 ng/mL。实验表明,本文研制的基于智能手机系统和免疫分析的手持式试纸条分析仪有望成为对麻痹性贝毒进行现场快速检测的有效工具。
手持式分析仪;智能手机;试纸条;现场快速检测;麻痹性贝类毒素
海洋生物毒素是由海洋中的有毒藻类通过食物链传递给藻食性的鱼、虾及贝类等生物,并在其体内蓄积形成的有毒高分子化合物。海洋毒素种类繁多,其中贝类毒素是危害较大者之一。贝类毒素包括麻痹性贝类毒素(PSP)、腹泻性贝类毒素(DSP)、神经性贝类毒素(NSP)和记忆缺失性贝类毒素(ASP)。其中麻痹性贝类毒素是世界分布最广、危害最大的一类赤潮藻毒。它是一类拥有胍基的三环氨基甲酸酯类化合物及其衍生物,包括石房蛤毒素STX(saxitoxin)及其天然衍生物如膝沟藻毒素GTXs(gonyantoxins)、新石房蛤毒素neoSTX(neosaxitoxin)组成,由海洋有毒甲藻代谢产生[1]。人们在食用麻痹性贝毒污染的贝类后,会对人体神经肌肉产生麻痹作用,作用机理主要表现为阻断神经细胞钠离子通道,从而造成神经系统传输障碍[2]。中毒严重时,则会出现呼吸困难,咽喉紧张,随着肌肉麻痹不断扩展加重,最终导致死亡[3]。麻痹性贝类毒素具有突发性和广泛性,其毒性大、反应快、无适宜解毒剂的特点,因此开展对麻痹性贝类毒素的现场快速检测及排除方法的研究对确保水产品及人民生命财产安全具有十分重要的意义。本文主要以麻痹性贝类毒素中的主要成份STX进行研究。
在PSP毒性的评估方法中,作为标准方法的是动物实验,如小鼠生物测定法(MBA)。小鼠生物学测定方法在1978年由Yasumoto建立,是许多国家普遍采用的检测贝毒的方法[4]。具体步骤是将贝类样品的酸性提取液在小鼠腹腔注射,记录小鼠的死亡时间。该方法使用“鼠单位”(Mu)来表达,美国公职分析化学家协会(AOAC)定义一个鼠单位为一只 20 g重的小白鼠在腹腔注射后15 min内死亡的毒素最小剂量。小鼠生物测试法的优点是检测技术简单、方法易掌握、仪器简易,不需要精密的高端仪器和专门的操作人员。该方法虽然容易掌握,不需要使用专门仪器,缺点是不具有特异性,不能确定样品中毒素成分和结构,不同品系、不同批次的小鼠对毒素的敏感性差异较大,并且小鼠死亡时间的判断受主观因素、实验室饲养条件以及实验人员操作手法影响,样品中生物基质成分复杂、干扰程度比较大,特别是游离脂肪酸对小鼠毒性影响很大,常常造成假阳性[5-6]。高效液相色谱法(HPLC)是目前较为常用的检测贝类毒素的理化分析方法,常见贝类毒素均能使用HPLC进行检测,灵敏度和准确性高,是比较成熟的理化分析技术[7]。HPLC方法利用毒素分子上的羧基官能团与荧光物质反应,生成的荧光性物质经反相色谱分离后在检测器上响应。HPLC的灵敏度和准确性高,同时还能确定毒素种类,但其荧光标记试剂极不稳定,且设备精密复杂,检测用时长。而免疫方法检测是利用抗原-抗体反应确定毒素的类型及含量,包括酶联免疫反应(ELISA),放射免疫反应(RIA),竞争性酶免疫分析(EIA)等方法。ELISA技术检测贝类毒素具有检测下限低,检测范围广,同时具有特异性高、仪器设备投资少、检测成本低、样品前处理简便及阳性结果与其他方法相一致等优点,非常适合于对贝类毒素进行快速筛选检测[8-9]。而免疫方法在针对有些贝类毒素的检测时,如麻痹性毒素STX,可能存在与其他毒素之间的交叉反应;在检测过程中,还有可能出现假阳性的情况[10-12]。
目前实验室检测麻痹性贝类毒素的方法中,小鼠法和HPLC由于仪器设备庞大,专业性强等原因无法发展成现场的快速检测方法[13];免疫方法则较为适合发展成现场检测的方法。但由于常规酶标仪的体积较大,不适合在现场环境下使用。为了能够适应贝类毒素的现场快速检测,本文研究了一种基于试纸条的现场快速检测麻痹性贝类毒素的手持式分析仪。所使用的试纸条采用竞争免疫分析方法检测,可以快速测量海洋毒素。新型手持式试纸条毒素分析仪使用低成本智能手机和3d打印配件组成。图像采集和数据处理都是采用自制的iOS应用程序iStrip完成的。该手持式试纸条毒素分析系统有望成为一个现场毒素快速测量的平台。
1 材料与方法
1.1 试剂和仪器
石房蛤毒素(STX)购自美国Calbiochem;贝肉样品取自深圳大亚湾水产区;金标免疫分析仪购自杭州奥唯生物技术有限公司;甲醇、纯水、盐酸、PBS、0.45 μm滤膜,便携式离心机,手持式均质器,移液枪,振荡器,手持式试纸条毒素分析仪。

图1 试纸条检测原理图
1.2 试纸条检测原理
利用试纸条来检测海洋毒素是采用竞争性免疫分析原理。滴加在加样槽上的溶液在硝酸纤维素膜的毛细管作用下发生了显色变化。这是由于测试样品与分析物受体进行了免疫反应,在样品通过特定区域时,免疫复合物被固定,因此实验结果是在试纸条上会出现肉眼可辨别的颜色变化的条带。如图1所示,Au-Ab1是抗体Ab1耦合胶体金而形成的抗体标记物,固定在共轭层上。检测线固定了抗原或抗原的类似物,质控线固定了另一种抗体Ab2。在加样槽中滴加样品溶液时,测试样品中的抗原会先与抗体标记物形成Au-Ab1-Ag复合物,在毛细管作用下,样品溶液进行流动到质控线与Ab2结合,形成Au-Ab1-Ag-Ab2复合物以确定试纸条的可用性[14]。
1.3 标准品及实际样品的配制
为了建立STX标准曲线,用HCl(pH=3.0)配制6.25 ng/mL~100 ng/mL的STX标准溶液,本文采用的STX标准品浓度分别是6.25 g/mL,12.5 ng/mL,25 ng/mL,50 ng/mL,100 ng/mL。在实际样品贝肉中用0.1M盐酸提取,将贝肉搅碎后加入萃取液后,充分振荡,水浴加热5 min,离心10 min,使用0.45 μm滤膜过滤后收集上清液即可。

图3 研制的软件iStrip操作流程图
1.4 手持式试纸条毒素分析系统设计
1.4.1 手持式试纸条毒素分析系统硬件设计
手持式分析仪包括两大部分,一是智能手机,一个是3d配件(如图2(a)所示)。手持式分析仪配件是用Solidworks设计,采用ABS(acrylonitrile butadiene styrene)塑料进行3D打印。整个配件的尺寸为97 mm×58mm×39 mm,可使手机及试纸条固定在同一直线上方便进行检测,如图2(b)。配件主要有手机定位槽和试纸条定位槽两个部分,手机定位槽上的孔洞是为了配合手机上的按钮以防止机械触碰影响手机操作。智能手机上的摄像头为35 mm的焦距,这个焦距成像距离短不足以满足实验的需要,因此我们在检测仪上外加了一个11 mm的微焦镜头,它的成像距离为25 mm刚好可以连接手机镜头和匹配分析仪的后端。

图2 手持式分析仪结构图和实物图
1.4.2 手持式试纸条毒素分析系统软件设计
海洋毒素的浓度主要是通过检测线的的颜色强度来确定的。智能手机通过拍摄试纸条图像,采用自制软件iStrip进行分析,软件流程图如图3所示,提取子图像特征值,建立标准曲线。实际样品的浓度便可根据已建立的标准曲线来计算得到。iStrip的工作流程包括校准,样品测量和数据共享。在校准过程中,iStrip进行标准物质标定并建立标准曲线,在界面中对标准物质实验中数和标准物质重复数组进行设置。当所有标准物质实验组的图像采集完毕时,系统内部将进行分析,建立标准曲线,并将校准参数写入校准文件及更新内置运算单元参数。使用iStrip采集未知样品的图像,然后利用线性相关性计算样品浓度。在这些过程中,校准和测量阶段的数据都能以txt格式存在智能手机中。
1.4.3 手持式检测仪用于STX的检测
进行STX实际样品的检测时,需先用手持式分析仪确定STX的标准曲线(如图4)。将准备好的各5种不同浓度的STX标准溶液(本文采用的浓度梯度为6.25 ng/mL,12.5 ng/mL,25 ng/mL,50 ng/mL和100 ng/mL)分别吸取50 μL滴加到试纸条的加样槽中,等待15 min左右,试纸条上的检测线和质控线颜色发生变化,便可用检测仪对试纸条进行采集分析,提取试纸条中心的G分量曲线。对每个样品的G分量曲线进行去基线,排除光源强度不稳定,试纸条晕染过程不均匀等因素干扰。再对G分量曲线进行滤波算法,去除试纸条或溶液中杂质的带来的尖刺影响,使曲线光滑,利于后续分析。最终把G分量曲线上T检测线的谷值作为标准曲线的特征值。在一定的检测范围内,每个浓度与之相对应的谷值相对应(在本文中标准品浓度以10为底的对数与各浓度对应图像的特征值成线性关系),即可得到一条标准曲线。得出加标浓度的标准曲线后,可以直接检测未知浓度样品,并且通过分析仪的软件界面上读取样品中所含毒素的浓度。

图4 用手持式分析仪检测样品流程图

图5 快速检测系统标定曲线
2 结果与讨论
2.1 手持式试纸条毒素分析仪性能测试
使用浓度分别为6.25 ng/mL,12.5 ng/mL,25 ng/mL,50 ng/mL和100 ng/mL的STX标准品制定标准曲线,用手持式检测仪逐个采集试纸条上的图像,如图5(a)所示,五条试纸条的质控线是一致的,均为有效,检测线随着浓度的增大而颜色变浅。在整个软件分析过程中,我们使用的是RGB颜色通道中的G通道值进行像素值的获取;在图像采集中,iStrip会扫描整个试纸条来获取到每个试纸条上相应位置的G通道值,因此扫描软件上会出现整条G通道分量的扫谱线(如图5(b))。用自制的软件iStrip进行分析,可以检测到每条试纸条上的像素出现两个波谷,一个为质控线,一个为检测线,质控线的像素点值基本一致,而检测线的像素点值随着浓度的增大而变大,因此浓度越高,颜色越浅,像素值越大,相对应的特征值,也就是检测线T线的谷值越大,依据这个规律可建立起STX的标准曲线(标准曲线结果如图5(c)。其中,横坐标为各个STX标准品浓度以10为底的对数,纵坐标为各浓度对应图像的特征值,各浓度采用6个重复组,标定曲线斜率为-36.624,截距为145.122,线性度为0.967 2。)
使用手持式试纸条毒素分析仪对浓度分别为40×10-9,80×10-9的STX进行检测,每种浓度将测得的结果与已知浓度数值相对比,测试装置的准确度。在此标定曲线的基础上,对已知浓度STX标准品的测试结果如表1所示。
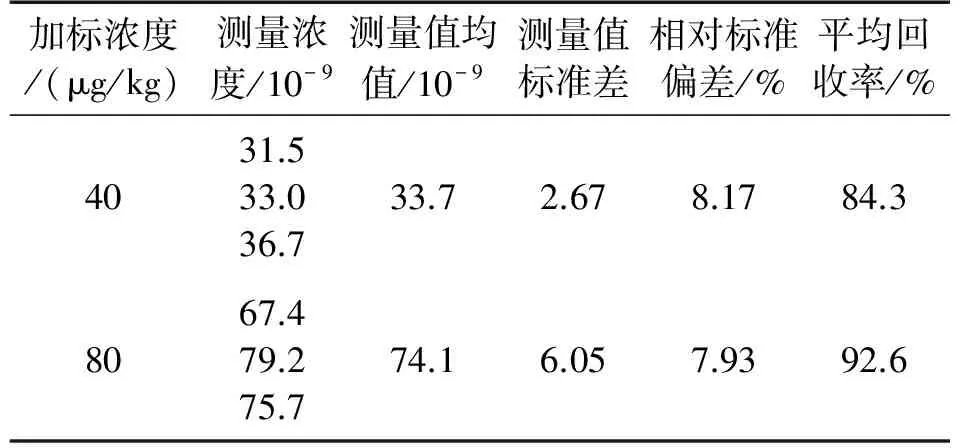
表1 STX加标检测结果
相对标准偏差体现了手持式试纸条分析仪对毒素检测的重复性。表中可以看出,分析仪对于毒素浓度的浓度有着较高的平均回收率(>80%),且仪器相对标准偏差小于10%,说明本仪器对样品中STX毒素的浓度进行检测是可靠和稳定的,所设计的现场快速检测麻痹性贝毒STX的仪器性能可满足现场检测的需求。对于商用试纸条分析仪而言,主要通过检测照射在试纸条后的反射光强来计算吸光度。在入射光的光强确定的情况下,假如试纸条显色区域较薄而且均匀,即反射的光程保持一样,则反射光的光强只和试纸条上的待测物浓度成单值函数。而试纸条分析仪采集的试纸条图像的有效区域为红色,使用互补色G分量进行分析,实验证明与浓度成线性关系,符合朗伯-比尔定律。两者都是使用了绿光通道上的吸光度来检测浓度,原理上是互通的。使用手持式试纸条毒素分析仪和商用的金标免疫分析仪分别对6.25 ng/mL~80 ng/mL的16个加标样品进行检测,检测结果如图5(d),图为两种检测方法的Bland-Altman图,横坐标为同一样品两种测量方法的测量均值,纵坐标为其同一样品测量结果比值。从图中可以看出,13.5%(2/16)的点(图中实心圆圈代表的点)在95%一致性界限以外;在一致性界限范围内,比值的最大值为1.12,最小值为0.81。也就是手持式毒素分析仪的测量值是商用读卡器的0.81到1.12倍,即对于大多数样品来说,手持式毒素分析仪的测量值与商用读卡器测量结果相差12%到19%。在STX毒素检测的实际应用中,这种差异是可接受的,因此这两种仪器具有较好的一致性。
2.2 手持式试纸条毒素分析仪重现性与检测下限测试
使用加标40 ppb的STX加标样品进行实验,在2 h每间隔5 min记录测量仪器的特征值,共24组记录值,测定其变异系数,通过变异系数反应手持式毒素分析仪的重现性,实验结果如图6所示。在标定曲线的浓度范围内,变异系数为1.6%,小于10%,重现性较好。
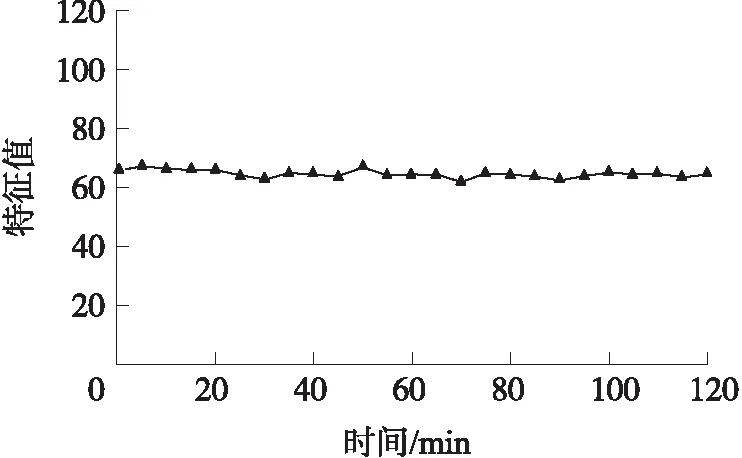
图6 手持式毒素分析仪检测特征值2 h变化图
使用空白样品检测结果计算快速检测装置的检测下限。测定一定数量的空白样品试纸条,通过毒素分析仪计算得出对应数值,如表2所示。

表2 空白样品检测结果 单位:μg/kg
表1中,C0为空白样品的实际检测值,AVG为空白样品实际检测值的平均值,SD为测量值的标准差,LOD为检测下限。其中检测下限的计算方法如下:
LOD=AVG+3SD
由计算结果可知,分析仪检测下限约为5.19 ppb,当样品中STX浓度小于检测下限时,系统检测误差较大。在实际应用中,应选择合理的稀释或浓缩倍数对样品进行处理。
2.3 手持式试纸条毒素分析仪特异性测试
使用50×10-9的标准品和50×10-9的膝沟藻毒素(GTX-2,3)、短裸甲藻毒素(PbTx-2)、大田软海绵酸(OA)标准品对手持式试纸条毒素分析仪的特异性进行实验。其中GTX-2,3、PbTx-2与STX同属于麻痹性的贝类毒素,而OA属于腹泻性贝类毒素。可得系统的响应曲线如图7所示。
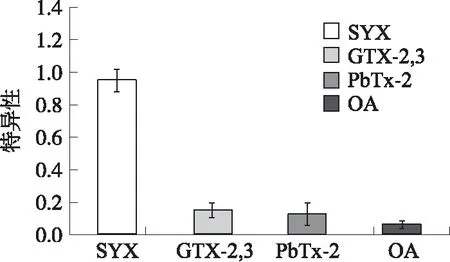
图7 毒素分析仪特异性响应
图7中,横坐标为毒素标准品浓度以10为底的对数,纵坐标为检测系统得出的毒素浓度特异性结果。STX毒素浓度检测特异性为95.2%,由于GTX-2,3与STX具有类似的分子结构,因此手持式试纸条毒素分析仪对GTX-2,3有较高的交叉反应率(15.0%),而对于PbTx-2和OA的交叉反应率较低(<15.0%)。由实验结果可知,手持式试纸条毒素分析仪对STX有着良好的特异性。
2.4 实际样品测试
联合国卫生组织规定100 g贝类可食部分的PSP限量为80 μg STX eq/100 g,毒素试纸条分析仪的检测范围是5.2 ng/mL~100 ng/mL,因此在检测实际样品时需要对样品中的毒素进行提取和稀释以尽量保证在分析仪的检测范围之内。若样品超出检测范围,可对待测溶液进一步稀释后,即可使用手持式试纸条毒素分析仪对实际贝肉样品中的毒素含量进行测定。表3为9个实际样品的检测结果,其中第1、2、3号为在贝肉基质中加标1 000 ppb的样品,超出系统检测范围,均检出浓度>100 ppb。第7、8、9是贝肉基质空白样品,系统均检出小于检测下限。对于4,、5、6号加标80×10-9的贝肉样品,本系统检测浓度有较高的准确率。
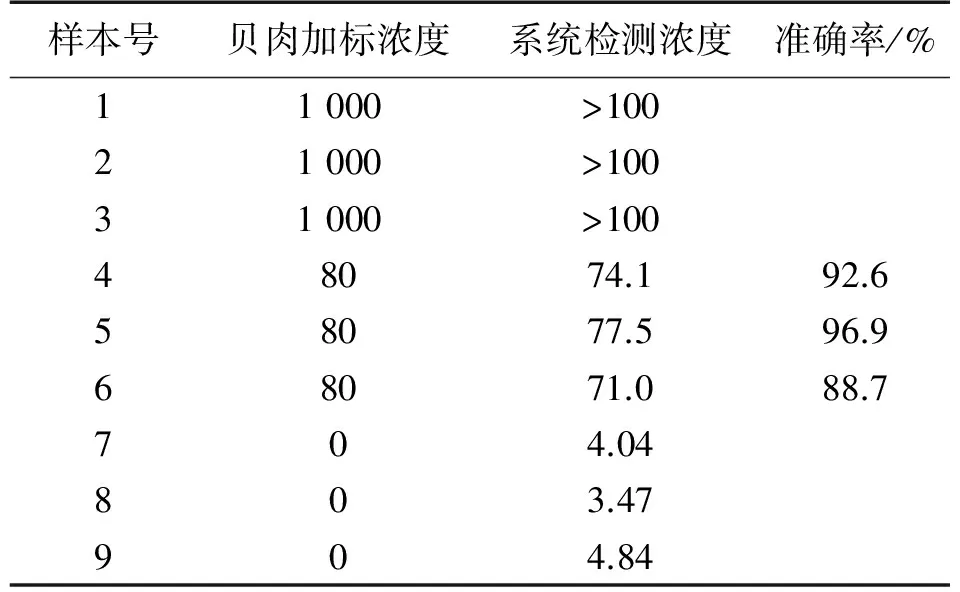
表3 STX样品检测结果
在实验室环境下使用手持式试纸条毒素分析仪完成1个实际样品检测的用时为20 min,而且操作简便,适用于批量检测,样品数量越多能够节省的时间越多。由实验结果可知,所设计的手持式试纸条毒素分析仪能够满足现场快速检测的需求。

表4 快速检测装置与其他方法的比较
由表4可知而对于手持式试纸条毒素分析仪和主流的小鼠法,质谱法的比较可知,所设计的手持式试纸条毒素分析仪具有检测时间短,一致性好,检测限低,操作难度低等优点,体现了仪器方法的优越性。
3 结论
本论文采用手持式试纸条分析仪以现场和快速为目的对海洋毒素浓度定量化水平分析。这种方法是用基于试纸条并配合智能手机和相关电路实现的,由于传统检测方法(如小鼠生物法)存在着一些不足,不能满足现场的快速检测,因而采用试纸条及其检测设备,可以更快速更方便的满足检测的需要。研制的软件iStrip操作方便,只需几个按钮便能完成操作,而且还能对检测的海洋毒素进行定量化分析。总之,由于智能手机的普及和便携式仪器的高适应、高集成和容易操作的特点,可将此仪器广泛推广和应用。对比现有的商用仪器对STX的检测,可证明此检测仪器可定性和定量化检测实际样品的毒素浓度。因此,手持式试纸条毒素分析仪在海洋环境监测应用和食品分析领域中将有很好的应用前景。
[1] 杜伟,陆斗定. 有毒赤潮藻及其毒素的危害与检测[J]. 海洋学研究,2008,26(2):89-94.
[2] Baden D G. Marine Toxins[J]. Handbook of Clinical Neurology,1995,21(65):141.
[3] 蒋幼民,张连生,赵文彬. 麻痹性贝类毒素中毒的流行病学特征[J]. 现代预防医学,2004,31(5):711-712.
[4] Hummert C,Shen J,Luckas B. Automatic High-Performance Liquid Chromatographic Method for the Determination of Diarrhetic Shellfish Poison[J]. Journal of Chromatography A,1996,729(1):387-392.
[5] Ben-Gigirey B,Rodríguez-Velasco M,Otero A,et al. A Comparative Study for PSP Toxins Quantification by Using MBA and HPLC Official Methods in Shellfish[J]. Toxicon,2012,60(5):864-873.
[6] 曹际娟,卫锋,马惠蕊,等. 贝类毒素检测技术及研究进展[J]. 检验检疫科学,2004,14(1):53-56.
[7] Carmichael W,Evans W,Yin Q,et al. Evidence for Paralytic Shellfish Poisons in the Freshwater Cyanobacterium Lyngbya Wollei(Farlow ex Gomont)comb. Nov[J]. Applied and Environmental Microbiology,1997,63(8):3104-3110.
[8] 于兵,曹际娟,尤永莉,等. ELISA与小白鼠生物法检测贝类中麻痹性贝毒的比较[J]. 检疫检疫科学,2005,15(1):34-35.
[9] 王峰,刘飞,孟令花,等. 基于抗体包被金磁纳米微粒修饰的磁性安培免疫传感器研制及对人血清癌抗原19-9的检测[J]. 传感技术学报,2009(9):1232-1238.
[10] Usleber E,Dietrich R,Bürk C,et al. Immunoassay Methods for Paralytic Shellfish Poisoning Toxins[J]. Journal of AOAC International,2001,84(5):1649-1656.
[11] Qi-fang L. Detection of Paralytic Shellfish Poisoning(PSP),Diarrhetic Shellfish Poison(DSP),Neurotoxic Shellfish Poison(NSP)by ELISA[J]. China Tropical Medicine,2012,11:38.
[12] 苏凯麒,邹玲,王琴,等. 基于细胞阻抗传感器的腹泻性毒素检测系统设计与实现[J]. 传感技术学报,2014,27(3):283-288.
[13] 谢东华,干宁,王峰,等. 鱼肉中氯霉素检测用抗体包被金磁纳米微粒修饰安培免疫传感器[J]. 传感技术学报,2009,22(10):1371-1377.
[14] 刘仁沿,梁玉波,陈冰君,等. 胶体金免疫层析方法快速检测腹泻性贝毒软海绵酸的初步研究[J]. 分析试验室,2008,27(7):27-28.
NewHandheldStripAnalyzerforOn-SiteRapidDetectionofParalyticShellfishPoisoningBasedonaSmartphone*
ZHONGLongjie1,2,WANZijian1,2,SUKaiqi1,PANYuxiang1,LIHongbo1,WANGPing1,2*
(1.Biosensor National Special Laboratory,Key Laboratory for Biomedical Engineering of Education Ministry,Department of Biomedical Engineering,Zhejiang University,Hangzhou 310027,China;2.State Key Laboratory of Transducer Technology,Chinese Academy of Sciences,Shanghai 200050,China)
Saxitoxin(STX)are common marine toxins which can affect human health through food chain by accumulating in shellfishes. It is urgently required to have a convenient method for on-site detection of marine toxins to avoid the poisoning incidents that have occurred frequently. In this work,a handheld analysis meter system cooperating with competitive immunoassay strips is designed for rapid detection of STX. The smartphone is used as light detector,for image acquisition and data processing by a specific application. The 3D-printed portable accessory of smartphone is fixed for test strip. The method is simple and fast,with a detection limit of STX of 5.2 ng/mL,respectively. It can provide quantitative analysis of STX in the range of 5.2 ng/mL~100 ng/mL. Based on the smartphone system and biochemical analysis,it will be promising tool for on-site rapid detection for paralytic shellfish poisoning.
handheld analyzer;mobile terminal;test strip;on-site rapid detection;paralytic shellfish poisoning
10.3969/j.issn.1004-1699.2017.12.002
项目来源:国家海洋公益专项项目(201305010)
2017-05-10修改日期2017-07-18
R318
A
1004-1699(2017)12-1787-07
钟隆洁(1994-),男,浙江大学生物医学工程2016级硕士研究生,从事生物医学工程与生物医学传感器研究,21615047@zju.edu.cn;
王平(1962-),男,浙江大学,教授,博士生导师,主要研究方向为传感器与检测技术、生物芯片与生物电子学、人工嗅觉与人工味觉等,cnpwang@zju.edu.cn。
