日粮添加地衣芽孢杆菌对仔猪发酵床垫料理化性质及微生物群落的影响
2017-12-25宦海琳白建勇闫俊书周维仁徐小明顾洪如
宦海琳,白建勇,闫俊书,周维仁,徐小明,顾洪如
日粮添加地衣芽孢杆菌对仔猪发酵床垫料理化性质及微生物群落的影响
宦海琳,白建勇,闫俊书,周维仁,徐小明,顾洪如*
(江苏省农业科学院畜牧研究所,南京 210014)
试验旨在研究发酵床饲养模式下,猪日粮中添加地衣芽孢杆菌对发酵床的理化性质和微生物群落的影响。分别饲喂基础饲粮(对照组)、基础饲粮+杆菌肽锌+硫酸黏杆菌素(抗生素组)和基础日粮+地衣芽孢杆菌(益生菌组)的试验日粮。结果表明:饲粮中添加地衣芽孢杆菌能显著提高发酵床垫料蛋白酶活性(p<0.05),对垫料脲酶活性和铵态氮含量无显著影响(P>0.05);试验第15 d时,抗生素组的垫料放线菌数量显著低于对照组(p<0.05);第35 d时,益生菌组的芽孢杆菌数量显著高于其他组(p<0.05);第49 d时,益生菌组的芽孢杆菌数量显著高于抗生素组(p<0.05),抗生素组的葡萄球菌数量比对照组显著降低(p<0.05);益生菌组、抗生素组的大肠杆菌低于对照组,抗生素组的细菌总数、芽孢杆菌数量低于对照组,但差异均不显著(P>0.05),饲粮抗生素一定程度上减少了垫料益生菌,但能有效减少垫料病原菌;各处理组间,垫料微生物DGGE的香农-威纳指数、均匀度均无显著差异(P>0.05)。饲用地衣芽孢杆菌显著增加垫料中芽孢杆菌分布数量,提高垫料中垫料蛋白酶活,没有显著影响垫料细菌多样性指数,一定程度上提高粪便原位降解效率。
地衣芽孢杆菌;垫料;理化性质;微生物群落
随着规模集约化养猪的发展,猪粪尿带来的环境污染问题日益突出。微生物发酵床养猪技术利用微生物的分解能力,降解、消化生猪养殖过程中产生的粪尿排泄物,实现猪粪尿就地减量化,缓解规模养猪场的环境污染问题,是一种生态养殖的新模式。但由于生猪养殖中饲添和治疗过量使用抗生素,影响发酵床垫料微生物的生长繁殖,降低微生物对粪便的分解能力,发酵产热量减少[1],制约了发酵床技术的推广。
芽孢杆菌作为益生菌,具有酶系丰富、抑菌和抗逆性强等优良特性,在饲料生产、粪便处理和环境污染治理等方面得到广泛应用[2-3]。在饲粮中添加芽孢杆菌制剂能改善动物肠道,提高消化吸收功能,抑制有害菌的增殖,提高机体免疫力[4-5],是最具潜力的抗生素替代品。目前饲用芽孢杆菌的研究主要集中于传统水冲圈养殖,而在发酵床饲养条件下,研究饲用芽孢杆菌对发酵床垫料的影响却罕见报道。
发酵床具有丰富的微生物多样性[6],微生物区系与发酵菌剂、粪便微生物以及垫料基质的理化性质等因素紧密相关[7-8]。研究发现发酵床垫料和猪粪便中含有的细菌种类基本相同,但含量差异较大,肠道细菌与垫料环境之间具有双向的适应性和选择性[9]。已有的研究结果表明,绝大部分饲用芽孢杆菌不能在畜禽肠道定植,属于肠道中的“过路菌”,通过粪便排出动物体外[10]。芽孢杆菌作为添加到垫料中的发酵床菌剂,已在发酵床中应用[11],随着粪便排出的饲用芽孢杆菌对垫料微生物的影响尚未有研究。本研究以发酵床饲养模式为基础,研究饲粮中添加芽孢杆菌,对发酵床的理化性质和微生物群落的影响,为饲用芽孢杆菌在发酵床养殖模式中的应用提供参考,为垫料中粪便原位转化效率的提高建立理论依据。
1 材料与方法
1.1 基础饲粮与试验设计
基础饲粮参照NRC(1998)猪的营养需要配制。本试验分为如下3组:对照组(Control treatment,CT)饲喂基础饲粮;抗生素组(Antibiotic treatment,ABT)在基础饲粮中添加40 mg·kg-1杆菌肽锌和20 mg·kg-1硫酸黏杆菌素;益生菌组(Probiotics treatment,PBT)在基础饲粮中添加300 mg·kg-1地衣芽孢杆菌。
将108头35日龄,体重13 kg左右的苏钟猪,随机分成3组,每组3重复,每重复12头,自由采食及饮水。试验于江苏省农业科学院六合基地发酵床猪场进行。每组饲养栏的发酵面积35 m2,深60 cm。发酵床所用垫料主要为稻壳、木屑(分别占50%左右),垫料已使用6个月饲养1批猪。发酵床的日常维护主要包括垫料的浅层翻扒,将粪便集中的区域人工分散在发酵床面10 cm下[6]。
1.2 样品的采集与制备
在正试期第15、35、49 d,每栏(重复)猪舍按照Z字形选取5个采样点,于发酵床床面0~20 cm切面采集垫料样本,5个点充分混匀,再采用四分法取500 g,放入冰盒中带回实验室,取100 g左右用于微生物平板培养,其余部分存放于-70℃冰箱。
1.3 测定指标及方法
1.3.1 垫料理化性质
垫料中蛋白酶的测定采用滴定法[12],垫料中脲酶的测定采用比色法[12],垫料铵态氮的测定采用氯化钾浸提-靛酚蓝比色法。
1.3.2 垫料主要菌群数量
总细菌用营养琼脂(NA)培养基37℃恒温培养24 h;芽孢杆菌的稀释液在80℃水浴10 min后用营养琼脂(NA)培养基37℃恒温培养24 h;放线菌用高氏一号培养基28℃恒温培养7 d;真菌用马铃薯葡萄糖琼脂培养基28℃培养5 d;金黄色葡萄球菌、大肠杆菌分别用甘露醇氯化钠琼脂(MSA)、伊红美兰琼脂培养基(EMB)37℃恒温培养48 h。每个样品做3个平行,同时测定每个样品的水分。微生物数量用每克垫料(干重)中微生物菌落数的对数lg(CFU·g-1干重)表示。
1.3.3 垫料微生物区系
1.3.3.1 垫料样品的预处理
发酵床垫料样品的预处理参考宦海琳等[8]的方法。称取5 g解冻样品,用50 mL磷酸盐缓冲液浸提15 min,单层纱布过滤,取滤液经 10 000 r·min-1离心10 min,弃上清,留沉淀备用。
1.3.3.2 垫料微生物总DNA的提取
将前处理的样品转移至已灭菌的含锆珠的Screw-capped管中混匀,加入1 mL TNI 50和150 μL酸性酚(水饱和酚),Bead-beader匀浆(2000 r·min-1,3 min),冰上冷却,加入 150 μL 氯仿/异戊醇,10 000 r·min-1离心5 min。上清液加入150 μL氯仿/异戊醇和150 μL TE 饱和酚,10 000 r·min-1离心 1 min。上清液加入 300 μL 氯仿/异戊醇,10 000 r·min-1离心 1 min收集上层水相,加醋酸钠和异丙醇沉淀,沉淀物用70%的冰乙醇,风干沉淀,加无菌TE缓冲液溶解。
1.3.3.3 细菌16S rDNA V3区PCR扩增
用带有GC夹的细菌通用引物341F-GC(5′CGCCC GCCGC GCGCG GCGGG CGGGG CGGGG GCACG GGGGG CCTAC GGGAG GCAGC AG)和 517R(5′ATTAC CGCGG CTGCT GG)[13]。PCR 反应体系为:Premix Taq(含缓冲液、dNTP、MgCl2、Taq DNA 聚合酶,购于 TaKaRa 公司)25 μL,DNA 模板 2 μL,上下游引物 3 μL,无菌双蒸水 19 μL,BSA(牛血清白蛋白)1 μL。反应条件为:94℃预变性 5 min,94℃变性 40 s,56℃退火1 min,72℃延伸40 s,35个循环,72℃延伸10 min,4℃保存。
1.3.3.4 DGGE分析
DGGE分析采用Bio-Rad电泳系统,聚丙烯酰胺凝胶浓度为8%,变性梯度为42%~60%[14],200 V电压预电泳10 min,然后在60 V固定电压下电泳16 h,电泳结束后用银染法染色。在60℃,1×TAE,60 V条件下电泳16 h,DGGE凝胶经GS-800型扫描仪(Bio-Rad,美国)扫描输入计算机,采用凝胶分析软件Molecular Analysis 1.61(Bio-Rad,美国)进行分析。用Shannon-Wiener多样性指数(H′),均匀度指数(E′)指标来比较各个样品的细菌多样性,计算公式如下:

式中:Pi由公式Pi=ni/H计算得来(ni为密度曲线上某一条带的峰高;H为所有峰高之和);E′=H/lnS(S为样品中总的条带数)。
采用UPGMA分析比较不同垫料细菌群落结构的相似性。
1.4 数据统计与分析
用Excel 2003对原始数据进行初步统计,用SPSS 19.0软件进行单因素方差分析(One-way ANO VA),并用Duncan法进行多重比较,结果用“平均值±标准误”表示。
2 结果与分析
2.1 地衣芽孢杆菌对发酵床垫料蛋白酶、脲酶活性和铵态氮含量的影响
地衣芽孢杆菌对发酵床垫料理化性质的影响如表1所示。试验第15 d时,益生菌组垫料蛋白酶比对照组、抗生素组均显著提高(p<0.05);第35 d时,益生菌组垫料蛋白酶比对照组显著提高(p<0.05);整个养殖期,益生菌组垫料蛋白酶均高于其他组。试验第35、49 d时,益生菌组垫料脲酶活性分别比对照组提高 15.27%、20.99%,但均未达到显著差异(P>0.05)。整个试验期各组铵态氮含量随着养殖时间的延长而增加,各组间的铵态氮含量没有明显差异(P>0.05)。
2.2 地衣芽孢杆菌对发酵床垫料微生物数量的影响
地衣芽孢杆菌对发酵床垫料微生物数量的影响如表2所示。发酵床垫料微生物主要由细菌组成,细菌分布数量在 9.1×108~2.0×109CFU·g-1之间,真菌分布数量在 1.3×106~3.7×106CFU·g-1之间,放线菌分布数量在 1.9×106~2.0×107CFU·g-1之间;在细菌组成中,芽孢杆菌的分布数量要大于金黄色葡萄球菌、大肠杆菌,三种细菌的分布数量分别为1.4×107~5.0×107CFU·g-1、4.2×105~1.6×106CFU·g-1、3.0×105~6.5×106CFU·g-1。
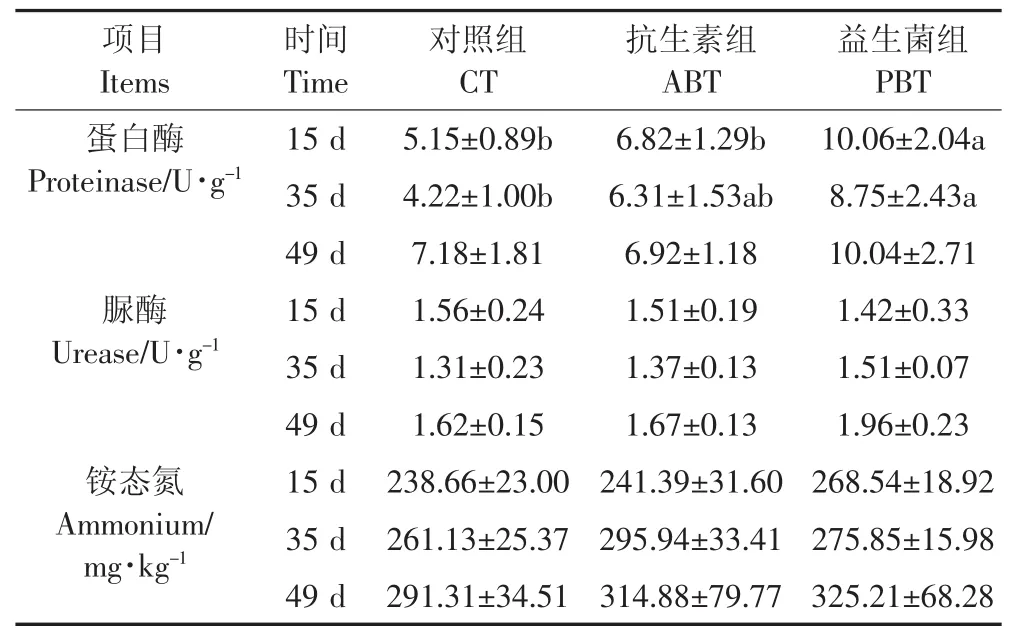
表1 益生菌对发酵床垫料蛋白酶、脲酶活性和铵态氮含量的影响Table 1 Effects of probiotics on the activity of proteinase,urease and the content of ammonium in fermentation-bed litters
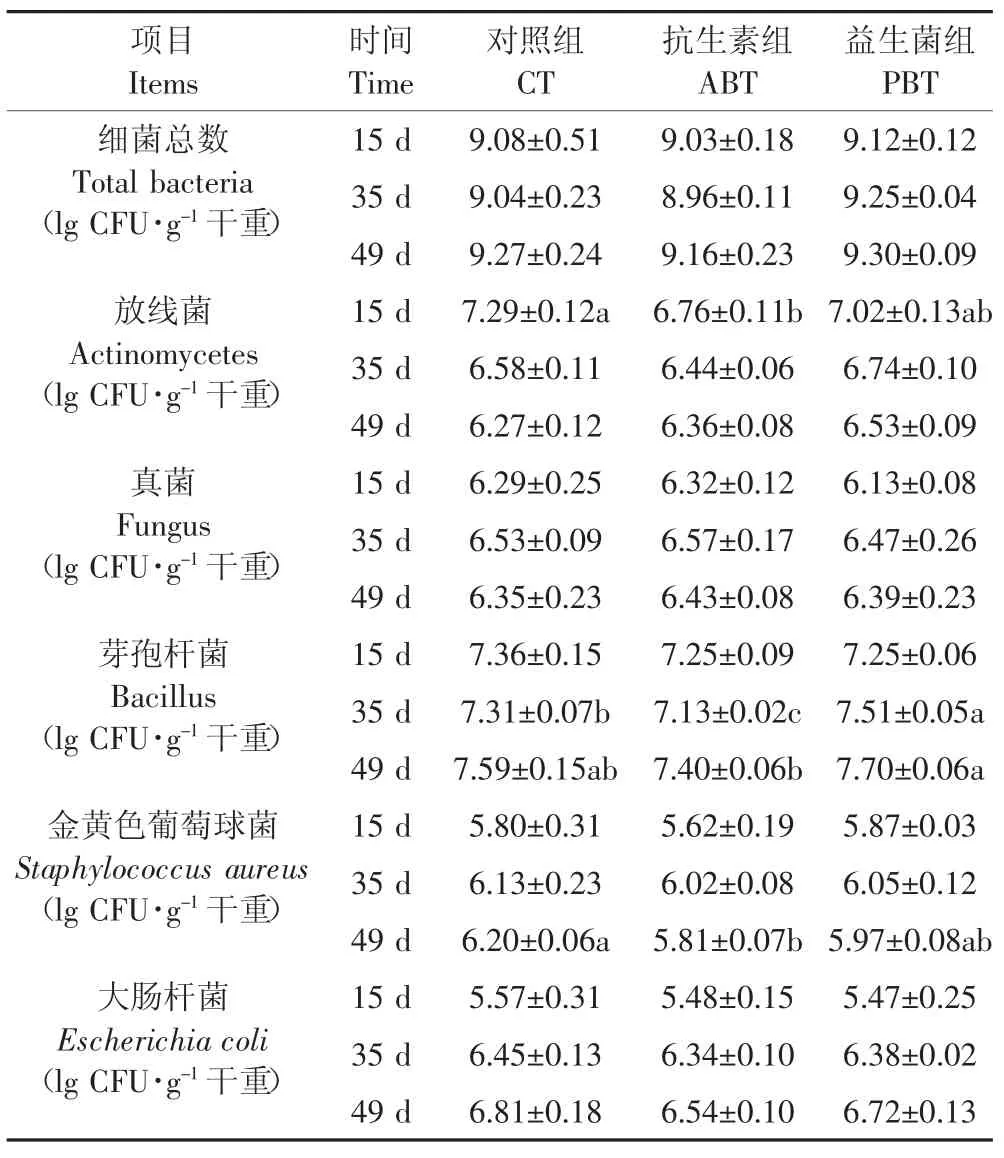
表2 益生菌对发酵床垫料主要菌群数量的影响Table 2 Effects of probiotics on the number of main microbial flora in fermentation-bed litters
试验第15 d时,抗生素组发酵床垫料放线菌数量显著低于对照组(p<0.05);试验第35 d时,益生菌组的芽孢杆菌数量显著高于对照组和抗生素组(p<0.05);试验第49 d时,益生菌组的芽孢杆菌数量显著高于抗生素组(p<0.05),抗生素组的金黄色葡萄球菌数量均比对照组显著降低(p<0.05)。养殖期间,益生菌组、抗生素组的大肠菌群低于对照组,抗生素组的细菌总数低于对照组,益生菌组的细菌总数均高于其他组,但差异均不显著(P>0.05)。整个试验期,各处理组的真菌总数没有显著差异。
2.3 地衣芽孢杆菌对发酵床垫料微生物区系的影响
将PCR的扩增产物进行DGGE分离,得到不同垫料样品的细菌DGGE图谱(图1)。由图1可知,DGGE图谱中电泳条带数目、强度和迁移率均存在一定程度的差异,显示生物发酵床中的细菌种群的多样性,同时也表明饲喂不同日粮影响了发酵床系统的细菌丰富度,从而使垫料微生物群落结构多样性发生变化。由图1还看出,不同垫料间具有许多共同的条带,说明这些发酵床垫料存在一些共有的细菌类型,而且某些公共条带的强度上也不相同,表明同一微生物物种在不同垫料样品的丰度上也存在一定的差异。
为了进一步揭示垫料间细菌DNA片段的差异,采用UPGMA对垫料样品的DDGE指纹图谱作相似性聚类分析,其结果见图2。对照组与益生菌组在66%的相似性水平上聚为一类。一般不同条带相似度高于60%的两个群体就具有较好的相似性[15]。抗生素组与对照组的相似性低,仅为53%。根据电泳图谱中每个条带的信息,对各样品中的细菌多样性指数(H′),丰富度(E)等指标进行了综合分析,结果如表3所示。垫料样品各组间发酵床垫料细菌多样性指数(H′),丰富度(E)均无显著差异(P>0.05)。
3 讨论
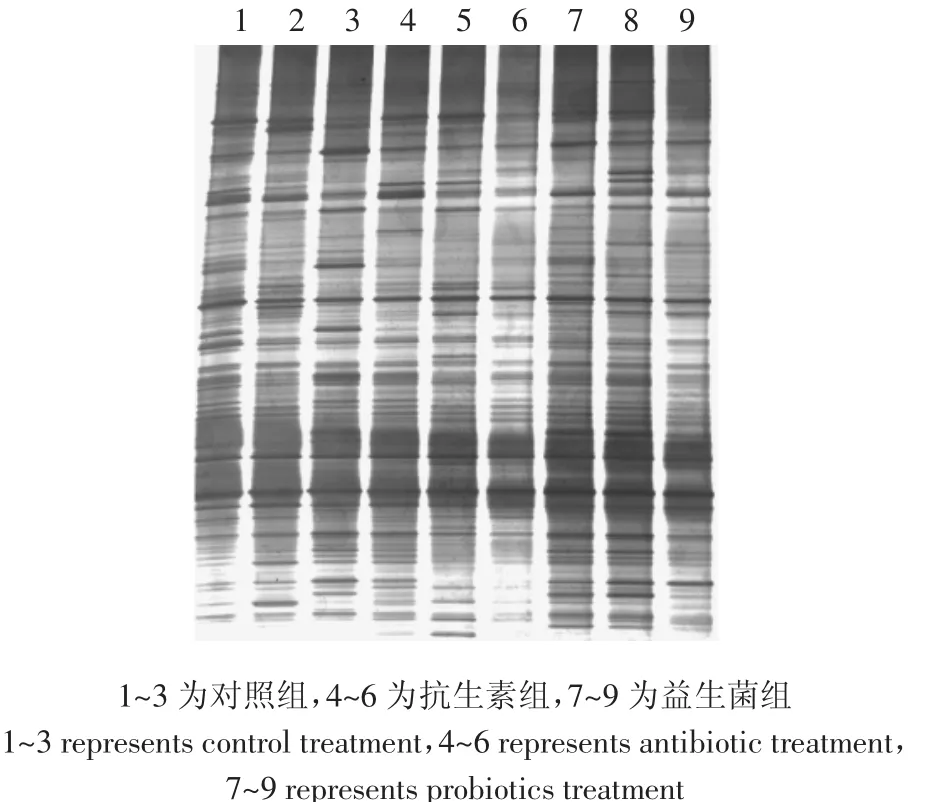
图1 发酵床垫料DGGE图谱Figure 1 DGGE profile in fermentation-bed litters
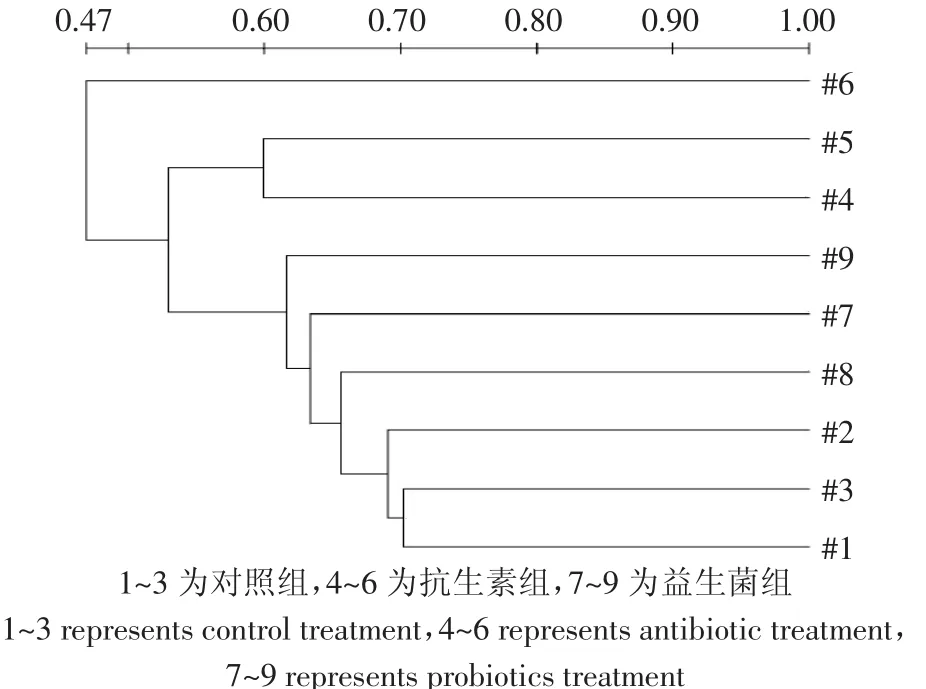
图2 发酵床垫料细菌群落聚类分析进化树Figure 2 Clustering phylogenetic analysis in fermentation-bed liters

表3 益生菌对发酵床垫料DGGE图谱条带数和多样性指数的影响Table 3 Effects of probiotics on the evenness and Shannon index of DGGE profiles in fermentation-bed litters
发酵床垫料的酶活性高低是评价垫料运行和微生物活性的有效指标[16]。蛋白酶参与粪便中含氮化合物的分解,将垫料中的蛋白质分解为小肽、氨基酸等小分子物质。脲酶能够将尿素分解为氨、二氧化碳和水。垫料中蛋白酶和脲酶是由微生物合成,二者与垫料氮素转换密切相关[17]。本研究显示,饲粮中添加益生菌显著提高垫料蛋白酶活性,脲酶与对照组相比有提高趋势,表明益生菌在饲粮中的添加能够在一定程度上提高垫料对粪便的原位降解效率。张庆宁等[18]在发酵床中分离的优势芽孢杆菌能够分泌过氧化氢酶、脲酶、蛋白酶等酶类,利用猪粪迅速生长。尹红梅等[19]在室内模拟条件下,将微生物制剂接种到锯木屑-稻壳垫料中,发现接种组比未接种组蛋白酶、脲酶活性都显著提高,试验进行49 d时益生菌组的蛋白酶高于对照组,但无显著差异,增幅小于15 d和35 d时。究其原因可能与试验后期粪便量增多有关,饲喂芽孢杆菌与垫料中添加芽孢杆菌联合使用,能更高效地提高粪便的原位降解效率。铵态氮、硝态氮、亚硝态氮、氨态氮是垫料中无机氮的主要存在形式[20],铵态氮能够进一步转化为NH3,所以通常用铵态氮含量来反映垫料中NH3的生成状况。脲酶能够将尿素分解成氨,增加垫料铵态氮含量[16],土壤中的脲酶活性与铵态氮含量表现出一定的正相关[21]。发酵良好的垫料中存在一定的孔隙,在有氧条件下硝化细菌能够将铵态氮转化为亚硝态氮或硝态氮[22],垫料中的细菌能以铵态氮和硝态氮为氮源直接将无机氮转化为菌体蛋白[23]。益生菌组垫料铵态氮含量的增加可能与脲酶活性的增强直接相关。
微生物区系及其优势微生物在垫料发酵和使用过程中起着非常重要的作用[24]。发酵床基质垫料中不同微生物分布数量与垫料的理化性质、微生物间的相互作用、肠道微生物等多种因素密切相关[25-26]。肠道微生物又与饲粮变化有关[4-5]。本试验研究了饲粮对发酵床基质垫料微生物种群结构的影响,结果发现在垫料微生物组成中,细菌是优势种群,对猪粪的降解、病原菌的抑制等起主导作用,真菌和放线菌的分布数量与细菌相比,低2~3个数量级,基质垫料中细菌数量随使用时间呈现上升趋势,放线菌数量基本呈逐渐减少趋势,研究结果与郑雪芳等[27]一致。已有研究表明芽孢杆菌属细菌是垫料细菌的优势菌,对猪生物发酵床垫料中有机质的降解发挥重要作用[28-29]。本试验发现,垫料中芽孢杆菌分布数量高于大肠杆菌、金黄色葡萄球菌,为细菌中的优势菌群。饲粮中添加地衣芽孢杆菌,提高了仔猪消化道芽孢杆菌数量[30],芽孢杆菌随粪便排泄到发酵床垫料中,显著增加垫料中芽孢杆菌的分布。芽抱杆菌耐高温和耐酸碱,易适应发酵床的垫料环境。发酵床垫料微生物的活动类似于好氧堆肥,而在好氧堆肥过程中,厚壁菌门中的芽孢杆菌属细菌能迅速定植,快速降解堆料中的有机物,在堆肥过程中始终占优势[31]。饲粮芽孢杆菌组的垫料细菌总数有上升趋势,大肠杆菌有减少趋势,究其原因可能是随着垫料发酵,所形成的有益微生物种群能有效抑制大肠杆菌的生长。饲粮抗生素组的放线菌、金黄色葡萄球菌分布数量显著低于对照组,细菌总数、大肠杆菌、芽孢杆菌有下降趋势,表明饲粮抗生素对垫料益生菌有不利影响,但其在一定程度上能有效减少大肠杆菌、金黄色葡萄球菌等病原菌的数量。
在养殖过程中,发酵床垫料微生物区系及多样性呈动态变化。仔猪保育期各年限、各厚度和各层次的垫料细菌DGGE图谱中条带丰富度明显高于育成期垫料,而随着使用年限增加,猪生物发酵床垫料中的微生物群落的多样性有降低的趋势[32]。本试验在仔猪饲粮中添加芽孢杆菌、抗生素,垫料细菌DGGE的多样性指数(H)、均匀度(E)均无显著差异,究其原因可能是与保育期猪粪尿数量有关。随着猪育肥期粪便量的增加,垫料细菌多样性是否受饲粮影响,还需进一步研究。
4 小结
(1)在发酵床饲养条件下,饲用芽孢杆菌显著增加垫料中芽孢杆菌分布数量,提高垫料中垫料蛋白酶活,一定程度上提高粪便原位降解效率。
(2)饲粮抗生素一定程度上减少了垫料益生菌,但能有效减少垫料病原菌。
(3)在仔猪饲粮中添加芽孢杆菌、抗生素,垫料细菌DGGE的多样性指数、均匀度均无显著差异。
[1]何 鑫,任正平,陆冬梅,等.抗生素对苏淮猪发酵床养殖环境的影响[J].家畜生态学报,2009,30(4):44-47.HE Xin,REN Zheng-ping,LU Dong-mei,et al.Effect of antibiotics on production environment of Suhuai pigs based on ferment bed culture system[J].Journal of Domestic Animal Ecology,2009,30(4):44-47.
[2]徐庆贤,官雪芳,林碧芬,等.几株猪粪堆肥发酵菌对堆肥发酵的促进作用[J].生态与农村环境学报,2013,29(2):253-259.XU Qing-xian,GUAN Xue-fang,LIN Bi-fen,et al.Effects of strains of Zymogen on composting of pig manure[J].Journal of Ecology and Rural Environment,2013,29(2):253-259.
[3]李卓佳,林 亮,杨莺莺,等.芽孢杆菌制剂对虾池环境微生物群落的影响[J].农业环境科学学报,2007,26(3):1183-1189.LI Zhuo-jia,LIN Liang,YANG Ying-ying,et al.Influence of Bacillus on the microbial communities in shrimp ponds[J].Journal of Agro-Environment Science,2007,26(3):1183-1189.
[4]齐 博,武书庚,王 晶,等.枯草芽孢杆菌对肉仔鸡生长性能、肠道形态和菌群数量的影响[J].动物营养学报,2016,28(6):1748-1756.QI Bo,WU Shu-geng,WANG Jing,et al.Effects of Bacillus subtilis on growth performance,intestinal morphology and bacterial enumeration of broilers[J].Chinese Journal of Animal Nutrition,2016,28(6):1748-1756.
[5]蒋佳璇,王淑京,任志鸿,等.猪源益生芽孢杆菌的分离鉴定与生物学特性分析[J].动物营养学报,2016,28(11):3542-3548.JIANG Jia-xuan,WANG Shu-jing,REN Zhi-hong,et al.Isolation,identification and biologic characterization of Bacillus spp from swine[J].Chinese Journal of Animal Nutrition,2016,28(11):3542-3548.
[6]刘 波,郑雪芳,朱昌雄,等.脂肪酸生物标记法研究零排放猪舍基质垫层微生物群落多样性[J].生态学报,2008,28(11):5488-8497.LIU Bo,ZHENG Xue-fang,ZHU Chang-xiong,et al.The diversity of PLFAs biomarkers for the microbial community in the stroma cushion of non-pollution pigsty[J].Acta Ecologica Sinica,2008,28(11):5488-8497.
[7]毕泗伟,吴祖芳,虞耀土.16S rDNA基因文库技术分析发酵床细菌群落的多样性[J].宁波大学学报,2013,26(1):18-22.BI Si-wei,WU Zu-fang,YU Yao-tu,et al.The bacteria diversity of fermentation bed in pig-farming by 16S rDNA gene clone library analysis[J].Journal of Ningbo University,2013,26(1):18-22.
[8]宦海琳,闫俊书,周维仁,等.不同垫料组成对猪用发酵床细菌群落的影响[J].农业环境科学学报,2014,33(9):1843-1848.HUAN Hai-lin,YAN Jun-shu,ZHOU Wei-ren,et al.Effects of different bedding litters on bacterial community in pig biobed[J].Journal of Agro-Environment Science,2014,33(9):1843-1848.
[9]周学利,吴锐锐,李小金,等.发酵床养猪模式中猪肠道与垫料间的菌群相关性分析[J].家畜生态学报,2014,35(2):70-75.ZHOU Xue-li,WU Rui-rui,LI Xiao-jin,et al.Correlation analysis of bacteria from pig intestine and padding in the breeding pattern of fermentation bed[J].Journal of Domestic Animal Ecology,2014,35(2):70-75.
[10]张新熊,彭 锋,毛光平,等.饲用芽孢杆菌研究与应用进展[J].应用与环境生物学报,2013,19(5):891-897.ZHANG Xin-xiong,PENG Feng,MAO Guang-ping,et al.Advance in research and application of Bacillus probiotis[J].Chin J Appl Environ Biol,2013,19(5);891-897.
[11]张 霞,杨 杰,李 健,等.猪发酵床不同原料垫料重金属元素累积特性研究[J].农业环境科学学报,2013,32(1):166-171.ZHANG Xia,YANG Jie,LI Jian,et al.Accumulated characteristics of heavy metals in different pig bio-bed materials[J].Journal of Agro-Environment Science,2013,32(1):166-171.
[12]关松荫.土壤酶及其研究方法[M].北京:农业出版社,1980.GUAN Song-yin.Soil enzyme and its research method[M].Beijing:A-gricultural Press,1980.
[13]Veneklaas E J,Stevens J,Cawthray G R,et al.Chickpea and white lupin rhizosphere carboxylates vary with soil properties and enhance phosphorus uptake[J].Plant and Soil,2003,248:187-197.
[14]刘绍雄,王明月,王 娟,等.基于PCR-DGGE技术的剑湖湿地湖滨带土壤微生物群落结构多样性分析[J].农业环境科学学报,2013,32(7):1405-1412.LIU Shao-xiong,WANG Ming-yue,WANG Juan,et al.Analyzing soil microbial community structure diversity from Jianhu wetland lakeside zone using PCR-DGGE technique[J].Journal of Agro-Environment Science,2013,32(7):1405-1412.
[15]赵云丽,李 刚,修伟明,等.非抗虫转基因棉花对土壤细菌群落多样性的影响[J].农业环境科学学报,2015,34(4):716-721.ZHAO Yun-li,LI Gang,XIU Wei-ming,et al.Effects of insect non-resistant transgenic cottons on bacterial community diversity in soil[J].Journal of Agro-Environment Science,2015,34(4):716-721.
[16]Tiquia S M.Evolution of extracellular enzyme activities during manure composting[J].Journal of Applied Microbiology,2002,92:764-775.
[17]孙 彦.发酵床养鸭对垫料卫生状况及肉鸭肠道微生物多样性的影响[D].雅安:四川农业大学,2014.SUN Yan.The effects of number and diversity of intestinal flora in ducks and the hygiene of the padding by breeding duck on the fermentation bed[D].Ya′an:Sichuan Agricultural Uniersity,2014.
[18]张庆宁,胡 明,朱荣生,等.生态养猪模式中发酵床优势菌群的微生物学性质及其应用研究[J].山东农业科学,2009(4):99-105.ZHANG Qing-ning,HU Ming,ZHU Rong-sheng,et al.Microbial properties and application of superior bacteria in deep-litter ecosystem for piggery[J].Shandong Agriculture Science,2009(4):99-105.
[19]尹红梅,贺月林,张德元,等.发酵床微生物接种试验研究[J].家畜生态学报,2010,31(6):49-54.YIN Hong-mei,HE Yue-lin,ZHANG De-yuan,et al.Study on inoculation of biology bed with microbes[J].Journal of Domestic Animal Ecology,2010,31(6):49-54.
[20]Smith K A,Mctaggart I P,Taurata H.Emission of NO2and NO associated with nitrogen fertilization in intensive agriculture and the potential for mitigation[J].Soil Use Management,1997,13:296-304.
[21]王 芳,张玉龙,肖质秋,等.渗灌不同灌水控制上下限组合对保护地土壤脲酶活性的影响[J].土壤通报,2012,42(6):1393-1398.WANG Fang,ZHANG Yu-long,XIAO Zhi-qiu,et al.Effects of different combinations of upper and lower limits of subsurface irrigation on urease activity in protected field[J].Chinese Journal of Soil Science,2012,42(6):1393-1398.
[22]焦洪超,栾炳志,宋志刚,等.发酵床养猪垫料基础参数变化规律研究[J].中国兽医学报,2013,33(10):1610-1615.JIAO Hong-chao,LUAN Bing-zhi,SONG Zhi-gang,et al.Study on the basic parameters of litters in fermenting bed system of pig production[J].Chinese Journal of Veterinary Science,2013,33(10):1610-1615.
[23]朱 玉.用于发酵床养殖的细菌分离鉴定及应用效果研究[D].雅安:四川农业大学,2011.ZHU Yu.Isolation and identification of bacterial strains and their application in deep litter system[D].Ya′an:Sichuan Agricultural University,2011.
[24]李庆康,吴 雷,刘海琴,等.我国集约化畜禽养殖场粪便处理利用现状及展望[J].农业环境保护,2000,19(4):251-254.LI Qing-kang,WU Lei,LIU Hai-qin,et al.Status and prospect of treatment and utilization of manure on intensive livestock and poultry farms[J].Agro-environmental Protection,2000,19(4):251-254.
[25]朱红,常志州,王世梅,等.基于畜禽废弃物管理的发酵床技术研究:发酵床剖面特征研究[J].农业环境科学学报,2007,26(2):754-758.ZHU Hong,CHANG Zhi-zhou,WANG Shi-mei,et al.Deep litter system for management of livestock profile characteristics of litter in deep-litter system[J].Journal of Agro-Environment Science,2007,26(2):754-758.
[26]刘 波,李兆龙,唐建阳,等.微生物发酵床大栏养殖猪群管理的研究[J].福建农业学报,2014,29(11):1051-1057.LIU Bo,LI Zhao-long,TANG Jian-yang,et al.Breeding management for large population of pigs in large scale piggery of microbial fermentation bed[J].Fujian Journal of Agricultural Sciences,2014,29(11):1051-1057.
[27]郑雪芳,刘 波,朱育菁,等.养猪发酵床垫料微生物及其猪细菌性病原群落动态的研究[J].农业环境科学学报,2016,33:425-432.ZHENG Xue-fang,LIU Bo,ZHU Yu-jing,et al.Community dynamic of bacteria,fungi,actinomycetes and pig bacterial pathogens in the stroma cushion of pig-on-litter system[J].Journal of Agro-Environment Science,2016,33:425-432.
[28]赵国华,方雅恒,陈 贵.生物发酵床养猪垫料中营养成分和微生物群落研究[J].安微农业科学,2015,43(8):98-99.ZHAO Guo-hua,FANG Ya-heng,CHEN Gui.Study on the nutritional components and microbial community in beddings of pig raising by bio-fermentation bed[J].Journal of Anhui Agricultural Sciences,2015,43(8):98-99.
[29]张学峰,周贤文,陈 群,等.不同深度垫料对养猪土著微生物发酵床稳定期微生物菌群的影响[J].中国兽医学报,2013,33(9):1458-1462.ZHANG Xue-feng,ZHOU Xian-wen,CHEN Qun,et al.The influence of padding of different depth in native microorganism fermintation bed of pigs on microbial flora during steady period.[J].Chinese Journal of Veterinary Science,2013,33(9):1458-1462.
[30]徐小明,白建勇,宦海琳,等.地衣芽孢杆菌对发酵床饲养仔猪生长性能、消化酶及肠道主要菌群数量的影响[J].中国畜牧兽医,2015,42(4):923-928.XU Xiao-ming,BAI Jian-yong,HUAN Hai-lin,et al.Effect of Bacillus licheniformis on growth performance,digestive enzymes and the number of intestinal main microbial flora in piglets raised in fermentation bed[J].China Animal Husbandary Veterinary Medicine,2015,42(4):923-928.
[31]Yi J,Wu H Y,Wu J,et al.Molecular phylogenetic diversity of Bacillus community and its temporal spatial distribution during the swine manure of composting[J].Applied Microbiology and Biotechnology,2012,93(1):411-421.
[32]王 迪.猪用生物发酵床垫料中微生物群落多样性变化及芽孢杆菌分离与鉴定[D].武汉:华中农业大学,2012.WANG Di.The Change of microbial community diversity in deep-litter system and the isolation and identification of Bacillus[D].Wuhan:Huazhong Agricultural University,2012.
Effects of diet with Bacillus licheniformis on physicochemical properties and microbial community in litters of piglet biobed
HUAN Hai-lin,BAI Jian-yong,YAN Jun-shu,ZHOU Wei-ren,XU Xiao-ming,GU Hong-ru*
(The Institute of Animal Science,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China)
To investigate the effects of Bacillus licheniformis on the physicochemical properties and microbial community in litters of piglet biobed,weaned piglets were fed in three groups.The first group was fed a basal diet plus B.licheniformis(probiotics treatment,PBT),the second group was fed a basal diet plus bacitracin zinc and sulfate prime enemy(antibiotic treatment,ABT),and the last group was fed a basal diet only(control treatment,CT).The results showed that the activity of proteinase in PBT was significantly improved(p<0.05),while no significant difference in urease activity or ammonium concentration was observed among the three treatments(P>0.05).On day 15,the total number of cells of Actinomyces in ABT was significantly increased(p<0.05).On day 35,the number of Bacillus in PBT was significantly increased(p<0.05).On day 49,the number of Bacillus in PBT was significantly higher than that in ABT(p<0.05),and the number of Staphylococci in ABT was significantly lower than that in CT(p<0.05).The numbers of Escherichia coli in ABT and PBT were lower than that in CT.The total numbers of bacterial and Bacillus in PBT were lower than that in CT,although these differences were not significant(P>0.05).The results indicated that dietary antibiotics might inhibit the growth of pathogenic microorganisms,while the probiotic bacteria population might also be affected.No significant difference(P>0.05)was observed in the DGGE Shannon-Wiener index or the evenness between the three treatments.In general,the addition of B.licheniformis significantly increased the population of Bacillus.The protease activity in the litters of piglet biobed and the degradation efficiency of the manure were improved,while no significant change was observed in the bacterial community diversity.
Bacillus licheniformis;biobed litters;physicochemical properties;microbial community
X172
A
1672-2043(2017)10-2114-07
10.11654/jaes.2017-0490
宦海琳,白建勇,闫俊书,等.日粮添加地衣芽孢杆菌对仔猪发酵床垫料理化性质及微生物群落的影响[J].农业环境科学学报,2017,36(10):2114-2120.
HUAN Hai-lin,BAI Jian-yong,YAN Jun-shu,et al.Effects of diet with Bacillus licheniformis on physicochemical properties and microbial community in litters of piglet biobed[J].Journal of Agro-Environment Science,2017,36(10):2114-2120.
2017-04-05 录用日期:2017-06-01
宦海琳(1981—),女,江苏扬州人,硕士,副研究员,研究方向为畜牧微生物学。E-mail:huanhl@126.com
*通信作者:顾洪如 E-mail:guhongru@163.com
江苏省农业自主创新资金项目[CX13(5040)];江苏省农业三新工程项目(SXGC[2016]331)
Project supported:Jiangsu Agriculture Science and Technology Innovation Fund[CX(13)5040];Jiangsu agriculture Province New Project Fund(SXGC[2016]331)
