丹参乙酸镁减轻脑缺血/再灌注诱导的神经细胞凋亡作用及机制
2017-12-25,,,,,3*
,, ,, ,3*
(1.长沙医学院药学院,湖南 长沙410219; 2.湖南九典制药股份有限公司;3.上海修实生物科技有限公司)
·基础医学·
丹参乙酸镁减轻脑缺血/再灌注诱导的神经细胞凋亡作用及机制
娄峥1,周雅倩1,徐献1,雷文枚2,任贤1,3*
(1.长沙医学院药学院,湖南 长沙410219; 2.湖南九典制药股份有限公司;3.上海修实生物科技有限公司)
目的探讨丹参乙酸镁对于大鼠脑缺血/再灌注损伤中的保护作用及其机制。方法动物实验采用大鼠线栓法缺血/再灌注模型,使大鼠脑缺血2 h后,再灌注24 h。细胞实验采用NG108-15神经细胞株缺氧/复氧模型,低氧无糖培养2 h后,复氧24 h。检测神经细胞凋亡、NADPH氧化酶 (NOX)活性及H2O2水平。结果
与模型组比较,丹参乙酸镁组大鼠脑组织神经细胞凋亡明显下降,NOX活性和H2O2水平均降低。结论丹参乙酸镁具有抗脑缺血/再灌注损伤的作用,其机制与抑制NOX活性,减少H2O2生成有关。
丹参乙酸镁; 缺血/再灌注; 氧化应激
临床治疗过程中对于缺血性脑卒中通常使用组织型纤溶酶原激活剂(tissue plasminogen activator,t-PA)进行溶栓,给药使其恢复血液灌流后,除缺血外,再灌注本身也能给脑造成损伤,统称为缺血/再灌注损伤 (cerebral ischemia reperfusion injury,CI/R)。氧化应激是指机体活性氧(reactive oxygen species,ROS)产生过多和/或抗氧化能力降低,使得ROS 在细胞内大量蓄积而导致细胞凋亡、坏死的氧化损伤过程[1],是造成脑缺血/再灌注损伤的机制之一。
丹参多酚酸盐是中药丹参的水溶性提取物,已用于辅助治疗心绞痛等缺血性心脏病,其中丹参乙酸镁是其主要药理活性成分[2]。丹参乙酸镁具有抗血小板聚集作用,对血管栓塞性疾病缺血期即发挥溶栓治疗作用,同时在再灌注期具有良好的抗氧化特性。基于氧化应激是导致脑缺血/再灌注损伤的重要机制之一,本研究拟探讨丹参乙酸镁对脑缺血/再灌注诱导的神经凋亡作用及机制。
1 材料与方法
1.1材料健康雄性SD大鼠,体重 250~300 g,中南大学实验动物学部提供。NG108-15细胞株(小鼠神经细胞瘤与大鼠神经胶质瘤融合细胞株)购于中国科学院上海生命科学研究院。实验仪器:组织包埋机(LEICA)、石蜡切片机(LEICA)、生化培养箱(Thermo)、多功能酶标仪(Beckman)。实验试剂:丹参乙酸镁(上海绿谷制药股份有限公司)、依达拉奉(中国计量科学研究院)、Caspase-3活性检测试剂盒(碧云天生物技术研究所)、NADPH氧化酶(NADPH oxidase,NOX)活性试剂盒(杰美基因医药科技有限公司)、VAS2870(NOX特异性抑制剂,Sigma)、TUNEL原位杂交试剂盒(Roche)。
1.2方法动物实验:构建线栓法脑缺血/再灌注(middle cerebral artery occlusion,MCAO)模型[3]:10%水合氯醛腹腔麻醉实验动物后,暴露并分离左侧颈总动脉(CCA),颈外动脉(ECA) 和颈内动脉(ICA)。结扎CCA近心端及ECA,用动脉夹暂时夹闭ICA。于CCA远心端放置一打好结的备用丝线,在此线下端剪一小口,将MCAO栓线(购于北京沙东生物技术有限公司,栓线头部直径为0.40±0.02 mm)插入至颈内动脉,收紧丝线,放开ICA上的动脉夹,顺ICA 将栓线送至颅内,从CCA分叉处算起,插入深度为约20 mm。阻断血流2 h后,栓线取出以实现再灌注,同时将备用线结扎CCA远心端,并缝好皮肤,再灌注24 h后处理动物。
54只SD大鼠随机平均分为以下6组:正常对照组(Control组):不作任何处理;假手术组(Sham组):分离出CCA、ECA和ICA,不插入栓线;脑缺血再/灌注组(I/R组):缺血2 h,再灌注24 h;丹参乙酸镁+脑缺血/再灌注组(I/R+MLB组):再灌注后30 min舌下静脉给药(用量:20 mg/kg 0.9%NaCl溶解);依达拉奉+脑缺血/再灌注组(I/R+Edaravone组):再灌注后30 min舌下静脉给药(用量:6 mg/kg 溶于60 ℃0.9%NaCl溶液);溶媒+脑缺血/再灌注组(I/R+Vehicle组):再灌注后30 min舌下静脉给药0.9%NaCl溶液。
处死动物后横切一部分脑组织做TUNEL染色等组织学检验,取缺血侧脑组织检测Caspase-3酶活性、NOX活性、H2O2含量等生物化学检验。
细胞实验[4]:构建缺氧/复氧模型(H/R):接种NG108-15细胞株于6孔板或12孔板中,待其贴壁以后,弃掉正常培养的12%血清高糖培养基,孔内滴入无血清高糖培养基继续常温常氧培养12~18 h而使细胞周期同步化。细胞周期同步化后弃掉无血清培养基,滴入灭菌平衡盐溶液,放入低氧(1%)37 ℃培养箱中培养2 h,即低氧无糖处理。弃掉平衡盐溶液,继续使用12%血清高糖培养基常温常氧培养箱中培养24 h,即复氧处理。复氧过程后按照不同检测方法进行相关检测。
实验分组:正常对照组(Control组):同步化后2 h改用12%血清高糖培养基培养;缺氧/复氧模型组(H/R组):按上述方法造模;丹参乙酸镁+缺氧/复氧组(H/R+MLB组):在造模复氧阶段,在培养基中加入丹参乙酸镁溶液,浓度为10-5mol/L;依达拉奉+缺氧/复氧组(H/R+Edaravone组):在造模复氧阶段,在培养基中加入以0.1%DMSO溶解的浓度为10-5mol/L依达拉奉(不溶于37 ℃培养基);VAS2870+缺氧/复氧组(H/R+VAS2870组):在造模复氧阶段,在培养基中加入以0.1% DMSO溶解浓度为10-5mol/L的VAS2870(不溶于37℃培养基);溶媒组+缺氧/复氧组(H/R+Vehicle组):在造模复氧阶段,在培养基中加入0.1%DMSO。H/R处理后,进行Hoechst染色检测细胞凋亡程度、测定NOX活性以及H2O2含量等生物化学检验,每组进行6次独立实验。
1.3细胞凋亡检测脑组织细胞凋亡采用TUNEL染色。凋亡细胞使得内源性核酸内切酶激活,细胞DNA在内切酶作用下出现断裂,随之出现单链或双链DNA缺口,并产生与DNA断点数目相当的3′-OH末端。暴露的3′-OH可以在末端脱氧核苷酸转移酶(Terminal Deoxynucleotidyl Transferase,TdT) 的催化下加上荧光素(FITC) 标记的dUTP (fluorescein-dUTP),形成不溶性的深蓝色至蓝紫色的NBT-formazan。显微镜观察,细胞核深蓝色至蓝紫色颗粒者为TUNEL阳性细胞,每张切片各取5个不重叠视野,统计阳性细胞数(每平方毫米的TUNEL阳性细胞数目),数目越多则表明细胞凋亡越多。具体步骤按试剂盒厂家提供的说明进行(Roche公司,瑞士)。
NG108-15神经细胞的凋亡检测采用Hoechst染色。Hoechst 33258染色凋亡细胞,由于染色质会固缩,在荧光显微镜下观察,凋亡细胞的细胞核会呈碎块状致密浓染或呈致密浓染,颜色相对正常细胞颜色呈白色。每组每样本随机选取3个视野,计算细胞凋亡率(凋亡细胞数量/总细胞数量)。
1.4 Caspase-3活性检测Caspase-3活性是反映细胞凋亡的重要指标。Caspase-3酶可催化底物Ac-DEVD-pNA产生黄色的pNA,通过测定pNA吸光度可计算Caspase-3活性。一个酶活性单位定义为当底物饱和时,在37 ℃可以催化1 nmol Ac-DEVD-pNA生成1nmol pNA的Caspase-3的酶量。脑组织Caspase-3活性检测具体步骤按试剂盒厂家提供的说明进行(碧云天生物技术研究所,江苏南京)。
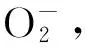
1.6 H2O2水平检测H2O2是NOX下游的重要氧化物,也是造成细胞损伤的重要活性氧。按厂家提供标准品制备标准曲线,在将脑组织匀浆液和NG108-15神经细胞裂解液与试剂盒工作液反应,于酶标仪540 nm检测吸光度值,再根据标准曲线计算出样品中H2O2水平,详细步骤按试剂盒厂家提供的说明进行(碧云天生物技术研究所,江苏南京)。
1.7统计分析采用SPSS20.0软件,数据表示均为均数±标准差,多组均数比较采用ANOVA及Bonferroni’s多重比较t检验分析。P<0.05为差异具有统计学意义。
2 结 果
2.1丹参乙酸镁对缺血/再灌注大鼠脑组织细胞凋亡的作用见图1。对照组和假手术组脑组织中几乎未见阳性细胞,缺血/再灌注组TUNEL阳性细胞明显增加。

图1 丹参乙酸镁对缺血/再灌注诱导的神经细胞凋亡的影响(n=6) A:显微镜下TUNEL染色阳性细胞(200×);B:显微镜下TUNEL染色阳性细胞数量;C:Caspase-3相对活性. 与Sham比较,**:P<0.01;与I/R比较,++:P<0.01
凋亡细胞核固缩,细胞核染成深蓝色至蓝紫色颗粒。给予丹参乙酸镁后, TUNEL阳性细胞数目显著减少(P<0.01)。阳性对照药依达拉奉也能显著降低TUNEL阳性细胞数目(图1B)。缺血/再灌注组脑组织Caspase-3活性显著升高,给予丹参乙酸镁或依达拉奉可以显著降低Caspase-3活性(P<0.01,图1C),该结果与TUNEL结果一致。丹参乙酸镁的溶媒(生理盐水)对TUNEL染色和Caspase-3活性均明显无影响。
2.2丹参乙酸镁对缺血/再灌注大鼠脑组织NOX活性和H2O2生成的影响如图2所示,对照组和假手术组脑组织NOX活性和H2O2含量无显著差别,排除了造模手术本身影响。缺血/再灌注组脑组织NOX活性和H2O2含量较假手术组有显著升高。给予丹参乙酸镁或阳性对照药依达拉奉可以显著降低NOX活性和H2O2含量,而溶媒生理盐水对NOX活性和H2O2含量均明显无影响。
2.3丹参乙酸镁对低氧/复氧诱导的NG108-15神经细胞凋亡的作用如图3A所示,对照组Hoechst染色阳性细胞较少,低氧/复氧组Hoechst染色阳性细胞明显增加(箭头所示)。丹参乙酸镁、依达拉奉或NOX特异性抑制剂VAS2870处理后Hoechst染色阳性细胞较低氧/复氧组显著减少(图3B)。丹参乙酸镁溶媒对Hoechst染色无明显影响。
2.4丹参乙酸镁对低氧/复氧处理的NG108-15神经细胞NOX活性和H2O2生成的影响如图4所示,低氧/复氧组NG108-15神经细胞NOX活性和H2O2水平较对照组显著升高。丹参乙酸镁、依达拉奉及NOX特异性抑制剂VAS2870处理后可显著降低NOX活性和H2O2水平。1%DMSO溶媒对NOX活性和H2O2生成无明显影响。

图2 丹参乙酸镁对缺血/再灌注大鼠脑组织NOX活性和H2O2生成的影响(n=6)A:NOX活性;B:H2O2水平 与Sham比较,**:P<0.01;与I/R比较,++:P<0.01
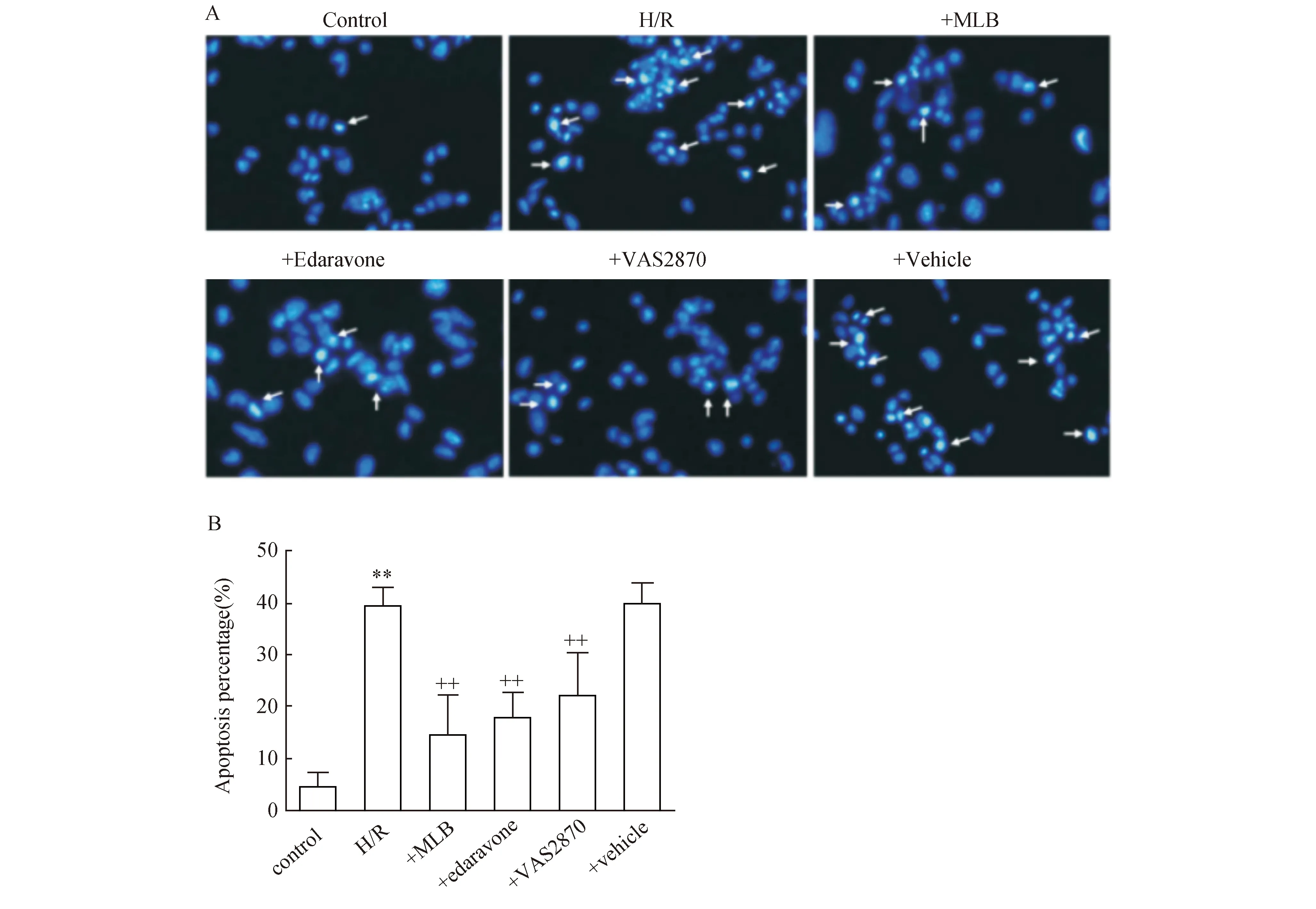
图3 丹参乙酸镁对低氧/复氧诱导的NG108-15神经细胞凋亡的影响(n=6)A:细胞学形态学(200×);B:凋亡率相对百分数 与Control比较,**:P<0.01;与H/R比较,++:P<0.01

图4 丹参乙酸镁对低氧/复氧处理的神经细胞中NOX活性和H2O2生成的影响(n=6)A:NOX活性;B:H2O2浓度 与Control比较,**:P<0.01;与H/R比较,++:P<0.01
3 讨 论
氧化应激是脑缺血/再灌注损伤所涉及的重要机制之一,抗氧化剂依达拉奉可以改善脑卒中后中枢神经功能,减轻症状,恢复意识和行动能力[5]。但依达拉奉对于肝、肾等重要脏器有严重的不良反应,极大的限制了该药在临床上的使用,仅有日本和欧洲少数国家批准上市。
以丹参乙酸镁为主要成分的丹参多酚酸盐注射剂是一个抗脑缺血/再灌注的理想候选药物,现阶段已经作为一个上市药物广泛的用于心血管疾病的治疗,如动脉粥样硬化、心肌缺血等,其机制涉及到抗炎、抗氧化、抗血小板等作用[6]。临床循证医学发现,丹参多酚酸盐对于脑卒中有一定的辅助治疗作用,但其作用机制尚不清楚。
本研究使用大鼠在体线栓法脑缺血/再灌注模型,通过减少脑动脉血流量,造成一侧脑部供血不足,在拔除栓线以后,其脑动脉血流可以恢复到造模前80%左右,脑梗死区域明显,神经功能损伤严重。该模型广泛用于模拟缺血性脑卒中的发生与恢复供血治疗过程。在术后给予丹参乙酸镁和依达拉奉后,通过TUNEL染色检测神经细胞凋亡情况,可以观察到对照组与假手术组TUNEL阳性细胞基本没有出现,而在脑缺血/再灌注模型组,TUNEL阳性细胞明显增多,在给予丹参乙酸镁以及依达拉奉以后,TUNEL阳性细胞有所降低,阳性细胞颗粒颜色变浅。在细胞水平,Hoechst染色实验也证明在给予丹参乙酸镁、依达拉奉后同样可以减少低氧/复氧模型所造成的神经细胞凋亡。以上实验说明丹参乙酸镁可以通过维持神经细胞正常形态、减少细胞凋亡等方面有效保护脑卒中发生与治疗过程中的脑缺血/再灌注损伤,表明丹参乙酸镁与阳性药依达拉奉的保护程度相似,其机制可能与抑制氧化应激有关。

综上所述,本研究结果表明丹参乙酸镁具有抗脑缺血/再灌注诱导神经细胞凋亡作用,其机制与抑制NOX活性,减少ROS生成有关。
[1] Dulyaninova NG,Malashkevich VN,Almo SC,et al.Regulation of myosin-IIA assembly and Mts1 binding by heavy chain phosphorylation[J].Biochemistry-Us,2005,44(18):6867-6876.
[2] Wu WY,Wang YP.Pharmacological actions and therapeutic applications of Salvia miltiorrhiza depside salt and its activecomponents[J].Acta Pharmacol Sin,2012,33(9):1119-1130.
[3] Zhang HF,Li TB,Lou Z,et al.Inhibition of myosin light chain kinase reduces NADPH oxidase-mediated oxidative injury in rat brainfollowing cerebral ischemia/reperfusion[J].Naunyn Schmiedebergs Arch Pharmacol,2015,388(9):953-963.
[4] Yang ZB,Luo XJ,Ren KD,et al.Beneficial effect of magnesium lithospermate B on cerebral ischemia-reperfusion injury in rats involves the regulation of miR-107/glutamate transporter 1 pathway[J].Eur J Pharmacol,2015,766:91-98.
[5] Manzanero S,Santro T,Arumugam TV.Neuronal oxidative stress in acute ischemic stroke:Sources and contribution to cell injury[J].Neurochem Int,2013, 62(5):712-718.
[6] 娄峥,彭军.丹参乙酸镁的心脑血管保护作用及机制研究进展[J].中国动脉硬化杂志,2013,(9):855-858.
[7] Dulyaninova NG,Malashkevich VN,Almo SC,et al.Regulation of myosin-IIA assembly and Mts1 binding by heavy chain phosphorylation[J].Biochemistry-Us,2005,44(18):6867-6876.
[8] Clark K,Middelbeek J,Dorovkov MV,et al.The alpha-kinases TRPM6 and TRPM7,but not eEF-2 kinase,phosphorylate the assembly domain of myosin IIA,IIB and IIC[J].Febs Lett,2008,582(20):2993-2997.
[9] Tang XN,Cairns B,Kim JY,et al.NADPH oxidase in stroke and cerebrovascular disease[J].Neurol Res,2012,34(4):338-345.
[10] Tuo YH,Liu Z,Chen JW,et al.NADPH oxidase inhibitor improves outcome of mechanical reperfusion by suppressing hemorrhagic transformation[J].J Neurointerv Surg,2017,9(5):492-498.
[10] Tuo YH,Liu Z,Chen JW,et al.NADPH oxidase inhibitor improves outcome of mechanical reperfusion by suppressing hemorrhagic transformation[J].J Neurointerv Surg,2017,9(5):492-498.
[11] Hecht N,Terveer N,Schollmayer C,et al.Opening NADPH oxidase inhibitors for in vivo translation[J].Eur J Pharm Biopharm,2017,115:206-217.
EffectofmagnesiumlithospermateBoncerebralischemia/reperfusion-inducedapoptosisandtheunderlyingmechanisms
LOU Zheng,ZHOU Yaqian,XU Xian,et al
(CollegeofPharmacy,ChangshaMedicalUniversity,Changsha410219,Hunan,China)
ObjectiveTo investigate whether lithospermate B is able to protect the rat brain from ischemia/reperfusion injury and the underlying mechanism.MethodRats were subjected to 2 h of cerebral ischemia and 24 h of reperfusion to establish anischemia/reperfusion injury model.In a NG108-15 nerve cell hypoxia/reoxygenation (H/R) injury model,cells were cultured in 2 h of hypoxia and 24 h of reoxygenation.And cellular apoptosis,nicotinamide adenine dinucleotide phosphate-oxidase (NOX)activity,and H2O2content were examined.ResultAdministration of salvia magnesium lithospermate B reduced apoptosis of nerve cells with a decrease in nicotinamide adenine dinucleotide phosphate-oxidase activity and H2O2production in the rat brains,compared with model group.In the experiments,the number of iHoechst staining positive cells,nicotinamide adenine dinucleotide phosphate-oxidase activity and H2O2level were decreased by the intervention of drugs.ConclusionThe results suggest that lithospermate B is able to protect the brain from ischemia/reperfusion oxidative injury,which is related to the inhibition of nicotinamide adenine dinucleotide phosphate-oxidase and a reduction of reactive oxygen species production.
magnesium lithospermate B; ischemia/reperfusion injury; oxidative stress
10.15972/j.cnki.43-1509/r.2017.05.009
2016-12-01;
2017-07-26
湖南省教育厅一般项目(15C0161)药学类专业校企合作人才培养示范基地(湘教通[2014]272号).
*通讯作者,E-mail:renxian87@163.com.
R961
A
蒋湘莲)
