咯萘啶逆转人乳腺癌MCF-7/ADM细胞耐药性及机制探讨
2017-12-25,,,
,,,
(北京大学深圳医院肿瘤科,广东 深圳 518000)
·基础医学·
咯萘啶逆转人乳腺癌MCF-7/ADM细胞耐药性及机制探讨
李柱,农巧红,童刚领,王树滨*
(北京大学深圳医院肿瘤科,广东 深圳 518000)
目的在明确咯萘啶(PND)逆转人乳腺癌细胞MCF-7/ADM耐药性的药效基础上,初步探索作用机制。方法采用MTT法检测单用阿霉素(ADM)和联用咯萘啶(PND)对人乳腺癌敏感细胞MCF-7和耐药细胞MCF-7/ADM的抑制作用,得出半数抑制浓度(IC50),并计算耐药倍数和逆转倍数。Western blot检测细胞中Fas和Caspases-3蛋白表达。结果ADM对MCF-7和MCF-7/ADM的IC50分别为1.399 μg/mL和43.885 μg/mL,耐药倍数为31.4倍。PND(0.5 μg/mL)联合ADM作用MCF-7/ADM的IC50为3.246 μg/mL,逆转倍数为13.5倍,并能提高耐药MCF-7/ADM中Fas和Caspases-3蛋白表达。结论PND能够逆转人乳腺癌细胞MCF-7/ADM耐药性,通过上调膜蛋白Fas表达,增加MCF-7/ADM对ADM的敏感性,从而促进细胞凋亡。
咯萘啶; 阿霉素; 乳腺癌; MCF-7/ADM细胞; 逆转耐药; 细胞凋亡
随着人们生存环境和生活习惯的改变,乳腺癌已成为女性癌症患者死亡率最高的的癌症[1]。虽然乳腺切除术能够有效降低肿瘤负荷,但存在预后差、免疫功能下降等问题,并且给患者心理带来极大的负担[2]。化疗是另一种乳腺癌治疗手段,但容易出现多药耐药(multidrug resistance,MDR)的棘手问题,这极大限制了阿霉素(adriamycin,ADM)等药物的抗肿瘤作用[3]。目前,解决MDR问题的主要研究方向为寻找有效的肿瘤耐药逆转剂[4]。本研究采用咯萘啶(pyronaridine,PND)联合ADM作用于人乳腺癌耐药细胞MCF-7/ADM,观察PND对MCF-7/ADM的逆转耐药作用,并初步探索作用机制。
1 材料与方法
1.1材料
1.1.1 细胞株 人乳腺癌细胞株MCF-7购于中国科学院上海细胞生物所。
1.1.2 药物与试剂 阿霉素购于南京奥多福尼生物科技有限公司,使用灭菌注射用水稀释成16 mg/mL的母液,分装后-20 ℃保存;咯萘啶购于上海恒远生物科技有限公司,使用DMSO配制为16 mg/mL的母液,分装,-20 ℃保存,使用时用培养基稀释成相应浓度。胎牛血清、RPMI-1640培养基、MTT噻唑蓝购于Solarbio公司。小鼠抗β-actin单抗、小鼠抗Fas单抗、兔抗Caspases-3单抗、辣根酶标记山羊抗小鼠或兔,均购自CST公司。
1.2方法
1.2.1 细胞培养和分组 使用含10%胎牛血清、100 U/mL 青霉素和100 μg/mL链霉素的RPMI-1640培养基,于37 ℃和5%CO2的培养箱中培养MCF-7细胞。以起始浓度为4 μg/mL的ADM培养基培养MCF-7细胞,待细胞稳定生长后,逐渐增加ADM的浓度,每次ADM浓度增加2倍,同时监测MCF-7细胞对ADM的IC50,待IC50达到40 μg/mL左右时,认为其出现较强耐药性,即成功培养出MCF-7/ADM细胞,在含1 μg/mL的ADM的上述培养基中,培养MCF-7/ADM细胞,以维持其耐药性。设置MCF-7/ADM组、MCF-7/ADM +ADM组、MCF-7/ADM +ADM +PND组,共三个组。
1.2.2 MTT法检测细胞抑制率 取对数生长期的细胞(MCF-7或MCF-7/ADM),制备成悬液,细胞计数板计数为1×104/mL,接种于96孔板,每孔200 μL,每组设3个副孔,细胞培养箱中培养24 h后,加入含相应浓度药物的无血清培养基进行干预,作为处理组,同时设立只加培养基的空白对照组和不加药物的阴性对照组,继续培养20 h后,每孔加入20 μL的 MTT溶液(5 mg/mL),然后继续培养4 h,吸去上清液后每孔加入200 μL的DMSO,摇床摇晃10 min,待晶体全部溶解后,使用酶标仪在490 nm处测定吸光度(OD)。使用公式计算抑制率,抑制率(%)=[1-(处理组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)]×100%。实验重复3次。
1.2.3 ADM对MCF-7和MCF-7/ADM的抑制作用 使用无血清培养基将ADM母液进行稀释,终浓度为0.01、0.05、0.25、1.25、6.25、31.25 μg/mL,然后干预MCF-7。同时,另外配制终浓度为5、10、20、40、80、160 μg/mL的ADM无血清培养基,用于干预MCF-7/ADM。其余操作方法同“1.2.2”,得出抑制率,分别计算出ADM对MCF-7和MCF-7/ADM的半数抑制浓度(IC50),然后计算耐药倍数,耐药倍数= (MCF-7的IC50)/(MCF-7/ADM的IC50)。
1.2.4 PND对MCF-7/ADM的抑制作用 使PND在无血清培养基中的终浓度分别为0.5、1、2、4、8、16 μg/mL,求出对MCF-7/ADM的抑制率,然后将各浓度对应的抑制率与不加药物的阴性对照组比较,计算出抑制率无统计学意义的PND浓度。
1.2.5 PND逆转MCF-7/ADM对ADM耐药的作用
将“1.2.4”筛选出的对MCF-7/ADM无显著抑制作用浓度的PND,与浓度分别为1、2、4、8、16、32 μg/mL的ADM联用,按照“1.2.2”的步骤,求出逆转后ADM对MCF-7/ADM的IC50,并计算逆转倍数,逆转倍数=(逆转前IC50)/(逆转后IC50)。
1.2.6 Western blot检测细胞凋亡通路蛋白 同时设置MCF-7/ADM组、MCF-7/ADM +ADM组、MCF-7/ADM +ADM +PND组,共三个组。MCF-7/ADM组正常培养传代。根据“1.2.3”和“1.2.5”中ADM对MCF-7/ADM的抑制率,选取单用ADM对MCF-7/ADM抑制率较低,但联用PND对MCF-7/ADM抑制率较高的某一浓度作为ADM的浓度,用于MCF-7/ADM +ADM组和MCF-7/ADM +ADM +PND组。MCF-7/ADM +ADM +PND组中的PND浓度与“1.2.5”中的浓度相同。将细胞配制成密度为3×104/mL的悬液,然后接种于6孔板,每孔2 ml,24 h后, MCF-7/ADM组只更换培养基,MCF-7/ADM +ADM组加入相应浓度的ADM,MCF-7/ADM +ADM +PND组同时加入ADM和PND,继续培养。24 h后,弃去上清液,加入200 μL含1%PMSF的细胞裂解液,冰上放置,并于振荡器上摇晃15 min,然后用细胞刮将细胞碎片刮至一侧,移液器转移至1.5 mL离心管中,放于4 ℃恒温离心机中,13 000 rpm离心10 min,转移上清液,BCA试剂盒检测蛋白含量,加入蛋白上样缓冲液,并补双蒸水将总蛋白浓度调至5 μg/μL,沸水浴加热5 min,分装,-20 ℃保存。配制聚丙烯酰胺凝胶,分离胶浓度10%,浓缩胶浓度5%,取10 μL样品上样,电泳结束后,转膜3 h,室温封闭2 h,加入一抗4 ℃孵育过夜(内参β-actin浓度1∶500,Fas和Caspases-3浓度1∶1 000),二抗(浓度1∶5000)室温孵育2 h,显色并曝光胶片。
2 结 果
2.1 ADM对MCF-7和MCF-7/ADM的抑制作用
表1和表2结果表明,ADM对MCF-7和MCF-7/ADM的抑制作用均与浓度呈正相关,但对两种细胞的效价差别较大,对MCF-7的IC50为1.399 μg/mL,但对MCF-7/ADM的IC50达43.885 μg/mL,耐药倍数为31.4倍。
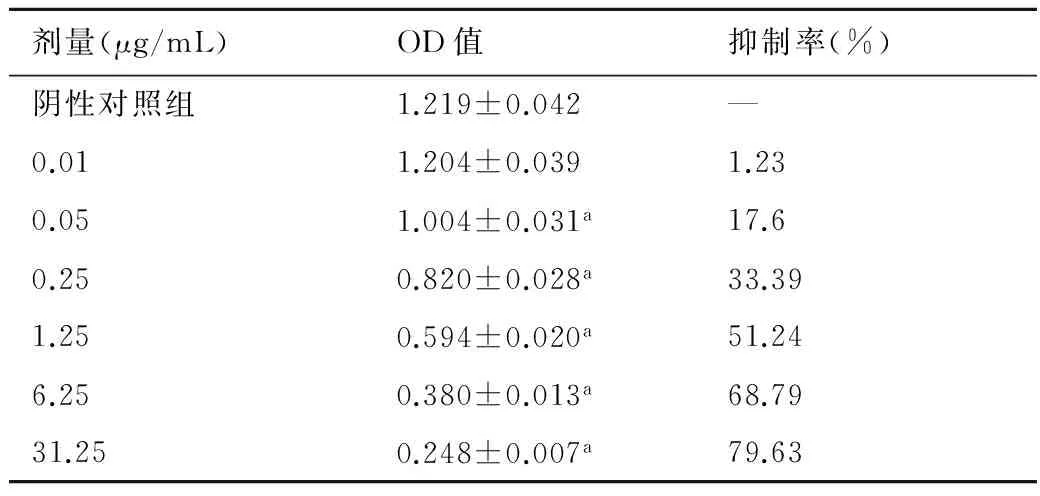
表1 ADM对MCF-7细胞的抑制作用
与阴性对照组比较,a:P<0.05
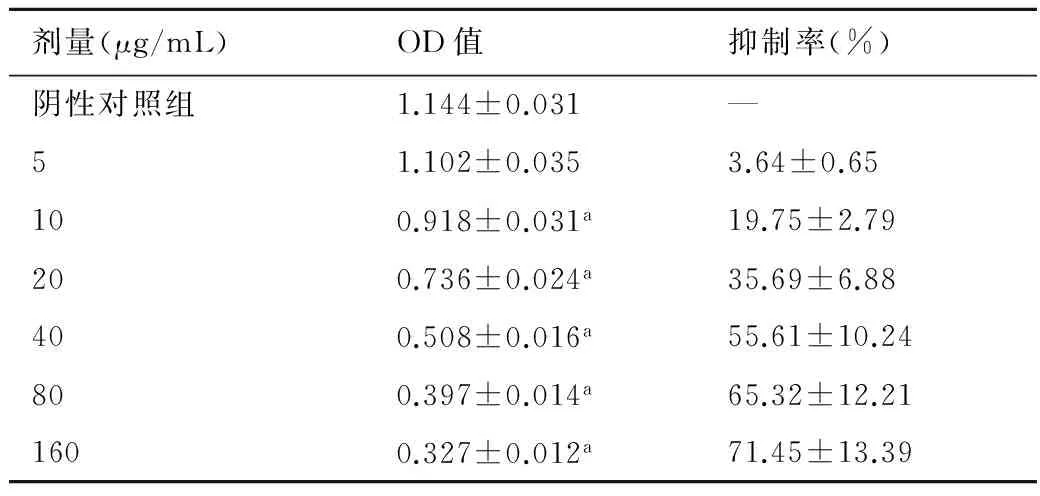
表2 ADM对MCF-7/ADM细胞的抑制作用
与阴性对照组比较,a:P<0.05
2.2 PND对MCF-7/ADM的抑制作用表3结果显示,高浓度PND对MCF-7/ADM具有较强的抑制作用,在较低浓度时仅有微弱的抑制作用,因此,选择无显著抑制作用浓度为0.5 μg/mL的PND,用于下一步逆转耐药性研究。
2.3 PND逆转MCF-7/ADM对ADM耐药的作用表4结果表明,与单用ADM比较,在联用PND时,低浓度的ADM对MCF-7/ADM具有显著的抑制作用,IC50为3.246 μg/mL,逆转倍数为13.5倍。
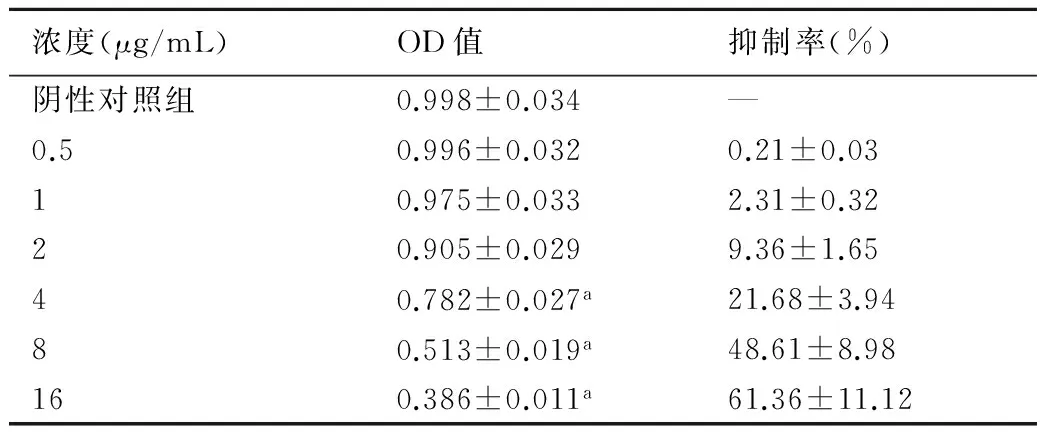
表3 PND对MCF-7/ADM细胞的抑制作用
与阴性对照组比较,a:P<0.05
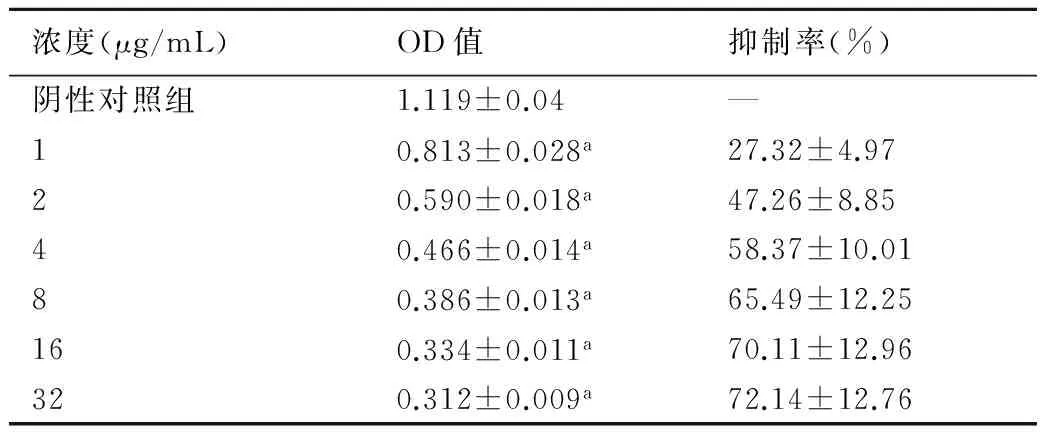
表4 PND逆转MCF-7/ADM对ADM耐药的作用
与阴性对照组比较,a:P<0.05
2.4细胞凋亡通路蛋白与MCF-7/ADM组比较, MCF-7/ADM +ADM组Fas和Caspase-3蛋白表达无显著性差异(P>0.05);而MCF-7/ADM +ADM+PND组中Fas和Caspase-3蛋白表达显著升高(P<0.05),结果见图1。

图1 联用PND对Fas和Caspase-3蛋白的影响1:MCF-7/ADM组;2:MCF-7/ADM+ADM组;3:MCF-7/ADM+ADM+PND组与MCF-7/ADM组比较,*:P<0.05
3 讨 论
细胞凋亡又称程序性死亡,是一种由基因调控的主动的死亡方式,在生理与病理中起到重要作用[5]。细胞凋亡通路主要分为线粒体途径和死亡受体途径,半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)是两条细胞凋亡通路的共同效应因子,在细胞凋亡中起到关键作用[6]。死亡受体Fas(又称APO-1或CD95)是一种细胞膜表面受体,能将凋亡信号转导给下游的Caspase,从而启动凋亡功能,诱导细胞发生程序性死亡[7]。研究表明,肿瘤的发生、发展与细胞凋亡通路密切相关,通过诱导细胞凋亡是治疗肿瘤的有效策略[8]。通过上调乳腺癌细胞膜表面Fas表达,进而将信号转导给下游Caspase,能促进该肿瘤细胞的凋亡[9]。ADM可通过Fas介导细胞凋亡信号,激活Caspase,从而发挥抗肿瘤作用[10-11]。但是,在治疗中可能会出现耐药情况,乳腺癌细胞对ADM敏感性下降,导致疗效不佳,虽然加大剂量可提高疗效,但容易引起严重的不良反应,限制了临床使用,因此,寻找有效的肿瘤耐药逆转剂成为是有效提高抗肿瘤治疗的重要手段[12-13]。PND是我国研制的抗疟药,能够逆转疟原虫对氯喹的耐药性,并且具有逆转肿瘤耐药性的作用,有望成为新一代肿瘤耐药逆转剂[14-15]。
本研究主要观察PND对乳腺癌的耐药逆转作用,结果表明,CMF-7/ADM对ADM具有较强的耐药性,耐药倍数达31.4倍,而与PND联用可有效逆转耐药性,逆转倍数为13.5倍。PND和ADM联用可上调细胞凋亡通路中Fas和Caspase-3蛋白的表达,从而增加CMF-7/ADM对ADM的敏感性,促使肿瘤细胞凋亡。综上所述,PND可逆转CMF-7/ADM对ADM的耐药性,其机制可能为上调膜表面Fas表达,增加CMF-7/ADM对ADM的敏感性,促进乳腺癌细胞凋亡。
[1] 黄国兴,苏国森,李上芹,等.亚甲蓝染色法乳腺癌前哨淋巴结活检术158例分析 [J].中南医学科学杂志,2016,44(1):38-40,50.
[2] 闫存礼,侯林都,夏秀林.原发肿瘤切除对晚期乳腺癌患者远期预后的影响 [J].中南医学科学杂志,2016,44(6):667-669,684.
[3] 张晓娇,李小娜,张慧珠.叶黄素等天然抗氧化剂逆转MCF-7/ADM多药耐药作用的筛选及机制研究 [J].中药药理与临床,2014,30(3):35-39.
[4] 盛佳钰,陈红风.MK-2206联合顺铂对乳腺癌4T1/DDP移植瘤耐药性的影响 [J].实用肿瘤杂志,2017,32 (1):33-38.
[5] 陈康,贺燕勤,于顾然.楮实子水煎剂对H2O2介导PC12细胞凋亡的影响 [J].四川中医,2017,35(2):41-44.
[6] Hazawa M,Kudo M,Iwata T,et al.Caspase-independent apoptosis induction of quorum- sensing autoinducer analogs against chronic myeloid leukemia K562 [J].Invest New Drugs,2012,30(3):862-869.
[7] Erdogan M,Kulaksizoglu M,Ganidagli S,et al.Fas/FasL gene polymorphism in patients with Hashimoto's thyroiditis in Turkish population [J].J Endocrinol Invest,2017,40(1):77-82.
[8] 陈干涛,董卫国.羟喜树碱通过诱导自噬抗宫颈癌的机制研究 [J].实用癌症杂志,2017,32(3):349-353.
[9] Shi LY,Han Z,Li XX,et al.Inactivated Sendai virus strain Tianjin induces apoptosis in breast cancer MCF-7 cells by promoting caspase activation and Fas/FasL expression [J].Cancer Biother Radiopharm,2015,30(1):33-40.
[10] 杨旭东,张杰,杨清东,等.白毛藤多糖联合阿霉素对乳腺癌细胞凋亡的影响 [J].中医药通报,2017,16(1):64-66,12.
[11] 易坚,刘志勇,刘凤恩.二氢丹参酮Ⅰ抑制乳腺癌细胞生长的机制 [J].广东医学,2016,37(22):3371-3375.
[12] Baek JS,Cho CW.A multifunctional lipid nanoparticle for co-delivery of paclitaxel and curcumin for targeted delivery and enhanced cytotoxicity in multidrug resistant breast cancer cells [J].Oncotarget,2017,8(18):30369-30382.
[13] 顾卓珺,王萌,方琼艳,等.载阿霉素普朗尼克化聚酰胺-胺树状聚合物对乳腺癌多药耐药细胞株MCF-7/ADR的抑制作用 [J].药学学报,2014,49(8):1188-1193.
[14] 农巧红,李柱,程勃然,等.PND对乳腺癌多药耐药的逆转作用分析 [J].中国医学创新,2015,12(21):56-57.
[15] 王莹,刘继华,刘屹,等.HPLC法测定磷酸咯萘啶注射液的含量 [J].海峡药学,2016,28(7):55-56.
ReversaleffectandmechanismofpyronaridineondrugresistanceofbreastcancercellMCF-7/ADM
LI Zhu,NONG Qiaohong,TONG Gangling,et al
(DepartmentofOncology,ShenzhenMedicalCollege,PekingUniversity,Shenzhen518000,GuangdongChina)
ObjectiveBased on the effect of pyronaridine (PND) in reversing drug- resistance of human breast cancer cell MCF-7/ADM,to explore the mechanism of action.MethodsThe inhibitory effect of simple adriamycin (ADM) and combined with PND on sensitive human breast cancer cell MCF-7 and drug-resistance MCF-7/ADM was detected by MTT assay,and to calculate median inhibitory concentration,resistance index and reversal index.Cells were designated as MCF-7/ADM group,MCF-7/ADM+ADM group and MCF-7/ADM+ADM+PND group.Western blot detected the expression of Fas and Caspases-3 in cells.ResultsThe IC50of ADM to MCF-7 and MCF-7/+ADM were 1.399 μg/mL和43.885 μg/mL,respectively,and the resistance index was 31.4.The IC50of PND combined with ADM to MCF-7/ADM was 3.246 μg/mL,and the reversal index was 13.5.Compared with MCF-7/ADM group,the expression of Fas and Caspases had no statistic difference (P>0.05) in MCF-7/ADM +ADM group,but the expression increased significantly in MCF-7/ADM +ADM+PND group (P<0.05).ConclusionPND could reverse drug- resistance of MCF-7/ADM by up-regulating expression of membrane protein Fas,which increased sensibility of MCF-7/ADM to ADM,and induced the cell apoptosis.
pyronaridine;adriamycin;breast cancer;MCF-7/ADM cell;reversing drug-resistance;apoptosis
10.15972/j.cnki.43-1509/r.2017.04.005
2017-02-20;
2017-05-23
深圳市创新知识计划基础研究项目(JCYJ2015040309144300).
*通讯作者,E-mail:zhuewt@163.com.
R737.9
A
秦旭平)
