恶臭假单胞菌产羰基还原酶的发酵条件优化
2017-12-23,,
,,
(1.浙江医药高等专科学校 制药工程学院,浙江 宁波 315100;2.浙江工业大学 药学院,浙江 杭州 310014)
恶臭假单胞菌产羰基还原酶的发酵条件优化
何军邀1,2,白东亚2,王普2
(1.浙江医药高等专科学校 制药工程学院,浙江 宁波 315100;2.浙江工业大学 药学院,浙江 杭州 310014)
从土样中筛选得到一株产羰基还原酶的菌种恶臭假单胞菌(Pseudomonasputida)ZJPH1606,该菌能不对称催化2′-三氟甲基苯乙酮合成(R)-1-(2-三氟甲基苯基)乙醇,对映体过量值超过99.0%.通过单因素考察产酶培养基组成发现:葡萄糖、牛肉膏和MgSO4·7H2O对酶活的影响较为明显,进一步采用响应面法对产酶培养基进行了优化.结果表明:最优发酵培养基组成为葡萄糖38.5 g/L,牛肉膏32.7 g/L,MgSO4·7H2O 1.1 g/L.在最适培养条件下,菌体酶活力达0.31 U/g,较优化前提高了71.0%.该研究结果丰富了羰基还原酶数据库的基因序列,为高效合成(R)-1-(2-三氟甲基苯基)乙醇提供了新途径.
恶臭假单胞菌;羰基还原酶;菌种筛选;(R)-1-(2-三氟甲基苯基)乙醇;培养基优化
手性仲醇含有一个活泼的羟基官能团,是用于合成药物、香精香料、农业化学品和特殊材料的重要手性砌块[1-2].利用生物催化技术将潜手性酮不对称还原成为手性仲醇,是合成手性仲醇可靠和有效的方法[3-4].由于生物催化不对称还原具有立体选择性高、环境友好等优点,已经成为近年来的研究热点[5-8].(R)-1-(2-三氟甲基苯基)乙醇是合成抗肿瘤药物GSK461364的关键手性中间体,GSK461364(化学名:5-[6-[(4-甲基-1-哌嗪)甲基]-1H-苯并咪唑-1-基]-3-[(1R)-1-[2-(三氟甲基)苯基]乙氧基]-2-噻吩胺)是ATP竞争性抑制剂,强选择性作用于受体Plk1激酶抑制剂,可调控细胞有丝分裂,用于治疗晚期实体瘤和非Hodgkins淋巴瘤[9].(R)-1-(2-三氟甲基苯基)乙醇的制备主要包括化学法[10]和生物法[11-12].Martins等[10]采用IrCl3/(R,R)-TsDPEN为催化剂,底物2′-三氟甲基苯乙酮的浓度为1 mol/L,反应24 h,主产物为R型,转化率和e.e.值分别为100%和75%,产物的光学纯度不理想.该手性醇的生物法制备也已有一些报道,如Nakamura等[11]采用白地霉(Geotrichumcandidum)为催化剂,以26.7 mmol/L 2′-三氟甲基苯乙酮为底物,添加NAD+和异丙醇参与辅酶再生,30 ℃,反应20 h制得S构型产物,产率和e.e.值分别为13%和97%.许建和等[12]采用基因挖掘技术,构建重组工程菌E.ColiBL21(DE3)/pET-KtCR,底物浓度为10 mmol/L条件下,得到R构型产物的产率和e.e.值分别为2%和99%.
笔者通过筛选取自全国各地的35 份土样,得到一株产羰基还原酶菌种恶臭假单胞菌(Pseudomonasputida)ZJPH1606,该菌株能高立体选择性不对称还原2′-三氟甲基苯乙酮,产物(R)-1-(2-三氟甲基苯基)乙醇的e.e.值超过99.0%.为提高产酶能力,通过单因素进行考察,并对重要影响因素采用中心组合实验设计(Central composite design),优化菌种发酵培养基组成,确定最优产酶条件.
1 材料与方法
1.1 菌种与材料
1.1.1 菌 种
恶臭假单胞菌(Pseudomonasputida)ZJPH1606,由本课题组从土壤中筛选得到.
1.1.2 试 剂
2′-三氟甲基苯乙酮购自韶远科技(上海)有限公司,外消旋1-(2-三氟甲基苯基)乙醇由实验室合成制得(纯度>97.1%).其他试剂为国产生化试剂或分析纯.
1.1.3 培养基
富集培养基:邻三氟甲基苯乙酮4.0 g/L,(NH4)2SO42.0 g/L,KH2PO42.0 g/L,NaCl 1.0 g/L,MgSO4·7H2O 0.5 g/L,pH 6.5.
固体培养基:葡萄糖10.0 g/L,酵母提取物6.0 g/L,(NH4)2SO43.0 g/L,KH2PO41.5 g/L,NaCl 0.8 g/L,MgSO4·7H2O 0.8 g/L,琼脂粉20.0 g/L,pH 6.5.
种子培养基和初始发酵培养基:葡萄糖15.0 g/L,酵母提取物10.0 g/L,(NH4)2SO42.0 g/L,KH2PO42.0 g/L,NaCl 1.0 g/L,MgSO4·7H2O 0.5 g/L,pH 6.5.
1.2 试验方法
1.2.1 菌种筛选
10 mL的生理盐水中加入1 g土样并摇匀,吸取200 μL悬浊液加入富集培养基,30 ℃,200 r/min,培养5~7 d.将富集培养基分别稀释100~10 000 倍,各吸取100 μL涂布在平板培养基上,30 ℃恒温培养2~3 d.对平板培养基长出的菌株进行转化能力考察,选取优良菌株.筛菌流程:富集培养→平板初筛→菌种复筛→种子培养→发酵培养→生物转化→气相色谱检测产物→获得优良菌株.
1.2.2 菌种鉴定
利用Hitachi(日立)-7650透射电子显微镜观察ZJPH1606菌的细胞形态,并由上海生工测序16S rDNA,将所得基因序列对比分析GenBank保藏的基因序列,构建系统发育树,以确定该菌的种属.
1.2.3 种子培养
从培养成熟的平板培养基中挑取1环菌体接入装液量为100 mL的种子培养基中(250 mL锥形瓶),温度30 ℃,摇床转速200 r/min,培养12 h.
1.2.4 摇床发酵培养
将培养好的种子液以8%(体积分数)接种量转接至装有60 mL发酵培养基的250 mL锥形瓶中,温度30 ℃,摇床转速200 r/min,培养36 h.
1.2.5 中心组合实验设计
对初始培养基成分中的碳源、氮源及金属离子的种类及浓度进行优化,通过单因素实验法,选取葡萄糖、牛肉膏和MgSO4·7H2O三个重要因素,利用Design expert 8.0.6软件进行Box-Behnken中心组合实验设计(三因素三水平),以酶活(U/g)为响应值,共需17 组实验,每组设3 个平行样.实验设计软件Design expert 8.0.6对实验数据自动进行回归分析,用F(Fischer)检验评价数学模型方程的显著性,由确定系数R2确定方程的拟合性.
1.2.6 酶活力测定
酶活力定义:30 ℃,200 r/min下,1 min还原2′-三氟甲基苯乙酮生成1 μmol (R)-1-(2-三氟甲基苯基)乙醇所需的酶量定义为一个酶活力单位(U).羰基还原酶的酶活力(Enzyme activity)以1 g干菌体中所含有的酶活力单位表示(U/g).
酶活力测定方法:取发酵液,离心分离菌体(9 000×g,4 ℃,15 min),以磷酸盐缓冲溶液PBS(0.1 mol/L,pH 6.5)洗涤,离心后称取菌体(湿重)1.0 g重悬于10 mL磷酸缓冲液中,加入5 mmol/L 2′-三氟甲基苯乙酮,1 g乳糖,温度30 ℃,摇床转速200 r/min,反应1 h,离心后上清液用10 mL乙酸乙酯萃取,用气相色谱检测产物浓度,计算其酶活力.
1.2.7 气相分析方法
GC-2014气相色谱仪(日本SHIMADZU公司),气相柱为CP-Chirasil-Dex毛细管手性色谱柱(25 m×0.25 mm×0.25 μm);氮气作为载气,柱流速2.0 mL/min;升温程序为柱温100 ℃,保持3 min,以8 ℃/min升至150 ℃;进样口温度250 ℃;检测器为FID,温度250 ℃;进样量1 μL,分流比15∶1.气相色谱图如图1所示,溶剂(乙酸乙酯)保留时间为1.121 min,内标(十二烷)保留时间为6.035 min,S构型产物醇保留时间为7.953 min,R构型产物醇保留时间为8.215 min.产物的光学纯度由对映体过量值e.e.表征为

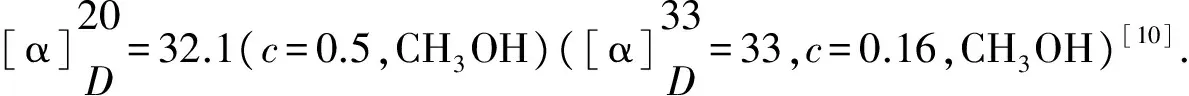

图1 产物气相色谱分析图Fig.1 GC analysis of the product
2 结果与讨论
2.1 菌种筛选与鉴定
通过初筛和复筛,从土样中筛选得到一株产羰基还原酶菌株ZJPH1606,能高选择性催化合成(R)-1-(2-三氟甲基苯基)乙醇(产物e.e.值>99.0%).经保守序列对比,该菌与恶臭假单胞菌(Pseudomonassp. PcFRB017,GenBank登录号为No. AB548844.1)的相似度为100%.菌落形态:菌落呈乳白色,表面湿润,光滑有光泽,不规则状,略微凸起.细胞形态:细体呈粗细不均的短杆状[(0.3~0.7) μm×(0.9~3.5) μm],可单个或聚集成丛,革兰氏染色呈阴性.结合菌体形态和基因保守序列对比分析,鉴定该菌为恶臭假单胞菌(Pseudomonasputida)ZJPH1606,该菌株保藏于中国典型培养物保藏中心,保藏号:CCTCC M 2017110.
2.2 单因素实验考察
培养基成分(如碳源、氮源及金属离子)的组成及浓度对菌体酶活和生物量影响较大,优化实验以酶活为主要考察指标,首先确定碳源、氮源组成,再通过优化培养基各成分质量浓度以提高酶活.
实验选取了葡萄糖、麦芽糖、乳糖、可溶性淀粉、甘油和蔗糖作为唯一碳源,考察碳源对菌体生物量和酶活的影响,结果表明:以葡萄糖为碳源时,酶活力最高.进而考察了葡萄糖质量浓度对酶活力的影响,结果如图2所示,在初始质量浓度为10 g/L时酶活为0.09 U/g,而在35.0 g/L时酶活最高达到0.20 U/g.
实验从蛋白胨、牛肉膏、酵母膏、乙酸铵、(NH4)2SO4和NH4Cl等氮源中优选牛肉膏作为P.putidaZJPH1606氮源,考察了其质量浓度对产酶的影响,结果显示当质量浓度为30.0 g/L时酶活达到0.25 U/g(图3).

图2 葡萄糖质量浓度对酶活及菌体生物量的影响Fig.2 Effect of glucose concentration on the enzyme activity and biomass
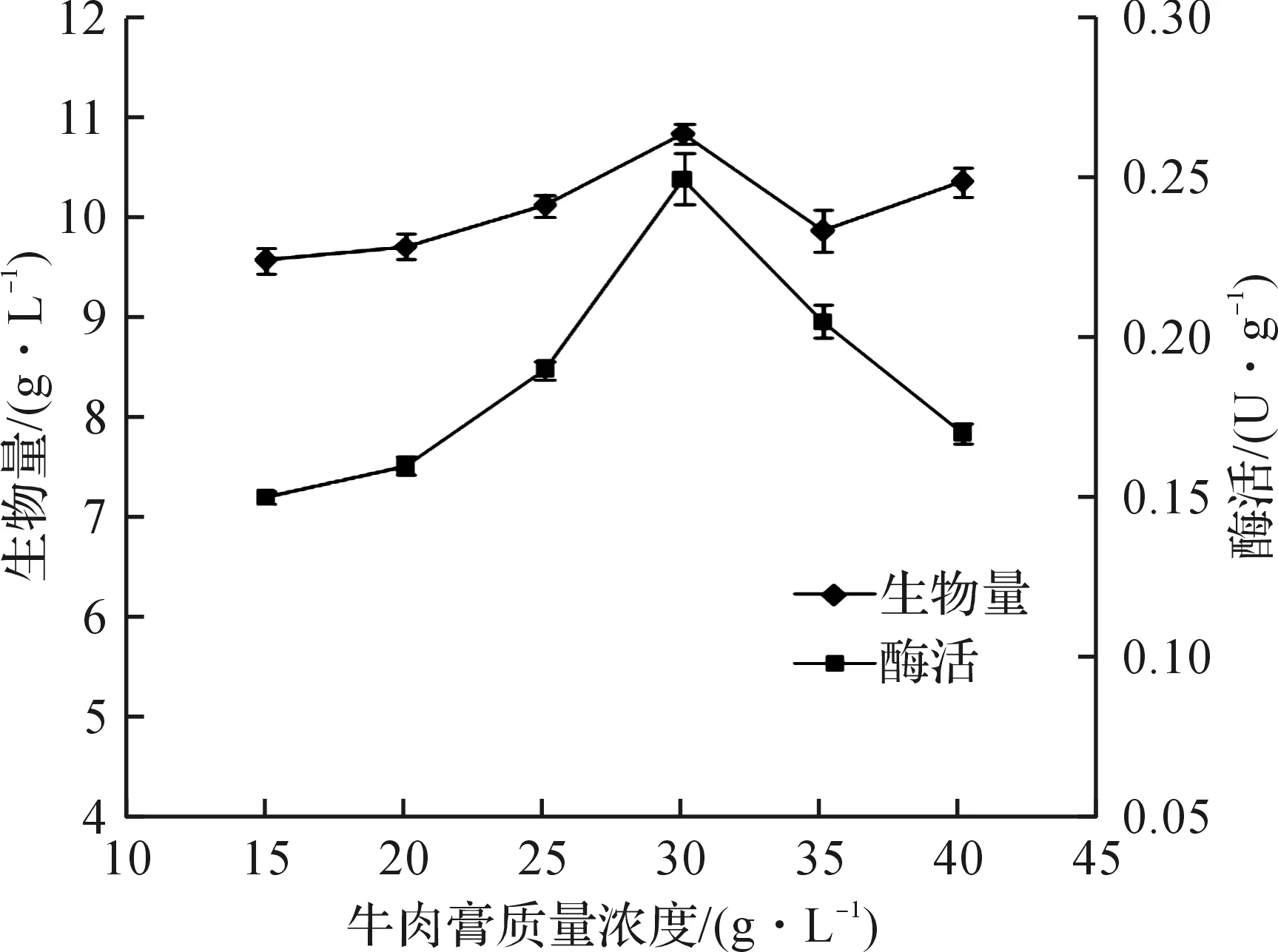
图3 牛肉膏质量浓度对酶活及菌体生物量的影响Fig.3 Effect of beef extract concentration on the enzyme activity and biomass
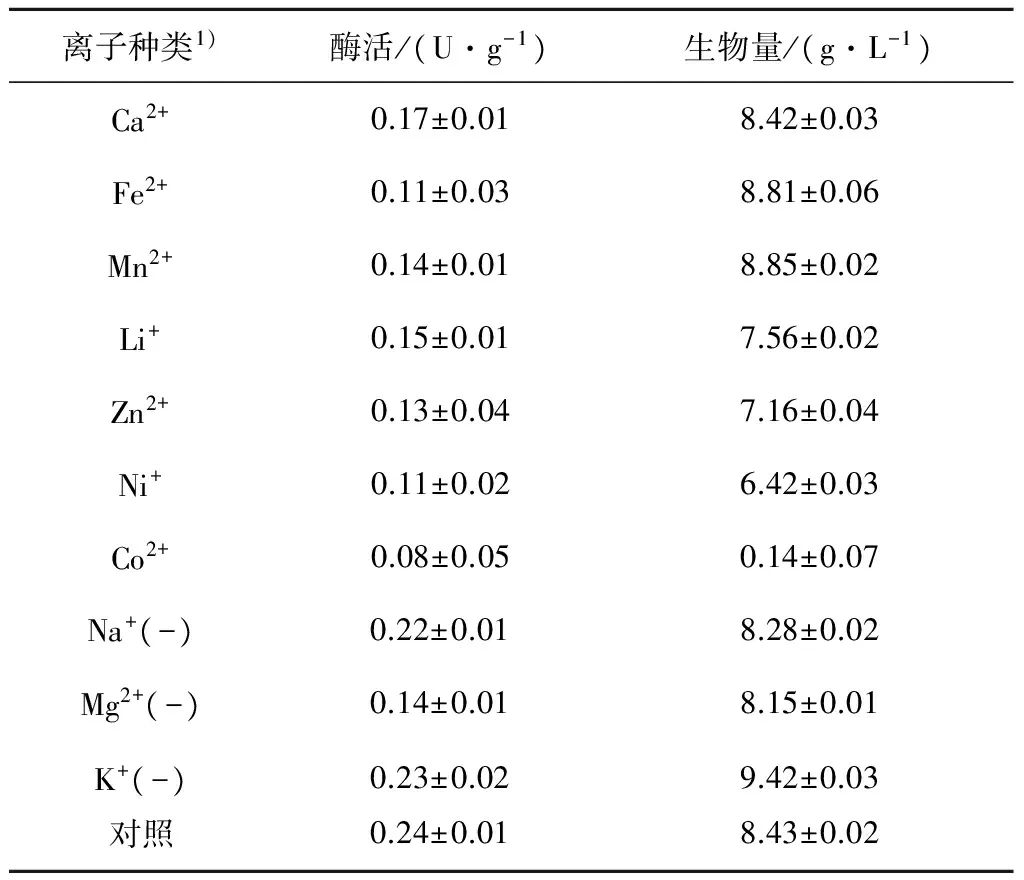
考察了金属离子对酶活的影响,金属离子的添加质量浓度为0.25 g/L,选取CaCl2,CoCl2,FeSO4,Li2SO4,ZnSO4,MnSO4,Ni2SO4添加到培养基中,替代原初始培养基中的NaCl,KH2PO4和MgSO4·7H2O,以及对原培养基中的三种离子化合物进行筛选,考察菌体生物量和酶活的变化情况.表1结果表明:在原培养基中添加其他金属离子,酶活都有不同程度降低;去除原培养基中的Na+和K+,酶活变化不明显,而Mg2+的去除,酶活由0.24 U/g降低到0.14 U/g,降低了41.7%.因此,选出Mg2+为影响酶活的重要影响因素,并对其质量浓度进行优化.由图4可知:当MgSO4的质量浓度为0.8 g/L时,酶活达到最高0.28 U/g.
表1金属离子对菌体生物量及酶活影响
Table1Effectofdifferentmetalionsonthebiomassandenzymeactivity
离子种类1)酶活/(U·g-1)生物量/(g·L-1)Ca2+0.17±0.018.42±0.03Fe2+0.11±0.038.81±0.06Mn2+0.14±0.018.85±0.02Li+0.15±0.017.56±0.02Zn2+0.13±0.047.16±0.04Ni+0.11±0.026.42±0.03Co2+0.08±0.050.14±0.07Na+(-)0.22±0.018.28±0.02Mg2+(-)0.14±0.018.15±0.01K+(-)对照0.23±0.020.24±0.019.42±0.038.43±0.02
注:1) (-)代表此组实验不添加该金属离子.
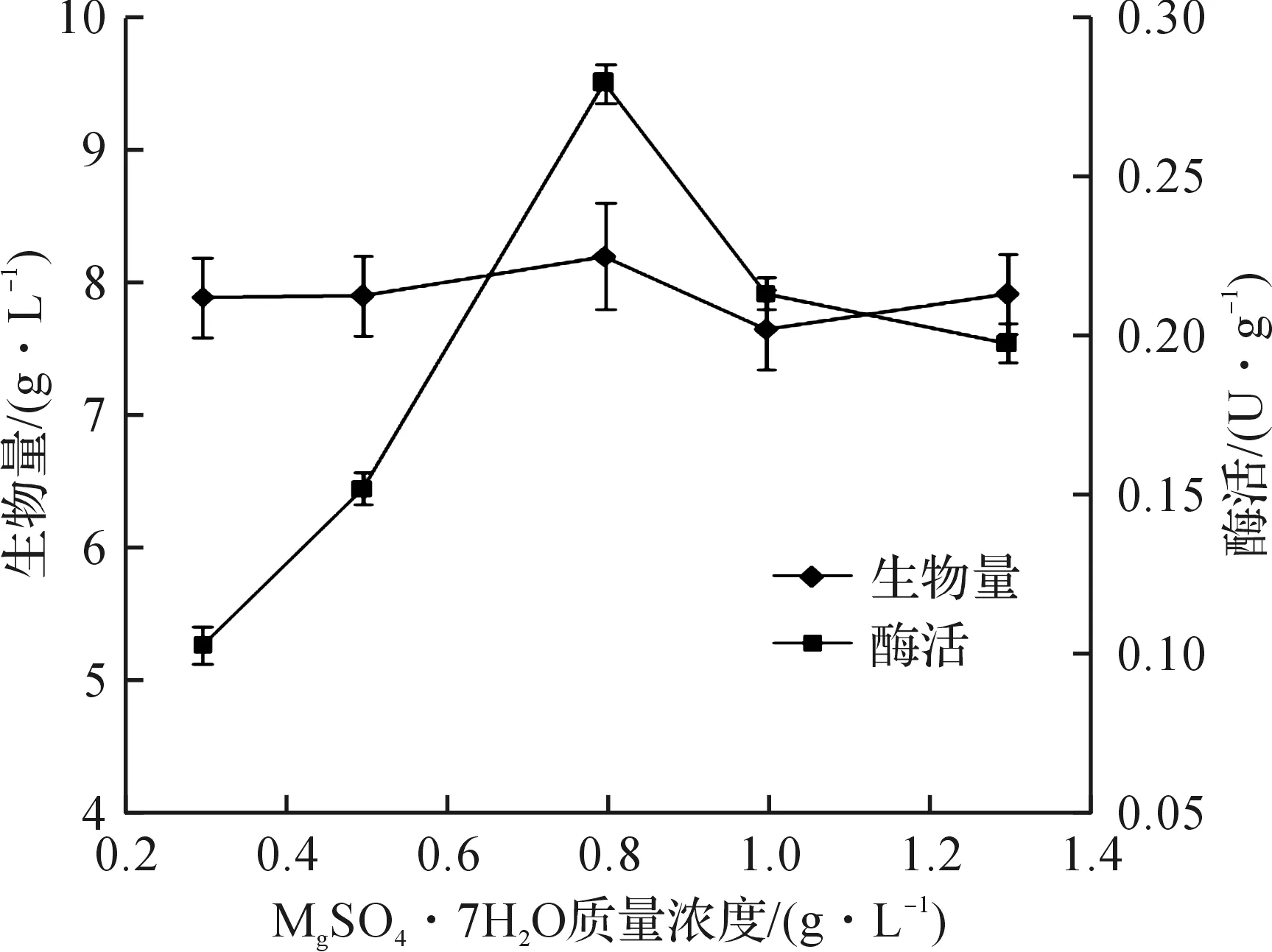
图4 MgSO4·7H2O质量浓度对酶活及菌体生物量的影响Fig.4 Effect of single MgSO4·7H2O concentration on the enzyme activity and biomass
2.3 中心组合实验设计
应用响应面法优化发酵产酶条件是普遍有效的方法[13-14].响应面实验所考察的是在一定范围内各因素最优比,无法对所选浓度范围之外的情况进行分析,因此在设计响应面试验时,先通过最陡爬坡实验确定不同因素的浓度选取范围,使显著因素葡萄糖、牛肉膏和MgSO4·7H2O的浓度取值趋近于最优点.在单因素实验数据的基础上,对所选显著变量分别按2.5,2.5,0.2的步长配制培养基.如表2所示,五种培养基组成中,序号3验证组的菌体酶活力最高(0.28 U/g),说明该组变量取值更趋近于最优点.因此,选择3号实验组中的发酵培养基配比为中心点,进行响应面实验设计.

表2 最陡爬坡实验设计及结果Table 2 Experimental design and results of steepest ascent
按照Box-Behnken实验的设计原理,设计三因素三水平的响应面实验,以葡萄糖X1,牛肉膏X2,MgSO4·7H2OX3三个因素为自变量,酶活作为响应值,设计N=17的三因素三水平实验,并对所得数据进行回归分析,得到拟合方程模型.各因素编码值及水平如表3所示,实验设计及实验结果见表4.
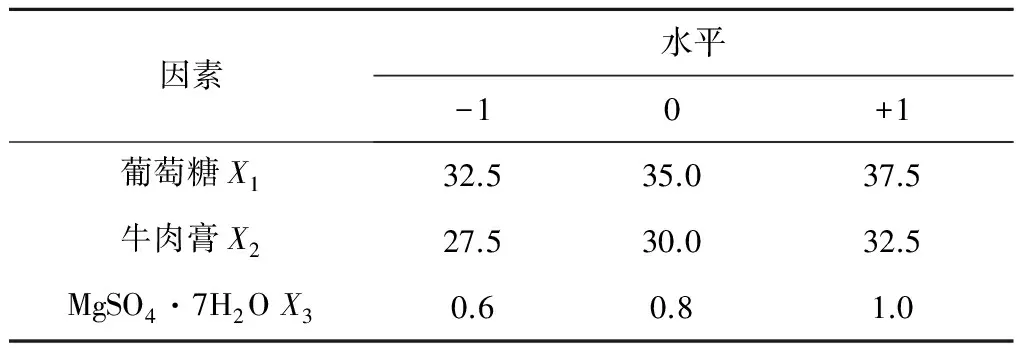
表3 响应面分析实验因素水平Table 3 Factors and levels of response surface experiment g/L
表4Box-Behnken响应面设计及试验结果
Table4ResponsesurfaceBox-Behnkendesignandcorrespondingresults

试验号X1X2X3酶活/(U·g-1)10-110.212-1100.2030000.33410-10.185-10-10.1761010.177-1-100.1780000.309-1010.23100000.331101-10.19120000.31130000.31141100.19150110.22160-1-10.17171-100.16
采用Box-Behnken响应面试验设计,确定显著影响因子的最优水平.由SAS 8.0软件拟合得到多元回归模型为:
酶活=0.32-8.75×10-3X1+1.12×10-2X2+1.50×10-2X3-0.486X1X2-1.75×10-2X1X3-2.50×10-3X2X3-0.07X12-0.06X22-0.05X32
利用Design expert 8.0.6软件对数据进行二次多项式方差分析,结果如表5所示.该模型P=0.000 1<0.05,失拟值为0.570 5,表明该模型分析结果可信,各因素对酶活影响显著.决定系数R2=0.988 1,说明该模型预测值与实际值相关联度高,可以用于预测实验结果.由响应面回归分析和回归方程拟合绘制响应面,如图5~7所示.
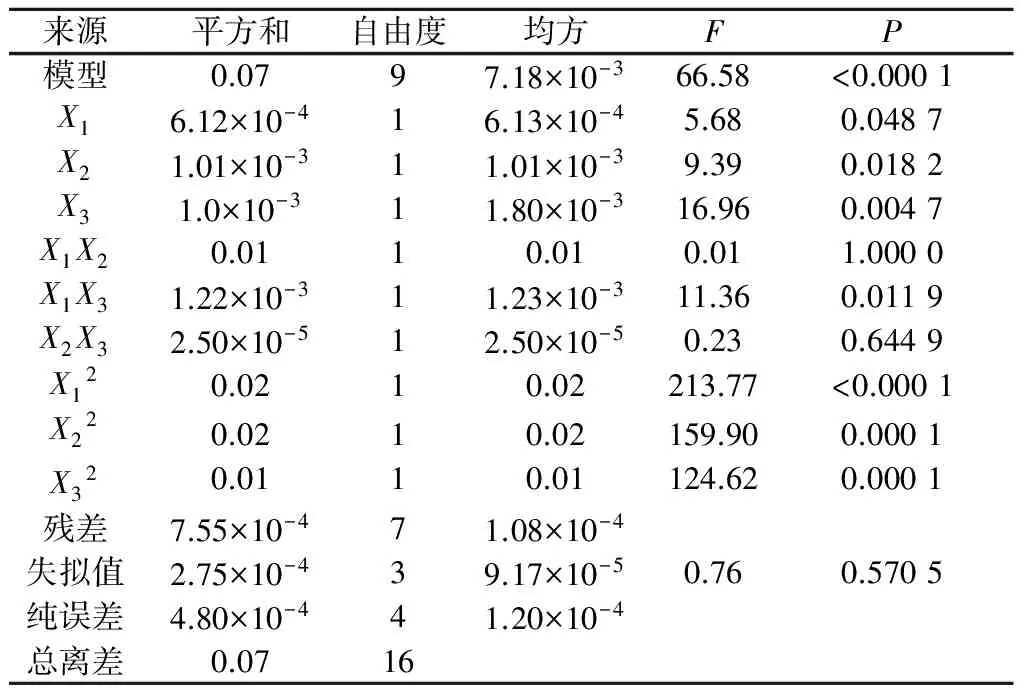
表5 回归模型系数显著性检验Table 5 Significance test of the regression coefficients

图5 葡萄糖和牛肉膏质量浓度对酶活的影响Fig.5 Effect of glucose and beef extract concentration on enzyme activity

图6 牛肉膏和MgSO4·7H2O质量浓度对酶活的影响 Fig.6 Effect of beef extract and MgSO4·7H2O concentration on enzyme activity

图7 葡萄糖和MgSO4·7H2O质量浓度对酶活的影响 Fig.7 Effect of glucose and MgSO4·7H2O concentration on enzyme activity
由响应面图5~7可知:两两因素葡萄糖/牛肉膏,牛肉膏/MgSO4·7H2O,葡萄糖/MgSO4·7H2O构成的响应面,其图形均呈现上凸的山丘状,表明酶活存在极大值;经对酶活数据进行分析,预测最大酶活为0.32 U/g,三因素最优质量浓度分别为葡萄糖38.5 g/L,牛肉膏32.7 g/L,MgSO4·7H2O 1.1 g/L.
验证模型预测值准确性的实验表明:在最优化条件下进行5 组250 mL摇瓶发酵实验,酶活分别为0.31,0.32,0.30,0.31,0.32 U/g,其平均酶活为0.31 U/g,与预测值(0.32 U/g)非常接近,相对误差为3.1%,表明该模型能较准确地预测发酵水平.
3 结 论
从土样中筛选得到一株产羰基还原酶的菌株,经鉴定为恶臭假单胞菌(Pseudomonasputida)ZJPH1606,该菌能高选择性催化底物制备(R)-1-(2-三氟甲基苯基)乙醇.利用单因素实验,确定最佳培养基组成为葡萄糖35.0 g/L,牛肉膏30.0 g/L,MgSO40.8 g/L.进一步利用中心组合实验得到最优培养基组成:葡萄糖38.5 g/L,牛肉膏32.7 g/L,MgSO4·7H2O 1.1 g/L.在优化条件下,酶活由初始酶活0.09 U/g提高到0.31 U/g,较优化前提高了71.0%.菌株ZJPH1606所产羰基还原酶具很好的催化选择性,产物e.e.值>99.0%,具有较好的应用前景.
[1] ZHENG G W, XU J H. New opportunities for biocatalysis: driving the synthesis of chiral chemicals[J]. Current opinion in biotechnology, 2011,22(6):784-792.
[2] NI Y, XU J H. Biocatalytic ketone reduction: A green and efficient access to enantiopure alcohols[J]. Biotechnology advances, 2012,30(6):1279-1288
[3] TORRELO G, HANEFELD U, HOLLMANN F. Biocatalysis[J]. Catalysis letters, 2015,145(1):309-345.
[4] PATEL R N. Synthesis of chiral pharmaceutical intermediates by biocatalysis[J]. Coordination chemistry reviews, 2008,252(5/7):659-701.
[5] CHADHA A, VENKATARAMAN S, PREETHA R, et al.Candidaparapsilosis: a versatile biocatalyst for organic oxidationreduction reactions[J]. Bioorganic chemistry, 2016,68:187-213.
[6] BODAI V, NAGY-GYOR L, ORKENYI R, et al.Wickerhamomycessubpelliculosusas whole-cell biocatalyst for stereoselective bioreduction of ketones[J]. Journal of molecular catalysis B: enzymatic, 2016,134:206-214.
[7] XU Q, XU X, HUANG H, et al. Efficient synthesis of (R)-2-chloro-1-phenylethol using a yeast carbonyl reductase with broad substrate spectrum and 2-propanol as cosubstrate[J]. Biochemical engineering journal, 2015,103:277-285.
[8] MAKINO Y, ITOH N. Development of an improved phenylacetaldehyde reductase mutant by an efficient selection procedure[J]. Applied microbiology and biotechnology, 2014,98(10):4437-4443.
[9] OLMOS D, BARKER D, SHARMA R, et al. Phase I study of GSK461364, a specific and competitive polo-like kinase 1 inhibitor, in patients with advanced solid malignancies[J]. Clinical cancer research, 2011,17(10):1-11.
[10] MARTINS J E D, WILLS M. Ir (III) complexes of diamine ligands for asymmetric ketone hydrogenation[J]. Tetrahedron, 2009,65(29/30):5782-5786.
[11] NAKAMURA K, MATSUDA T. Asymmetric reduction of ketones by the acetone powder ofGeotrichumcandidum[J]. Journal of organic chemistry, 1998,63(24):8957-8964.
[12] 许建和,许国超,郁惠蕾,等.一种羰基还原酶、基因及其在不对称还原前手性羰基化合物中的应用:ZL201210423006[P].2013-01-16.
[13] 欧志敏,徐佳慧,王莹.响应面法优化羰基还原酶产生菌BacillusanthracisCGMCC No. 12337的培养条件[J].浙江工业大学学报,2017,45(3):279-284.
[14] 李永幸,杨帆,姜泽东,等.响应面优化微泡菌ALW1产褐藻胶裂解酶的发酵条件[J].发酵科技通讯,2016,45(2):75-80.
OptimizationoffermentationconditionsforcarbonylreductaseproductionbyPseudomonasputida
HE Junyao1,2, BAI Dongya2, WANG Pu2
(1.Department of Pharmaceutical Engineering, Zhejiang Pharmaceutical College, Ningbo 315100, China; 2.College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
A bacterial strainPseudomonasputidaZJPH1606 containing carbonyl reductase was screened out from soil, which can reduce 2′-(Trifluoromethyl)acetophenone to (R)-1-[2-(trifluoromethyl)phenyl] ethanol with enantiomeric excess (e.e.) higher than 99.0%. By single factor experiment, glucose, beef extract and MgSO4·7H2O were found to be significant factors influencing the carbonyl reductase production. In order to improve the enzyme production, the medium components were further optimized by response surface methodology. The results showed that the enzyme activity reached highest when the fermentation medium was composed of glucose 38.5 g/L, beef extract 32.7 g/L, MgSO4·7H2O 1.1 g/L. Under the optimum conditions, the enzyme activity reached 0.31 U/g, increased by 71.0% compared to the original medium components. This study enriched the gene sequences database of carbonyl reductase and provided a new approach for the efficient synthesis of (R)-1-[2-(trifluoromethyl)phenyl] ethanol.
Pseudomonasputida; carbonyl reductase; strain screening; (R)-1-[2-(trifluoromethyl)phenyl]ethanol; medium optimization
2017-08-20
国家自然科学基金资助项目(21676250);浙江省公益技术研究项目(2015C33137);浙江省自然科学基金资助项目(LY16B060010);宁波市科技创新团队资助项目(2015C110027)
何军邀(1974—),男,浙江宁海人,教授,博士,研究方向为生物催化与生物转化,E-mail:hejunyao1974@126.com.
TQ033/O643
A
1674-2214(2017)04-0243-06
朱小惠)
